2. 华东师范大学生态与环境科学学院, 上海 200241;
3. 上海立昌环境工程股份有限公司, 上海 200241
采矿、冶炼、农药的施用和含砷(As)污水的排放是造成我国土壤As污染的主要人为来源[1]。固定/稳定化技术具有操作简单、高效、经济、适用范围广等特点,成为目前治理土壤As污染应用最为广泛的技术之一。稳定化技术通过改变As的赋存形态,从而降低在环境中的移动性和生物有效性[2]。但土壤中As的总量并未改变,易受到环境因素的影响而再次释放。因此,稳定化土壤的暴露情景对As的环境行为及长期稳定性产生了重要的影响。
磷(P)和砷(As)属同族元素,化学性质类似,两者均以阴离子的形式存在土壤中。P和As之间存在的竞争吸附关系影响了土壤中As的活化和迁移[3-4]。王小玲等[5]通过研究As和P在不同污染类型土壤的竞争吸附发现,PO43-能够将AsO43-从双电层的扩散层中和水合氧化物型表面部分置换出来,一部分As的吸附位点被P占据,从而造成As的吸附量减少。另外,pH是影响As的赋存形态、土壤胶体表面电荷以及土壤对As吸附量的重要因素。当pH 3 ~ 6时,土壤中H2AsO4-占总As的80%以上;当pH 7 ~ 10时,As主要以HAsO42-的形式存在[6]。有研究表明,当土壤pH降低时,正电荷增加,含砷阴离子有利于被带正电荷的铁氧化物等吸附而稳定在土壤中[7]。
含Fe材料作为常见的稳定药剂,通过吸附和共沉淀作用,能够降低As在土壤环境中的可移动性和生物有效性,而被广泛地运用。如卢冲等[8]以亚铁盐和生石灰分别作为稳定剂和辅助剂,发现土壤有效As的稳定化处理主要是将As转化为弱结晶和结晶铁铝或铁锰水化氧化物结合态。国内外学者关于含Fe材料对As污染土壤稳定化处理开展了大量的研究,但大多集中于稳定药剂的组合及pH、竞争性阴离子、稳定化时间等单因素对稳定化效果的影响。通常稳定化土壤可用于治理区域内景观绿化或河岸护坡用土,pH变化及磷肥的施用是其主要的环境影响因子,然而基于特定用途的环境因子对稳定化土壤的复合影响鲜有报道。为此,本文通过研究pH和P的交互作用对不同含Fe材料稳定化土壤As释放的影响,采用动力学方程对As的释放规律进行描述,初步探讨了As释放可能的作用机理,以期为稳定化土壤的环境风险评估及其处置和再利用提供理论依据。
1 材料与方法 1.1 试验材料供试样品采自青海泽库县某提金矿堆污染场地表层(0 ~ 40 cm)土壤,除去石砾和植物残体,经自然风干,研磨过2 mm筛,并充分混匀,备用。土壤类型为黄色砂质土壤,As的浸出浓度为30.2 mg/L,其他重金属浸出浓度未检出,其基本理化性质见表 1。供试含Fe材料为分析纯化学试剂硫酸亚铁(FeSO4)、硫化亚铁(FeS)、铁粉(Fe0)。
|
|
表 1 土壤的基本理化性质 Table 1 Basic physiochemical properties of tested soil |
准确称取过2 mm筛多份500.00 g土样置于一系列1 000 ml聚乙烯瓶中,按照质量比1%分别加入FeSO4、FeS和Fe0粉,每处理重复3次。加蒸馏水使得土壤含水率为30%,用玻璃棒搅拌均匀,自然条件下养护60 d,进行稳定化过程。每天通过称重法添加蒸馏水,以保持土壤含水率不变。土壤As的稳定效率按照下列公式计算:η = (C0-Cs)/C0×100%;式中,η为稳定效率(%);C0为稳定前土壤As的浸出浓度(mg/L);Cs为稳定后土壤As的浸出浓度(mg/L)。经3种含Fe材料处理后土壤As的稳定化效果见表 2。
|
|
表 2 不同含Fe材料对土壤As的稳定化效果 Table 2 Stabilization efficiencies of arsenic in soils by different iron-containing materials |
分别称取4.000 g FeSO4、FeS和Fe0稳定化土壤于若干个100 ml离心管,加入40 ml浓度为0和2 mmol/L磷酸二氢钾(KH2PO4)溶液,以0.01 mol/L氯化钠为支持电解质,为模拟酸性、中性和碱性条件下稳定化土壤As的释放规律,设置3种pH梯度,分别为3、7和11。各处理重复3次。每天测定溶液的pH及通过NaOH和HCl调节pH到设定值。在室温、3 000 r/min条件下,分别水平振荡2、8、24、48、96和144 h,离心过滤后测定上清液中As和其他金属元素的浓度。
1.3 测定方法土壤基本理化性质按照土壤农化常规分析方法测定[9];采用GB/T 22105.2-2008、GB/T 17141- 1997、GB/T 17138-1997、HJ 491-2009测定土壤As、Pb、Cd、Cu、Zn、Cr的浓度。采用《铬酸钡分光光度法》(HJ/T 342-2007)测定SO42-的含量。
土壤浸出浓度试验参照《固体废物浸出浓度浸出方法硫酸硝酸法》(HJ/T 299-2007)操作:称取150 g过2 mm筛的稳定化土壤样品置于提取瓶中,按照液固比为10︰1 (L/kg)的比例加入pH为3.20 ± 0.05硫酸硝酸浸提剂,在(23 ± 2)℃下翻转振荡18 h后取出,静置0.5 h,过0.45 μm的滤膜,收集浸出液于4 ℃下保存。
2 结果与讨论 2.1 pH和磷的交互作用对砷释放的影响图 1表示添加P和未添加P时,在不同pH条件下,3种含Fe材料稳定化土壤As的释放量随时间的变化。从图 1可以看出,不同pH对稳定化土壤As的释放量也产生了显著的影响。未添加P时,在pH = 3条件下,3种稳定化土壤As的释放量随时间增加呈缓慢降低的趋势,表明延长酸性条件下的停留时间,能够促进释放的As重新趋于稳定化,这与吕洪涛等[10]的研究结果相一致。未添加P时,在pH = 3和pH = 7条件下,144 h后FeSO4稳定化土壤As的释放量分别为4.67和19.23 mg/kg,FeS稳定化土壤为13.17和63.58 mg/kg,Fe0稳定化土壤为2.98和18.92 mg/kg;而在pH = 11条件下,3种稳定化土壤As的释放量显著增加,相同时间内As的释放量分别为49、212.72和31.10 mg/kg,分别约为pH = 3条件下的10.5、16和10倍,表明在碱性条件下稳定化土壤中As的稳定性较差。这是因为随着pH增大,土壤携带的负电荷增多,从而增加了与AsO43-之间的排斥力,促进As的解吸[11]。同时OH-的增多,对AsO43-吸附点位的竞争作用更加强烈,也导致了As的释放量增加[12]。与未添加P的体系相比,添加P时在3种pH条件下As的释放量更高,FeSO4稳定化土壤As最终的释放量在pH = 3、7、11条件下分别约为无P体系的33倍、5.5倍、3.5倍,FeS稳定化土壤在3种pH条件下分别约为15倍、4倍、1.8倍,而Fe0稳定化土壤约为29倍、5.6倍、4倍,其中P的存在使得3种稳定化土壤As的释放量都在酸性条件下增加倍数最高。Impellitteri等[13]研究表明,土壤中的一些吸附位点对P的亲和力更高,特别是在低pH条件下PO43-吸附能力增强,更易于将AsO43-从双电层的扩散层中和水合氧化物型表面部分置换出来,由此可见在酸性条件下P促进As的释放量增加更为显著。而添加P时,在pH = 11条件下,受PO43-竞争吸附及负电荷排斥的共同作用,3种稳定化土壤在整个周期内As的释放量都保持较快速度增加。
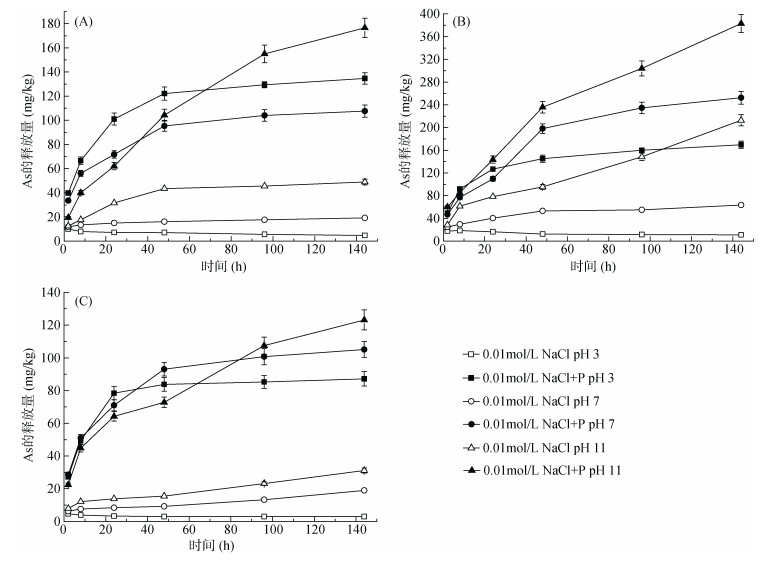
|
(A. FeSO4稳定化土壤;B. FeS稳定化土壤;C. Fe0稳定化土壤) 图 1 稳定化土壤中As的释放随时间的变化 Fig. 1 Arsenic releases from stabilized soils with time |
由图 1所示,在相同的试验条件下,3种稳定化土壤As的释放量相差较大,144 h后FeSO4、FeS和Fe0稳定化土壤As的最高释放量分别为176.57、383.06和123.15 mg/kg,其中Fe0稳定化土壤As的稳定性最高,As的释放量分别约低于FeSO4和FeS稳定化土壤的30.3%和67.9%。同时在各个体系中Fe0稳定化土壤都表现出最高的稳定性,而FeS稳定化土壤最差。
2.2 稳定化土壤砷的释放动力学3种含Fe材料稳定化土壤各个体系As的释放量具有明显的时间差异(图 1)。添加P时在pH = 3和pH = 7条件下,3种稳定化土壤As在开始的48 h内迅速释放,48 h后As的释放量增加较为缓慢,趋于平衡。另外未添加P时,在pH = 11条件下FeSO4稳定化土壤,以及pH = 7下的FeS稳定化土壤As的释放量都呈现类似的趋势,表明该过程在某种程度受动力学控制[14-15]。而未添加P时在pH = 7和pH = 11条件下,Fe0稳定化土壤呈现相反的变化趋势,即As的释放量先缓慢增加,48 h后增加较快。
目前,描述土壤中化学反应动力学模型应用较广泛的主要有双常数方程和Elovich方程、抛物线扩散方程、准一级动力学方程和准二级动力学方程等,其中双常数方程和Elovich方程常用于P、As等含氧酸根和重金属离子的吸附-解吸动力学[16],实际应用表明,能够描述反应机制复杂的动力学过程。如Elovich方程不仅适用于溶质在本体或界面处的扩散,还包括表面的活化与去活化作用等。应用双常数方程和Elovich方程拟合3种稳定化土壤在各个体系中As的释放量随时间的关系由表 3所示。这两个方程都能较好地描述稳定化土壤中As的释放过程(R2≥0.80),决定系数(R2)达到显著水平。由于稳定化土壤类型的不同,两种动力学模型拟合的适宜性也表现不同。就整体而言,对于FeSO4稳定化土壤,Elovich方程拟合性更好,而双常数方程拟合FeS和Fe0稳定化土壤更优。由此可见,该3种稳定化土壤As的释放过程受动力学控制。
|
|
表 3 稳定化土壤砷的释放动力学方程拟合 Table 3 Kinetic equations fitting for arsenuc releases from stabilized soils |
研究表明,含Fe材料稳定化土壤As以Fe、Ca、Al、Mg和Mn等金属氧化物的结合态形式存在[17-19],铁型砷和钙型砷的含量相对较高,另外也有少量的硫化砷生成[20]。因此稳定化土壤As的释放可能还与这些元素的溶出有关,通过测定在各个体系相关元素的释放量随时间的变化,以分析可能的控制As释放的作用机理。
图 2表示添加P和未添加P时,3种稳定化土壤中Ca、Mg和SO42-的溶出量在不同pH条件下随时间的变化。Mn只在部分体系中检出(图 2未显示),Fe和Al在各个体系均未检出,这可能是由于不同形态As的溶解度不同,一般而言Ca3(AsO4)2 > Mg3(AsO4)2 > Mn3(AsO4)2 > AlAsO4 > FeAsO4[21]。从图 2可以看出,对于在pH = 3条件下的绝大部分体系来说,3种稳定化土壤中Ca、Mg的溶出量和As的释放量随时间增加具有相似的变化趋势,且由表 4可知,Ca、Mg、Mn的溶出量与As的释放量之间存在显著或极显著相关,表明该3种金属氧化物的溶解导致了其结合态As的释放。但值得注意的是,未添加P时,稳定化土壤As的释放量与Ca、Mg、Mn的溶出量之间呈显著或极显著负相关;而添加P时,呈显著或极显著正相关。这是因为低pH条件下,Ca、Mg、Mn氧化物溶解所释放的As会迅速被未溶解的Fe、Al氧化物重新吸附[22],从而导致酸性条件下As的释放量降低(图 1),与Ca、Mg、Mn的溶出量呈反相关。而P存在时,由于酸性条件下P具有较强的吸附作用,增强了与As对吸附位点的竞争,有效抑制了As的重新吸附[23-24],所以As的释放量与Ca、Mg、Mn的溶出量呈正相关。总体而言,在pH = 11条件下Ca、Mg的溶出量较低(Mn未检出),与As的释放量相关性未显著,表明在碱性条件下As的释放受3种金属元素的影响较小。同时,添加P在碱性条件下Ca、Mg易与PO43-发生沉淀作用[25],也导致了pH = 11下Ca、Mg的溶出量明显降低。
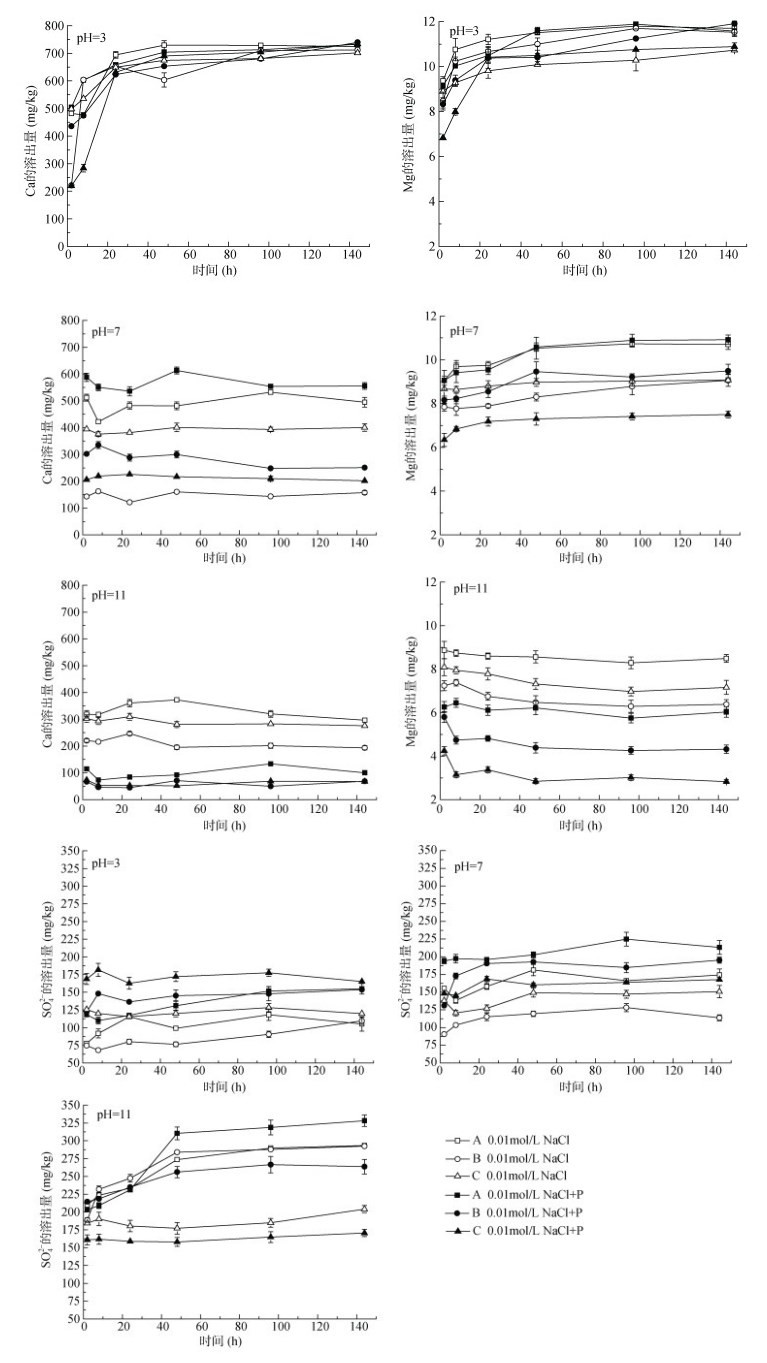
|
(图例中A: FeSO4稳定化土壤; B: FeS稳定化土壤; C: Fe0稳定化土壤) 图 2 稳定化土壤中Ca、Mg和SO42-的溶出量随时间的变化 Fig. 2 Releases of Ca, Mg and SO42- from stabilized soils with time |
|
|
表 4 稳定化土壤As的释放量与其他元素溶出量之间的Pearson相关系数 Table 4 Pearson correlation coefficients between arsenic releases and other elements from stabilized soils |
在适度的还原环境下,土壤中的As能以硫化物形式存在,包括砷黄铁矿(FeAsS)、硫化砷(AsS、As2S3)、硫砷铜矿(CuAsS4)等,其中黄铁矿最为常见,易被氧化成硫酸盐而释放出As[26-27]。由图 2所示,在pH = 11条件下,FeSO4和FeS稳定化土壤SO42-的溶出量与As释放量的变化趋势呈相似的动力学特征,且两者存在显著或极显著相关(表 4),表明这2种稳定化土壤在碱性条件下SO42-的溶出对As的释放具有重要的影响。相关研究发现As的硫化物能够很好地溶于碱,其主要化学反应式为[28]:
| $ {\rm{FeAsS}} + 11{{\rm{H}}_{\rm{2}}}{\rm{O}} = {\rm{Fe}}{\left( {{\rm{OH}}} \right)_3} + {\rm{HAsO}}_4^{2 - }{\rm{ + SO}}_4^{2 - } + 18{{\rm{H}}^ + } + 14{\rm{e}} $ | (1) |
| $ {\rm{A}}{{\rm{s}}_2}{{\rm{S}}_3} + 6{\rm{NaOH}} = {\rm{N}}{{\rm{a}}_3}{\rm{As}}{{\rm{S}}_3} + {\rm{N}}{{\rm{a}}_3}{\rm{As}}{{\rm{O}}_3} + 3{{\rm{H}}_2}{\rm{O}} $ | (2) |
反应(2)中AsS33-能进一步氧化成SO42-和AsO43-,因此较高的pH有利于含As硫化物溶解,从而导致As的释放。这与李世玉等[29]研究结果相似,该研究发现,主导铁盐治理后的沉积物As的溶出机制不是铁(氢)氧化物的溶解作用,而可能与硫化物参与As的吸附沉淀有关。但Fe0稳定化土壤As的释放量与SO42-的溶出量相关性较低,这可能是由于Fe0的固As机理与FeSO4、FeS不尽相同[30]。
3 结论pH对稳定化土壤中As的释放产生了明显的影响。在低pH条件下,随着时间的延长能够促进释放的As重新趋于稳定化,而较高pH条件下,使得3种稳定化土壤中As的释放量显著增加。添加P时,在3种pH条件下,稳定化土壤中As的释放量都高于无P体系,由于在酸性条件下PO43-更易于置换出AsO43-,As的释放量增加最为明显。Fe0稳定化土壤在各个体系中As都表现出更高的稳定性,而FeS稳定化土壤最差。
3种稳定化土壤各个体系As的释放特征具有明显的时间差异。对于大部分体系来说,在开始的48 h内,As的释放量增加较快,之后增加缓慢,趋于平衡。通过双常数方程和Elovich方程进行拟合发现,FeSO4稳定化土壤能用Elovich方程较好地描述,而双常数方程拟合FeS和Fe0稳定化土壤效果更优。
除了As的吸附-解吸作用,在酸性和碱性条件下,不同结合态As的溶解也控制着稳定化土壤中As的释放。在酸性条件下,3种稳定化土壤As的释放主要受Ca、Mg、Mn氧化物结合态As溶解的影响,而碱性条件下,FeSO4和FeS稳定化土壤中As的释放可能与硫化物的溶解有关。
| [1] |
廖自基. 微量元素的环境化学及生物效应[M]. 北京: 中国环境科学出版社, 1992
(  0) 0) |
| [2] |
Kumpiene J, Lagerkvist A, Maurice C. Stabilization of As, Cr, Cu, Pb and Zn in soil using amendments-A review[J]. Waste Management, 2008, 28(1): 215-225 DOI:10.1016/j.wasman.2006.12.012 (  0) 0) |
| [3] |
李士杏, 骆永明, 章海波, 等. 不同性质铁铝土对砷酸根吸附特性的比较研究[J]. 土壤学报, 2012, 49(3): 474-480 (  0) 0) |
| [4] |
Zeng X, Wu P, Su S, et al. Phosphate has a differential influence on arsenate adsorption by soils with different properties[J]. Plant Soil & Environment, 2012, 58(9): 405-411 (  0) 0) |
| [5] |
王小玲, 马杰, 顾明华, 等. 砷和磷在不同污染类型土壤中的竞争吸附动力学[J]. 生态环境学报, 2015, 24(4): 694-699 (  0) 0) |
| [6] |
Bissen M, Frimmel F H. Arsenic-a review Part Ⅰ: Occurrence, toxicity, speciation, mobility[J]. Acta Hydrochimica et Hydrobiologica, 2003, 31(1): 9-18 DOI:10.1002/aheh.200390025 (  0) 0) |
| [7] |
Jain A, And K P R, Loeppert R H. Arsenite and arsenate adsorption on ferrihydrite: Surface charge reduction and net OH- release stoichiometry[J]. Environmental Science & Technology, 1999, 33(8): 3696 (  0) 0) |
| [8] |
卢聪, 李青青, 罗启仕, 等. 场地土壤中有效态砷的稳定化处理及机理研究[J]. 中国环境科学, 2013, 33(2): 298-304 DOI:10.3969/j.issn.1000-6923.2013.02.016 (  0) 0) |
| [9] |
杨剑虹, 王成林, 代亨林. 土壤农化分析与环境监测[M]. 北京: 中国大地出版社, 2008
(  0) 0) |
| [10] |
吕洪涛, 贾永锋, 闫洪, 等. pH值、碱类型及预停留时间对铁砷共沉淀物长期稳定性的影响[J]. 生态学杂志, 2008, 27(9): 1576-1579 (  0) 0) |
| [11] |
Masscheleyn P H, Delaune R D, Jr W H P. Effect of redox potential and pH on arsenic speciation and solubility in a contaminated soil[J]. Environmental Science & Technology, 1991, 25(8): 1414-1419 (  0) 0) |
| [12] |
罗磊, 张淑贞, 马义兵. 土壤中砷吸附机理及其影响因素研究进展[J]. 土壤, 2008, 40(3): 351-359 DOI:10.3321/j.issn:0253-9829.2008.03.004 (  0) 0) |
| [13] |
Impellitteri C A. Effects of pH and phosphate on metal distribution with emphasis on As speciation and mobilization in soils from a lead smelting site[J]. Science of The Total Environment, 2005, 345(1/2/3): 175-190 (  0) 0) |
| [14] |
Rubinos D A, Iglesias L, Díaz-Fierros F, et al. Interacting effect of pH, phosphate and time on the release of arsenic from polluted river sediments (Anllóns River, Spain)[J]. Aquatic Geochemistry, 2011, 17(3): 281-306 (  0) 0) |
| [15] |
Qi Y, Donahoe R J. The environmental fate of arsenic in surface soil contaminated by historical herbicide application[J]. Science of the Total Environment, 2008, 405(1/2/3): 246-254 (  0) 0) |
| [16] |
吴萍萍, 曾希柏, 白玲玉. 不同类型土壤中As(V)解吸行为的研究[J]. 环境科学学报, 2011, 31(5): 1004-1010 (  0) 0) |
| [17] |
莫小荣, 吴烈善, 王芸, 等. 复合材料对砷污染土壤稳定化处理及机理研究[J]. 环境科学学报, 2017, 37(3): 1115-1121 (  0) 0) |
| [18] |
吴烈善, 莫小荣, 曾东梅, 等. 复合矿化稳定剂对土壤中砷稳定效果的研究[J]. 土壤通报, 2014, 45(6): 1522-1526 (  0) 0) |
| [19] |
胡立琼, 曾敏, 雷鸣, 等. 含铁材料对污染水稻土中砷的稳定化效果[J]. 环境工程学报, 2014, 8(4): 1599-1604 (  0) 0) |
| [20] |
Bostick B C, Fendorf S. Arsenite sorption on troilite (FeS) and pyrite (FeS2)[J]. Geochimica et Cosmochimica Acta, 2003, 67(5): 909-921 DOI:10.1016/S0016-7037(02)01170-5 (  0) 0) |
| [21] |
Hess R E, Blanchar R W. Arsenic stability in contaminated soils[J]. Soil Sci. Soc. Am. J. (United States), 1976, 40(6): 847-852 DOI:10.2136/sssaj1976.03615995004000060017x (  0) 0) |
| [22] |
Masue Y, Loeppert R H, Kramer T A. Arsenate and arsenite adsorption and desorption behavior on coprecipitated aluminum: Iron hydroxides[J]. Environmental Science & Technology, 2007, 41(3): 837-842 (  0) 0) |
| [23] |
Jain A, Loeppert R H. Effect of competing anions on the adsorption of arsenate and arsenite by ferrihydrite[J]. Journal of Environmental Quality, 2000, 29(5): 1422-1430 (  0) 0) |
| [24] |
Jackson B P, Miller W P. Effectiveness of phosphate and hydroxide for desorption of arsenic and selenium species from iron oxides[J]. Soil Science Society of America Journal, 2000, 64(5): 1616-1622 DOI:10.2136/sssaj2000.6451616x (  0) 0) |
| [25] |
孟顺龙, 裘丽萍, 陈家长, 等. 污水化学沉淀法除磷研究进展[J]. 中国农学通报, 2012, 28(35): 264-268 DOI:10.3969/j.issn.1000-6850.2012.35.049 (  0) 0) |
| [26] |
Cappuyns V, Swennen R. Kinetics of element release during combined oxidation and pH (stat) leaching of anoxic river sediments[J]. Applied Geochemistry, 2005, 20(6): 1169-1179 DOI:10.1016/j.apgeochem.2005.02.004 (  0) 0) |
| [27] |
Bose P, Sharma A. Role of iron in controlling speciation and mobilization of arsenic in subsurface environment[J]. Water Research, 2002, 36(19): 4916-4926 DOI:10.1016/S0043-1354(02)00203-8 (  0) 0) |
| [28] |
李勇, 徐忠敏, 吕翠翠, 等. 碱浸预处理提高某含砷锑难处理金精矿回收率的试验研究[J]. 黄金, 2013, 34(3): 61-64 (  0) 0) |
| [29] |
李世玉, 刘彬, 杨常亮, 等. 上覆水pH值和总磷浓度对含铁盐的高砷沉积物中砷迁移转化的影响[J]. 湖泊科学, 2015, 27(6): 1101-1106 (  0) 0) |
| [30] |
钟松雄, 尹光彩, 陈志良, 等. 水稻土中砷的环境化学行为及铁对砷形态影响研究进展[J]. 土壤, 2016, 48(5): 854-862 (  0) 0) |
2. School of Ecological and Environmental Science, East China Normal University, Shanghai 200241, China;
3. Shanghai Li Chang Environmental Engineering Company Limited by Shares, Shanghai 200241, China
 2019, Vol. 51
2019, Vol. 51


