2. 福建师范大学湿润亚热带山地生态国家重点实验室培育基地,福州 350007
氮素是植物生长重要的元素之一[1],在不同生态系统中,微生物和植物参与土壤氮素的转化和利用[1-3],而较低的利用和较高的损失会带来环境问题[4-5]。研究表明,土壤中无机氮素的微生物同化固定受到土壤有效碳源的控制,提高土壤有效碳源的含量会促进土壤氮的同化作用和保持[5-6]。甚至有人提出碳和养分平衡假说,试图来解释其机理[7],达到深入认识碳与其他因素之间关系的目的。因此,研究土壤碳氮相互关系,对于了解凋落物分解、根系分泌物等不同碳源对氮转化、生物有效性和生态环境效应方面的调节作用具有重要的意义。
森林生态系统碳输入主要以雨水淋洗冠层和树干、淋洗凋落物或凋落物分解物释放碳进入土壤[8],由于有机物质向微生物提供了可利用的碳源和能源,其性质和含量影响土壤氮素转化[9-10]。研究表明,土壤有机碳源通过微生物影响NH4+-N和NO3--N的固定,导致氮储量的增加,进而影响微生物对不同形态氮的吸收同化[11-12];活性碳促进土壤微生物保持氮[6],研究发现,添加葡萄糖和氮肥后,NO3--N下降,亚态氮上升[13]。针对中亚热带杉木林土壤(可溶性碳258 mg/kg)无机氮含量、净矿化和净硝化速率,研究葡萄糖碳施用水平对土壤的影响,且在添加葡萄糖碳量为C 1 000 mg/kg时NO3--N降到最低[14]。而活性碳(葡萄糖)添加对微生物的影响与土壤有机碳的水平有关[15],不同的碳含量又会影响沉降氮在不同树种凋落物层的转化[16]。在碳含量较高(可溶性碳508 mg/kg)的亚热带阔叶林(罗浮栲)土壤,外源活性碳水平与土壤氮的关系还不清楚,阻碍了对不同植被类型和土壤条件下的碳氮关系的理解。本研究采用室内培养试验,通过添加不同量的葡萄糖碳,目的是研究活性碳水平对无机氮影响及NH4+-N和NO3--N的响应差异,为了解活性碳对土壤氮素转化影响的机理提供理论参考。
1 材料与方法 1.1 供试土壤供试土壤采自福建省建瓯万木林自然保护区(27.03°N,118.09°E)罗浮栲林,该区地处武夷山山脉东南、鹫峰山脉西北,海拔高度230 ~ 556 m。本地属中亚热带季风气候,年均气温19.4 ℃,年均降水量1 731.4 mm,年均蒸发量1 466 mm,相对湿度81%,全年无霜期达277 d,土壤为花岗岩发育的红壤。
罗浮栲群落是万木林分布面积最大的一个群落,罗浮栲林地位于中上坡,坡向270°,坡度35°,海拔350 m,树龄130 a。样地平均树高和胸径分别为25 m和31.1 cm。群落以壳斗科栲属占优势地位,主要有罗浮栲、丝栗栲(Castanopsis fargesii)、拉氏栲(Castanopsis lamontii)、南岭栲(Castanopsis fordii)等,灌木层物种比较丰富。该样地土壤pH、总碳、可溶性碳和总氮分别是:5.0、28.3 g/kg、508 mg/kg, 2.1 g/kg。万木林罗浮栲群落具有典型的中亚热带地带性特征。
1.2 试验设计2015年7月在罗浮栲林选10 m × 10 m的3块小区,每个小区选3个点取0 ~ 15 cm土样,3块小区的土壤各自充分混合后,按照需要量带回实验室,去除可见根系和碎石,磨碎过筛(孔径2 mm)。称50 g(以烘干土计)土样倒入350 ml培养瓶,加入葡萄糖溶液,使葡萄糖添加量水平分别为C 0、300、600、900、1 000、1 100、1 300 mg/kg土壤。设置样品水分含量为饱和持水量(water-holding capacity)的60%,在25 ℃培养21 d,培养开始前,分析土壤样品碳氮。在培养期间每隔2 d用称重法补充损失水分,培养瓶用带孔(孔径2 mm,5个)的塑料薄膜覆盖。
1.3 分析方法土壤取样时,在每个处理的3个重复中各称取相当于8 g烘干土重的2份新鲜土样,其中一份在黑暗条件下用氯仿熏蒸处理24 h。与此同时,另外一份非熏蒸。将所取土样全部装入离心管中,并加入40 ml 0.5 mol/L的K2SO4溶液(土水比1:5)浸提,浸提液直接用定量滤纸过滤到带盖的尿杯中,滤纸上凋落物残体和离心管中土壤用水充分清洗两次后,收集、烘干、磨细后装入自封袋中,用于分析全氮和红外光谱。提取液体中的NH4+-N、NO3--N和可溶性全氮含量采用荷兰Skalar SAN++连续流动分析仪测定;K2SO4溶液浸提后的残余土壤、凋落物样品中的全碳与全氮含量采用C、N元素分析仪(Elementar Vario EL Ⅲ,德国)测定;残余土壤物用FTIR光谱仪(Agilent Cary 660 -FTIR)分析红外光谱。可溶性有机氮(SON)由K2SO4溶液中的全氮与NH4+-N和NO3--N的差值计算。微生物生物量氮的计算用熏蒸与未熏蒸全氮的差值除以系数0.45。
1.4 数据处理各指标的变化值由培养后数值减去培养前,然后进行葡萄糖添加处理间比较。数据采用Excel 2010计算,SPSS 17.0软件进行统计分析,Origin 8.0作图。采用单因素方差分析(one-way ANOVA)检验不同葡萄糖碳量对土壤氮的影响差异,显著性水平设为P = 0.05。
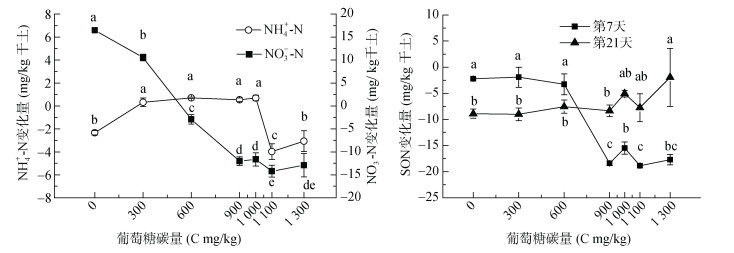
2 结果与分析 2.1 不同碳添加量对土壤可溶性氮的影响培养21 d后,未添加碳处理NH4+-N降低2.3 mg/kg;碳添加量为1 100和1 300 mg/kg时,NH4+-N降低3.98和3.01 mg/kg,但是当碳添加量在300 ~ 1 000 mg/kg时,NH4+-N却增加0.3 ~ 0.7 mg/kg,与对照和高碳添加处理差异显著(P < 0.05)(图 1)。未添加碳处理NO3--N增加16.5 mg/kg,碳添加量900 ~ 1 300 mg/kg时,NO3--N变化量平均为-12.7 mg/kg,说明碳添加降低NO3--N含量,且碳的添加,NO3--N损失28.35 mg/kg。
|
(图中不同小写字母表示同一指标不同碳处理间差异达到显著水平(P < 0.05),下同) 图 1 碳添加量对土壤铵态氮、硝态氮和可溶性有机氮变化量的影响 Fig. 1 Effects of C addition on changes of ammonium, nitrate and soluble organic nitrogen in soil after incubation |
添加碳后土壤可溶性有机氮(SON)含量变化如图 1。在培养第7天,随碳添加量的增加,SON含量逐步降低,且在C 900 mg/kg开始降低幅度最大,变化量是负值。从SON变化量可以看出,培养第21天,SON变化在碳添加量为0 ~ 600 mg/kg范围内较第7天继续降低,而碳添加量900 mg/kg以后,SON含量高于第7天。
2.2 不同碳添加量对微生物生物量氮的影响培养21 d后,微生物生物量氮(MBN)在碳添加量0 ~ 300 mg/kg时没有变化,在300 ~ 600 mg/kg时随碳添加量增加而升高并达到最大值(图 2);在碳添加量为1 100 mg/kg时,MBN又回落到最小值,1 300 mg/kg时又恢复到较高水平。氯仿熏蒸处理后,与未熏蒸样品比较,氮的增加主要来自微生物,以此表示微生物生物量氮形态的变化。结果显示,随着碳添加量的增加,可溶性全氮增加,其中可溶性有机氮(SON)增加47.8 ~ 64.1 mg/kg (图 2),占可溶性全氮的77% ~ 91%,且该比例随碳添加而增加,在碳添加量 > 900 mg/kg时,不再升高。

|
图 2 碳添加量对土壤微生物生物量氮(MBN)和可溶性有机氮(SON)变化的影响 Fig. 2 Effects of C addition on changes of MBN and SON in soil after incubation |
由表 1可知,与未添加碳处理相比,添加C 900 mg/kg时,NO3--N显著降低,而SON、MBN、残余土壤氮显著增加,其中残余土壤氮增加5.64 mg/kg。由于MBN应包含在残余土壤氮中,因此,还有4.40 mg/kg可能在凋落物残渣中,因为,凋落物残渣氮含量由9.87 g/kg增加到10.16 g/kg。
|
|
表 1 土壤各形态氮含量(mg/kg) Table 1 Nitrogen contents under different nitrogen status in soil |
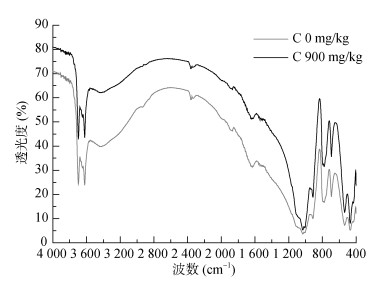
培养21 d土壤可溶性氮提取后,对剩余土壤残体样品进行红外光谱分析(图 3)可知,样品添加不同碳量得到的红外吸收形状较相似。在吸收峰最高的426 ~ 600 cm-1、900 ~ 1 200 cm-1范围内,添加C 900 mg/kg造成的差异最小,而在次吸收峰500 ~ 900 cm-1、1 300 ~ 3 714 cm-1和3 660 ~ 3 700 cm-1范围内添加碳造成的差异最大。
|
图 3 碳添加量对土壤红外光谱图的影响 Fig. 3 Effects of C addition on infrared spectral in soil |
培养21 d,随着碳添加量增加,阔叶林土壤NO3- -N含量开始降低(图 1)。类似地,Gilliam等[17]发现,添加果糖C 230 mg/kg就能降低NO3--N含量,Yamasaki等[18]发现在100 d培养试验中添加葡萄糖C 800 mg/kg降低NO3--N。而其他碳源,比如凋落物、葡萄糖、氨基酸和单宁等也会调控土壤氮素转化[19-23]。但是这些研究都没有考虑葡萄糖碳添加范围或对氮形态的影响差异。我们前期的工作显示,在土壤可溶性碳含量比较低的杉木林土壤,随碳添加量,土壤NO3--N开始降低,到1 000 mg/kg的碳添加量不再明显降低[14]。由于有机碳对微生物活性和氮动态的影响与土壤可溶性有机碳状态有关[15,24]。因此,本文针对土壤可溶性碳含量较高的阔叶林(罗浮栲林)土壤开展研究,结果显示,在葡萄糖添加量为C 900 mg/kg时NO3--N降低到最低。由于本文碳添加量设置水平与已有的研究[14]不一样,还不能明确NO3--N降低到最低值在针叶林和阔叶林受碳影响的水平差异,但都有一个使NO3--N含量降低到最低的碳水平,这一点是肯定的。再者本文碳添加对NH4+-N的影响与已有研究[14]不一致,本文中NH4+-N并没有随碳添加量而降低。在杉木土壤研究发现NH4+-N会随碳添加量的增加迅速降低[14],可能与杉木林凋落物中较高的单宁含量会促进NH4+-N降低[21]有关。
研究表明碳添加促进微生物对氮的需求[25],阔叶林凋落物降低氮素损失、增加土壤氮保持,而且NO3--N降低幅度大于NH4+-N[17]。向土壤中添加葡萄糖或蔗糖的试验结果都表明,活性碳增加微生物对氮的固定[26],甚至添加葡萄糖作用远高于叶提取物、腐植酸等碳源[11]。另一方面,已有研究结果表明当土壤有机碳源不足时,微生物对NH4+-N的吸收同化能力强于NO3--N;当有充足的有机碳源时,微生物对这两种形态氮素的固定能力几乎相当[27]。研究表明有效性碳的增加将有利于异养菌固定有效性NH4+-N和NO3--N,导致氮储量的增加[12]。本文结果显示,在培养的第7天,可溶性有机氮(SON)从碳添加量为900 mg/kg时降低很多(图 1),而通过氯仿熏蒸后与未熏蒸样品间的差值来表示微生物源的SON(28.1 ~ 69.0 mg/kg)却在升高;到21 d同样的微生物源的SON达到47.8 ~ 64.1 mg/kg(图 2),说明微生物以SON的形式保持大量氮。但是有关生物对氮的保持,在相关研究中并未提到会以什么形态氮存在[28]。而且,图 1显示在C 900 ~ 1 300 mg/kg范围内,与培养前比较第21天的SON高于第7天,那么7 ~ 21 d期间,增加的SON来自于有机氮分解还是来自于微生物释放,值得探究。相关研究显示在有葡萄糖存在条件下,NH4+-N来自微生物有机氮的矿化大于矿物固定氮的释放[30]。那么,是无机氮转化为SON被微生物固定,还是微生物固定了无机氮后转化为了SON。相关研究显示,玉米秸秆(较高的C/N比)加入在60% WHC下培养21 d后,氨基酸矿化最低,大量氨基酸直接被吸收,在缺少矿质氮的情况下更是如此[29],这也正是本文在随葡萄糖碳添加量增加培养时无机氮降低,而微生物中的SON维持较高水平的原因。
也有研究认为无机氮的降低可能与凋落物[30]和土壤固相固定氮[31]有关。本文结果显示,只有在60% WHC条件下,葡萄糖碳添加提高了土壤中凋落物残渣氮浓度,尽管微生物生物量氮增加较多(表 1),且SON的变化也受微生物的影响(图 1),而通过土壤全氮变化减去微生物生物量氮发现,土壤用K2SO4提取后的残余土壤对氮的保持也增加(表 1),可见,微生物固持氮不是唯一无机氮降低的原因。Ma等[32]对农业土壤的研究表明,在葡萄糖添加为C 3 228 mg/kg条件下生物和非生物是NH4+-N保持的主要机理,其非生物机理也是通过测定可溶性氮提取后土壤残体的方法确定的,这和本文是一致的。结合NH4+-N第21天的微量增加,甚至降低,表明高碳水平会促进有机质的分解,但有机氮的矿化还是不够理想;而红外光谱数据也显示,在高碳添加下,吸收峰强度降低,由于样品为硫酸钾溶液提取后的土壤,说明在高碳条件下土壤中吸收红外的物质量在降低,有机质在分解;由于3 696 cm-1、3 621 cm-1处的强而宽的双峰,这是H键键合-OH的伸缩振动的特征吸收,这些羟基主要来源于样品中的纤维素、糖类以及淀粉等碳水化合物以及醇类和酚类等,这个峰同时也掩盖了芳香环上C-H的伸缩振动;2 358 cm-1处一个弱的吸收峰属于三键,累积双键伸缩振动;1 635 cm-1(双键伸缩振动)和779、692、536、470 cm-1(苯环上C-H的弯曲振动)可以证明芳香类物质的存在;1 031 cm-1处为碳水化合物中的C-O振动,912 cm-1属于烯烃的C-H的弯曲振动。结果显示土壤样品最高的吸收峰变化不大,说明碳添加主要引起部分易分解芳香类物质的分解,使结构较复杂的苯环类等物质积累;而碳水化合物的相对含量减少,可能是由于碳的添加使土壤中微生物活性增大,大量的碳水化合物被微生物快速分解。甚至碳添加促进土壤中顽固性老有机碳的分解[33-34],因此,碳添加可能使有机质氮的浓度增加,土壤矿物有更多的空间位置保持氮,有机氮更加稳定,碳氮的这种关系值得关注。
4 结论葡萄糖碳添加以降低中亚热带阔叶林土壤NO3--N含量为主,通过NO3--N的微生物同化转化为有机氮,使该地区在降雨较多的情况下降低NO3--N的淋溶或反硝化气态损失风险,增加可溶性有机氮的淋溶风险。但是在生态系统氮需求发生改变时可溶性有机氮能迅速响应使该地区森林土壤能够有效矿化,并满足植物生长需求,提高生态系统中氮的可利用性。碳添加使土壤矿物对氮的保持增加,且有机氮变得更加稳定;碳添加使土壤有机质氮浓度增加,结合凋落物归还量增加和分解加快,土壤有机氮的积累可能变得缓慢。
| [1] |
Zhang J B, Zhu T B, Cai Z C, et al. Nitrogen cycling in forest soils across climate gradients in Eastern China[J]. Plant and Soil, 2011, 342(1): 419-432 (  0) 0) |
| [2] |
Burger M, Jackson L E. Plant and microbial nitrogen use and turnover: Rapid conversion of nitrate to ammonium in soil with roots[J]. Plant and Soil, 2004, 266(1): 289-301 (  0) 0) |
| [3] |
Rennenberg H, Dannenmann M, Gessler A, et al. Nitrogen balance in forest soils: Nutritional limitation of plants under climate change stresses[J]. Plant Biology, 2009, 11(suppl 1): 4-23 (  0) 0) |
| [4] |
Xu Y B, Xu Z H, Cai Z C, et al. Review of denitrification in tropical and subtropical soils of terrestrial ecosystems[J]. Journal of Soils Sediments, 2013, 13(4): 699-710 DOI:10.1007/s11368-013-0650-1 (  0) 0) |
| [5] |
Stark J M, Hart S C. High rates of nitrification and nitrate turnover in undisturbed coniferous forests[J]. Nature, 1997, 385(6611): 61-64 DOI:10.1038/385061a0 (  0) 0) |
| [6] |
Kaye J P, Hart S C. Competition for nitrogen between plants and soil microorganisms[J]. Trends in Ecology and Evolution, 1997, 12(4): 139-143 DOI:10.1016/S0169-5347(97)01001-X (  0) 0) |
| [7] |
Hamilton J G, Zangerl A R, Delucia E H, et al. The carbon-nutrient balance hypothesis: Its rise and fall[J]. Ecology letters, 2001, 4(1): 86-95 DOI:10.1046/j.1461-0248.2001.00192.x (  0) 0) |
| [8] |
Kanerva S, Smolander A. Microbial activities in forest floor layers under silver birch, Norway spruce and Scots pine[J]. Soil Biology and Biochemistry, 2007, 39(7): 1459-1467 DOI:10.1016/j.soilbio.2007.01.002 (  0) 0) |
| [9] |
贾俊仙, 李忠佩, 车玉萍. 添加葡萄糖对不同肥力红壤性水稻土氮素转化的影响[J]. 中国农业科学, 2010, 43(8): 1617-1624 (  0) 0) |
| [10] |
贾俊仙, 李忠佩, 车玉萍. 添加葡萄糖对不同肥力黑土氮素转化的影响[J]. 土壤学报, 2011, 48(1): 207-211 (  0) 0) |
| [11] |
Szili-Kovács T, Török K, Tilston E L, et al. Promoting microbial immobilization of soil nitrogen during restoration of abandoned agricultural fields by organic additions[J]. Biology and Fertility of Soils, 2007, 43(6): 823-828 DOI:10.1007/s00374-007-0182-1 (  0) 0) |
| [12] |
Venterea R T, Groffman P M, Verchot L V, et al. Gross nitrogen process rates in temperate forest soils exhibiting symptoms of nitrogen saturation[J]. Forest Ecology and Management, 2004, 196(1): 129-142 DOI:10.1016/j.foreco.2004.03.016 (  0) 0) |
| [13] |
Dendooven L, Alcántara-Hernández R J, Valenzuela-Encinas C, et al. Dynamics of carbon and nitrogen in an extreme alkaline saline soil: A review[J]. Soil Biology and Biochemistry, 2010, 42(6): 865-877 DOI:10.1016/j.soilbio.2010.02.014 (  0) 0) |
| [14] |
马红亮, 魏春兰, 李磊, 等. 添加葡萄糖对杉木人工林土壤氮素转化及净矿化和硝化的影响[J]. 林业科学研究, 2014, 27(3): 356-362 (  0) 0) |
| [15] |
Hoyle F C, Murphy D V, Brookes P C. Microbial response to the addition of glucose in low-fertility soils[J]. Biology and Fertility of Soils, 2008, 44(4): 571-579 DOI:10.1007/s00374-007-0237-3 (  0) 0) |
| [16] |
Ste-Marie C, Houle D. Forest floor gross and net nitrogen mineralization in three forest types in Quebec, Canada[J]. Soil Biology and Biochemistry, 2006, 38(8): 2135-2143 DOI:10.1016/j.soilbio.2006.01.017 (  0) 0) |
| [17] |
Gilliam F S, Lyttle N L, Thomas A, et al. Soil variability along a nitrogen mineralization and nitrification gradient in a nitrogen-saturated hardwood forest[J]. Soil Science Society of American Journal, 2005, 69(1): 247-256 (  0) 0) |
| [18] |
Yamasaki A, Tateno R, Shibata H. Effects of carbon and nitrogen amendment on soil carbon and nitrogen mineralization in volcanic immature soil in southern Kyushu, Japan[J]. Journal of Forest Research, 2011, 16(5): 414-423 DOI:10.1007/s10310-011-0272-7 (  0) 0) |
| [19] |
Kuzyakov Y, Hill P W, Jones D L. Root exudate components change litter decomposition in a simulated rhizosphere depending on temperature[J]. Plant and Soil, 2007, 290(1): 293-305 (  0) 0) |
| [20] |
Zhang J, Sun W, Zhong W, et al. The substrate is an important factor in controlling the significance of heterotrophic nitrification in acidic forest soils[J]. Soil Biology and Biochemistry, 2014, 76(4): 143-148 (  0) 0) |
| [21] |
Ma H L, Gao R, Yin Y F, et al. Effects of leaf litter tannin on soil ammonium and nitrate content in two different forest soils of mount Wuyi, China[J]. Toxicological and Environmental Chemistry, 2016, 98(3/4): 395-409 (  0) 0) |
| [22] |
Ma H L, Pei G T, Gao R, et al. Mineralization of amino acids and its signs in nitrogen cycling of forest soil[J]. Acta Ecologica Sinica, 2017, 37(1): 60-63 DOI:10.1016/j.chnaes.2016.09.001 (  0) 0) |
| [23] |
Li H C, Hu Y L, Mao R, et al. Effects of nitrogen addition on litter decomposition and CO2 release: Considering changes in litter quantity[J]. Plos One, 2015, 10(12): e0144665 DOI:10.1371/journal.pone.0144665 (  0) 0) |
| [24] |
Xiong Y M, Zeng H, Xia H P, et al. Interactions between leaf litter and soil organic matter on carbon and nitrogen mineralization in six forest litter-soil systems[J]. Plant and Soil, 2014, 379(1): 217-229 (  0) 0) |
| [25] |
Chen R, Senbayram M, Blagodatsky S, et al. Soil C and N availability determine the priming effect: Microbial N mining and stoichiometric decomposition theories[J]. Global Change Biology, 2014, 20(7): 2356-2367 DOI:10.1111/gcb.2014.20.issue-7 (  0) 0) |
| [26] |
Magill A H, Aber J D. Variation in soil net mineralization rates with dissolved organic carbon additions[J]. Soil Biology and Biochemistry, 2000, 32(5): 597-601 DOI:10.1016/S0038-0717(99)00186-8 (  0) 0) |
| [27] |
俞慎, 李振高. 稻田生态系统生物硝化-反硝化作用与氮素损失[J]. 应用生态学报, 1999, 10(5): 630-634 DOI:10.3321/j.issn:1001-9332.1999.05.033 (  0) 0) |
| [28] |
Ma Q, Wu Z J, Pan F F, et al. Effect of glucose addition on the fate of urea-15N in fixed ammonium and soil microbial biomass N pools[J]. European Journal of Soil Biology, 2016(75): 168-173 (  0) 0) |
| [29] |
Pinggera J, Geisseler D, Merbach I, et al. Effect of substrate quality on the N uptake routes of soil microorganisms in an incubation experiment[J]. European Journal of Soil Biology, 2015, 69: 17-23 DOI:10.1016/j.ejsobi.2015.04.002 (  0) 0) |
| [30] |
Cheng Y, Wang J, Zhang J B, et al. The mechanisms behind reduced NH4+ and NO3- accumulation due to litter decomposition in the acidic soil of subtropical forest[J]. Plant and Soil, 2014, 378(1): 295-308 (  0) 0) |
| [31] |
Darrouzet-Nardi A, Weintraub M N. Evidence for spatially inaccessible labile N from a comparison of soil core extractions and soil pore water lysimetry[J]. Soil Biology and Biochemistry, 2014, 73(6): 22-32 (  0) 0) |
| [32] |
Ma Q, Wu Z J, Shen S M, et al. Responses of biotic and abiotic effects on conservation and supply of fertilizer N to inhibitors and glucose inputs[J]. Soil Biology and Biochemistry, 2015, 89(3): 72-81 (  0) 0) |
| [33] |
Fontaine S, Barot S, Barré P, et al. Stability of organic carbon in deep soil layers controlled by fresh carbon supply[J]. Nature, 2007, 450(7167): 277-280 DOI:10.1038/nature06275 (  0) 0) |
| [34] |
Miao S J, Ye R Z, Qiao Y F, et al. The solubility of carbon inputs affects the priming of soil organic matter[J]. Plant and Soil, 2017, 410(1/2): 129-138 (  0) 0) |
2. State Key Laboratory of Subtropical Mountain Ecology (Funded by Ministry of Science and Technology and Fujian Province), Fujian Normal University, Fuzhou 350007, China
 2019, Vol. 51
2019, Vol. 51


