2. 四川省原子能研究院辐照保藏四川省重点实验室,成都 610101
随着经济的快速增长,人类活动给环境带来的污染日渐严重。据我国首次土壤污染状况调查显示,全国土壤总的点位超标率达到16.1%,其中无机污染物的超标最为严重,占全部超标点位的82.8%,而无机污染物中,镉(Cd)和镍(Ni)的点位超标率最高,分别为7.0%和4.8%[1]。尽管Ni是一种必需的生命元素,但已有研究表明过量的Ni对人体具有一定的毒性和致癌性[2-4]。同时Ni污染土壤造成农业减产,并通过食物链危害动物及人类的情况已经成为世界范围关注的问题[5]。因此,对于Ni污染土壤的治理和修复成为关注的热点,且近年来专家们也提出了几种技术修复Ni污染土壤,主要包括物理化学修复技术和生物修复技术。虽然物理化学修复技术具有较好的效果,但是过高的成本和可能带来的二次污染等问题限制了这种方法的实施。而生物修复技术具有成本低、可大面积修复、二次污染小等特点[6],并且可与其他技术联用,从而成为目前修复Ni污染土壤有效的方法[7-8]。
超富集植物被认为在土壤修复领域具有较大的应用潜力,目前发现的超富集植物中60%以上是Ni的超富集植物,但大部分超富集植物的生物量较小,能应用到实际环境中的较少。植物-微生物联合修复是一种新兴的技术,主要是利用微生物-土壤-植物之间互利共生的关系,促进植物的生长发育,增加植物对Ni的吸收,从而增强对Ni的修复效果。
本文综述了我国土壤中Ni污染的现状,植物-微生物联合修复Ni污染土壤的基本原理以及植物-微生物联合修复Ni污染土壤的效果,并对该技术的应用前景进行了展望。
1 我国土壤中镍污染现状土壤中Ni的来源可以分为自然来源和人为来源。在自然来源中,岩石风化与成土过程对土壤中Ni的含量影响很大,这决定了土壤中Ni的背景含量。土壤Ni污染是由人类活动造成的土壤中Ni含量过高,主要包括工业生产、矿业活动以及污水、污泥的灌溉等[8]。
当前,我国土壤中Ni污染状况不容乐观,全国土壤污染调查中Ni的点位超标率达到4.8%,仅次于Cd污染[1]。随着我国城市化水平的提高,城市土壤面临的重金属污染源较多。由于人们生活水平的提高,城市土壤环境质量受到越来越多的重视。耕作土壤环境质量关系粮食作物安全以及人体的健康。根据前人研究,我国一些主要城市如长春市[9]、成都市[10]、武汉市[11]、西安市[12]、天津市[13]、石家庄市[14]、海伦市[15]、北京市[16]、杭州市[17]、郑州市[18]和广州市[19]的耕作土壤中Ni的平均含量分别为74.3、62.8、37.3、33.2、31.9、28.1、25.7、23.5、22.6、15.4和12.4 mg/kg,其中长春市和成都市的土壤中Ni的平均含量超标,对作物的品质有一定的影响;而大部分城市土壤中Ni的平均含量低于土壤环境质量二级标准,但其中仍有部分点位由于长期污水污泥灌溉、农药化肥的施用等情况的出现致使Ni的累积而超标。植物-微生物联合修复是一种新兴的并且能较好地用于Ni污染土壤的技术,能够实现原位修复,且经济适用,在国内外得到了很多学者的推广。
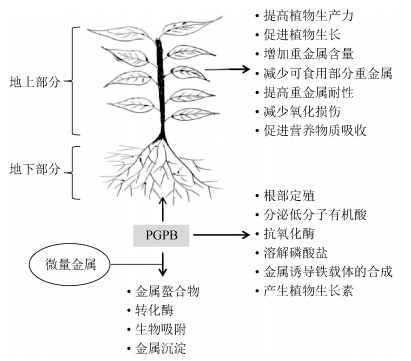
2 植物-微生物联合修复镍污染土壤的基本原理植物修复技术利用Ni富集植物对土壤中Ni进行吸收,从地下转移到茎、叶等地上部分,然后将植物的地上部分收割并集中回收处理Ni。但大部分超富集植物的生物量较小,加上土壤中可被植物利用的Ni含量低,从而应用到实际污染场地中修复效率并不高[20]。微生物在土壤中无处不在,在净化环境方面起着重要的作用。在修复Ni污染土壤时,利用耐Ni微生物固定Ni离子或将有毒的Ni形态转变为无毒或低毒的形态,可以改善Ni污染的土壤环境[21]。但由于微生物和土壤难以分离,微生物吸收的Ni仍然残留在土壤中,因此直接利用微生物修复Ni污染土壤有一定的回收难度。微生物在土壤环境中与植物相互作用,一些微生物能够促进植物生长发育,并能活化土壤中Ni,从而提高植物对土壤Ni的提取效果。此外,植物的根系分泌物也能被微生物所利用,促进微生物的生长和繁育。图 1为植物促生菌(plant growth-promoting bacteria,PGPB)与植物根际的协同作用和后续效应,反映了PGPB在土壤中发挥的作用。植物-微生物联合修复技术是目前国内外研究的热点,该技术可以充分发挥微生物和植物在修复技术上各自的优势,提升去除土壤中Ni的效率。其中微生物促进植物生长以及提高植物对Ni的吸收可分为以下几个作用。
|
图 1 耐金属PGPB与植物根际的协同作用和后续效应[22] Fig. 1 Synergistic and subsequent effects between plant rhizosphere and metal tolerant PGPB |
微生物在旺盛的生命活动代谢过程中,将分泌出大量的次生代谢产物,而分泌的植物激素如细胞分裂素(CK)、赤霉素(GA)、吲哚乙酸(IAA)等可促进植物根系的生长并增加对土壤养分和水分的吸收[23]。PGPB是植物-微生物联合修复Ni污染土壤常用的微生物。PGPB体内含有1-氨基环丙烷-1-羧酸(ACC)脱氨酶,可将植物分泌的ACC分解为α-丁酮酸和氨,增加了氮的来源,同时由于ACC可参与合成抑制植物生长的乙烯,从而ACC脱氨酶的存在可以促进植物的生长[24-25]。因此,ACC脱氨酶在植物-微生物联合修复技术中起到了重要的作用。Ma等[26]将耐Ni的假单胞菌A3R3接种于香雪球(Alyssum serpyllifolium)和芥菜(Brassica juncea),由于这种菌能分泌ACC脱氨酶、植物激素(IAA)和铁载体并具有溶磷作用等特点,因此显著促进了植物的生长,从而提高了植物对污染土壤中Ni的去除率,取得了一定的修复效果。
2.2 微生物的固氮和溶磷作用以及铁载体的合成植物的生长离不开营养元素(氮、磷、钾),营养元素缺乏将抑制植物的生长。众所周知,大气中的N2是不能直接被植物吸收利用的,只能靠固氮微生物将其转化为可以被植物利用的形式。如与植物共生的慢生根瘤菌RM8在Ni污染土壤中仍有固氮能力[27],这种植物内生菌在缺氮的土壤中对植物的生长起着重要的作用,是优于根际微生物的[28],能够为植物生长提供大量的氮元素。磷是仅次于氮的营养元素,但土壤中磷大部分是以沉淀的形式存在,不能被植物吸收[22]。而微生物能分泌有机酸将磷溶解,其中假单胞菌、芽孢杆菌和根瘤菌等被认为具有较好的溶磷作用[29-30],能促进植物对磷的吸收。铁也是植物生长发育不可缺少的元素,但在土壤环境中,铁主要以不溶的氢氧化物、氧化物、磷酸盐等形式存在,而根际微生物产生的铁载体对铁具有较强的络合能力,将不溶的铁转化为可被植物吸收的营养元素,可保证植物更好地生长[26,31]。同时,由于土壤中微量的铁被植物吸收,植物病原体的繁育将受到抑制,也间接促进了植物的生长[32]。
2.3 微生物抑制植物病原体植物病原体能侵害植物,造成植物生长失调,甚至导致植物死亡。除了铁载体对植物病原体有抑制作用,微生物还可通过与植物病原体在营养及生态位点的竞争和在代谢过程中产生抗生素,抑制植物病原体的生长[32],因此植物受到病原体的侵害减少,植物生长量将得到增长。
2.4 微生物对镍的固化和活化作用采用植物修复重金属污染土壤,关键在于重金属的生物有效性,这决定了植物对重金属的吸收效率[33]。一些学者认为,微生物对土壤中的Ni具有固化作用,如Ni被微生物吸收后可形成金属-有机化合物,降低Ni的生物有效性[21]。Wani等[34]研究发现,将根瘤菌RP5接种于豌豆,由于根瘤菌降低了Ni的毒性,并且分泌了植物激素,植物的生长量明显提高,但却减少了对Ni的吸收。因此土壤中Ni稳定化之后可以降低Ni的生物有效性[35],有效提高植物的生长。
但将Ni固定于土壤中,对环境仍存在潜在的危害,一旦环境条件发生改变,Ni就会继续对土壤造成危害。而增加Ni污染土壤中Ni的生物有效性是提高生物修复效果的重要因素。但也有学者认为,微生物分泌的代谢产物(如有机酸、铁载体、生物表面活性剂等)在降低土壤pH、改变氧化还原电位、增加重金属络合剂等方面起着重要作用,这些环境条件的改变将增加Ni的生物有效性[36-37],促进植物对Ni的吸收,从而加大植物对Ni的去除率。
3 植物-微生物联合修复镍污染土壤的效果由于植物-微生物联合修复技术具有良好的生态效益、成本低等优势,在土壤环境修复与治理领域拥有巨大的发展潜力,因此国内外学者对植物-微生物联合修复技术对土壤中Ni修复效果也做了大量研究。
3.1 微生物对植物生长发育的影响植物在Ni污染土壤中的生长状况反映了植物对Ni的耐性程度,一般情况下,高耐性植物对Ni的去除效果更好。由于部分微生物具有促进植物生长的能力,在植物-微生物联合修复Ni污染土壤方面具有重要作用。
表 1是近年来国内外学者关于微生物在Ni污染土壤中对植物生长状况的影响研究。这些研究从植物根际或者其他地方筛选了一些耐Ni微生物,将其接种于植物的根际部分,发现这些微生物的接种均不同程度地促进了植物的生长,包括植物根、茎、叶的增长或者植物鲜重、干重的增加。从表 1中对3种超富集植物的研究可以看出,内生菌对超富集植物生长的促进作用较小,但蔡信德等[38]所选用的外源菌显著促进了超富集植物的生长,其中元江蛇纹岩土壤中的植物地上部的生物量增长了309%。因此,选用超富集植物修复Ni污染土壤时,加入部分促进植物生长的耐Ni外源菌,能更大程度地促进植物对Ni的吸收累积。由于超富集植物存在生物量较少、生长缓慢等缺点,很多学者采用普通的富集植物进行植物-微生物修复的研究,并发现了很多内生菌和外源菌对植物的生长均有较好的促进作用。Ma等[41]筛选了5种从超富集植物根际中分离出的微生物,并接种于Brassica juncea、Brassica oxyrrhina这两种植物上,这些微生物均对植物的生长有不同程度的促进作用,其中Psychrobacter sp. SRA2对Brassica juncea的促进作用最为显著,相对于未接种微生物的植物,其干重和鲜重分别增加了351%和285%。
|
|
表 1 微生物对植物修复Ni污染土壤中植物生长的影响 Table 1 Effects of microorganisms on plant growth in Ni contaminated soil |
土壤中有效态Ni的含量对植物吸收Ni有较大影响,活化土壤中Ni,能增加植物对Ni的吸收[38],提升植物对污染土壤中Ni的修复效果。
表 2是部分微生物对Ni污染土壤中Ni有效态含量的影响。从表 2中可知,不同微生物对土壤中Ni的有效态含量影响不同,表中大部分微生物有活化土壤中Ni的作用,如Microbacterium arabinogalactanolyticum、Bacillus subtilis 174、Psychrobacter sp. SRA1、Bacillus cereus SRA10和Bacillus weihenstephanensis SRP12等。但也有少部分微生物降低了土壤中有效态Ni的含量,如Pseudomanas vesicularis、Psychrobacter sp. SRA2等,可能是因为植物吸收了土壤中被活化的Ni,从而导致土壤中Ni的活性降低。
|
|
表 2 微生物对植物修复Ni污染土壤中镍有效态含量的影响 Table 2 Effects of microorganisms on available fraction of Ni in Ni contaminated soil |
植物对Ni的吸收反映了植物对Ni的去除效果,而植物对Ni的吸收表现在植物根、茎、叶中Ni的含量,以及植物对Ni的总吸收量。表 3反映了微生物在Ni污染土壤中对植物吸收Ni的影响,不同学者从不同方面研究并得到了植物对Ni的吸收状况。这些研究均认为微生物的加入促进了植物对Ni的吸收,虽然有些植物体内Ni含量有所降低,但却通过增加植物的生物量提升了植物对Ni的总吸收量。Ma等[42]、Khan等[47]和Weyens等[50]筛选的微生物分别使Brassica sp.、Althea rosea和yellow lupine这3种植物对污染土壤中Ni的去除效率增加了100%以上,显著提高了植物对污染土壤中Ni的修复性能。
|
|
表 3 微生物对植物修复Ni污染土壤中植物对镍吸收的影响 Table 3 Effects of microorganisms on Ni uptake by plant in Ni contaminated soil |
由于植物-微生物联合修复技术具有巨大潜力,因此寻找增强植物对Ni去除效果的微生物是目前研究的重点。通过研究微生物在Ni污染土壤中对植物生长状况、有效态Ni含量以及植物吸收Ni的影响,对于寻找合适的植物和微生物修复Ni污染土壤具有重要意义。
4 小结与展望由于植物-微生物修复技术充分发挥了植物和微生物修复各自的优点,在污染土壤中Ni的修复有了更好的效果,因此是目前国内外研究的热点。其中植物和微生物的选择是重点也是难点,虽然目前已发现了300多种Ni的超富集植物,但是从目前的研究来看,由于超富集植物较难获得、生物量较小等缺点,部分学者仍然选择非超富集植物进行Ni污染土壤修复的研究。在菌种的选择上内生菌和外源菌均有涉及,且均能促进植物对污染土壤中Ni的吸收,提高土壤中Ni的修复效果。
有研究发现[51],向土壤中加入某些化合物(EDTA、天然低分子有机酸等)能增加植物中Ni的含量。由于有机酸不仅能活化土壤中Ni,促进植物对Ni的吸收,同时还能给微生物提供营养,促进微生物的繁育。因此,在开展植物-微生物联合修复土壤的研究中,可考虑加入适量有机酸,如草酸、柠檬酸、酒石酸、苹果酸等。同时大量筛选具有重金属修复功能的PGPB,建立PGPB库对植物-微生物联合修复方案的实施具有重要意义。目前土壤修复案例中能应用的植物不多,且国内发现的超富集植物较少,因此土壤修复植物的筛选以及我国超富集植物的寻找也是研究的重点。
| [1] |
环境保护部, 国土资源部. 全国土壤污染状况调查公报[J]. 国土资源通讯, 2014(8): 26-29 (  0) 0) |
| [2] |
刚葆琪, 庄志雄. 我国镍毒理学研究进展[J]. 卫生毒理学杂志, 2000, 14(3): 129-135 DOI:10.3969/j.issn.1002-3127.2000.03.001 (  0) 0) |
| [3] |
Costa M, Davidson T L, Chen H B, et al. Nickel carcinogenesis: Epigenetics and hypoxia signaling[J]. Mutation Research, 2005, 592(1/2): 79-88 (  0) 0) |
| [4] |
吴茂江. 镍与人体健康[J]. 微量元素与健康研究, 2014, 31(1): 74-75 (  0) 0) |
| [5] |
Salt D E, Blaylock M, Kumar N P B A, et al. Phytoremediation: A novel strategy for the removal of toxic metals from the environment using plants[J]. Biotechnology, 1995, 13(5): 468-474 (  0) 0) |
| [6] |
倪妮, 宋洋, 王芳, 等. 多环芳烃污染土壤生物联合强化修复研究进展[J]. 土壤学报, 2016, 53(3): 561-571 (  0) 0) |
| [7] |
Ho C, Hseu Z, Chen N, et al. Evaluating heavy metal concentration of plants on a serpentine site for phytoremediation applications[J]. Environmental Earth Sciences, 2013, 70(1): 191-199 DOI:10.1007/s12665-012-2115-z (  0) 0) |
| [8] |
Adiloglu S, Saglam M T, Adiloglu A, et al. Phytoremediation of nickel (Ni) from agricultural soils using canola (Brassica napus L.)[J]. Desalination & Water Treatment, 2016, 57(6SI): 2383-2388 (  0) 0) |
| [9] |
郭平, 谢忠雷, 李军, 等. 长春市土壤重金属污染特征及其潜在生态风险评价[J]. 地理科学, 2005, 25(1): 108-112 DOI:10.3969/j.issn.1000-0690.2005.01.017 (  0) 0) |
| [10] |
陈永琴. 成都市近郊蔬菜地土壤重金属污染状况调查与评价[J]. 安徽农业科学, 2013(22): 9257-9258, 9272 DOI:10.3969/j.issn.0517-6611.2013.22.029 (  0) 0) |
| [11] |
杜维, 李爱民, 安堃达. 武汉东西湖区某蔬菜地土壤重金属污染评价[J]. 环境科学与技术, 2015, 38(S1): 469-473 (  0) 0) |
| [12] |
李斌, 刘波, 方兰, 等. 西安郊区农耕地和大棚菜地土壤重金属迁移的对比研究[J]. 干旱地区农业研究, 2010, 28(4): 223-227 (  0) 0) |
| [13] |
许萌萌, 刘爱风, 师荣光, 等. 天津农田重金属污染特征分析及降雨沥浸探究[J]. 环境科学, 2018, 39(3): 1-11 (  0) 0) |
| [14] |
马建军, 杜彬. 河北省农田耕层土壤中镍含量及其质量评价[J]. 安全与环境学报, 2009, 9(3): 87-90 DOI:10.3969/j.issn.1009-6094.2009.03.022 (  0) 0) |
| [15] |
陈玉东, 周健民, 邢璐, 等. 黑龙江海伦市农田土壤重金属与磷素含量的特征研究[J]. 土壤, 2015, 47(5): 965-972 (  0) 0) |
| [16] |
索琳娜, 刘宝存, 赵同科, 等. 北京市菜地土壤重金属现状分析与评价[J]. 农业工程学报, 2016, 32(9): 179-186 (  0) 0) |
| [17] |
吴龙, 金铨, 龚立科, 等. 杭州地区稻田土壤中镉、铅、汞、砷、铬和镍的污染状况[J]. 中国卫生检验杂志, 2017, 27(11): 1621-1623 (  0) 0) |
| [18] |
沈阿林, 王洋洋, 孙世恺. 郑州郊区蔬菜基地土壤重金属含量及其污染评价[J]. 甘肃农业大学学报, 2009, 44(2): 126-131 DOI:10.3969/j.issn.1003-4315.2009.02.027 (  0) 0) |
| [19] |
柴世伟, 温琰茂, 张云霓, 等. 广州市郊区农业土壤重金属含量特征[J]. 中国环境科学, 2003, 23(6): 33-37 (  0) 0) |
| [20] |
Puschenreiter M, Stoger G, Lombi E, et al. Phytoextraction of heavy metal contaminated soils with Thlaspi goesingense and Amaranthus hybridus: Rhizosphere manipulation using EDTA and ammonium sulfate[J]. Journal of Plant Nutrition and Soil Science, 2001, 164(6): 615-621 DOI:10.1002/(ISSN)1522-2624 (  0) 0) |
| [21] |
蔡信德, 仇荣亮, 陈桂珠. 微生物在镍污染土壤修复中的作用[J]. 云南地理环境研究, 2005, 17(3): 9-12 DOI:10.3969/j.issn.1001-7852.2005.03.002 (  0) 0) |
| [22] |
Ashraf M A, Hussain I, Rasheed R, et al. Advances in microbe-assisted reclamation of heavy metal contaminated soils over the last decade: A review[J]. Journal of Environmental Management, 2017, 198: 132-143 (  0) 0) |
| [23] |
Malhotra M, Srivastava S. Stress-responsive indole-3- acetic acid biosynthesis by Azospirillum brasilense SM and its ability to modulate plant growth[J]. European Journal of Soil Biology, 2009, 45(1): 73-80 DOI:10.1016/j.ejsobi.2008.05.006 (  0) 0) |
| [24] |
Glick B R. Phytoremediation: synergistic use of plants and bacteria to clean up the environment[J]. Biotechnology Advances, 2003, 21(5): 383-393 DOI:10.1016/S0734-9750(03)00055-7 (  0) 0) |
| [25] |
Hassan W, Bashir S, Ali F, et al. Role of ACC-deaminase and/or nitrogen fixing rhizobacteria in growth promotion of wheat (Triticum aestivum L.) under cadmium pollution[J]. Environmental Earth Sciences, 2016, 75(3): 1-14 (  0) 0) |
| [26] |
Ma Y, Rajkumar M, Luo Y, et al. Inoculation of endophytic bacteria on host and non-host plants-effects on plant growth and Ni uptake[J]. Journal of Hazardous Materials, 2011, 195: 230-237 DOI:10.1016/j.jhazmat.2011.08.034 (  0) 0) |
| [27] |
Wani P A, Khan M S, Zaidi A. Effect of metal tolerant plant growth promoting Bradyrhizobium sp. (vigna) on growth, symbiosis, seed yield and metal uptake by greengram plants[J]. Chemosphere, 2007, 70(1): 36-45 DOI:10.1016/j.chemosphere.2007.07.028 (  0) 0) |
| [28] |
Hurek T, Reinhold-Hurek B. Azoarcus sp. strain BH72 as a model for nitrogen-fixing grass endophytes[J]. Journal of Biotechnology, 2003, 106(2/3): 169-178 (  0) 0) |
| [29] |
Chen Y P, Rekha P D, Arun A B, et al. Phosphate solubilizing bacteria from subtropical soil and their tricalcium phosphate solubilizing abilities[J]. Applied Soil Ecology, 2006, 34(1): 33-41 (  0) 0) |
| [30] |
Rodriguez H, Fraga R, Gonzalez T, et al. Genetics of phosphate solubilization and its potential applications for improving plant growth-promoting bacteria[J]. Plant and Soil, 2006, 287(1-2): 15-21 DOI:10.1007/s11104-006-9056-9 (  0) 0) |
| [31] |
Rajkumar M, Ae N, Prasad M N, et al. Potential of siderophore-producing bacteria for improving heavy metal phytoextraction[J]. Trends in Biotechnology, 2010, 28(3): 142-149 DOI:10.1016/j.tibtech.2009.12.002 (  0) 0) |
| [32] |
马莹, 骆永明, 滕应, 等. 内生细菌强化重金属污染土壤植物修复研究进展[J]. 土壤学报, 2013, 50(1): 195-202 (  0) 0) |
| [33] |
Wijayawardena M A, Naidu R, Megharaj M, et al. Using soil properties to predict in vivo bioavailability of lead in soils[J]. Chemosphere, 2015, 138: 422-428 DOI:10.1016/j.chemosphere.2015.06.073 (  0) 0) |
| [34] |
Wani P A, Khan S, Zaidi A. Effect of metal-tolerant plant growth-promoting Rhizobium on the performance of pea grown in metal-amended soil[J]. Archives of Environmental Contamination and Toxicology, 2008, 55(1): 33-42 DOI:10.1007/s00244-007-9097-y (  0) 0) |
| [35] |
陶雪, 杨琥, 季荣, 等. 固定剂及其在重金属污染土壤修复中的应用[J]. 土壤, 2016, 48(1): 1-11 (  0) 0) |
| [36] |
Ma Y, Prasad M N, Rajkumar M, et al. Plant growth promoting rhizobacteria and endophytes accelerate phytoremediation of metalliferous soils[J]. Biotechnology Advances, 2011, 29(2): 248-258 DOI:10.1016/j.biotechadv.2010.12.001 (  0) 0) |
| [37] |
Chen X, Liu X, Zhang X, et al. Phytoremediation effect of Scirpus triqueter noculated plant-growth-promoting bacteria (PGPB) on different fractions of pyrene and Ni in co-contaminated soils[J]. Journal of Hazardous Materials, 2017, 325: 319-326 DOI:10.1016/j.jhazmat.2016.12.009 (  0) 0) |
| [38] |
蔡信德, 仇荣亮, 陈桂珠, 等. 接种泡囊假单胞菌对土壤生物性质及A.corsicum吸收Ni的影响[J]. 生态学报, 2006, 26(5): 1405-1413 DOI:10.3321/j.issn:1000-0933.2006.05.015 (  0) 0) |
| [39] |
Visioli G, Vamerali T, Mattarozzi M, et al. Combined endophytic inoculants enhance nickel phytoextraction from serpentine soil in the hyperaccumulator Noccaea caerulescens[J]. Frontiers in Plant Science, 2015, 6: 638 (  0) 0) |
| [40] |
Rajkumar M, Freitas H. Effects of inoculation of plant-growth promoting bacteria on Ni uptake by Indian mustard[J]. Bioresource Technology, 2008, 99(9): 3491-3498 DOI:10.1016/j.biortech.2007.07.046 (  0) 0) |
| [41] |
Ma Y, Rajkumar M, Freitas H. Improvement of plant growth and nickel uptake by nickel resistant-plant-growth promoting bacteria[J]. Journal of Hazardous Materials, 2009, 166(2): 1154-1161 (  0) 0) |
| [42] |
Ma Y, Rajkumar M, Freitas H. Isolation and characterization of Ni mobilizing PGPB from serpentine soils and their potential in promoting plant growth and Ni accumulation by Brassica spp.[J]. Chemosphere, 2009, 75(6): 719-725 DOI:10.1016/j.chemosphere.2009.01.056 (  0) 0) |
| [43] |
Babu A G, Kim J D, Oh B T. Enhancement of heavy metal phytoremediation by Alnus firma with endophytic Bacillus thuringiensis GDB-1[J]. Journal of Hazardous Materials, 2013, 250/251: 477-483 DOI:10.1016/j.jhazmat.2013.02.014 (  0) 0) |
| [44] |
Mohammadzadeh A, Tavakoli M, Chaichi M R, et al. Effects of nickel and PGPBs on growth indices and phytoremediation capability of sunflower (Helianthus annuus L.)[J]. Archives of Agronomy and Soil Science, 2014, 60(12): 1765-1778 DOI:10.1080/03650340.2014.898839 (  0) 0) |
| [45] |
朱宏吉, 胡宗福. 解磷酵母Pichia farinose FL7用于镍污染土壤植物提取的研究[J]. 中国生物工程杂志, 2015(11): 36-45 (  0) 0) |
| [46] |
Kamran M A, Eqani S A, Bibi S, et al. Bioaccumulation of nickel by E. sativa and role of plant growth promoting rhizobacteria (PGPRs) under nickel stress[J]. Ecotoxicology and Environmental Safety, 2016, 126: 256-263 DOI:10.1016/j.ecoenv.2016.01.002 (  0) 0) |
| [47] |
Khan W U, Yasin N A, Ahmad S R, et al. Role of Ni- tolerant Bacillus spp. and Althea rosea L. in the phytoremediation of Ni-contaminated soils[J]. International Journal of Phytoremediation, 2017, 19(5): 470-477 DOI:10.1080/15226514.2016.1244167 (  0) 0) |
| [48] |
Abou-Shanab R A, Angle J S, Delorme T A, et al. Rhizobacterial effects on nickel extraction from soil and uptake by Alyssum murale[J]. New Phytologist, 2003, 158(1): 219-224 DOI:10.1046/j.1469-8137.2003.00721.x (  0) 0) |
| [49] |
Zaidi S, Usmani S, Singh B R, et al. Significance of Bacillus subtilis strain SJ-101 as a bioinoculant for concurrent plant growth promotion and nickel accumulation in Brassica juncea[J]. Chemosphere, 2006, 64(6): 991-997 DOI:10.1016/j.chemosphere.2005.12.057 (  0) 0) |
| [50] |
Weyens N, Croes S, Dupae J, et al. Endophytic bacteria improve phytoremediation of Ni and TCE co-contamination[J]. Environmental Pollution, 2010, 158(7): 2422-2427 DOI:10.1016/j.envpol.2010.04.004 (  0) 0) |
| [51] |
王学锋, 崔倩. EDTA、柠檬酸对向日葵吸收重金属Cd-Ni的影响[Z].昆明: 第二届全国农业环境科学学术研讨会, 2007
(  0) 0) |
2. Irradiation Preservation Key Laboratory of Sichuan Province, Sichuan Institute of Atomic Energy, Chengdu 610101, China
 2019, Vol. 51
2019, Vol. 51


