土壤pH是土壤各种化学性质的综合反映,与土壤微生物的活动、土壤有机质的合成分解、营养元素的转化与释放及有效性、土壤养分保持能力等都有关系。土壤pH通过对土壤物理、化学及生物学特性的影响而使植物外观形态、物质代谢、生长发育以及品质和产量等方面发生变化[1-2]。适宜的土壤pH条件下植物生长状态良好[3],生长调节能力强[4],植物的净光合速率达到最大值[5-6],物质的吸收、同化合成、积累多[7-8],可以为植物生长发育提供所需的养分和能源[9]。而土壤pH过高或过低则会引起细胞膜透性、可溶性糖含量、可溶性蛋白含量、超氧化物歧化酶和过氧化氢酶活性等生理指标的变化[10-11]。曾有学者研究表明:生长在中偏酸性土壤的三七其总皂苷含量高[12],近碱性(平均pH为7.236)土壤条件可促进连翘药材中连翘苷的积累[13];滇重楼新老根茎总皂苷含量随土壤pH升高而增加[14],柔毛淫羊藿总黄酮和淫羊藿苷含量与土壤pH(5.99 ~ 8.22)呈极显著正相关[15];川芎有效成分与土壤pH(4.43 ~ 6.58)显著负相关[16]。
活血丹Glechoma longituba(Nakai) Kupr.为唇形科活血丹属植物,干燥地上部分入药,药材名连钱草,除西藏、新疆、青海、甘肃外,全国均有分布。味辛、微苦,性微寒,入肝、肾、膀胱经;具有清热解毒、利尿排石、散瘀消肿的功效,用于治疗尿路结石、肝胆结石等症[17-18],是胆乐胶囊、排石颗粒等中成药的主要原料之一。近年来,随着对肝胆系统结石症研究的不断深入,连钱草以其疗效显著、毒副作用小等特点越来越受关注[19],需求量日益增加。为保障活血丹药材实现安全、有效、稳定、可控,本试验研究了不同土壤pH条件下,活血丹的生长和生理特性响应,以及其药材活性成分的影响,以期为活血丹适宜种植区确定、完善活血丹种植技术、保障其药材品质提供理论意义。
1 材料与方法 1.1 供试材料试验土壤取自紫金山,晾干过0.5 mm筛。供试土壤基本理化性质如下:黏壤土,pH 7.0,有机质含量35.01 g/kg,阳离子交换量242.08 mmol/kg,全氮1.779 g/kg,全磷0.654 g/kg,全钾13.28 g/kg。供试植物采于南京紫金山,经南京农业大学中药材研究所郭巧生教授鉴定为唇形科活血丹属植物活血丹G.longituba,2016年5月于南京农业大学中药材研究所试验大棚扦插育苗备用,8月中旬选择长势一致的健壮活血丹幼苗进行栽培试验。盆高18 cm ×直径12 cm,每盆装1.5 kg过筛土壤,移栽5株大小一致的活血丹幼苗,试验期间管理措施一致。
1.2 试验设计土壤原始pH为7.0,经过预实验得知:土壤pH与NaOH的线性关系为y= 0.689x1+ 7.059(R2 = 0.991),与H2SO4的线性关系为y = -1.036x2 + 6.917(R2 = 0.996),其中y表示土壤pH,x1表示每千克土壤所需NaOH(g),x2表示每千克土壤所需H2SO4(ml)。缓苗后用NaOH或H2SO4调节土壤pH至4.5、5.5、6.5、7.5、8.5、9.5,每处理5盆重复,试验中每3 d使用pH计测定pH,根据线性关系计算所需NaOH或H2SO4的量后,用蒸馏水配制成溶液均匀倒入盆中。
|
|
表 1 试验设计 Table 1 Experiment design |
10月中旬采收前进行测定,每盆随机取3株,测定叶长、叶宽、节间距、节间数,茎粗、茎长及干重。叶长、叶宽为基部向上第3个茎节叶片的长度和宽度,节间距为基部向上第3个茎节和第4个茎节之间的长度,节间数为基部到顶部节间的数量,茎粗为基部向上第3个茎节和第4个茎节之间的茎节直径,茎长为活血丹基部到顶部的长度,干重为每盆地上部分55 ℃烘干至恒重的重量。
1.3.2 活血丹生理指标测定活血丹生理指标的测定材料均取其植株自上而下数第2茎节和第3茎节的幼嫩的完整叶片。叶绿素、类胡萝卜素含量测定采用乙醇浸提法;游离氨基酸总量测定采用茚三酮显色法,可溶性糖含量测定采用蒽酮比色法,可溶性蛋白含量测定采用考马斯亮蓝G-250法;超氧化物歧化酶(SOD)活性测定采用氮蓝四唑法,过氧化物酶(POD)活性测定采用愈创木酚法,过氧化氢酶(CAT)活性测定采用高锰酸钾滴定法,丙二醛(MDA)含量测定采用硫代巴比妥酸法[20]。
1.3.3 活血丹药材品质测定活血丹地上部分采收后,洗净、晾干,放入烘箱55 ℃烘干至恒重,用打粉机打粉,过60目筛备用。醇溶性浸出物按照药典规定方法(通则2201)测定,总黄酮含量用分光光度法测定,三萜酸类(熊果酸与齐墩果酸)和酚酸类(绿原酸、咖啡酸、迷迭香酸)含量采用HPLC法测定。
三萜酸类测定条件分别精密称取齐墩果酸、熊果酸对照品14.10 mg和11.20 mg,用甲醇溶解,然后定容至25 ml,4 ℃贮藏,配成浓度分别为0.564 mg/ml和0.420 mg/ml的标准品溶液。精密称取活血丹粉末(过60目筛)0.50 g,加入88%乙醇39 ml,称定重量,超声提取(超声频率:40 kHz;超声电功率:150 W) 60 min,取出静置至室温,称定补足重量,过0.45 μm微孔滤膜。以乙腈(A)-0.05%乙酸铵(B)为流动相进行等度洗脱,洗脱比例(A︰B)为77︰23,色谱柱为迪马钻石plus C18,4.6×250 mm,5 μm;检测波长为210 nm;流速为0.5 ml/min;进样量为10 μl。
酚酸类的测定条件为实验室前期探索获得,酚酸类供试品溶液制备:40%乙醇,液料比40 ml/g,超声时间100 min。酚酸类液相方法:乙腈(A)-0.01%磷酸水溶液(B)为流动相进行梯度洗脱,流速为0.8 ml/min,柱温为35℃,进样量为10 μl,洗脱梯度为:0 ~ 15 min,A:10% ~ 15%;15 ~ 20 min,A:15% ~ 17%;20 ~ 23 min,A:17% ~ 25%;23 ~ 33 min,A:25% ~ 35%;33 ~ 36 min,A:35% ~ 95%;36 ~ 38 min,A:95%;38 ~ 43 min,A:95% ~ 10%;43 ~ 45 min,A:10%。色谱柱为迪马钻石plus C18,4.6 × 250 mm,5 μm。
1.4 统计分析试验数据采用Excel 2003和SPSS 18. 0软件进行统计分析,不同处理间数据的差异性采用方差分析(LSD),显著性水平为0.05。
2 结果与分析 2.1 土壤pH对活血丹生理特性的影响 2.1.1 土壤pH对活血丹光合色素的影响活血丹在pH 4.5 ~ 8.5能正常生长,pH 9.5中不能存活,故下文未有pH 9.5相关数据。光合作用是生物界赖以生存的基础,叶绿素作为进行光合的主要色素,其含量直接反映植物光合能力的强弱,同时也影响到植物生物量的积累。从表 2可以看出,随着土壤pH升高,活血丹叶片中叶绿素含量呈先增后降的趋势:其中叶绿素a在pH 6.5达到最大值1.86 mg/g,分别为其他处理的1.73、1.44、1.41及1.54倍,与其他处理均达到显著性差异;叶绿素b含量在pH 5.5 ~ 7.5之间时差异不显著,但显著高于pH 4.5与pH 8.5处理;叶绿素总量在pH 6.5达到最大值2.59 mg/g,分别为其他处理的1.52、1.29、1.28及1.38倍,与其他处理均达到显著性差异;叶绿素a/b也在pH 6.5达到最大值,分别为其他处理的1.45、1.42、1.37及1.39倍;土壤pH对类胡萝卜素含量影响较小,各处理间差异不显著。
|
|
表 2 土壤pH对活血丹光合色素的影响 Table 2 Effects of soil pH on contents of chlorophyll in G. longituba leaves |
可溶性糖、可溶性蛋白与游离氨基酸都是光合作用的产物,它们既是植物主要的营养物质也是渗透调节物质。如图 1所示:土壤pH对活血丹叶片游离氨基酸、可溶性蛋白和可溶性糖含量有均有显著影响。三者随着土壤pH的增加呈先降后升的趋势,在pH 6.5达到最小值,分别为25.17 μg/g、15.59 mg/g、14.3 mg/g;土壤pH 6.5条件下,活血丹植株可溶性糖含量为其他pH处理的75.44%、85.49%、72.51%和71.91%,可溶性蛋白分别为其他处理的67.55%、84.62%、90.28%和86.10%。
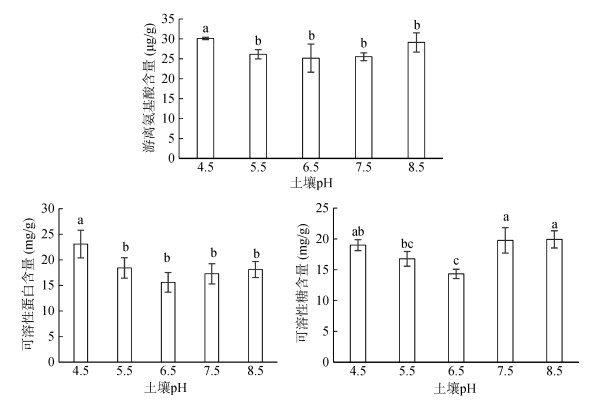
|
(图中小写字母不同表示处理间差异显著(P < 0.05),下图同) 图 1 土壤pH对活血丹游离氨基酸、可溶性蛋白及可溶性糖含量的影响 Fig. 1 Effects of soil pH on contents of free amino acid, soluble proteins and soluble sugar in G. longituba |
氧化物歧化酶(SOD)、过氧化物酶(POD)、过氧化氢酶(CAT)是主要的抗氧化酶,能清除植物体内多余的自由基,防止自由基的毒害;丙二醛(MDA)是膜脂过氧化最重要的产物之一,可通过MDA了解膜脂过氧化的程度,以间接测定膜系统受损程度以及植物的抗逆性。不同土壤pH对活血丹叶片SOD、POD、CAT活性及MDA含量的影响结果见图 2:SOD、POD及CAT活性随着土壤pH的增加呈先增后降的趋势,最大值出现在土壤pH 6.5时,分别为310.32 U/g、3 615.56 U/(g·min)和25.84 mg/(g·min),SOD和CAT活性在不同处理间有显著差异,但POD活性在不同处理间的差异未达显著水平。
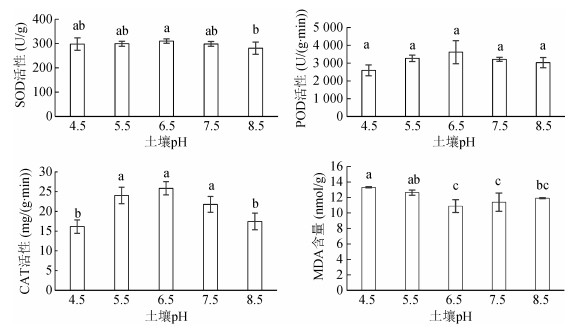
|
图 2 土壤pH对活血丹叶片保护酶活性及丙二醛含量的影响 Fig. 2 Effects of soil pH on activities of SOD, POD, CAT and contents of MDA in G. longituba |
MDA含量随着土壤pH的增加呈先减少后增加的趋势,在pH 6.5时为最小值10.88 nmol/g,分别较其他处理少18.24%、13.83%、4.44%和8.65%。pH 6.5处理的保护酶活性和MDA含量与pH 7.5处理均未达到显著性差异。
2.2 土壤pH对活血丹生长的影响不同的土壤pH对活血丹生长指标具有显著的影响,其结果如表 3所示。
|
|
表 3 土壤pH对活血丹生长的影响 Table 3 Effects of soil pH on growth indexes of G. longituba |
可耐受土壤pH范围内,活血丹植株生长和干物质积累量均随土壤pH的增加而呈现先升后降的趋势,在土壤pH 6.5时与其他处理有显著差异,植株生长最为健壮:如叶片长、宽较其他处理显著增大,叶片长宽比显示此时叶片更扁一些;茎长最大值60.53 cm分别为其他处理的2.22、1.71、1.39和1.51倍;茎直径最大值1.38 mm分别为其他处理的1.42、1.26、1.24和1.44倍,尤其活血丹干物质积累量甚至可以达到其他处理的7.16、2.26、1.21、1.96倍。但折干率在不同处理间未达到显著性差异,这可能与植物在适宜土壤pH条件下的水分吸收特性相关。
2.3 土壤pH对活血丹药材品质的影响土壤pH对活血丹药材醇溶性浸出物及活性成分的含量影响结果如图 3所示,不同土壤pH下,活血丹醇溶性浸出物含量均高于250 mg/g,符合药典规定标准。活血丹内总黄酮含量在土壤pH 4.5 ~ 8.5之间呈单峰曲线,峰值在土壤pH 6.5处,为15.73 mg/g,与除pH 5.5处理外的总黄酮含量差异显著。就三萜酸含量而言,齐墩果酸和熊果酸含量的最高值0.71 mg/g和2.87 mg/g也出现在土壤pH 6.5时,与其他处理达显著性差异。植株内3种酚酸随土壤pH的变化则不尽相同,植株绿原酸和咖啡酸含量随土壤pH的增加为先增加后稳定的趋势,在pH 6.5 ~ 8.5之间显著高于pH 4.5和pH 5.5处理;迷迭香酸含量的变化比较复杂,呈现降-升-降的趋势,pH 7.5时最高,为2.26 mg/g,与其他处理均达到显著性差异。

|
图 3 土壤pH对活血丹化学成分含量的影响 Fig. 3 Effects of soil pH on contents of active ingredients inG. longituba |
本研究发现活血丹光合色素在土壤pH 4.5 ~ 8.5之间,随着土壤pH增加呈先增后减的趋势,在pH 6.5达到最大值。喻崎雯等[21]曾对不同土壤pH对普通野生稻生理特性的影响研究发现叶绿素含量随着pH的增加先增后减;孙晓刚等[7]也提出酸碱胁迫下牡丹3个品种的chla、chlb、chla+b的含量有所下降,降幅随胁迫程度的加深而增大,不利土壤pH会提高色素酶的活性,加速光合色素降解。
试验中活血丹叶片氨基酸、可溶性糖和可溶性蛋白含量随着土壤pH的增加呈先降后升的趋势,谷值在土壤pH 6.5出现,可能是由于土壤pH 4.5、5.5、7.5、8.5对于活血丹生长造成一定胁迫作用,影响了光合产物的积累,该情况在土壤pH 4.5时更为显著。而康洪梅等[22]研究表明毛枝五针松可溶性糖及脯氨酸含量随着pH的增加先增加后减少;喻崎雯等[21]研究表明在pH为6.8的中性条件下,普通野生稻叶片可溶性糖含量最高。这可能是因为土壤pH是活血丹生长的关键因素,不良土壤pH条件下,活血丹植株合成更多的氨基酸、可溶性糖和可溶性蛋白等渗透调节物质来增强其抵抗能力,具体机理有待进一步深入研究。
本研究显示随土壤pH的增加,超氧化物歧化酶(SOD),过氧化物酶(POD)和过氧化氢酶(CAT)均呈先增加后减少的趋势,且均在pH 6.5达到最大值,pH 5.5 ~ 7.5处理间差异均不显著,表明在pH 5.5 ~ 7.5时活血丹叶片抗氧化和抗衰老能力较强。冯建灿等[11]也提出过喜树中保护酶活性随着pH的增加先增后减。试验中活血丹丙二醛(MDA)含量在pH 6.5和pH 7.5时较低,其他pH处理下MDA含量显著升高,而崔喜艳等[10]研究表明烟草MDA含量与pH增长呈正相关,这可能是由于所研究物种和植物不同生长期的差异而造成的。
3.2 活血丹生长与土壤pH的相关性土壤pH对土壤肥力及养分的有效性影响很大[23],土壤过酸或过碱,都会降低植物所需养分的有效性,导致植株某些元素营养失调[24]。活血丹植株在土壤pH 6.5 ~ 7.5形态最为饱满健壮,干物质积累量最大,即适宜土壤pH的养分有效性高、利于活血丹的生长及生物量的积累,而不利酸碱条件时土壤养分有效性降低、肥力下降,任广炼和李凌[3]、卿尚模等[4]、孙晓刚等[7]、伍杰等[8]学者也曾有类似报道。但折干率变化趋势随土壤pH的增加先减后增,且没有达到显著差异,可能是在不利酸碱条件下,活血丹细胞失水导致含水量降低所致。
3.3 活血丹药材品质形成与土壤pH的相关性绿原酸、咖啡酸与迷迭香酸三者具有较强的抗氧化、抑菌、抗炎药理作用[25-27],曾有学者从活血丹中检测并分离到[28],此外也有报道将总黄酮、熊果酸和齐墩果酸作为活血丹质量评价的指标性成分[29-30],同时结合药典标准,本试验选择醇溶性浸出物、总黄酮、三萜酸类(齐墩果酸及熊果酸)、酚酸类(绿原酸、咖啡酸与迷迭香酸)共同作为活血丹药材品质评价参考指标。试验中活血丹药材醇溶性浸出物、总黄酮、齐墩果酸及熊果酸含量最大值均在土壤pH 6.5 ~ 7.5时,随着土壤酸碱度的增强其含量减少。尚辛亥等[31]曾报道在适宜的土壤中生长的高山红景天活性成分和产量最高。许兴等[32]也提出土壤含盐量过高与过低都不利于枸杞果实多糖含量的积累。活血丹药材绿原酸、咖啡酸及迷迭香酸含量三者变化大趋势类同,绿原酸和咖啡酸在pH 6.5 ~ 8.5含量较高但彼此间无显著差异,迷迭香酸在pH 7.5含量最高,即表明酚酸类物质在中性和碱性土壤中积累较多。可能是碱性土壤中,养分有效性降低,促进了活血丹产生酚酸类物质以抵御不良生长环境。
4 结论活血丹在pH 4.5 ~ 8.5均能生长且醇溶性浸出物均能达到药典规定标准,在pH 9.5土壤中不能存活;不同土壤pH对活血丹生长指标、生理指标及其药材品质形成影响显著,中性微酸性土壤利于活血丹茎叶生长、光合色素形成、干物质积累及其指标性成分的形成。
| [1] |
赵彦坤, 张文胜, 王幼宁, 等. 高pH对植物生长发育的影响及其分子生物学研究进展[J]. 中国生态农业学报, 2008, 16(3): 783-787 (  0) 0) |
| [2] |
唐琨, 朱伟文, 周文新, 等. 土壤pH对植物生长发育影响的研究进展[J]. 作物研究, 2013, 27(2): 207-212 DOI:10.3969/j.issn.1001-5280.2013.02.25 (  0) 0) |
| [3] |
任广炼, 李凌. 不同pH值处理对黄连木幼苗生长的影响[J]. 贵州林业科技, 2014, 42(4): 17-20 (  0) 0) |
| [4] |
卿尚模, 易时来, 朱旭荣, 等. 不同土壤pH值对资阳香橙等4种柑桔砧木苗生长的影响[J]. 中国南方果树, 2007, 36(6): 10-12 DOI:10.3969/j.issn.1007-1431.2007.06.004 (  0) 0) |
| [5] |
皇甫诗男, 高庆玉, 张丙秀, 等. 不同土壤pH对蓝莓光合作用的影响[J]. 北方园艺, 2017(13): 31-37 (  0) 0) |
| [6] |
刘爽, 王庆成, 刘亚丽, 等. 土壤酸度对脂松苗木光合和叶绿素荧光的影响[J]. 应用生态学报, 2009, 20(12): 2905-2910 (  0) 0) |
| [7] |
孙晓刚, 王莉莉, 郭太君. 土壤pH值对3个牡丹品种的生长及光合特性的影响[J]. 东北林业大学学报, 2016, 44(3): 42-46 DOI:10.3969/j.issn.1000-5382.2016.03.009 (  0) 0) |
| [8] |
伍杰, 刘燕云, 兰常军, 等. 土壤pH值对康定木兰幼苗生长的影响[J]. 四川林业科技, 2017, 38(3): 88-92 (  0) 0) |
| [9] |
吴泽富, 周运超, 张静, 等. 粗壮女贞(苦丁茶)生理特性对pH胁迫的响应[J]. 贵州农业科学, 2012, 40(1): 47-50 DOI:10.3969/j.issn.1001-3601.2012.01.015 (  0) 0) |
| [10] |
崔喜艳, 陈展宇, 张美善, 等. 土壤pH值对烤烟叶片生理生化特性的影响[J]. 植物生理学通讯, 2005, 41(6): 737-740 (  0) 0) |
| [11] |
冯建灿, 邓建钦, 张玉洁, 等. 培养液pH值对喜树幼苗生长与SOD活性、脯氨酸和叶绿素含量的影响[J]. 经济林研究, 2001, 19(3): 6-8 DOI:10.3969/j.issn.1003-8981.2001.03.002 (  0) 0) |
| [12] |
崔秀明, 陈中坚, 王朝梁, 等. 土壤环境条件对三七皂甙含量的影响[J]. 人参研究, 2000, 12(3): 18-21 (  0) 0) |
| [13] |
雷立, 任宏力, 李惠民, 等. 商洛不同产地连翘有效成分含量与土壤因子的相关性研究[J]. 山东农业科学, 2016, 48(05): 55-57, 61 (  0) 0) |
| [14] |
毛玉东, 梁社往, 何忠俊, 等. 土壤pH对滇重楼生长、养分含量和总皂甙含量的影响[J]. 西南农业学报, 2011, 24(3): 985-989 DOI:10.3969/j.issn.1001-4829.2011.03.031 (  0) 0) |
| [15] |
孔璐, 黎云祥, 权秋梅, 等. 不同群落类型柔毛淫羊藿总黄酮和淫羊藿苷含量及其与土壤因子的关系[J]. 应用生态学报, 2010, 21(10): 2517-2522 (  0) 0) |
| [16] |
银玲, 彭月, 陈鸿平, 等. 川芎有效成分与土壤营养值相关性研究[J]. 中国实验方剂学杂志, 2013, 19(24): 121-125 (  0) 0) |
| [17] |
国家药典委员会.中华人民共和国药典(一部)[S].北京: 中国医药科技出版社, 2015: 170
(  0) 0) |
| [18] |
金淑琴. 金钱草、广金钱草、连钱草的考证及临床应用[J]. 首都医药, 2001, 8(11): 54 DOI:10.3969/j.issn.1005-8257.2001.11.049 (  0) 0) |
| [19] |
李建兵. 连钱草泡服为主防治胆道结石术后复发[J]. 江西中医药, 2004, 35(3): 21 DOI:10.3969/j.issn.0411-9584.2004.03.012 (  0) 0) |
| [20] |
李合生. 植物生理生化试验原理和技术[M]. 北京: 高等教育出版社, 2000
(  0) 0) |
| [21] |
喻崎雯, 马祖陆, 伊文超, 等. 不同土壤pH对普通野生稻生理特性的影响[J]. 安徽农业科学, 2013, 41(2): 473-475, 478 DOI:10.3969/j.issn.0517-6611.2013.02.002 (  0) 0) |
| [22] |
康洪梅, 张珊珊, 杨文忠, 等. 土壤pH值对极小种群毛枝五针松生理特性的影响[J]. 东北林业大学学报, 2016, 44(6): 4-6, 10 DOI:10.3969/j.issn.1000-5382.2016.06.002 (  0) 0) |
| [23] |
乔红波, 张慧, 高瑞, 等. 三门峡烟区土壤pH时空变异特征[J]. 中国烟草科学, 2010, 31(4): 48-51 DOI:10.3969/j.issn.1007-5119.2010.04.010 (  0) 0) |
| [24] |
赵静, 沈向, 李欣, 等. 梨园土壤pH值与其有效养分相关性分析[J]. 北方园艺, 2009(11): 5-8 (  0) 0) |
| [25] |
Wen A M, Delaquis P, Stanich K, et al. Antilisterial activity of selected phenolic acids[J]. Food Microbiology, 2003, 20(3): 305-311 DOI:10.1016/S0740-0020(02)00135-1 (  0) 0) |
| [26] |
Orban Z, Mitsiades N, Burke T R, et al. Caffeic acid phenethyl ester induces leukocyte apoptosis, modulates nuclear factor-kappa B and suppress acute inflammation[J]. Neurolmmuno Modulation, 2000, 7(2): 99-105 (  0) 0) |
| [27] |
周丹, 刘艾林, 杜冠华. 迷迭香酸的药理学研究进展[J]. 中国新药杂志, 2011, 20(7): 594-598 (  0) 0) |
| [28] |
朱求方, 王永毅, 瞿海斌. 连钱草的化学成分研究[J]. 中草药, 2013, 44(4): 387-390 (  0) 0) |
| [29] |
刘丽, 李姿, 马雪莲, 等. 外源水杨酸处理对活血丹中次生代谢产物积累的影响[J]. 南京农业大学学报, 2016, 39(3): 379-385 (  0) 0) |
| [30] |
黄天赐.不同产地连钱草药材质量分析和比较的研究[D].武汉: 湖北中医药大学, 2013 http://cdmd.cnki.com.cn/Article/CDMD-10507-1013207410.htm
(  0) 0) |
| [31] |
尚辛亥, 王洋, 阎秀峰. 土壤水分对高山红景天生长和红景天苷含量的影响[J]. 植物生理学通讯, 2003, 39(4): 335-336 (  0) 0) |
| [32] |
许兴, 郑国琦, 周涛, 等. 宁夏枸杞耐盐性与生理生化特征研究[J]. 中国生态农业学报, 2002, 10(3): 74-77 (  0) 0) |
 2019, Vol. 51
2019, Vol. 51


