2. 云南省农业科学院花卉研究所,昆明 650205;
3. 江苏省地理信息资源开发与利用协同创新中心,南京 210023;
4. 南京师范大学江苏省物质循环与污染控制重点实验室,南京 210023
芥蓝,又名甘蓝菜、盖蓝菜,为十字花科芸薹属一年生草本植物,以肥嫩的花薹和嫩叶供食用,是我国的特产蔬菜之一,广泛分布于广东、广西、福建和云南等地[1]。随着人们生活水平的提高,芥蓝的社会需求量逐年增加,从而驱动了芥蓝的规模化和集约化种植。但高强度单一的种植模式以及不合理的养分管理导致土壤连作障碍问题日益突出,特别是土传根肿病害发生严重,每年因根肿病造成芥蓝减产20%,严重时可达70%,甚至绝收[2-3]。十字花科根肿病是由芸薹根肿菌(Plasmodiophora brassicae Woron)引起的土传植物病害,该病原菌专性寄生,在无寄主植物存在时,其休眠孢子仍能在土壤中存活达20 a之久。所以,土壤一旦感染了该病原菌,将不再适宜十字花科植物的种植[4]。此外,因过量施肥导致的土壤酸化和重金属积累也是引起芥蓝产量和品质下降的原因之一[5]。
目前,生产上防控十字花科根肿病的主要措施包括农业防治、生物防治和化学防治。利用非寄主作物轮作是解决根肿病高发最为有效的传统方法,但是由于规模化种植区有较为成熟的生产-销售产业链,轮作往往会限制该产业的稳定发展;且轮作的作物常常经济效益不高,受地租成本不断上涨的限制,轮作已无法满足芥蓝现代化生产的要求[6]。而通过向连作土壤中添加拮抗微生物对防控根肿病具有一定的效果[7],但是其效果往往不稳定,这可能与连作后的土壤环境不一定适合外源添加有益菌的生长,而且这些外源添加的有益菌还需要与土著微生物进行养分和生态位的竞争有关[8]。而使用化学防治的方法,往往能够获得较好的效果;但是由于农药施用量大,在土壤中易积累,严重威胁着农产品安全和人体健康[9]。强还原土壤处理(Reductive soil disinfestation, RSD)是一种作物种植前的土壤处理方法,能够有效缓解土壤酸化、次生盐渍化,杀灭土传病原菌,改善土壤结构,重建土壤微生物区系,从而消除土壤连作障碍[10-11]。Liu等[12]的研究表明,杀菌效率不仅受有机物料中易分解有机碳含量的影响,还受有机物料类型的影响。因此,本研究以云南省昆明市安宁县八街镇的芥蓝生产基地为研究对象,研究液体有机物料和固体有机物料RSD处理对芥蓝连作系统产量、发病率、重金属有效性、病原菌数量及微生物活性的影响,旨在寻求一种快速修复芥蓝连作蔬菜地的方法,为芥蓝等十字花科作物可持续生产提供一定的理论依据和技术支持。
1 材料与方法 1.1 试验地概况田间试验位于云南省昆明市安宁县八街镇的芥蓝生产基地(24°42′N,102°22′E),属亚热带高原季风气候,季节温差不大,干湿季分明。年平均气温14.9 ℃,年平均降水量约为1 000.5 mm。试验前该基地已连续多年种植芥蓝,土壤连作障碍发生严重,芥蓝产量由最初的10.5 t/hm2下降至处理前的6 t/hm2。试验前0 ~ 20 cm土层的基本理化性质为pH 6.99,电导率0.45 mS/cm,有机碳和全氮含量分别为35.1 g/kg和2.88 g/kg。
1.2 试验设计田间试验共设置3个处理:①不做任何土壤处理的对照(CK);②固体有机物料RSD处理,即在土壤表面均匀添加12 t/hm2固体有机物料(C/N:122)后通过旋根机将其与耕作层土壤混合均匀,灌溉至田间最大持水量并覆膜(RSD_BA);液体有机物料RSD处理,即在土壤表面通过喷灌的方式均匀添加6 t/hm2液体有机物料(C/N:30),灌溉至田间最大持水量并覆膜(RSD_MO)。各处理重复3次,按随机排列分布。每个小区面积120 m2 (3 m × 40 m),各小区之间用60 cm深、30 cm宽的水泥埂隔开。RSD处理过程中的土壤温度为30 ~ 40 ℃,处理时间为25 d。
1.3 土壤样品采集及预处理待RSD处理结束后,揭开塑料薄膜,采集土壤样品。各小区按“S”形采样路线,用采样器(直径为2.5 cm)随机采取8个0 ~ 20 cm的土芯,混合均匀后剔除植物残根和石砾等杂质,过2 mm筛。过筛后的新鲜土壤样品分成两部分:一部分保存于4 ℃用于土壤理化性质和微生物活性的测定;一部分保存于–80 ℃用于土壤基因组DNA的提取。
1.4 测定方法 1.4.1 土壤pH、电导率(EC)和NO3--N的测定土壤pH(水土比2.5︰1)采用S200K pH计(Mettler, Switzerland)测定;电导率EC(水土比5︰1)采用DDS-320电导率仪(Dapu, China)测定。土壤中NO3--N用2 mol/L的KCl浸提,浸提液过滤后用流动分析仪(Skalar San++, The Netherlands)测定。
1.4.2 土壤有效态重金属含量的测定土壤中B元素用沸水法提取[13],称取10 g土样,按水土比2︰1用沸水浸提15 min,稍冷却后立即干过滤,滤液保存待测定;土壤中Fe、Mn、Zn和Cu元素用M3法提取,称取3 g过2 mm筛的干土至125 ml锥形瓶中,加入30 ml M3浸提液,摇床浸提5 min,过滤后滤液保存待测定。土壤中B、Fe、Mn、Zn和Cu采用电感耦合等离子体原子发射光谱法测定。
1.4.3 土壤DNA的提取和细菌、真菌、芸薹根肿菌的定量称取0.5 g置于–80 ℃冰箱中的土壤,用BioFast Soil Genomic DNA Extraction Kit(Bioer Technology Co., Ltd., Hangzhou, China)按说明书上的步骤进行土壤总DNA的提取,所有DNA样品保存在–20 ℃冰箱待用。
用于定量细菌16S rRNA、真菌ITS和芸薹根肿菌18S rRNA基因的引物如表 1所示。Real-time PCR扩增反应在CFX96TM Real-Time System(Bio-Rad Labora tories Inc.,Hercules,CA,USA)上进行。扩增体系为10 μl SYBR® Premix Ex TaqTM (2×,Takara,中国大连),正、反向引物各1 μl,2 μl的DNA模板和6 μl无菌去离子水。PCR的反应条件如表 1所示,各基因的标准曲线参照López-Mondéjar等[14]的方法构建。
|
|
表 1 定量PCR所用的引物和反应条件 Table 1 Primers and PCR conditions used in quantitative real-time PCR |
土壤微生物活性的测定参照Adam和Duncan[20]的方法。称取过2 mm筛的鲜土2 g,置于50 ml离心管中,分别加入15 ml磷酸缓冲液(60 mmol/L,pH 7.6)和0.2 ml FDA溶液(1 000 μg/ml),用封口膜封口,在30℃、100 r/min条件下反应20 min,结束后立即加入15 ml氯仿/甲醇(2︰1)溶液终止反应,2 000 r/min离心3 min后取上清液过0.22 μm有机相滤膜,滤液用分光光度计在490 nm处测定吸光值。标准曲线浓度由0、1、2、3、4 μg/ml建立,R2为0.999 9。
1.4.5 芥蓝产量及根肿病发病率的测定待所有芥蓝花薹收获以后,统计各小区花薹的累计重量,计算产量;并在各小区随机选取50棵芥蓝植株,统计根部有膨大根瘤的植株数,计算得到芥蓝根肿病的发病率。
1.5 统计分析采用SPSS 19.0进行统计分析,单因素方差(One- way ANOVA)配合Fisher’s LSD检验多处理间均值差异的显著性;Spearman相关性分析检验芥蓝产量、发病率与芸薹根肿病病原菌数量和微生物活性之间以及土壤pH和有效态重金属含量之间的相关性。
2 结果与分析 2.1 不同有机物料土壤强还原处理对土壤理化性质的影响如表 2所示,与CK处理相比,土壤强还原处理(RSD_BA,RSD_MO)均能显著(P < 0.05)提升土壤pH,且RSD_BA处理后土壤pH高于RSD_MO处理,但差异不显著(P > 0.05)。不同有机物料土壤强还原处理对电导率无显著影响,但RSD_BA的电导率较CK和RSD_MO处理有明显降低。与CK处理相比,RSD_BA和RSD_ MO处理均能显著(P < 0.05)降低土壤中NO3--N的含量,且RSD_BA处理中NO3--N的含量最低,仅为19.18 mg/kg。结果表明:土壤强还原处理能够有效消除土壤中积累的NO3--N,缓解土壤酸化问题,且RSD_BA处理对土壤酸化和盐渍化问题的改良效果优于RSD_MO处理,这可能与
|
|
表 2 不同有机物料土壤强还原处理对土壤化学性质的影响 Table 2 Effects of reductive soil disinfestation incorporated with different organic substrates on soil chemical properties |
RSD_BA处理中有机物料的添加量较大,有机物的组成也更复杂,能够刺激更多厌氧微生物如反硝化微生物的生长,而NO3--N在被反硝化微生物还原成N2、N2O等气体的过程中消耗了大量的H+有关。此外,由于固体较液体有机物料更难分解,因此在土壤强还原过程中发挥作用的时间也更长,从而加强了NO3--N的去除。
2.2 不同有机物料土壤强还原处理对土壤有效态重金属含量的影响如表 3所示,与CK处理相比,RSD_MO和RSD_BA处理均能显著(P < 0.05)降低土壤有效态Fe,Mn,Zn,Cu和B的含量,其中RSD_MO处理后各有效态重金属含量分别降低了71.3%、79.7%、85.6%、73.6%和46.1%;而RSD_BA处理后分别降低了71.9%、79.3%、85.3%、76.6%和51.0%,但RSD_MO和RSD_BA处理间各有效态重金属含量均无显著差异(P > 0.05)。结果表明:土壤强还原处理能够显著降低土壤中有效态重金属的含量,减少因重金属积累对植物造成的毒害作用,同时还能降低作物重金属超标的风险,这可能与土壤强还原处理后pH显著上升,重金属活性被钝化有关。Spearman相关性分析显示土壤pH和有效态重金属含量呈显著(P < 0.05)负相关,验证了土壤强还原处理能够通过提高土壤pH来降低土壤中有效性重金属的含量(表 4)。
|
|
表 3 不同有机物料土壤强还原处理对土壤有效态重金属含量的影响 Table 3 Effects of reductive soil disinfestation incorporated with different organic substrates on soil available heavy metal contents |
|
|
表 4 土壤pH和有效态重金属含量的Spearman相关性分析 Table 4 Spearman correlation coefficients between soil pH and available heavy metal contents |
如图 1A和1B所示,与CK处理相比,RSD_MO和RSD_BA处理均能显著(P < 0.05)增加土壤中细菌数量,减少土壤真菌数量,但RSD_MO和RSD_BA处理间细菌和真菌的数量均无显著差异(P > 0.05)。由图 1C可知,RSD处理后,土壤中芸薹根肿菌的数量均有所下降,且在RSD_BA处理中达到显著;RSD_MO和RSD_BA处理的杀菌率分别为63.2%和90.6%。与CK处理相比,RSD_MO和RSD_BA处理均显著(P < 0.05)提高土壤细菌/真菌(B/F),且RSD_MO处理的B/F值显著高于RSD_BA处理(图 1D)。这表明,土壤强还原处理能够显著增加B/F值,促使微生物区系由连作后具有高病原菌数量的“真菌型”向土壤强还原处理后病原菌数量显著下降、细菌数量显著增加的“细菌型”转变。另外,RSD_BA处理的杀菌率较RSD_MO处理高,这可能与RSD_BA处理中有机物料的添加量较大,能够在土壤强还原过程中释放出更多的杀菌物质有关;也可能是因为固体有机物料在土层中是没有移动性的,仅在混匀的土层产生还原作用,而液体有机物料在一定程度上会向深层土壤下渗,从而稀释了土壤还原作用,导致杀菌率不高。
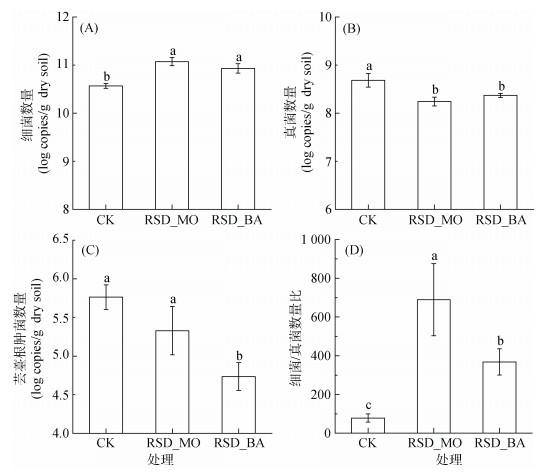
|
(图柱上方小写字母不同表示处理间差异达到P < 0.05显著水平,下图同) 图 1 不同有机物料土壤强还原处理对土壤中细菌、真菌数量,细菌/真菌比及芸薹根肿菌数量的影响 Fig. 1 Effects of reductive soil disinfestation incorporated with different organic substrates on populations of bacteria, fungi, Plasmodiophora brassicae and B/F ratio |
如图 2所示,与CK处理相比,RSD处理均能显著(P < 0.05)增加土壤微生物活性,其中RSD_MO和RSD_BA处理分别增加1.5倍和2倍,且RSD_MO和RSD_BA处理间差异显著(P < 0.05)。结果表明:土壤强还原过程中,微生物能够分解利用有机物料中的碳、氮源,为自身的生长提供养分和能量,从而提高微生物活性;而RSD_BA处理的微生物活性显著高于RSD_MO处理,这可能与RSD_BA处理中有机物料的添加量较大,有机物的组成也更复杂,能够刺激更多的微生物种类生长有关。
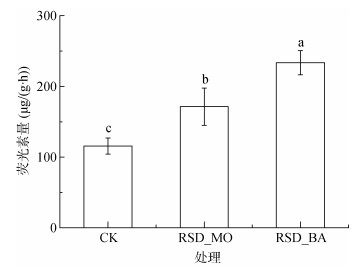
|
图 2 不同有机物料土壤强还原处理对土壤微生物活性的影响 Fig. 2 Effects of reductive soil disinfestation incorporated with different organic substrates on soil microbial activity |
如图 3A所示,土壤强还原处理均能显著(P < 0.05)增加芥蓝产量,与CK处理相比,RSD_MO和RSD_BA处理的产量分别增加6.5和9.6 t/hm2,增幅分别达到268%和397%。由图 3B可知:土壤强还原处理均能显著(P < 0.05)降低根肿病的发病率,与CK处理相比,RSD_MO和RSD_BA处理的发病率分别降低了37.3%和56.7%,防控率分别达到60.9%和92.4%。结果表明:RSD_BA处理对产量的增幅明显(P < 0.05)优于RSD_MO处理,这可能与RSD_BA处理后根肿病的发病率较低有关,也可能与RSD_BA处理中有机物料的添加量较大,能够为芥蓝的生长提供更多的养分有关。
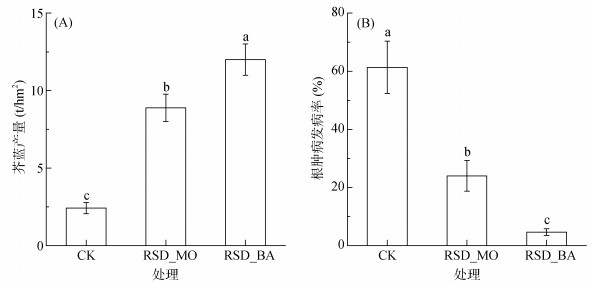
|
图 3 不同有机物料土壤强还原处理对芥蓝产量(A)与根肿病发病率(B)的影响 Fig. 3 Effects of reductive soil disinfestation incorporated with different organic substrates on yield (A) and clubroot disease incidence (B) of Chinese kale |
相关性分析显示:芥蓝的产量与根肿病发病率和芸薹根肿菌数量呈显著(P < 0.05)负相关,与微生物活性呈显著(P < 0.05)正相关;而土壤微生物活性与根肿病的发病率和芸薹根肿菌的数量均呈显著(P < 0.05)负相关(表 5)。结果表明:RSD处理以后,土壤中病原菌的数量下降,微生物活性增强,土壤抑病能力加强,进而减少根肿病的发生率,提高芥蓝产量。
|
|
表 5 芥蓝产量、根肿病发病率、病原菌数量和微生物活性之间的Spearman相关性分析 Table 5 Spearman correlation coefficients between yield, disease incidence, Plasmodiophora brassicae abundance, and microbial activity |
因单一作物连续种植和“大水大肥大药”的管理方式引起的土壤酸化、次生盐渍化、病原菌富集是作物产生连作障碍的主要因素,严重制约着我国可持续农业的发展[21]。土壤强还原处理是一种高效环保的杀菌方法,具有处理时间短、不耽误农时的优点,且在缓解甜瓜、香蕉和洋桔梗连作障碍中取得了较好的效果[22-23]。在本研究中,固体或者液体有机物料的土壤强还原处理均能显著提高土壤pH,减少硝酸盐的积累,这是因为在强还原条件下土壤NO3--N和SO42-等离子的还原会消耗大量的H+,从而达到有效缓解土壤酸化和盐渍化的目的,这与朱同彬等[24]的研究结果一致。有研究表明:Fe、Mn、Zn、Cu、B等植物生长所必需的微量金属元素,在植物体内积累过多也会导致植物中毒,从而造成作物减产[25-28]。另外,连作导致的土壤酸化能够促进重金属的活化和释放,使其从残渣态转化为有效态,从而威胁植物的正常生长[29]。本研究发现,强还原处理在提升土壤pH的同时,钝化了重金属的有效性,使土壤中有效态的重金属含量在植物正常生长所需的范围内,从而有效解决了植物因重金属富集导致的农产品安全问题和因重金属中毒产生的减产问题。
土壤微生物生态失衡,病原菌富集、有益菌减少是土壤连作土传病害频发的关键原因[30]。薛超等[31]的研究表明,土壤连作后驱使微生物区系由“细菌主导型”向“真菌主导型”转化。土壤B/F是衡量土壤质量的生物指标之一。本研究中,固体或液体有机物料的土壤强还原处理均能显著提高土壤B/F,比对照处理增加4倍以上,这在一定程度上表明微生物区系由连作诱导的高病原菌数量的“真菌型”向土壤强还原后病原菌数量显著下降、细菌数量显著增加的“细菌型”转化。另外,液体有机物料土壤强还原处理的B/F值显著高于固体有机物料处理,这是因为液体有机物料的C/N较固体有机物料低,且易分解有机碳的含量较高,可以刺激更多的细菌迅速生长繁殖,从而增加土壤B/F值。植物的发病率与土壤中的病原菌数量呈正相关。因此,有效降低土壤中病原菌的数量是所有灭菌方法成功与否的关键。本研究发现,固体或液体有机物料的土壤强还原处理均能降低土壤中芸薹根肿菌的数量,这是因为在土壤强还原过程中,厌氧微生物通过利用有机物料中易分解的部分,产生一些具有杀菌作用的小分子有机酸、离子、有毒气体等,从而对病原菌起到杀灭作用[32-33]。此外,芸薹根肿菌是好氧性真菌,土壤强还原过程中营造的厌氧环境也是导致其死亡、数量下降的原因之一。而固体有机物料强还原处理的杀菌效果更好,达到90.6%,这是因为固体有机物料与耕作层土壤混匀后不会随着灌溉水而移动,因此只在耕作层土壤经微生物分解并产生杀菌作用,而液体有机物料与灌溉水混合后会随着土壤下渗,能在更深的土层产生作用的同时,也减弱了强还原在耕作层的杀菌作用。田间试验与实验室的控制试验不同,在实验室条件下,液体或固体有机物料均能与病土充分混合,不会出现液体有机物料下渗的情况,因此得出的液体田间理论施用量可能偏低,下一步的田间试验需增加液体有机物料的施用量,看能否增加杀菌效率。此外,固体有机物料的组成更复杂,且更难分解利用,因此在强还原过程中对微生物区系的改良效果优于液体有机物料,且能维持更长的有效杀菌时间,从而达到更好的杀菌效率,这与刘亮亮等[22]的研究结果类似。
杀菌率是衡量土壤灭菌成功与否的关键,而作物再次连作之后的发病率及产量才是衡量灭菌方法能否有效缓解作物连作障碍的重要指征。Zhao等[30]的研究表明,土壤灭菌以后,在连作黄瓜根系分泌物的影响下,土壤中尖孢镰刀菌的数量显著提升,但是未能到达发病的数量阈值,仍能确保当季黄瓜获得较高的产量。本研究结果与此一致,我们发现土壤强还原处理后,芥蓝的发病率显著低于对照,减少了37.3% ~ 56.7%;而产量显著高于对照,增幅达到268% ~ 379%,恢复到新土的生产力。土壤强还原处理不仅是一种高效的土壤灭菌方法,而且也是一种有效改善土壤结构、恢复土壤微生物活性的方法[11]。本研究发现,土壤强还原处理后,土壤微生物活性增加1.5 ~ 2倍,从而提升了微生物养分转换和土壤抑病能力,使得作物连作以后,病原菌数量虽然有所回升,但植物发病率仍能控制在符合农业生产的范围之内。
本研究的结果表明,固体有机物料土壤强还原处理,能够较液体有机物料取得更显著的杀菌效果,从而在芥蓝连作以后,根肿病的发病率更低,产量更高,是一种能够快速缓解十字花科蔬菜地连作障碍,实现可持续种植的有效措施。而关于一次土壤强还原处理能维持芥蓝等十字花科蔬菜连作种植多少茬,目前还不得而知,有待进一步的研究。
| [1] |
杨仕春.不同甘蓝与白菜品种抗根肿病鉴定及土壤中根肿菌检测研究[D].重庆: 西南大学, 2013
(  0) 0) |
| [2] |
岳芹湘. 十字花科根肿病发生及综合防治技术[J]. 云南农业, 2013(10): 25-26 DOI:10.3969/j.issn.1005-1627.2013.10.017 (  0) 0) |
| [3] |
索欢, 陈龙正, 徐海, 等. 十字花科根肿病研究进展[J]. 安徽农业科学, 2015(14): 115-117 DOI:10.3969/j.issn.0517-6611.2015.14.046 (  0) 0) |
| [4] |
杜艳, 刘邮洲, 李建斌, 等. 十字花科根肿病研究现状及展望[J]. 江苏农业科学, 2014, 42(10): 122-126 DOI:10.3969/j.issn.1002-1302.2014.10.038 (  0) 0) |
| [5] |
柴阿丽, 朱发娣, 王惟萍, 等. 十字花科根肿病接种技术及发病条件研究[J]. 华北农学报, 2015, 30(s1): 266-271 DOI:10.7668/hbnxb.2015.S1.048 (  0) 0) |
| [6] |
陈静.荞麦与甘蓝轮间作对甘蓝根肿病防治效果的研究[D].重庆: 西南大学, 2015
(  0) 0) |
| [7] |
钱玲, 童江云, 赵明朗, 等. 微生物肥对连作障碍土壤上芥蓝生长的影响[J]. 长江蔬菜, 2015(4): 54-56 DOI:10.3865/j.issn.1001-3547.2015.04.019 (  0) 0) |
| [8] |
孙良菲, 任佐华, 彭沙莎, 等. 白菜根肿病菌拮抗微生物的筛选及防治效果评价[J]. 湖南农业科学, 2013(1): 84-87 DOI:10.3969/j.issn.1006-060X.2013.01.023 (  0) 0) |
| [9] |
Hiroharu M, Seiya T, Yukiko K, et al. Reduction of resting spore density of Plasmodiophora brassicae and clubroot disease severity by liming[J]. Soil Science & Plant Nutrition, 2002, 48(5): 685-691 (  0) 0) |
| [10] |
朱同彬, 孟天竹, 张金波, 等. 强还原方法对退化设施蔬菜地土壤的修复[J]. 应用生态学报, 2013, 24(9): 2619-2624 (  0) 0) |
| [11] |
蔡祖聪, 张金波, 黄新琦, 等. 强还原土壤灭菌防控作物土传病的应用研究[J]. 土壤学报, 2015, 52(3): 469-476 (  0) 0) |
| [12] |
刘亮亮, 崔慧灵, 孔继婕, 等. 强还原处理所使用有机物料与其杀菌效果的相互关系[J]. 植物保护, 2017, 43(2): 73-81 DOI:10.3969/j.issn.0529-1542.2017.02.012 (  0) 0) |
| [13] |
马玲, 刘军, 程丽娅. 沸水浸提-ICP法直接测定土壤有效硼[J]. 安徽地质, 2007, 17(3): 193-197 DOI:10.3969/j.issn.1005-6157.2007.03.009 (  0) 0) |
| [14] |
Lópezmondéjar R, Antón A, Raidl S, et al. Quantification of the biocontrol agent Trichoderma harzianum with real-time TaqMan PCR and its potential extrapolation to the hyphal biomass[J]. Bioresource Technology, 2010, 101(8): 2888-2891 (  0) 0) |
| [15] |
Dorsch M, Lane D, Stackebrandt E. Towards a phylogeny of the genus Vibrio based on 16S rRNA sequences[J]. International Journal of Systematic Bacteriology, 1992, 42(1): 58-63 (  0) 0) |
| [16] |
Muyzer G, Waal E C D, Uitterlinden A G. Profiling of complex microbial populations by denaturing gradient gel electrophoresis analysis of polymerase chain reaction- amplified genes coding for 16S rRNA[J]. Applied & Environmental Microbiology, 1993, 59(3): 695-700 (  0) 0) |
| [17] |
Fierer N, Jackson J A, Vilgalys R, et al. Assessment of soil microbial community structure by use of taxon-specific quantitative PCR assays[J]. Applied & Environmental Microbiology, 2005, 71(7): 4117-4120 (  0) 0) |
| [18] |
Vilgalys R, Hester M. Rapid genetic identification and mapping of enzymatically amplified ribosomal DNA from several Cryptococcus species[J]. Journal of Bacteriology, 1990, 172(8): 4238-4246 DOI:10.1128/jb.172.8.4238-4246.1990 (  0) 0) |
| [19] |
Faggian R, Strelkov S E, Dixon G R. Detection and measurement of Plasmodiophora brassicae[J]. Journal of Plant Growth Regulation, 2009, 28(3): 282-288 DOI:10.1007/s00344-009-9092-9 (  0) 0) |
| [20] |
Adam G, Duncan H. Development of a sensitive and rapid method for the measurement of total microbial activity using fluorescein diacetate (FDA) in a range of soils[J]. Soil Biology & Biochemistry, 2001, 33(7/8): 943-951 (  0) 0) |
| [21] |
缪其松, 张聪, 广建芳, 等. 设施土壤连作障碍防控技术研究进展[J]. 北方园艺, 2017(16): 180-185 (  0) 0) |
| [22] |
刘亮亮, 黄新琦, 朱睿, 等. 强还原土壤对尖孢镰刀菌的抑制及微生物区系的影响[J]. 土壤, 2016, 48(1): 88-94 (  0) 0) |
| [23] |
Huang X, Liu L, Teng W, et al. Changes in the soil microbial community after reductive soil disinfestation and cucumber seedling cultivation[J]. Applied Microbiology & Biotechnology, 2016, 100(12): 1-13 (  0) 0) |
| [24] |
朱同彬, 孙盼盼, 党琦, 等. 淹水添加有机物料改良退化设施蔬菜地土壤[J]. 土壤学报, 2014(2): 335-341 (  0) 0) |
| [25] |
常红岩, 孙百晔, 刘春生. 植物铜素毒害研究进展[J]. 山东农业大学学报(自然科学版), 2000, 31(2): 227-230 DOI:10.3969/j.issn.1000-2324.2000.02.030 (  0) 0) |
| [26] |
周亚敏, 尹楚钰, 吴杰琳, 等. 过量硼对农作物的毒害效应及其相关机理概述[J]. 农业资源与环境学报, 2012(4): 60-61 (  0) 0) |
| [27] |
陈玉真.土壤锌对植物的毒害效应及临界值研究[D].福州: 福建农林大学, 2011
(  0) 0) |
| [28] |
刘春光, 何小娇. 过量硼对植物的毒害及高硼土壤植物修复研究进展[J]. 农业环境科学学报, 2012, 31(2): 230-236 (  0) 0) |
| [29] |
郭军, 顾闽峰, 祖艳侠, 等. 设施栽培蔬菜连作障碍成因分析及其防治措施[J]. 江西农业学报, 2009, 21(11): 51-54 DOI:10.3969/j.issn.1001-8581.2009.11.018 (  0) 0) |
| [30] |
Zhao J, Mei Z, Zhang X, et al. Suppression of Fusarium wilt of cucumber by ammonia gas fumigation via reduction of Fusarium population in the field[J]. Scientific Reports, 2017, 7: 43103 DOI:10.1038/srep43103 (  0) 0) |
| [31] |
薛超, 黄启为, 凌宁, 等. 连作土壤微生物区系分析、调控及高通量研究方法[J]. 土壤学报, 2011, 48(3): 612-618 (  0) 0) |
| [32] |
黄新琦, 温腾, 孟磊, 等. 土壤强还原过程产生的有机酸对土传病原菌的抑制作用[J]. 植物保护, 2015(6): 38-43 DOI:10.3969/j.issn.0529-1542.2015.06.006 (  0) 0) |
| [33] |
Huang X, Wen T, Zhang J, et al. Toxic organic acids produced in biological soil disinfestation mainly caused the suppression of Fusarium oxysporum, f. sp. cubense[J]. Biocontrol, 2015, 60(1): 113-124 DOI:10.1007/s10526-014-9623-6 (  0) 0) |
2. Flower Research Institute, Yunnan Academy of Agricultural Sciences, Kunming 650205, China;
3. Jiangsu Center for Collaborative Innovation in Geographical Information Resource Development and Application, Nanjing 210023, China;
4. Jiangsu Provincial Key Laboratory of Materials Cycling and Pollution Control, Nanjing Normal University, Nanjing 210023, China
 2019, Vol. 51
2019, Vol. 51


