2. 华中农业大学资源环境学院,农业部长江中下游耕地保育重点实验室,武汉 430070;
3. 石河子大学农学院,新疆生产建设兵团绿洲生态农业重点实验室,新疆石河子 832000
土壤次生黏土矿物在形成过程中受气候、母岩、植被、地貌、介质环境、风以及成岩作用等多种因素的影响,其晶型结构稳定,而形貌与亚结构非常敏感,对土壤与环境的演变有很好的指示作用。关于盐渍化土壤中黏土矿物类型演化特征研究,国内外文献资料涉及极少。早期受限于研究技术和手段,学者们主要是对盐渍化土壤中黏土矿物类型进行判断[1-2]。随着科学技术的进步,着眼于盐化环境中黏土矿物的形成和转化机理研究成为可能。如泰国学者研究发现,受干旱气候影响,泰国热带草原的含盐土壤中物质的淋洗率较低,大量可溶态Si4+积累,使Si4+进入高岭石而形成蒙脱石,发生“复硅”现象,导致热带土壤中除了地带性的高岭石之外,还有蒙脱石[3]。Abbaslou和Abtahi[4]研究伊朗盐土淀积层中黏土矿物,提出该地区土壤中伊利石和绿泥石主要来自于母质,伊蒙混层矿物和绿蒙混层矿物是风化的产物,坡缕石可能来自于富含盐基离子的土壤溶液和蒙脱石转化。Joeckel和Ang Clement[5]研究表明,美国的北普拉特河谷中盐碱化湿地土壤表层以伊利石为主,下层是蒙脱石,高pH、高交换性K+含量以及干湿交替有助于伊利石的形成。Furquim等[6]根据其Fe3+含量推断出盐湖水很少影响的上部土层中铁贝得石是盐碱环境中云母转化而来,蛭石是其转化的中间阶段,而受到湖水水位上下波动影响的下部土层中皂石和硅镁石则是盐湖富Mg2+环境中水分蒸发后化学沉积形成的。分析发现,针对干旱、半干旱区盐渍化土壤中黏土矿物演化特征的相关研究,国内外文献资料涉及很少,研究深度不够,仅只是对土壤矿物组成的鉴定,缺乏其形成原因及分布特征的数据论证。
新疆位于中国西北干旱半干旱地区,土壤盐渍化问题突出,据统计当地受盐分影响的耕地面积约占总面积的31.1%[7]。因盐渍化土地面积大、分布广、盐分种类多,新疆被著名土壤学家柯夫达誉为“世界盐碱土的博物馆”。新疆以天山山脉为界,南北分布两大盆地,分别为北疆的准噶尔盆地和南疆的塔里木盆地。本研究以准噶尔盆地和塔里木盆地盐渍化土壤为研究对象,利用X-射线衍射仪(XRD)、透射电镜(STEM/EDS)等技术,鉴定干旱区盐渍化土壤中黏土矿物组成及形貌特征,并采用土壤次生碳酸盐中δ13C和δ18O同位素以及黏土矿物D和δ18O同位素测定,结合X射线荧光光谱(XRF)分析,解读土壤成土过程中的气候和环境演变等因素对干旱区盐渍化土壤中黏土矿物的影响,分析含盐土壤中黏土矿物的演化,以揭示新疆塔里木盆地和准噶尔盆地盐渍化土壤中黏土矿物的演化特征,推进干旱区盐渍化土壤黏土矿物形成学理论研究。
1 材料与方法 1.1 研究区概况本研究分别在准噶尔盆地石河子地区,塔里木盆地的阿克苏沙井子垦区和库尔勒地区第一师29团采集土壤样品(图 1)。准噶尔盆地,属典型温带大陆性干旱气候,冬季漫长而寒冷,夏季干旱少雨,年均降水量180 ~ 270 mm,年均蒸发量达1 500 ~ 2 000 mm;塔里木盆地属于暖温带极端干旱气候,年均降水量50 ~ 60 mm,年均蒸发量2 000 ~ 3 400 mm。由于年均蒸发量远远大于降雨量,引起强烈土壤蒸发,导致盐分难于被淋洗而从土体下部向表层聚集,研究区内土壤盐渍化问题严重,石河子地区盐土占耕地总面积38.36%[8],阿克苏地区41.32%的耕地受盐分影响,库尔勒地区约58.82%[9]。
|
图 1 研究区的地理位置 Fig. 1 Study area sites |
两盆地各选择6个剖面,准噶尔盆地采样剖面用Z1 ~ Z6表示,塔里木盆地采样剖面用T1 ~ T6表示,采样点景观特征见表 1和表 2。分层采集土壤样品1.00 ~ 2.00 kg,带回实验室风干,过筛,保存。
|
|
表 1 准噶尔盆地盐渍化土壤样品理化性质 Table 1 Physiochemical properties of salinized soils in Junggar Basin |
|
|
表 2 塔里木盆地盐渍化土壤样品理化性质 Table 2 Physiochemical properties of salinized soils in Tarim Basin |
土壤样品中可溶性盐基离子CO32-、HCO3-采用双指示剂滴定法测定,Cl-采用硝酸银滴定法测定,SO42-采用EDTA间接滴定法测定,Ca2+、Mg2+采用EDTA络合滴定法测定,Na+、K+采用火焰光度计方法测定。结果显示,准噶尔盆地采样剖面土壤中盐分的阴、阳离子以SO42-和Ca2+、Mg2+为主,其次为Cl-、HCO3-和Na+,K+和CO32-含量极低;塔里木盆地采样点土壤盐分的阴、阳离子分别以Cl-和Ca2+、Mg2+为主,其次为SO42-、HCO3-和Na+,K+含量非常少,CO32-含量也很低。土壤盐分含量用电导仪测定,土水比为1:5,用电导率表示;土壤机械组成采用简易比重计法,根据美国制土壤质地分类方法确定土壤质地;有机质含量采用重铬酸钾外加热法测定;土壤pH采用1:1土水比,pH计测定[10]。土壤理化性质结果见表 1和表 2。
1.3 土壤黏土矿物提取及测定土壤去掉粗有机物与石块后,加入30%双氧水,不断搅拌后沉淀倒去上清液,再加入双氧水,重复该过程,直至加入双氧水后不再产生大量气泡,此时土壤有机质被除去;然后加入0.02 mol/L HCl,不断搅拌后沉淀倒去上清液,再加0.02 mol/L HCl,重复该过程,直至没有气泡产生,说明已完全除去土壤中的CaCO3;再加入0.5 mol/L NaHCO3加热分散土粒,用沉降法分离出 < 2 μm的黏粒,烘干,研磨。
1.3.1 XRD测试土壤黏土矿物用连二亚硫酸钠-柠檬酸钠-重碳酸钠(DCB)处理后,制成镁-甘油饱和片和钾饱和片,其中钾片室温风干测试后,再分别经300℃和550℃加热2 h后测试,所有定向片使用D8 Advance-射线衍射仪(XRD)测试,测试过程采用Cu靶辐射,管压40 kV,管流40 mA;角度范围(2θ)3 ~ 30°,步长为0.02°,扫描速度为0.04°/s。
1.3.2 XRF测试利用XRF测定黏土矿物中Si、Fe、Al、Ca、Mg、K、Na、Ti、P元素的含量。
1.3.3 δ18O和δD同位素测定称取0.3 mg左右黏土矿物样品装入银杯(6 mm × 4 mm),折成小球,平衡72 h,利用自动进样器将样品送入元素分析仪(vario PYRO cube,德国Elementar公司),1 450 ℃条件下在玻璃碳管中高温裂解生成CO和H2,最后进入稳定同位素质谱(IsoPrime100,英国Isoprime公司)进行检测黏土矿物样品的δ18O和δD同位素,该试验在中国农科院同位素实验室完成。
1.4 土壤次生碳酸盐中δ13C和δ18O测定由于盐渍化土壤中存在大量白色盐结晶,不易与碳酸盐结晶体分离。文献表明在中国西北干旱区土壤中细颗粒组分(< 2 μm)碳酸盐能更好地反映成壤作用,其蕴含的地球化学信息可用来解读土壤形成时期的古气候和古环境信息[11-12]。本研究依据Stocks定理,采用沉降法获取2 μm的土粒,将分离出的2 μm土粒样品烘干,研磨,过200目筛后,称取2 ~ 4 mg样品放入锡箔杯中,通过自动进样器进入元素分析仪,通过燃烧(1 020℃)与还原(还原炉温度650℃)转化为纯净的CO2和N2气体,CO2再经过稀释器稀释,最后进入稳定同位素质谱仪(IsoPrime100,英国Isoprime公司)进行土壤碳酸盐中δ13C和δ18O测定,以国际标准VPDB为基准校正测定结果,该试验在中国农科院同位素实验室完成。
2 结果与分析 2.1 准噶尔盆地和塔里木盆地盐渍化土壤黏土矿物的类型根据盐渍化土壤中黏土矿物定向片的XRD图谱判断,两盆地内盐渍化土壤中主要黏土矿物类型包括蒙脱石、伊利石、绿泥石和高岭石。以准噶尔盆地的剖面Z1和Z2以及塔里木盆地T1和T2为例(图 2),对比XRD衍射图发现,剖面Z1和Z2各土层蒙脱石衍射峰(M)的峰强比剖面T1和T2中蒙脱石衍射峰的峰强强,伊利石衍射峰(I)的峰强则相反,绿泥石(Chl)和高岭石(Kao)衍射峰没有显著差异。
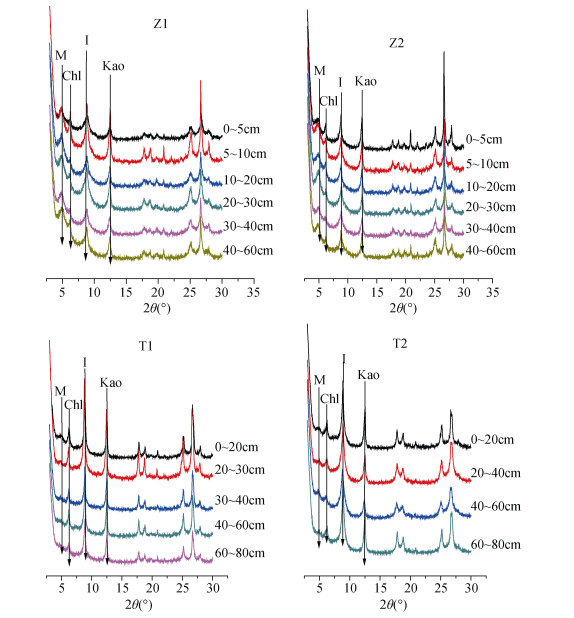
|
(图中M为蒙脱石,Chl为绿泥石,I为伊利石,Kao为高岭石) 图 2 土壤样品黏土矿物的XRD衍射图谱 Fig. 2 XRD patterns of soil clay minerals |
进一步对所有土壤黏土矿物的镁甘油饱和定向片的衍射图谱扣除背景后,利用OriginPro8软件,将样品中蒙脱石的1.8 nm衍射特征峰、伊利石1.0 nm衍射峰、高岭石和绿泥石的0.71 nm衍射峰的积分面积乘以比例系数,本研究中伊利石比例系数确定为3.5,蒙脱石、绿泥石和高岭石的比例系数均为2[13],再分别计算各个峰的面积占总积分面积的百分数,即为蒙脱石、伊利石、绿泥石+高岭石的矿物含量;然后对镁甘油饱和定向片的衍射图谱中0.35 nm衍射峰进行分峰,计算0.354、0.358 nm峰的峰面积比,区分绿泥石和高岭石各自的含量。本研究矿物含量以相对含量(%)表示,结果见表 3和表 4。
|
|
表 3 准噶尔盆地盐渍化土壤剖面各土层中黏土矿物组分相对含量(%) Table 3 Relative contents of clay minerals in salinized soil profiles in Junggar Basin |
|
|
表 4 塔里木盆地盐渍化土壤剖面各土层中黏土矿物组分相对含量(%) Table 4 Relative contents of clay minerals in salinized soil profiles in Tarim Basin |
准噶尔盆地盐渍化土壤样品中伊利石含量最高(约占36% ~ 69%),其次为蒙脱石(0 ~ 34%)和绿泥石(16% ~ 43%),高岭石最少(含量 < 10%)。各土层伊利石含量减少,相应蒙脱石含量增加,伊利石和蒙脱石含量之间存在极显著负相关关系(n=30,r=0.81,P < 0.01),表明新疆准噶尔盆地盐渍化土体中存在伊利石向蒙脱石的转化过程。同一剖面中表层0 ~ 10 cm土层蒙脱石含量最低,下层相对表层含量较高,如剖面Z3、Z4的表层0 ~ 10 cm土层中几乎没有蒙脱石存在,说明表层该转化过程弱,下层转化作用强。同时研究数据还表明,不同剖面的同一土层,盐分含量越高,伊利石含量越低,如各剖面的20 ~ 30 cm土层中盐分含量依次为:Z1 < Z3 < Z2 < Z4 < Z5,矿物含量计算结果表明伊利石含量排序同盐分含量序列相同;各剖面的30 ~ 40 cm土层中盐分含量依次为:Z2 < Z1 < Z3 < Z4 < Z5,矿物含量计算结果表明伊利石含量排序为Z2 < Z3 < Z1 < Z4 < Z5,说明10 cm以下土层土壤中盐分的存在影响伊利石含量,进一步分析10 cm以下土层中盐分含量(电导率)与伊利石含量的相关关系,结果表明两者达到极显著负相关(n=22,r=0.76,P < 0.01),盐分的存在有助于伊利石转化。
塔里木盆地盐渍化土壤全剖面不同土层矿物类型相同,矿物衍射峰峰形变化不明显。半定量计算矿物含量,结果表明伊利石约占总量67% ~ 86%,其次为绿泥石12% ~ 25%,少量高岭石,极少甚至没有蒙脱石。相关分析显示黏土矿物含量不受盐分的影响,矿物之间也不存在相关关系。与准噶尔盆地盐渍化土壤中黏土矿物的含量比较发现,塔里木盆地盐渍化土壤中伊利石含量相对较多,蒙脱石含量相对较少。
2.2 准噶尔盆地和塔里木盆地盐渍化土壤黏土矿物的化学元素组成利用XRF测定土壤黏土矿物的元素组成,结果见表 5。研究区土壤样品中黏土矿物主要是由SiO2、Al2O3和Fe2O3组成。两盆地盐渍化土壤黏土矿物元素组成中SiO2、Al2O3、K2O、CaO和Na2O的含量具有比较明显的差异。剖面Z1和Z3黏土矿物的元素组成中SiO2、CaO和Na2O含量高,剖面T3和T5则相反。文献提出在盐化环境中,黏土矿物中Al2O3和K2O含量减少的过程说明存在伊利石的退化,表征土壤中发生伊利石向蒙脱石的转化[14],本研究中剖面Z1和Z3黏土矿物的元素组成中Al2O3和K2O含量比剖面T3和T5低,再次证明准噶尔盆地盐渍化土壤中存在伊利石向蒙脱石转化的过程。
|
|
表 5 土壤黏土矿物的化学元素组成(%) Table 5 Element compositions in clay minerals in salinized soil profiles |
盐渍化土壤分布区自然植被覆盖度低,准噶尔盆地植被覆盖度一般在10%左右,高者在20% ~ 30%;塔里木盆地自然植被覆盖度一般 < 5%,因此研究区土壤过程受植物作用影响微弱,主要受荒漠区水热条件的控制。区域内气候炎热干燥,土壤风化程度较弱,长石、云母等原生矿物脱钾,形成大量伊利石。盐分在土体表面大量存在,表征当地土壤淋溶作用弱,这种弱的淋溶作用有利于伊利石的形成和保存,因而研究区土壤黏土矿物以伊利石为主。绿泥石主要阳离子为Si4+、A13+、Fe2+、Mg2+,是在干旱气候条件、富含Mg2+碱性环境下形成[15],盐化土壤溶液介质中因富含Mg2+,可为绿泥石的形成提供必要的物质条件。准噶尔盆地和塔里木盆地土壤富含钙镁碳酸盐(表 1 ~ 表 2),同时盐渍化土壤溶液中也有大量Mg2+,为绿泥石的形成提供了所需要的Mg2+,因而区域内盐渍化土壤中存在一定量绿泥石。高岭石在高度风化的土壤中普遍存在,主要形成于温暖、潮湿的气候条件[16-17],酸性介质(pH 5 ~ 6)下稳定存在。本研究认为新疆盐渍化土壤的高碱性环境并不具备生产高岭石的气候环境条件,研究区土壤中少量的高岭石可能是母质通过物理风化释放出来的。
3.1 准噶尔盆地和塔里木盆地盐渍化土壤中蒙脱石含量差异分析与塔里木盆地盐渍化土壤中黏土矿物的含量比较发现,准噶尔盆地盐渍化土壤中蒙脱石含量相对较高,伊利石含量相对较低。水分环境影响淋溶作用,影响矿物的转化和形成[18]。在温带地区,随着水分增加,伊利石中K+淋洗越多,形成的蒙脱石越多。文献中常用土壤次生碳酸盐中δ13C、δ18O同位素或土壤黏土矿物的δD和δ18O同位素解读土壤形成过程的气候信息[19-20],研究土壤发生、土壤景观历史、土壤形成过程中的古气候及古环境变化。新疆位于欧亚大陆腹地,土壤富含CaCO3(表 1 ~ 表 2),为利用碳酸盐研究土壤形成期气候条件提供了有利条件。本研究选择人为干扰较少的剖面Z4和T5,分析其不同土层土壤次生碳酸盐中碳、氧同位素以及土壤黏土矿物的氢、氧同位素的变化(表 6),重建两大盆地土壤形成时期的成土环境,分析准噶尔盆地和塔里木盆地盐渍化土壤中黏土矿物差异的原因。
|
|
表 6 土壤物质组成中同位素分析结果 Table 6 Isotope compositions in salinized soil constituents |
由于土壤表面强烈蒸发,干燥度提高可导致土壤黏土矿物的18O‰增加[21],且黏土矿物的δD和δ18O同位素比率一旦形成,即使与大气降水接触也不发生改变。因而通过测定黏土矿物中的氢、氧同位素δD和δ18O数据,便可以获取土壤成土作用和古气候条件的大量信息[22]。研究选择土壤剖面Z4和T5,测定其不同土层中黏土矿物的δD和δ18O(表 6)。剖面Z4所有土壤黏土矿物的δD和δ18O值均为负值,分别为-90.68‰ ~ -89.78‰和-4.24‰ ~ -1.73‰;剖面T5中黏土矿物的δD为-80.22‰ ~ -75.97‰,δ18O含量在表层最低为-1.59‰,其次是40 ~ 60 cm土层,10 ~ 40 cm土层中δ18O均为正值,可见准噶尔盆地盐渍化土壤中δD和δ18O比塔里木盆地盐渍化土壤中亏损更多。黏土矿物中δD和δ18O值越高,对应的温度越高[23],形成于湿润气候的黏土矿物比干旱气候的黏土矿物亏损更多的重同位素。塔里木盆地盐渍化土壤的δD和δ18O含量相对较高,准噶尔盆地盐渍化土壤δD和δ18O含量相对较低,说明塔里木盆地土壤样品中黏土矿物形成期气候干旱,而准噶尔盆地土壤形成时研究区的气候相对塔里木盆地气候湿润。
土壤碳酸盐中的碳氧同位素成分取决于古植被类型和当时气候,可以作为古植被类型和古气候的指示信息。土壤中碳同位素受植被生态变化控制。陆生高等植物中主要存在C3和C4两种光合作用类型。C3和C4植物的δ13C值不相重叠,C3和C4植物的δ13C平均值分别为-27‰和-13‰,C3植物生长环境下的土壤碳酸盐δ13C值为-9‰ ~ -13‰,C4植物生长环境下δ13C值为1‰ ~ 3‰。本研究中剖面Z4的各土层中次生碳酸盐的δ13C值均为负值且变化较大,为-3.73‰ ~ -1.45‰;剖面T5中各土层中次生碳酸盐的δ13C值为-0.40‰ ~ -0.19‰,明显高于准噶尔盆地盐渍化土壤。通过土壤中次生碳酸盐的δ13C值判断两大盆地土壤形成时C3和C4植物共生,0 ~ 60 cm土层土壤形成过程中,塔里木盆地C4植物比准噶尔盆地多。一般C4植物多是较耐干旱的草本植物,主要生长在极度干旱环境下,因而可以判断塔里木盆地气候相对准噶尔盆地干旱。次生碳酸盐中δ18O含量受干旱度的影响,随着干旱度提高,土壤水分蒸发强烈,使轻的H216O蒸发,δ18O在土壤碳酸盐中富集。剖面T5土层中次生碳酸盐δ18O值高于剖面Z4,表明塔里木盆地蒸发更强烈,使δ18O在盐渍化土壤的碳酸盐中富集,证明塔里木盆地比准噶尔盆地气温高,干旱度高。
以上黏土矿物氢、氧同位素和次生碳酸盐的碳、氧同位素结果表明研究区样品采集点土壤形成时,准噶尔盆地土壤形成期气候较塔里木盆地湿润,干旱度低。K+在盐基离子中最易被风化释放[24],一般随水分增加,伊利石中K+淋洗量增加,形成的蒙脱石量增加,比较而言,准噶尔盆地土壤形成期相对湿润的气候条件,为蒙脱石形成提供了更有利的水分条件。
根据矿物晶体结构可知,蒙脱石的层间一般被Na+、Ca2+和K+占据,而伊利石的层间主要被K+占据[25]。伊利石向蒙脱石的转化过程需要脱去K+和Al3+,Si4+进入,Na+和Ca2+取代层间K+。采样点盐渍化土壤呈强碱性反应,pH>8.5(表 1),利于土壤中的长石溶解并释放Si4+,为矿物转化提供Si4+;土壤溶液中存在着大量可溶性盐基离子Ca2+和Na+,其中Na+很容易置换伊利石层间K+[26],为转化过程提供物质条件。本研究矿物元素分析结果也表明,盐分含量较高的土壤黏土矿物中Na2O和CaO含量高于盐分含量低的土壤(表 5),说明高盐土壤的矿物中存在K+被Na+和Ca2+取代的现象。准噶尔盆地土壤中富含CaCO3(表 1),研究表明在碳酸盐环境中Mg和Si含量较高,利于伊利石转化形成蒙脱石[27-28],因而在相对湿润的气候条件下,土壤富含盐基离子和碳酸盐为准噶尔盆地盐渍化土壤中蒙脱石的形成提供了必要条件,导致土壤中蒙脱石含量相对较高。而塔里木盆地土壤形成期的干旱气候,其水分条件不利于伊利石脱K+,因而土壤中蒙脱石含量极少甚至没有。
本研究中准噶尔盆地盐渍化土壤中黏土矿物的TEM图像显示,采样点土壤黏土矿物组成中存在1.2 nm和1.3 nm晶层矿物(图 4A),该类矿物晶格条纹终端不平行,呈波浪形(图 4B)。Ahn和Peacor[29]、Amouric和Olives[30]已证明这种1.2 nm和1.3 nm晶层矿物是蒙脱石。Robert[31]通过室内试验证明,当水合Na+、Ca2+取代伊利石结构中的层间K+,就可使矿物结构发生改变,矿物层间距由1.0 nm扩大到1.2 ~ 1.4 nm。

|
(A:蒙脱石的1.2 ~ 1.3 nm晶格条纹;B:弯曲呈波浪形的晶格条纹) 图 4 准噶尔盆地盐渍化土壤中黏土矿物TEM图像 Fig. 4 TEM images of clay minerals of salinized soil in Junggar Basin of Xinjiang |
准噶尔盆地采样点土壤中,伊利石和蒙脱石含量呈极显著相关关系,存在伊利石向蒙脱石的转化过程。然而同一剖面中0 ~ 10 cm土层蒙脱石含量最低,下层相对表层较高,表明表层土壤中伊利石向蒙脱石转换作用很弱。基于本研究同位素的分析结果,认为这种现象是受到土壤形成期气候条件和土体内部上、下土层水分含量的影响。从表 6同位素分析结果可以发现,Z4表层0 ~ 10 cm土层次生碳酸盐中δ13C和δ18O值分别为-1.53‰和-9.44‰,黏土矿物中δD和δ18O分别为-89.81‰和-1.73‰,均高于下层土壤,表明表层土壤形成期的气候较下层土壤形成期干旱;同时受研究区年蒸发量大于降水量的气候条件影响,土壤表面蒸发强烈,导致土体内表层土壤含水量低于土体内部,可见,受成土过程中气候条件和现代土体内水分分布的影响,表层土壤的水分条件均不利于伊利石转换,因而表层土壤中蒙脱石极少甚至没有,而下层土体内蒙脱石含量相对较高。
10 cm以下土体中,蒙脱石含量相对表层较高,且盐分含量越高蒙脱石含量越高,即10 cm以下土层中土壤盐分的存在有助于伊利石转化形成蒙脱石。Velde和Church[32]研究特拉华州的盐沼中发现下层土壤也存在伊利石向蒙脱石转化的过程,认为受到盐沼中的高盐环境影响。Furquim等[6, 33]提出盐湖下层土壤的富Mg2+环境中伊利石转化形成蒙脱石。Aoudjit等[14]报道地势低洼、富含盐基离子的母质、高pH和盐基离子的化学环境都会影响土壤中蒙脱石的形成和分配。因此,本研究中10 cm以下土层在水分条件满足时,土壤溶液中的盐基离子含量越高,进入伊利石层间代替K+的数量就越多,形成的蒙脱石量越多,因而,在准噶尔盆地盐渍化土壤的土体下部,高盐也影响伊利石向蒙脱石转化。
4 结论1) 新疆盐渍化土壤富含钙镁碳酸盐,盐渍化土壤溶液中也有大量Mg2+,为绿泥石的形成提供了所需要的Mg2+,区域内土壤中存在一定量绿泥石。盐渍化土壤的高碱性环境并不具备形成高岭石的气候环境条件,本研究认为土壤中少量的高岭石可能是母质通过物理风化释放出来的。这两种矿物含量在塔里木盆地和准噶尔盆地盐渍化土壤中无明显差异。由于研究区域内气候炎热干燥,土壤风化程度较弱,长石、云母等原生矿物风化后形成大量伊利石。土壤次生碳酸盐碳氧同位素和黏土矿物的氢氧同位素结果证明,塔里木盆地盐渍化土壤形成期气候相对准噶尔盆地更干旱,该气候条件不利于土层中伊利石脱K+向蒙脱石转化,导致塔里木盆地盐渍化土壤中蒙脱石含量极低甚至没有,而伊利石含量高于准噶尔盆地盐渍化土壤。因而,塔里木盆地盐渍化土壤中黏土矿物类型以伊利石为主,其次为绿泥石,少量高岭石,蒙脱石含量极低甚至没有;准噶尔盆地盐渍化土壤中主要黏土矿物是伊利石,其次为绿泥石、蒙脱石,少量高岭石。
2) 塔里木盆地盐渍化土壤剖面中不同土层伊利石、绿泥石、高岭石和蒙脱石含量无明显差异。准噶尔盆地盐渍化土壤各土层中,随着伊利石含量减少,蒙脱石含量增加,存在伊利石向蒙脱石的转化。本研究表明准噶尔盆地采样点盐渍化土壤具备伊利石向蒙脱石转化所需要的水分条件和化学组分:①同位素测定结果证明准噶尔盆地采样区10 cm以下土层土壤形成期气候相对湿润,利于伊利石中K+淋失;②盐渍化土壤pH>8.5,促使土壤中原生矿物Si4+溶解,为转化过程提供足够的Si4+;③盐渍化土壤溶液中存在的大量Ca2+和Na+。因而,在相对湿润环境条件下,土体中伊利石K+淋失,Ca2+、Na+进入矿物晶格,形成结晶较差,晶格条纹弯曲、不平行的蒙脱石。0 ~ 10 cm土层由于土壤形成期相对下层土体形成期气候干旱,且现代土壤剖面中表层土壤水分含量较低,导致该土层土壤中伊利石转化作用很弱,形成的蒙脱石也极少;10 cm以下土体的土壤形成期气候相对湿润,加之在目前的气候条件下土体下部水分含量较表层高,水分条件利于伊利石向蒙脱石的转化,因而准噶尔盆地采样点盐渍化土壤10 cm以下土体中蒙脱石含量较表层高。同时10 cm以下土体内,随着土壤溶液中盐分含量增加,伊利石含量减少,表明准噶尔盆地盐渍化土壤中盐分促使伊利石转化。因而受到气候条件影响新疆塔里木盆地和准噶尔盆地盐渍化土壤中黏土矿物的组成呈现差异。土体上、下层水分条件和土壤可溶性盐含量是准噶尔盆地盐渍化土体中矿物形成和转化的主要影响因素。
| [1] |
Mahjoory R A. The nature and genesis of some salt-affected soils in Iran[J]. Soil Sci. Soc. Am. J., 1979, 43: 1019-1024 DOI:10.2136/sssaj1979.03615995004300050041x (  0) 0) |
| [2] |
Kohut C K, Dudas M J. Characteristics of clay minerals in saline alkaline soils in Alberta, Canada[J]. Soil Sci. Soc. Am. J., 1994, 58(1): 1260-1269 (  0) 0) |
| [3] |
Wongpokhom N, Kheoruenromne I, Suddhiprakarn A, et al. Micromorphological properties of salt affected soils in Northeast Thailand[J]. Geoderma, 2008, 144: 158-170 DOI:10.1016/j.geoderma.2007.10.026 (  0) 0) |
| [4] |
Abbaslou H, Abtahi A. Origin and distribution of clay minerals in calcareous, gypsiferous, saline soils and sediments of Bakhtegan lake bank, southern Iran[J]. Iran Agricultural Research, 2007, 25(2): 71-86 (  0) 0) |
| [5] |
Joeckel R M, Ang Clement B J. Soils, surficial geology, and geomicrobiology of saline-sodic wetlands, North Platte River Valley, Nebraska, USA[J]. Catena, 2005, 61(1): 63-101 DOI:10.1016/j.catena.2004.12.006 (  0) 0) |
| [6] |
Furquim S A C, Graham R C, Barbiero L, et al. Soil mineral genesis and distribution in a saline lake landscape of the Pantanal Wetland, Brazil[J]. Geoderma, 2010, 154: 518-528 DOI:10.1016/j.geoderma.2009.03.014 (  0) 0) |
| [7] |
田长彦, 周宏飞, 刘国庆. 21世纪新疆土壤盐渍化调控与农业持续发展研究建议[J]. 干旱区地理, 2000, 23(2): 177-181 DOI:10.3321/j.issn:1000-6060.2000.02.016 (  0) 0) |
| [8] |
李玉义, 柳红东, 张凤华, 等. 新疆玛纳斯河流域灌溉技术对土壤盐渍化的影响[J]. 中国农业大学学报, 2007, 12(1): 22-26 DOI:10.3321/j.issn:1007-4333.2007.01.005 (  0) 0) |
| [9] |
陈小兵, 杨劲松, 刘春卿, 等. 大农业条件下新疆土壤盐碱化及其调控对策[J]. 土壤, 2007, 39(3): 347-353 DOI:10.3321/j.issn:0253-9829.2007.03.004 (  0) 0) |
| [10] |
鲁如坤. 土壤农业化学分析[M]. 北京: 中国农业科技出版社, 1999
(  0) 0) |
| [11] |
王宁, 刘卫国. 中国西北干旱区不同粒径表土碳酸盐含量及碳、氧同位素组成[J]. 干旱区地理, 2010, 33(2): 158-163 (  0) 0) |
| [12] |
盛雪芬, 陈骏, 杨杰东, 等. 不同粒级黄土-古土壤中碳氧酸盐碳氧稳定同位素组成及其古环境意义[J]. 地球化学, 2002, 31(2): 105-112 DOI:10.3321/j.issn:0379-1726.2002.02.001 (  0) 0) |
| [13] |
李学垣. 土壤化学及实验指导[M]. 北京: 中国农业出版社, 1997
(  0) 0) |
| [14] |
Aoudjit H, Robert M, Elsass F, et al. Detailed study of smectite genesis in granitic saprolites by analytical electron microsopy[J]. Clay Minerals, 1995, 30: 135-147 DOI:10.1180/claymin.1995.030.2.05 (  0) 0) |
| [15] |
Jiang W T, Peacor D R. Formation of corrensite, chlorite and chlorite-mica stacks by replacement of detrital biotite in low-grade pelitic rocks[J]. J. metamorphic Geol., 1994, 12: 867-884 DOI:10.1111/j.1525-1314.1994.tb00065.x (  0) 0) |
| [16] |
Hughes J C, R, Gilkes J, Hart R D. Intercalation of reference and soil kaolins in relation to physico-chemical and structural properties[J]. Applied Clay Science, 2009, 45: 24-35 DOI:10.1016/j.clay.2009.04.006 (  0) 0) |
| [17] |
Khawmee K, Suddhiprakarn A, Kheoruenromne I, et al. Surface charge properties of kaolinite from Thai soils[J]. Geoderma, 2013, 192: 120-131 DOI:10.1016/j.geoderma.2012.07.010 (  0) 0) |
| [18] |
张治伟, 许娟娟, 严焕德, 等. 海拔与岩性变异对石灰性发育土壤黏土矿物组成的影响[J]. 土壤学报, 2017, 54(2): 535-542 (  0) 0) |
| [19] |
Yang S L, Ding Z L, Wang X, et al. Negative δ18O-δ13C relationship of pedogenic carbonate from northern China indicates a strong response of C3/C4 biomass to the seasonality of Asian monsoon precipitation[J]. Palaeogeography, Palaeoclimatology, Palaeoecology, 2012, 317/318: 32-40 DOI:10.1016/j.palaeo.2011.12.007 (  0) 0) |
| [20] |
Levin N E, Brown F H, Behrensmeyer A K, et al. Paleosol carbonates from the Omo Group: Isotopic records of local and regional environmental change in East Africa[J]. Palaeogeography, Palaeoclimatology, Palaeoecology, 2011, 307: 75-89 DOI:10.1016/j.palaeo.2011.04.026 (  0) 0) |
| [21] |
Southade R J, Tabro M J, Montanez I P. Paleoenviron mental reconstruction from chemical and isotopic compositions of permo-pennsylvanian pedogenic minerals[J]. Geochimica et Cosmochimica Acta, 2002, 66(17): 3093 DOI:10.1016/S0016-7037(02)00879-7 (  0) 0) |
| [22] |
Horbe A M C. Oxygen and hydrogen isotopes in pedogenic minerals — Implications for paleoclimate evolution in Amazonia during the Cenozoic[J]. Geoderma, 2011, 163: 178-184 DOI:10.1016/j.geoderma.2011.03.017 (  0) 0) |
| [23] |
Savin S M, Hsieh J C C. The hydrogen and oxygen isotope geochemistry of pedogenic clay minerals: Principles and theoretical background[J]. Geoderma, 1998, 82: 227-253 DOI:10.1016/S0016-7061(97)00103-1 (  0) 0) |
| [24] |
庄翔宇, 杨金玲, 张甘霖, 等. 亚热带花岗岩地区土壤矿物风化过程中盐基离子的释放特征[J]. 土壤, 2016, 48(2): 374-380 (  0) 0) |
| [25] |
Ransom B, Helgeson H C. Compositional end members and thermodynamic components of illite and dioctahedral aluminous smectite solid solutions[J]. Clays and Clay Minerals, 1993, 41(5): 537-550 DOI:10.1346/CCMN.1993.0410503 (  0) 0) |
| [26] |
李婷, 王火焰, 陈小琴, 等. 四种常规方法提取伊利石有效钾的机制比较[J]. 土壤学报, 2016, 53(3): 654-662 (  0) 0) |
| [27] |
Khormali F, Abtahi A. Origin and distribution of clay minerals in calcareous arid and semi-arid soils of Fars province, southern Iran[J]. Clay Minerals, 2003, 38(4): 511-527 DOI:10.1180/0009855023740112 (  0) 0) |
| [28] |
Velde B. Origin and mineralogy of clays: Clays and the environment[M]. Berlin: Springer, 1995
(  0) 0) |
| [29] |
Ahn J H, Peacor D R. Illite/smectite from gulf coast shales: A reappraisal of transmission electron microscope images[J]. Clays and Clay Minerals, 1989, 37(6): 542-546 DOI:10.1346/CCMN.1989.0370606 (  0) 0) |
| [30] |
Amouric M, Olives J. Transformation mechanisms and interstratification in conversion of smectite to kaolinite :An HRTEM study[J]. Clays and Clay Minerals, 1998, 46(5): 521-527 DOI:10.1346/CCMN.1998.0460505 (  0) 0) |
| [31] |
Robert M. The experimental transformation of mica toward smectite; relative importance of total charge and tetrahedral substitution[J]. Clays and Clay Minerals, 1973, 21: 167-174 DOI:10.1346/CCMN.1973.0210305 (  0) 0) |
| [32] |
Velde B, Church T. Rapid clay transformations in Delaware salt marshe[J]. Applied Geochemistry, 1999, 14: 559-568 DOI:10.1016/S0883-2927(98)00092-4 (  0) 0) |
| [33] |
Furquim S A C, Graham R C, Barbiero L. Mineralogy and genesis of smectites in an alkaline-saline environment of Pantanal wetland, Brazil[J]. Clays and Clay Minerals, 2008, 56(5): 579-595 DOI:10.1346/CCMN.2008.0560511 (  0) 0) |
2. Key Laboratory of Arable Land Conservation (Middle and Lower Reaches of Yangtze River), Ministry of Agriculture, College of Resources and Environment, Huazhong Agricultural University, Wuhan 430070, China;
3. Key Laboratory of Oasis Ecology Agricultural of Xinjiang Production and Construction Corp, College of Agriculture, Shihezi University, Shihezi, Xinjiang 832000, China
 2019, Vol. 51
2019, Vol. 51

