2. 土壤与农业可持续发展国家重点实验室(中国科学院南京土壤研究所),南京 210008;
3. 中国科学院南京地理与湖泊研究所,南京 210008
土壤微生物群落是土壤中的活性组分,是土壤分解系统的主导者,在推动土壤物质转换、能量流动和生物地球化学循环中起着重要作用[1]。土壤微生物对供养植物有效养分起着关键的作用,主要通过改变土壤物理性质间接影响作物养分吸收[2]。土壤温度对微生物活性的影响极其明显。大多数土壤微生物能够在温度为10 ~ 45℃范围内生长,最适温度为30 ℃。在10 ~ 30℃温度范围内,温度越高,微生物活动能力越强,超出这一温度范围,则微生物活动受到抑制,从而影响到土壤的腐殖或矿质化过程,影响到各种养分的形态转化[3]。土壤微生物群落结构组成及其变化在一定程度上反映了土壤的质量及其健全性[4]。
目前对土壤温度影响微生物群落结构的研究主要侧重于气候变暖或气温升高间接引起的土壤温度升高使微生物群落结构发生改变[5-8]。而对于低气温下改变土壤温度环境条件对细菌群落多样性和结构的影响报道较少。而且,传统细菌培养方法主要依赖于细菌分离与培养,只能获取0.001% ~ 15%的环境微生物信息,且研究周期长,对种群的动态分析难以进行;另外,人工培养条件对种群的原始结构存在极大的干扰性,降低了结果的可信度[9-10]。
基于聚合酶链式反应(PCR)的分子指纹图谱技术——末端限制性片段长度多态性(terminal restriction fragment length polymorphism,T-RFLP)是一种全面、分辨率高、重现性良好的分子指纹图谱技术,自1997年起受到研究者的关注[11-12]。因此,本研究采用基于T-RFLP技术初步研究了设施栽培自然环境条件下,土壤温度对不同施肥方式下设施菜地土壤细菌群落多样性和组成的影响,旨在为土壤养分有效性提供解释,以期为设施土壤施肥、土壤微生物生态环境健康维护和土壤可持续发展提供理论依据。
1 材料与方法 1.1 试验地概况试验在江苏省苏州市太仓陆渡镇现代农业园大棚内进行。大棚规格为8连栋大棚,每单栋大棚长40 m、宽8 m、高5 m,种植年限约3 a,以种植小白菜为主。供试土壤为潮土,砂壤土,基本理化性状为pH 8.31、有机质13.8 g/kg、电导率(EC) 467.33 µS/cm、碱解氮59.5 mg/kg、有效磷35.97 mg/kg、速效钾104.24 mg/kg。试验前,整地,30 cm深度耕地。每单栋大棚分为四畦,每半畦为一处理小区,小区面积24 m2(长16 m×宽1.5 m)。采用裂区区组设计,每小区为1个重复,共3个重复。
1.2 试验设计试验设置土壤温度和肥料处理两个因素。土壤温度采用地热线(宁波市鄞州东海畜牧器械厂生产,长100 m,功率为800 W)加热的方式,待整地均匀后将地热线铺设于5 ~ 25 cm深度,利用定时器和温控器调节温度。试验设对照不增温(10℃ ± 2℃)和增温(20℃ ± 2℃)两个温度水平,大棚内气温和湿度均为自然状态。根据当地施肥习惯鸡粪有机肥作为底肥,后期进行尿素追肥,设置习惯施肥和不施肥对照两种施肥模式。施用的商品有机肥鸡粪基本理化性质为pH 7.83、EC 3.37 mS/cm、碱解氮486.5 mg/kg、有效磷1.0 g/kg、速效钾9.1 g/kg,用量30 000 kg/hm2,撒施翻耕于0 ~ 25 cm土层;尿素用量N 360 kg/hm2,其中40%基施(N 144 kg/hm2),追肥3次,每次追肥72 kg/hm2。所有肥料处理的磷钾肥用量均相同。磷肥为过磷酸钙,用量为1 031.25 kg/hm2,钾肥为硫酸钾,用量为660 kg/hm2,全部基施。作物定植前15 d施入有机肥,精耕0 ~ 20 cm土层土壤,使肥料与土壤混匀。供试作物黄瓜和辣椒苗分别于2012年10月15日和16日定植。定植一周后开始进行土壤温度处理。试验处理设置见表 1。
|
|
表 1 试验处理 Table 1 Treatments of experiment |
于黄瓜和辣椒的生长末期,2013年1月20日采土壤样品,按照“S”曲线采取耕层0 ~ 20 cm的混合土样。土壤自然风干,研磨过2 mm筛,参照鲁如坤[13]相关方法测定土壤基本理化性状。
1.3.2 土壤细菌群落结构采集新鲜土壤样品,采用PCR的分子指纹图谱技术——末端限制性片段长度多态性(T-RFLP)初步研究土壤细菌群落结构多样性。
1) DNA提取。取新鲜土壤500 mg,利用DNA提取试剂盒(FastDNA ®SPIN Kit for Soil)提取土壤总DNA,具体步骤按照厂家提供的说明书进行。最后得到的基因组DNA保存于-20℃以进行下一步试验。
2) PCR扩增。采用针对细菌16S rRNA基因特异性引物,上游引物为8f(5′-AGAGTTTGATCCTGGC TCAG-3′),5′末端带有Cy5荧光标记;下游引物为926r(5′-CCGTCAATTCCTTTRAGTTT-3′),PCR产物长900 bp。PCR反应体系为25 µl,其组分包括:15.8 µl ddH2O,2.5 µl 2.5 mmol/L dNTP,2.5 µl 10×PCR buffer(不含Mg),2 µl 25 mmol/L MgCl2,上下游引物(10 pmol/L)各0.5 µl,0.2 µl 5 U/µl rTaq酶,0.1 µl模板DNA。PCR反应条件为:95℃预变性5 min,94℃变性30 s,54℃复性45 s,72℃延伸1 min,共30个循环,最后72℃延伸10 min。取5 µl PCR产物用1%的琼脂糖(质量分数)凝胶电泳检测。然后用纯化试剂盒AxyPrep PCR纯化PCR产物。
3) T-RFLP分析。用绿豆酶(Mung bean nuclease,TaKaRa)在30℃下硝化PCR产物35 min,50 µl硝化反应体系包含5 µl 10×绿豆酶buffer,0.1 µl绿豆酶和45 µl PCR产物;然后用PCR产物纯化试剂盒(Axygen)纯化硝化后的产物;接着用限制性核酸内切酶HhaⅠ(TaKaRa)酶切硝化纯化后产物,37℃酶切硝化3 h,此时10 µl酶切反应体系中包含1 µl 10×buffer、1 µl Hha I、8 µl纯化后产物、0.5 µl去离子水。上样体系剂量及电泳条件见表 2。对于细菌,由于相对数量过小的限制性末端片段(T-RFs)不会对群落的特性产生明显的影响[10],故在本研究中舍去了相对数量 < 1%的T-RFs,然后分别计算图谱中每一个峰的峰面积与所有峰总面积的比值。
|
|
表 2 T-RFLP上样体系 Table 2 Sampling system of T-RFLP analysis |
4) 细菌种群组成及变化的多样性指数测度。本研究主要采用α多样性方法,包括物种丰富度(S)、Margalef物种丰富度指数(da)、多样性指数(Shannon- Weiner)、均匀度指数(Pielou)和优势度指数(Simpson)。其中Shannon-Weiner指数反映了物种的多样性,Pielou指数反映了物种的均匀度,Simpson指数反映了物种的优势度。
5) 细菌群落结构相似性分析。采用非加权配对算数平均法(UPGMA)聚类分析不同土壤样品细菌群落结构的相似性。将T-RFLP数据转化为由0和1组成的二元矩阵,采用Bray-Crtis算法计算各样品之间物种群落组成的相似性。
1.4 数据分析采用Primer 5.0软件进行多样性指数分析,采用Excel 2003作图。
2 结果与分析 2.1 土壤理化性状从表 3可以看出,施肥使土壤pH升高,EC值大幅增加,同时速效养分及有机质含量均不同程度增加。不施肥处理,土壤增温比不增温使土壤速效养分、有机质含量略有增加,但增加不显著。施肥处理中,土壤增温明显增加土壤速效养分含量和EC值,但pH降低。
|
|
表 3 不同土壤温度和施肥方式下设施蔬菜生育中期土壤基本理化性状 Table 3 Soil physicochemical properties under different soil temperatures and fertilization patterns |
表 4显示了不同土壤温度和施肥方式下蔬菜结果期土壤细菌多样性指数的分析结果。可以看出,在种植黄瓜条件下,土壤细菌物种数目(S)在T4和T3处理中较高,T1和T2处理无差异,物种的个体数之和(N)大小排列顺序为T4 > T3 > T2 > T1,说明增温增加了土壤细菌物种的种类和数量。物种丰富度(d)除T4处理最低外,其余处理间差异不大。增温处理细菌Pielou指数低于对照不加温处理。Shannon-Weiner指数除T4处理最低外,其余处理间差异不大。增温使某些细菌的优势度体现出来,Simpson指数大小排列顺序为T4 > T3 > T1 > T2。
|
|
表 4 不同土壤温度和施肥方式下蔬菜结果期土壤细菌的多样性指数 Table 4 Indexes of soil bacteria diversity in fruiting period under different soil temperatures and fertilization patterns |
在种植辣椒条件下,土壤细菌物种数目大小排列顺序为T6 > T7 > T8 > T5。增温使细菌物种个体数增加明显,大小排序为T8 > T7 > T5 > T6。物种丰富度大小顺序为T6 > T7 > T8 > T5。Pielou指数以T6处理最高,T8处理最低,其余处理间差异不大。Shannon-Weiner指数表现为T6 > T7 > T5 > T8。Simpson指数大小排序为T8 > T5 > T7 > T6。
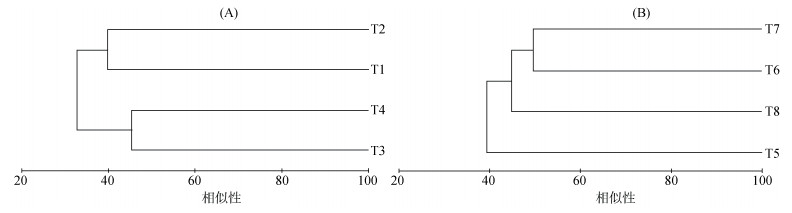
2.3 土壤细菌群落结构的相似性首先,用Treeflap软件对处理后的T-RFLP输出数据进行分析,然后,用Primer 5对土壤细菌群落结构的相似性进行分析和计算,并作出聚类图,如图 1所示。从图 1A可以看出,T3和T4处理相似度较高,T1和T2处理具有较高的相似性。从图 1B可以看出,T6和T7处理表现较高的相似性,出现差异较大的是T5处理,其次是T8处理。
|
(A:黄瓜;B:辣椒) 图 1 基于T-RFLP图谱的聚类分析 Fig. 1 Hierarchical cluster analysis based on T-RFLP profiles |
从图 2A可以看出,在黄瓜种植条件下,除T4处理外,其余处理均含有T-RF 61 bp。T3和T4增温处理出现T-RF 62bp,相对丰度分别为5.37%和4.34%,T1、T2和T3处理的T-RF 93 bp相对丰度较大,分别为6.84%、5.61%和8.57%。T-RF 94 bp只出现在T4处理中,相对丰度5.51%。T-RF 95 bp仅出现在不施肥的T1和T3处理中。96、205、207、213、353、378、382 bp T-RFs在施肥的T2和T4处理中相对丰度较高。T1、T2、T3和T4处理中相对丰度最大出现在93、93、93和94 bpT-RFs。
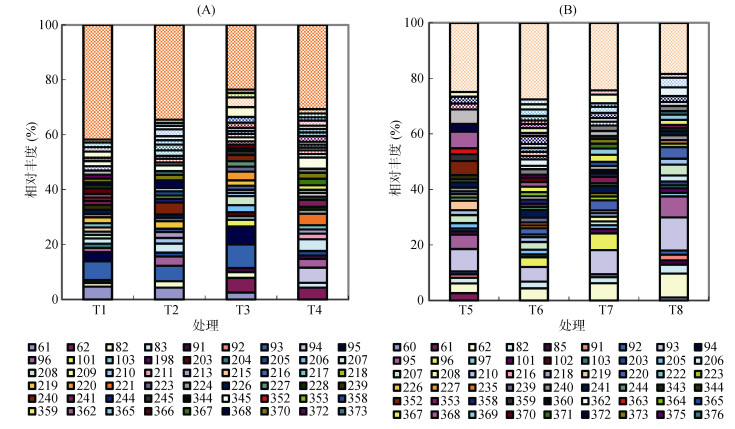
|
(A:黄瓜;B:辣椒) 图 2 土壤细菌16S rDNA酶(Hha I)切后各限制性片段(bp)的相对丰度 Fig. 2 Average relative abundances of soil bacterial 16S rDNA T-RFs with endonuclease Hha I under different soil temperatures and fertilization patterns |
从图 2B可以看出,在辣椒种植条件下,T5、T6、T7和T8处理主要T-RFs为93 bp和62 bp。93 bp在每个处理中相对丰度值均最大,分别为8.07%、5.26%、8.70%和11.89%,T-RF 62 bp在T5、T6、T7和T8处理中相对丰度分别为3.53%、4.37%、6.23%和8.61%。增温的T7和T8处理中T-RF 93 bp和T-RF 62 bp均高于不增温的T6和T7处理。T-RF 96 bp仅存在于T6和T7处理中。T-RF 82 bp存在于每个处理中,其中以T8处理中相对丰度值最大。T-RF 220 bp在增温的T7和T8处理中表现明显。T-RF 95 bp在T5和T8处理中应特别关注。
利用网络在线服务(http://trflp.limnology.wisc.edu/index.jsp)查询得知:T-RF 62 bp未找到相似菌类。T-RF 93 bp代表蚜虫内共生菌Buchnera aphidicola M63254,大量的脱磷孤菌Desulfovibrio senezii AF050100,Desulfovibrio sp. U52959。T-RF 94 bp代表圆杆菌Cyclobacterium marinum M62788,大量的食纤维菌属Cytophaga AB015524、AB015532、AB015587、AB015265,乙酸氧化脱硫单胞菌Desulfuromonas acetoxidans M26634,黄杆菌Flavobacterium columnare AB010952,土地杆菌Pedobacter heparinus M11657,鞘氨醇杆菌Sphingobacterium spiritivorum M58778。T-RF 95 bp代表芽孢杆菌Bacillus arsenicoselenatis AF064705;大量的硫酸盐还原菌:脱硫球茎菌属Desulfobulbus U85473、脱硫杆菌属Desulfohalobium retbaense U48244、脱硫管状菌属Desulforhopalus vacuolatus L42613、脱硫弧菌属Desulfovibrio alcoholovorans AF053751。T-RF 82 bp代表芽单胞菌属Blastomonas natatoria AB024288,长赤细菌Erythrobacter longus M59062,赤单胞菌Erythromonas ursincola AB024289,侵蚀侏囊菌Nannocystis exedens M94279,大量的紫杆菌属Porphyrobacter KK348 AB033325、Porphyrobacter KK351 AB033326和鞘氨醇单胞菌属Sphingomonas subterranea AB025014、Sphingomonas yanoikuyae U37524。
3 讨论土壤微生物在其生命活动中需要能量和养料,因此它们所处的生存条件,如温度、湿度、通气性、外界干扰(施肥等)均会对其生命过程产生影响。本研究结果表明,土壤不增温条件下,栽培黄瓜和辣椒土壤施肥均比不施肥使细菌多样性指数增加,但物种优势度降低。曾希柏等[14]研究表明适量化肥和有机肥配合施用可以显著增加土壤中细菌的丰度。土壤增温条件下,细菌多样性指数在施肥处理中较低,但物种的优势度提高。这可能是充足的养料供给和适宜的温度条件,使一部分对温度敏感的细菌活跃度增加,微生物生物量增加明显,成为优势物种[15]。土壤微生物的群体作用在一定程度上对抑制植物土传病害有积极的作用,土壤微生物群落结构越丰富,物种越均匀,多样性指数越高,对抗病原菌的综合能力越强[16-17]。本研究表明,土壤不增温条件下,辣椒T6处理比T5处理的细菌物种均匀度和多样性均高,但是T6处理的辣椒植株成活率和产量比T5处理低,因此,病原菌与微生物间的关系尚不明确,也可能是除细菌外的其他微生物活动的结果或者辣椒根系在低温下活性低导致的植株长势弱。
土壤增温比不增温使两种施肥条件下栽培黄瓜土壤细菌物种数目增加,物种总个体数增加。增温使细菌物种均匀度和多样性指数有所减小,但细菌物种的优势度提高。T3和T4处理、T1和T2处理种群结构相似度比较高,说明它们的种群结构比较接近,可能是土壤温度对细菌群落结构改变起主要作用。对生存环境变化较敏感的微生物种群丰度在土壤增温后发生了显著变化,其中一部分细菌种群丰度下降甚至消失,如增温使T4施肥处理微生物群落结构发生变化较大,61 bp和93 bp两个T-RFs消失,相反另一部分细菌受激发效应,种群丰度上升,T3和T4处理均出现两个新T-RFs,62 bp和94 bp。增温比不增温使两种施肥条件下栽培辣椒土壤物种个体数均增加。菌种群落结构相似性在T6和T7处理间较高,T8处理次之,说明增温和施肥均改善了土壤菌群结构。土壤增温使62 bp和93 bp两个T-RFs相对丰度增加明显,且施肥比不施肥处理相对丰度高。368 bp和352 bp两个T-RFs在低温土壤中相对丰度较大,而增温使这两种片段消失,表明368 bp和352 bp两个T-RFs代表的细菌可能比较耐受低温环境。此外,序列长度相同,但碱基排列可能不同,因此长度相同不一定是同一序列[18-19]。本文采用T-RFLP方法已经可以明确反映温度和施肥方式对设施土壤细菌群落结构的影响。在后续的研究中,可以考虑用克隆建库的方法做进一步的探索。
土壤温度变化可能引起土壤微生物群落某些特定种群的生理机能和生长发生改变,原因在于特定微生物种群之间对土壤温度的耐受力存在差异[20-21]。综上可以看出,两种作物栽培下,土壤增温对细菌群落62 bp作用明显,62 bp可能代表的是增温下土壤养分有效性提高的主要有益微生物。由于T-RF 62 bp片段在数据库中未找到对应的功能细菌类群,因此它们对施肥和土壤温度的响应机理还有待进一步研究。土壤温度升高通常提高养分的矿化速率,使土壤养分的有效性增加,为土壤微生物提供更多基质,有利于微生物群落的生长和繁殖,并间接提高土壤酶活性,这些过程和变化可能是同时发生的,并存在相互刺激和反馈作用,从而提高土壤生态系统物质的循环速率[22-23]。Malghani等[24]研究表明土壤微生物生物量碳氮在土壤温度20℃和施用有机肥的处理中比低土壤温度(10℃)处理中高。总之,土壤微生物活性受到多因素的影响,施肥、水分和温度等,这些因素可能共同作用影响微生物活性[26]。
4 结论与不增温相比,土壤增温促进不施肥和施肥两种处理土壤速效养分含量增加,这种促进作用在施肥处理下表现更明显。土壤不增温条件下,施肥使细菌Pielou均匀度指数和Shannon-Weiner多样性指数增加,Simpson优势度指数降低。土壤增温条件下,施肥使土壤细菌Pielou均匀度和Shannon-Weiner多样性指数减小,Simpson物种优势度提高。与不增温比,增温使土壤细菌均匀度指数和香浓多样性指数减低,但物种个体数和优势度指数增加明显。62 bp和93 bp两种T-RFs在土壤增温条件下优势度较高,主要代表共生菌和杆菌,其可能是增温下土壤养分有效性提高的主要有益微生物。
| [1] |
孔滨, 孙波, 郑宪清, 等. 水热条件和施肥对黑土中微生物群落代谢特征的影响[J]. 土壤学报, 2009, 46(1): 100-106 DOI:10.3321/j.issn:0564-3929.2009.01.014 (  0) 0) |
| [2] |
Paul E A, Clark F E. Soil microbiology and biochemistry[M]. 2nd ed. San Diego: Academic Press, 1996
(  0) 0) |
| [3] |
Yukiko S B, Takayuki N, Atsushi K. Effect of warming on the temperature dependence of soil respiration rate in Arctic, temperature and tropical soils[J]. Applied Soil Ecology, 2003, 22: 205-210 DOI:10.1016/S0929-1393(02)00158-0 (  0) 0) |
| [4] |
Visser S, Parkinson D. Soil biological criteria as indicators of soil quality: Soil microorganisms[J]. American Journal of Alternative Agriculture, 1992, 7(1): 33-37 (  0) 0) |
| [5] |
张乃莉, 郭继勋, 王晓宇, 等. 土壤微生物对气候变暖和大气N沉降的响应[J]. 植物生态学报, 2007, 31(2): 252-261 DOI:10.3321/j.issn:1005-264X.2007.02.008 (  0) 0) |
| [6] |
Schindlbacher A, Rodler A, Kuffner M, et al. Experimental warming effects on the microbial community of a temperate mountain forest soil[J]. Soil Biology Biochemistry, 2011, 43(7): 1417-1425 DOI:10.1016/j.soilbio.2011.03.005 (  0) 0) |
| [7] |
Fierer N, Schimel J P, Holden P A. Influence of drying-rewetting frequency on soil bacterial community structure[J]. Microbial Ecology, 2003, 45: 63-71 DOI:10.1007/s00248-002-1007-2 (  0) 0) |
| [8] |
徐振锋, 唐正, 万川, 等. 模拟增温对川西亚高山西类针叶林土壤酶活性的影响[J]. 应用生态学报, 2010, 21(11): 2727-2733 (  0) 0) |
| [9] |
王蓓, 孙庚, 罗鹏, 等. 模拟升温和放牧对高寒草甸土壤微生物群落的影响[J]. 应用与环境生物学报, 2011, 17(2): 151-157 (  0) 0) |
| [10] |
史青, 柏耀辉, 李宗逊, 等. 应用T-RFLP技术分析滇池污染水体的细菌群落[J]. 环境科学, 2011, 32(6): 1786-1792 (  0) 0) |
| [11] |
尹承苗, 王功帅, 李园园, 等. 连作苹果园土壤真菌的T-RFLP分析[J]. 生态学报, 2014, 34(4): 837-846 (  0) 0) |
| [12] |
孙庆华, 柏耀辉, 赵翠, 等. DGGE、T-RFLP、LH-PCR对两种活性污泥的微生物种群多样性分析的比较[J]. 环境工程学报, 2009, 3(8): 1365-1370 (  0) 0) |
| [13] |
鲁如坤. 土壤农业化学分析方法[M]. 北京: 中国农业科技出版社, 1999
(  0) 0) |
| [14] |
曾希柏, 王亚男, 王玉忠, 等. 不同施肥模式对设施菜地细菌群落结构及丰度的影响[J]. 中国农业科学, 2013, 46(1): 69-79 DOI:10.3864/j.issn.0578-1752.2013.01.009 (  0) 0) |
| [15] |
陈志豪, 梁雪, 李永春, 等. 不同施肥模式对雷竹林土壤真菌群落特征的影响[J]. 应用生态学报, 2017, 28(4): 1168-1176 (  0) 0) |
| [16] |
王亚男, 曾希柏, 王玉忠, 等. 设施蔬菜种植年限对氮素循环微生物群落结构和丰度的影响[J]. 应用生态学报, 2014, 25(4): 1115-1124 (  0) 0) |
| [17] |
王亚男, 曾希柏, 王玉忠, 等. 施肥模式对设施菜地根际土壤微生物群落结构和丰度的影响[J]. 生态学杂志, 2015, 34(3): 826-834 (  0) 0) |
| [18] |
马栋山, 熊薇, 张琼琼, 等. 基于T-RFLP和因子分析的香蒲根际细菌群落研究[J]. 中国环境科学, 2014, 34(10): 2684-2691 (  0) 0) |
| [19] |
Wang J J, Li Y M, Zhao Z W, et al. T-RFLP Analysis of soil microbial community from Shandong Province for forensic science[J]. Advanced Materials Research, 2012, 599: 250-253 DOI:10.4028/www.scientific.net/AMR.599.250 (  0) 0) |
| [20] |
隋心, 张荣涛, 钟海秀, 等. 利用高通量测序对三江平原小叶章湿地土壤细菌多样性的研究[J]. 土壤, 2015, 47(5): 919-925 (  0) 0) |
| [21] |
戴雅婷, 闫志坚, 解继红, 等. 基于高通量测序的两种植被恢复类型根际土壤细菌多样性研究[J]. 土壤学报, 2017, 54(3): 735-748 (  0) 0) |
| [22] |
Zsuzsanna N, Zalán G H, Károly M. Investigation of archaeal and bacterial community structure of five different small drinking water networks with special regard to the nitrifying microorganisms[J]. Microbiological Research, 2016, 188/189: 80-89 DOI:10.1016/j.micres.2016.04.015 (  0) 0) |
| [23] |
Wang J C, Zhang D, Zhang L, et al. Temporal variation of diazotrophic community abundance and structure in surface and subsoil under four fertilization regimes during a wheat growing season[J]. Agriculture, Ecosystems & Environment, 2016, 216(15): 116-124 (  0) 0) |
| [24] |
Malghani S, Reim A, Fischerc J V, et al. Soil methanotroph abundance and community composition are not influenced by substrate availability in laboratory incubations[J]. Soil Biology and Biochemistry, 2016, 101: 184-194 DOI:10.1016/j.soilbio.2016.07.009 (  0) 0) |
| [25] |
杨瑞红, 赵成义, 王新军, 等. 梭梭和柽柳土壤微生物多样性初步分析[J]. 土壤, 2016, 48(6): 1120-1130 (  0) 0) |
2. State Key Laboratory of Soil and Sustainable Agriculture, Institute of Soil Science, Chinese Academy of Sciences, Nanjing 210008, China;
3. Nanjing Institute of Geography and Limnology, Chinese Academy of Sciences, Nanjing 210008, China
 2019, Vol. 51
2019, Vol. 51


