2. 山东省腐植酸高效利用工程技术研究中心,山东泰安 271000;
3. 山东农业大学资源与环境学院,山东泰安 271018;
4. 山东农业大学化学学院,山东泰安 271018
随着我国经济的快速发展,农业生产中化肥、农药投入量日益增多,对土壤、水体、大气与生态平衡造成了严重的破坏,土壤退化、污染严重,对作物产量、品质、食品安全性和人体健康也造成了严重的威胁[1]。随着人们环境安全意识的提升,开始注重食品的安全性和品质,因此我国开始大力推进新型肥料的使用,实施减少化肥、农药投入量的“双减政策”。复合微生物菌剂本身含有大量高效有益活菌,施入土壤后在植物根际定殖,同时激活土著微生物,能在一定程度上降解污染环境的有机物[2]; 复合微生物菌剂还含有大量活性物质和有机质等营养成分,具有提高土壤微生物丰富度、优化土壤团粒结构、调节根部营养环境等作用; 此外,在其生命活动过程中还能产生各类植物生长刺激素,刺激植物生长[3-4]。因此,在自然生态系统中,微生物与植物的有益共生在防治植物病害和促进植物生长等方面发挥了重要的作用[5]。丁莉萍等[6]研究发现复合菌剂在提高樟树苗移栽成活率的同时,提高了土壤中有效养分含量,促进樟树苗对养分的吸收和利用,为樟树苗移栽后的生长打下了坚实的基础。前人大量研究表明:复合微生物菌剂可提高果园土壤微生物多样性,促进重茬果园土壤微生物生态系统的恢复[7]; 通过提高对花生根际化感物质的降解,来减轻花生网斑病、焦斑病和褐斑病的发病率,缓解连作障碍的同时,减少药物使用带来的环境污染[8]; 还可通过提高盐碱土耕层土壤脱盐率,降低土壤盐分含量,减轻盐害胁迫,促进苜蓿生长[9]。因此,应用微生物菌剂来调控土壤微生物群落结构和多样性、改善土壤营养条件、增强植物抗逆能力、减轻病虫害的发生,实现农业健康持续发展具有深远的意义。
棉花是我国仅次于粮食的第二大作物,也是关系国计民生的战略物资。然而,棉花主产区多为贫瘠土壤区,为了提高产量,人们加大了化肥的投入量,随着生产周期的推移,导致土壤板结、土壤团粒结构和通透性变差、耕地肥力下降、连作障碍等诸多问题[10]。研究表明:合理配施有机无机肥利于棉花的增产和增质,同时对土壤环境的改善也具有重要作用[11]。微生物肥料在与有机肥混施条件下提高了棉花产量、土壤肥力,降低了土壤容重,且微生物肥料与有机肥混施效果优于单一使用[12]。然而有关复合微生物菌剂对根际土壤微生物群落与土壤酶活性的影响及促进植物生长的机理等研究较少。因此,本试验以棉花为供试植物,通过盆栽试验,分析常规和灭菌条件下不同用量的复合微生物菌剂对棉花生长、生理代谢及土壤养分、酶活性和土壤微生物数量的影响,研究复合微生物菌剂的改土、促生效果及机理,对比常规与灭菌条件下的差异,同时探讨适宜的推荐用量,为复合微生物菌剂的大面积推广应用提供科学依据。
1 材料与方法 1.1 供试材料试验于2017年7月15日-8月30日在山东省泰安市肥城市农大肥业科技有限公司蔬菜大棚内实施,供试土壤基本理化性状:碱解氮60.38 mg/kg,全氮0.93 g/kg,有效磷31.74 mg/kg,速效钾95.09 mg/kg,有机质9.83 g/kg; 供试作物:鲁棉研28号; 供试肥料:农大肥业科技有限公司微生物肥料车间提供的常规复合微生物菌剂(有效活菌数≥10亿/ml; 有效氮磷钾含量≥6%)。灭菌复合微生物菌剂:常规复合微生物菌剂在120 ℃条件下灭菌30 min后获得。
1.2 试验设计常规和灭菌复合微生物菌剂各设2个施用量,不施肥处理为空白对照,复合微生物菌剂做追肥施入,共设5个处理,分别为:CK,不施肥; T1,灭菌复合微生物菌剂5 L/667m2; T2,灭菌复合微生物菌剂10 L/667m2; T3,常规复合微生物菌剂5 L/667m2; T4,常规复合微生物菌剂10 L/667m2,每个处理设6次重复,采用随机区组试验; 种播棉花,两片真叶后间苗定植,每盆留3棵棉花幼苗,总共30盆。定植后统一管理,每隔5 d处理1次,每个处理所需肥料总量溶于1.8 L水中稀释,即每盆施入300 ml稀释液,空白用等量蒸馏水,共处理8次,直至收获。
1.3 测定项目与方法 1.3.1 生长指标和产量的测定棉花幼苗生长期用直尺、游标卡尺和手持SPAD-502 PLUS叶绿素仪测定棉花株高、茎粗和叶片SPAD值; 处理45 d后收获,将植株地上部和地下部分开,根系先用5 mmol/L CaCl2冲洗,再用蒸馏水冲洗干净,称鲜物质量; 然后在110 ℃下杀青,80 ℃烘干至恒重,测干物质量。
1.3.2 植株生理指标测定光合色素含量的测定:用95%的乙醇研磨,25 ml定容后,分别在665、649和470 nm下测定吸光值[13]; 超氧化物歧化酶(SOD)活性测定:采用氮蓝四唑(NBT)法[14]; 过氧化物酶(POD)活性测定:采用愈创木酚法; 过氧化氢酶(CAT)活性测定:采用紫外吸收法[15]; 丙二醛(MDA)含量测定:采用硫代巴比妥酸法[16]; 超氧阴离子(O2· -)产生速率测定:采用羟氨氧化法[17]。
1.3.3 土壤各项指标测定用5:1的水土比浸提法测土壤pH; 采用平板菌落计数法测根际土壤细菌数、真菌数和放线菌数[18]; 采用重铬酸钾容量法测土壤有机质; 采用凯氏定氮法测全氮; 采用碱扩散法测碱解氮; 采用碳酸氢钠溶解-钼锑抗比色法测有效磷; 采用乙酸铵溶解-火焰光度计法测有效钾[17]; 采用苯酚-次氯酸钠比色法测脲酶活性,以24 h后1 g土壤中NH4+-N的质量(mg)表示; 采用滴定法测过氧化氢酶活性,用20 min后1 g土壤消耗0.02 mol/LKMnO4的ml数表示; 采用3, 5-二硝基水杨酸比色法测蔗糖酶活性,以24 h后1 g土壤中所含葡萄糖的质量(mg)表示; 采用磷酸苯二钠比色法测土壤磷酸酶活性,以24 h后1 g土壤中释放出的酚并转化为磷的质量(mg)表示; 采用氯化三苯基四氮唑法测土壤脱氢酶活性,结果以1 g土壤中三苯基甲臢(TPF)的质量(μg)表示[19]。
1.4 数据处理采用Excel 2003软件处理数据和绘表,采用DPS 7.05软件进行统计分析,采用最小显著极差法(LSD)进行差异显著性检验(P < 0.05)。
2 结果与分析 2.1 复合微生物菌剂对棉花生长的影响由表 1可知,不同处理对生长25、35和45 d后棉花株高、茎粗和SPAD值的影响不同,整体趋势为常规复合微生物菌剂处理优于灭菌复合微生物菌剂。与CK相比,常规和灭菌复合微生物菌剂均显著提高了不同测定时期棉花叶片SPAD值,35 d时效果最明显,与CK相比,T1、T2、T3和T4处理分别显著提高了11.02%、16.53%、15.82%和13.17%;在25 d时,仅常规复合微生物菌剂显著提高了棉花株高和茎粗,不同用量下差异不显著; 随着处理时间的推移和次数的增多,到35 d时,灭菌复合微生物菌剂用量达10 L/667m2时,其株高和茎粗开始显著高于CK; 直至处理45 d后,不同用量的灭菌复合微生物菌剂均显著提高了棉花株高和茎粗; 此外,在棉花整个苗期生育阶段,常规复合微生物菌剂处理的株高和茎粗均显著高于CK处理。
|
|
表 1 不同处理对棉花株高、茎粗和SPAD值的影响 Table 1 Effects of different treatments on shoot heights, stem diameters and SPAD values of cotton |
处理35 d后取棉花倒4叶测定叶片内光合色素含量,由表 2可知,与CK相比,常规和灭菌复合微生物菌剂均显著提高了棉花叶片内叶绿素a和叶绿素b含量以及叶绿素a/b,对类胡萝卜素含量的影响不显著; 其中,T1、T2、T3和T4的叶绿素a分别提高了21.60%、19.20%、25.60%和36.00%,叶绿素b分别提高了18.60%、16.28%、13.95%和25.58%,叶绿素a/b分别提高了25.98%、20.08%、23.62%和31.50%。以上结果表明常规复合微生物菌剂对光合色素的提高能力优于灭菌复合微生物菌剂,但不同用量的复合微生物菌剂对光合色素含量的影响差异较小。
|
|
表 2 不同处理对棉花叶片内光合色素含量的影响 Table 2 Effects of different treatments on photosynthetic pigment contents in cotton leaves |
棉花幼苗生长45 d后收获测得幼苗植株生物量如表 3所示,复合微生物菌剂可显著提高棉花幼苗地上部和地下部干、鲜物质量,且干、鲜物质量的变化趋势相同。棉花地上部生物产量随复合微生物菌剂用量的增多而增多,而地下部受复合微生物菌剂用量的影响不明显。等量条件下,常规复合微生物菌剂处理的棉花植株地上部与地下部生物量均显著高于灭菌复合微生物菌剂,T3与T1相比,地上部鲜物质量、干物质量,地下部鲜物质量、干物质量分别显著提高了50.50%、63.20%和5.10%、12.09%;T4与T2相比也分别显著提高了17.76%、18.26%和7.28%、11.96%。表明复合微生物菌剂可促进幼苗期棉花生物量的累积,进而为后期生殖生长提供充足的物质保障。
|
|
表 3 不同处理对棉花幼苗生物量的影响 Table 3 Effects of different treatments on seedling biomass of cotton |
由图 1可见,复合微生物菌剂显著提高了棉花叶片和根系内SOD、POD和CAT活性,且各处理叶片SOD和CAT活性高于根系,而POD活性与之相反。由图 1A可知,常规复合微生物菌剂对叶片和根系内SOD活性的提高能力较灭菌复合微生物菌剂明显,T3较T1分别显著提高了3.41%和37.58%,T4较T2分别显著提高了4.14%和19.56%,这表明常规复合微生物菌剂对根系SOD活性的提高能力大于叶片,而不同用量间的差异不显著。由图 1B可见,POD活性变化趋势与SOD相似,与T1相比,T3处理叶片和根系内POD活性分别显著提高了44.43%和3.29%;而T4与T2相比,仅叶片内显著提高了8.61%,根系内差异不显著,这表明常规复合微生物菌剂对叶片POD活性的提高能力较根系明显,然而用量升高后酶活性却有所降低,但差异不显著。由图 1C可见,与灭菌复合微生物菌剂处理相比,常规复合微生物菌剂处理降低了叶片CAT活性,差异不显著; 而根系内活性显著提高,T3比T1提高了98.46%,T4比T2提高了63.96%,这表明常规复合微生物菌剂对根系CAT活性的提高能力较叶片明显,且随用量的升高而升高。因此复合微生物菌剂可通过提高棉花体内抗氧化物酶的活性来缓解逆境胁迫下的氧化损伤,提高植物抵抗逆境胁迫的能力,且常规复合微生物菌剂的效果优于灭菌复合微生物菌剂,而不同用量间差异不显著。
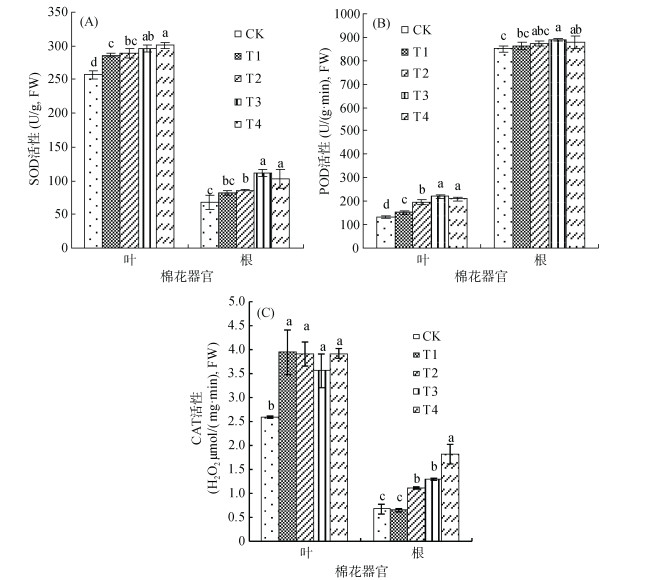
|
(图柱上方小写字母不同表示处理间差异达到P < 0.05显著水平,下同) 图 1 不同处理对棉花叶片和根系内超氧化物歧化酶(SOD)、过氧化物酶(POD)和过氧化氢酶(CAT)活性的影响 Fig. 1 Effects of different treatments on activities of superoxide dismutase (SOD), peroxidase (POD) and catalase (CAT) in cotton leaves and roots |
植物在生长过程中遭受逆境胁迫时体内代谢平衡发生紊乱,会累积大量有害过氧化物质(MDA、H2O2、O2· -),致使氧化还原平衡受损。由图 2可见,复合微生物菌剂显著降低了棉花叶片和根系内MDA含量和超氧阴离子产生速率,但降低能力与复合微生物菌剂的种类和用量有关。由图 2A可见,叶片内,T1、T2和T3处理间差异不显著,而T4与各处理相比存在显著性差异,T4与T2相比,显著降低了47.18%;根系内,灭菌条件下随用量的升高,MDA累积量逐渐降低,常规条件下却出现了相反的趋势,T3比T1显著降低了20.00%,而T4与T2相比有所升高,但差异不显著。由图 2B可见,常规复合微生物菌剂对叶片和根系内超氧阴离子产生速率的降低能力高于灭菌复合微生物菌剂,且均随用量的增加而降低,T3与T1相比,分别降低了14.16%和22.34%,T4与T2相比,分别降低了11.93%和5.91%,且仅根系内T3与T1间存在显著性差异。以上结果表明,复合微生物菌剂可通过提高棉花体内抗氧化物酶的活性来促进过氧化物质的分解,降低植物体内过氧化物质的积累量,保证植物体内正常的氧化还原电位,减轻膜质氧化损伤,最终提高植物抵抗逆境胁迫能力。
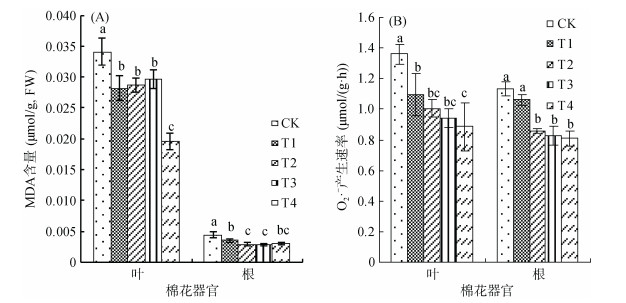
|
图 2 不同处理对棉花叶片和根系内丙二醛(MDA)含量和超氧阴离子(O2· -)产生速率的影响 Fig. 2 Effects of different treatments on MDA (MDA) contents and O2· - (O2· -) generation rates in cotton leaves and roots |
土壤酸碱度与根际微生物和根系分泌物息息相关,由图 3可见,复合微生物菌剂显著降低了根际土壤pH,与CK相比,T1、T2、T3和T4分别降低了4.27%、12.07%、5.00%和13.98%,即常规复合微生物菌剂的效果优于灭菌复合微生物菌剂,且用量对根际土壤pH的影响较菌剂是否灭菌更为显著,当用量达到10 L/667m2时,土壤的pH降到了7.0 ~ 7.2,把土壤从碱性调到了中性。
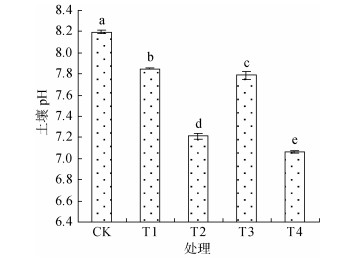
|
图 3 不同处理对棉花根际土壤pH的影响 Fig. 3 Effects of different treatments on soil pH in cotton rhizosphere |
由图 4可见,各处理土壤细菌数>放线菌数>真菌数,添加复合微生物菌剂后土壤微生物总量呈上升趋势。由图 4A可见,处理30 d时,与CK相比,除T1处理外,T2、T3和T4处理的根际土壤细菌数分别显著提高了19.05%、30.95%和103.10%;到处理45 d时,与CK相比,各处理分别显著提高了22.42%、19.89%、48.28%和58.59%,均高于30 d的细菌数,且常规复合微生物菌剂与灭菌复合微生物菌剂间存在显著性差异,而不同用量间差异不显著。由图 4B可见,复合微生物菌剂处理降低了根际土壤真菌数,处理30 d时,T1和T4与CK相比,显著降低了10.17%和23.38%;到处理45 d时,除T2外,其余各处理与CK相比,分别显著降低了10.53%、11.99%和23.82%,与30 d相比,各处理真菌数均有所降低,且两次结果均为复合微生物菌剂用量越高,真菌数越低,等量条件下,常规复合微生物菌剂的根际土壤真菌数低于灭菌复合微生物菌剂。由图 4C可见,复合微生物菌剂提高了根际土壤放线菌数,处理30 d时,与CK相比,除T1显著提高了38.17%,其余处理间差异不显著; 而到45 d时,除T4与CK相比差异不显著外,其余处理显著提高了13.11%、17.10%和20.14%。以上结果表明根际土壤细菌数和真菌数受常规复合微生物菌剂的影响效果较灭菌复合微生物菌剂明显,且用量越高效果越显著,而放线菌数的变化趋势与之相反。
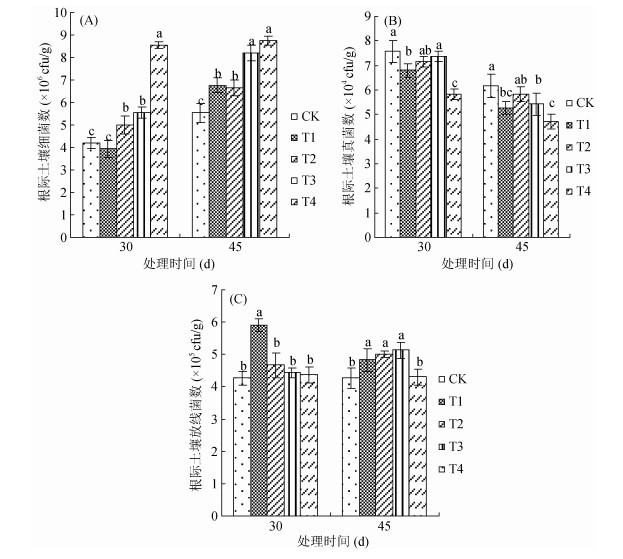
|
图 4 不同处理对棉花根际土壤细菌(A)、真菌(B)和放线菌数(C)的影响 Fig. 4 Effects of different treatments on soil bacteria(A), fungi(B) and actinomycetes(C) in cotton rhizosphere |
由表 4可知,复合微生物菌剂提高了土壤脲酶、脱氢酶、中性磷酸酶和蔗糖酶活性,除脲酶外,其余各酶活性与CK相比,均存在显著性差异。除T2外,T1、T3和T4脲酶活性与CK相比,也分别显著提高了7.55%、11.32%和5.67%,即复合微生物肥料用量越大,对脲酶活性的提高能力越小。与CK相比,T1、T2、T3和T4的土壤脱氢酶活性分别提高了7.91%、15.42%、20.56%和21.34%,土壤中性磷酸酶活性分别提高了36.69%、40.77%、42.47%和67.61%,土壤蔗糖酶活性分别提高了24.64%、67.91%、37.31%和82.09%,而土壤过氧化氢酶活性却显著降低了3.22%、6.44%、4.51%和6.77%。以上结果表明等量条件下常规复合微生物菌剂对土壤各酶活性的影响较灭菌复合微生物菌剂明显,脱氢酶、中性磷酸酶和蔗糖酶活性均随复合微生物菌剂用量的升高而升高,而土壤脲酶和过氧化氢酶活性的变化趋势与之相反。
|
|
表 4 不同处理对棉花根际土壤酶活性的影响 Table 4 Effects of different treatments on activities of soil enzymes in cotton rhizosphere |
由表 5可知,复合微生物菌剂提高了土壤养分及有机质含量,除碱解氮外,其余养分含量与CK相比均存在显著性差异,其中T1、T2、T3和T4的全氮含量分别提高了32.84%、76.12%、55.22%和67.16%,速效钾分别提高了8.99%、50.16%、5.07%和41.33%,有效磷分别提高了15.30%、13.07%、7.32%和12.42%,有机质分别提高了5.52%、15.13%、10.94%和9.41%,除T1外,碱解氮含量也分别显著提高了33.28%、8.15%和18.57%。这表明土壤养分含量随复合微生物菌剂用量的增加而增加,且等量条件下,灭菌复合微生物菌剂对土壤速效钾和有效磷的提高比例高于常规复合微生物菌剂,当用量为10 L/667m2时,碱解氮、全氮和有机质含量也表现出了相同的变化趋势。
|
|
表 5 不同处理对棉花根际土壤养分含量的影响 Table 5 Effects of different treatments on soil nutrient contents in cotton rhizosphere |
在自然生态系统中,80%以上的高等植物和微生物菌种处于共生关系,微生物可通过在土壤中形成庞大的菌丝网络来增加植物根系的吸收面积,从而增加根系对营养元素的吸收进而促进植物生长[20]。本研究发现复合微生物菌剂提高了幼苗期棉花叶片内光合色素总量和SPAD值,提高棉花的光合能力,促进碳水化合物的合成和转运,进而提高了棉花的株高和茎粗。因此,处理45 d后收获棉花幼苗发现复合微生物菌剂用量越多,棉花地上部生物量越多,而地下部生物量受复合微生物菌剂用量的影响不明显; 此外,常规复合微生物菌剂添加量达10 L/667m2时,效果最显著。王其传等[21]研究发现,微生物菌剂可同时提高辣椒叶片叶绿素总量和净光合速率(Pn),提高光合电子传递效率和植株净光合能力,最终促进辣椒生长,提高产量; 弓新国等[22]研究也发现苗期和大田期施用FZB42菌剂均可促进烤烟生长,减少病害发生,提高烟叶产量、质量。常规复合微生物菌剂对各指标的影响优于灭菌复合微生物菌剂,可能是常规复合微生物菌剂在为棉花生长提供所需养分的同时还含有大量高活菌,这些活菌在发酵过程中可产生各种有利于植物生长的代谢产物,如赤霉素(GA)、细胞分裂素(CTK)和吲哚乙酸(IAA)等促进植株生长的植物生长调节剂以及各类维生素、氨基酸和有机酸类物质,这些代谢产物对植物生长发育具有一定的调节促进作用[23-24]; 此外,微生物的活动和其代谢产物还可进一步活化土壤养分,改良土壤酸碱度和土壤通气性,进而提高土壤的保水保肥能力,最终促进苗期棉花的营养生长,为后期生殖生长和养分累积提供充足的物质保障。何瑞成等[25]研究表明,土壤微生物数量和活性与水稻有效穗数、每穗总粒数、千粒重以及产量具有很强的正相关性,改善土壤环境的同时提高作物产量。
植物体内防御酶活性与植物抗性关系密切,前人研究表明,微生物菌剂在提高小麦产量的同时,还能显著降低小麦纹枯病、根腐病和全蚀病的发病率[26]。本研究发现复合微生物菌剂可显著提高棉花叶片和根系内SOD、POD和CAT活性,降低MDA含量和超氧阴离子产生速率,常规复合微生物菌剂效果优于灭菌复合微生物菌剂,且用量为10 L/667m2的效果优于5 L/667m2。这表明复合微生物菌剂可通过提高棉花体内抗氧化物酶的活性来促进过氧化物质的分解,降低植物体内过氧化物质的累积量,保证体内正常的氧化还原电位,减轻膜质氧化损伤,最终提高植物抗逆境胁迫能力。陈冲等[27]研究同样发现施用复合微生物菌剂可提高烟草叶片内SOD和POD活性,降低MDA的含量,提高烟草的抗逆性。这可能是因为复合微生物菌剂所含的大量有益活菌物质和多种天然发酵活性物质能够在根区土壤繁殖形成有利于作物生长的微生物优势菌群,这些菌群在繁殖代谢过程中优化根际微域环境,促进植物根系对营养物质的吸收和生长,进而增强植物抵抗逆境胁迫的能力。常规复合微生物菌剂处理优于灭菌复合微生物菌剂的原因,一方面可能是常规复合微生物菌剂在促进植物对氮、磷、钾等大量元素吸收利用的同时,还能通过微生物的分泌代谢活化提高土壤中难溶不易被作物吸收的Fe、Mn、Cu、Zn等微量元素的生物有效性,而POD和CAT是典型的亚铁血红素酶,所以其活性与Fe含量高低有很强的相关性[28],Cu、Zn、Mn和Fe是SOD活性中心的金属元素[29],因而可通过提高棉花体内微量元素含量来进一步激活其根系和叶片内的抗氧化物酶活性; 另一方面常规复合微生物菌剂中的功能菌可作为诱导因子,激活并增强植株体内抗氧化物酶以及与抗病相关蛋白的活性来提高植物的抗性[30],因此遭受外界不良环境影响时,植物体会通过外界的信号源,激发自身已有的强大调控系统来抵御不良环境。
土壤微生物活性的强弱关系土壤新陈代谢的快慢,土壤内各种生化反应都离不开微生物的参与,微生物菌剂可通过改善土壤或基质的理化性质,促进植物生长,提高产量,改善品质[31-32]。已有研究表明,在黄瓜不同生育期施用枯草芽胞杆菌BSD2、放线菌S-317、木霉T36等多种有益微生物配成液态复合制剂后降低了根际真菌数,而细菌和放线菌数明显提高,改善土壤微生物的群落结构和土壤营养条件,增强植株的抗逆能力[33]; 复合微生物菌剂还可通过降低反硝化细菌、真菌数量和提高硝化细菌、氨化细菌、固氮菌、纤维素分解菌、放线菌数量来改变土壤生态环境[34]。本研究发现施入复合微生物菌剂后土壤微生物总量呈上升趋势,随处理时间的推移土壤细菌数逐渐增多,且常规复合微生物菌剂处理显著高于灭菌复合微生物菌剂处理,而根际土壤真菌数的变化趋势与之相反; 同时提高了根际土壤放线菌数,且在处理30 d时,仅灭菌复合微生物菌剂用量为5 L/667m2时效果显著,并随时间的推移,除常规复合微生物菌剂用量为10 L/667m2处理外,其余处理均显著高于CK,这与孔庆宇等[35]和尹淑丽等[36]研究结果相似。曹云等[37]研究发现在棉隆熏蒸结合微生物有机肥处理土壤的微生物数量和酶活性恢复速度和强度较普通有机肥处理强,病原菌数量及病原菌与真菌数量比值低,微生物碳源利用多样性指数最高。出现上述结果的原因,首先复合微生物菌剂含有大量氨基酸、多肽、单糖和多糖等有机成分和氮、磷、钾等营养成分,可为土著微生物的生长繁殖提供所需的氮源和能源[38]; 其次,常规复合微生物菌剂还含有大量有益微生物,施入土壤后在棉花根际定殖,从而提高根际微生物的丰富度和多样性,因此常规复合微生物菌剂处理的根际微生物总量高于灭菌复合微生物菌剂; 第三,微生物在生长繁殖过程中既存在互利共生也存在相互竞争的作用,当根际微域的某一群落变为优势种群时,必然会影响到其他群落的生长繁殖,所以当根际土壤细菌数显著增多时,其真菌数会有所降低。第四,土传病原菌主要为真菌型病原菌,常规复合微生物菌剂中所含的芽孢类杆菌、乳酸菌和酵母菌等多种有益菌可通过自身的代谢分泌来杀死根际土壤中原有病原菌,同时其分泌物可在植物根系形成保护膜,防止病原菌的入侵,减轻土传病害,降低根际土壤有害病原菌数[39],最终把“真菌型”土壤转化为“细菌型”土壤。
土壤酶是土壤有机质分解与养分转化和循环的驱动力,是土壤质量和生态稳定性的重要指标[40],不但影响土壤养分有效性,还能促进作物的生长发育和根系活力的提高[41]。已有研究表明,微生物菌剂的施用会影响土壤酶活性、土壤生化反应、土壤养分循环和作物对养分的吸收利用能力[42-43]。本研究发现,施入复合微生物菌剂提高了土壤脲酶、脱氢酶、中性磷酸酶和蔗糖酶活性,但土壤脲酶活性随肥料用量的增多而降低,其余酶活性均随肥料用量的增多而升高,而土壤过氧化氢酶活性却有所降低; 此外,常规复合微生物菌剂对土壤各酶活性的影响较灭菌复合微生物菌剂明显。张美存等[44]研究表明,向草坪土壤基质中施入放线菌、枯草芽孢杆菌和苏云金芽孢杆菌均可显著提高土壤蔗糖酶、脲酶、多酚氧化酶和过氧化物酶活性,本研究结果与此相似; 曹恩珲等[45]研究也表明复合微生物菌剂在降低番茄土壤酸度,增强土壤脲酶、磷酸酶、纤维素酶及过氧化氢酶活性的同时,还显著提高了土壤有机质和有效养分含量。此外,土壤水分、有机质、氮素和有效磷等物质也是影响土壤微生物群落结构的最主要环境因素[46-47]。本研究发现土壤养分含量随复合微生物菌剂施入量的增加而增加,且灭菌复合微生物菌剂对土壤速效钾和有效磷的提高比例高于常规复合微生物菌剂。这首先是复合微生物菌剂本身含有大量的养分和有机质,施入土壤后提高了土壤养分及有机质含量,因而土壤养分含量随复合微生物菌剂施入量的增加而增加; 其次,在充足的氮源、碳源供应下又加速了根际土壤微生物的繁殖和代谢,进而提高了微生物分泌物和生理活性物质的产生,在提高土壤酶活性的同时活化土壤中难溶不易移动的营养元素,以此提高土壤养分有效性[48]。然而常规复合微生物菌剂对土壤各酶活性的影响较灭菌复合微生物菌剂明显的原因可能是:复合微生物菌剂中的高活性微生物改善了土壤微环境,一定程度上激活了土壤中的土著微生物,并且常规复合微生物菌剂对根际土壤微生物丰富度和多样性的提高能力优于灭菌型复合微生物菌剂,这些微生物在繁殖代谢过程中加速有机化合物的分解,提供了酶促反应的底物,进而提高了胞外酶释放量和与提高酶活性有关物质的分泌量[48]。土壤脲酶活性随肥料用量的增多而降低的原因可能是:当肥料用量增多时,土壤供氮水平提高,为了减少氮素损失提高氮素利用率,微生物可通过改变自身的代谢分泌及根系的分泌来调整脲酶的活性。灭菌复合微生物菌剂处理的养分和有机质含量高于常规复合微生物菌剂的原因首先可能是高温灭菌时,复合微生物菌剂中有部分水分的蒸发,使养分含量升高; 其次,棉花在生长过程中需要不断从土壤中吸收水分和营养物质,并且本试验条件下,常规复合微生物菌剂处理的棉花生物量显著高于灭菌复合微生物菌剂处理,因而加大了对土壤养分的索取,所以收获后土壤养分含量相对较低。
4 结论常规和灭菌复合微生物菌剂均可提高幼苗期棉花叶片内光合色素含量,叶片和根系内SOD、POD和CAT等抗氧化物酶活性,降低MDA和O2·-等过氧化物质累积,进而提高棉花的光合性能和抗氧化损伤能力,提高植物抗逆性,促进碳水化合物的合成、转运和累积,最终提高了棉花的株高、茎粗和生物量的累积,常规复合微生物菌剂处理效果优于灭菌复合微生物菌剂,但不同用量间的差异较小。
常规和灭菌复合微生物菌剂均提高了根际土壤细菌数和放线菌数,且随处理时间的推移,其效果越明显,其中细菌数随用量的升高而增多,但放线菌数的变化与之相反,而根际土壤真菌数显著降低。因此改善了根际微生物生态平衡,优化了根际微域环境,促进了微生物和根系分泌,提高了土壤脲酶、脱氢酶、中性磷酸酶和蔗糖酶活性,进而提高了土壤有效氮、磷、钾和有机质含量,最终促进了棉花苗期生长和生物量的累积,为后期的生殖生长提供充足的物质保障。
| [1] |
叶邦兴, 唐海明, 汤小明, 等. 中国农田污染的现状及防治对策初探[J]. 中国农学通报, 2010, 26(7): 295-298 (  0) 0) |
| [2] |
张雪峰, 胡滨. 微生物肥料对土壤生态环境修复效应的影响[J]. 绿色科技, 2011(2): 98-100 DOI:10.3969/j.issn.1674-9944.2011.02.042 (  0) 0) |
| [3] |
郝彩琴, 刘美杰, 陈海燕. 菊科植物生物活性研究概述[J]. 西北林学院学报, 2010, 25(2): 45-49 (  0) 0) |
| [4] |
张曼丽, 陈剑山, 柳晓磊, 等. 水溶肥配施微生物菌剂对海南设施哈密瓜产量及土壤的影响[J]. 中国农技推广, 2017, 33(2): 54-56 (  0) 0) |
| [5] |
Spadaro D, Gullino M L. Improving the efficacy of biocontrol agents against soilborne pathogens[J]. Crop Prot, 2005, 24(7): 601-613 DOI:10.1016/j.cropro.2004.11.003 (  0) 0) |
| [6] |
丁莉萍, 孙维红, 李朋飞. 复合菌剂对樟树苗移栽生长及圃地土壤的影响[J]. 生物技术进展, 2017, 7(3): 236-240 (  0) 0) |
| [7] |
肖蓉, 孙海峰, 聂园军, 等. 复合微生物菌剂对重茬苹果园土壤细菌群落的影响[J]. 微生物学通报, 2016, 43(2): 301-309 (  0) 0) |
| [8] |
赵亚慧, 华雪洁, 杜海岩, 等. 花生化感物质降解菌和抗连作拮抗菌复合菌剂应用效果的研究[J]. 土壤通报, 2016, 47(3): 599-604 (  0) 0) |
| [9] |
逄焕成, 李玉义, 严慧峻, 等. 微生物菌剂对盐碱土理化和生物性状影响的研究[J]. 农业环境科学学报, 2009, 28(5): 951-955 DOI:10.3321/j.issn:1672-2043.2009.05.016 (  0) 0) |
| [10] |
冯国艺, 张谦, 雷晓鹏, 等. 滨海盐碱地不同适性棉花品种的筛选及其性状特征[J]. 河北农业科学, 2017, 21(3): 25-29 (  0) 0) |
| [11] |
孙凯宁, 于君宝, 王克安, 等. 不同肥料类型对滨海盐碱地棉花生长及肥料利用率的影响[J]. 中国农学通, 2015, 31(15): 91-96 DOI:10.11924/j.issn.1000-6850.casb14120073 (  0) 0) |
| [12] |
孙中涛, 姚良同, 孙凤鸣, 等. 微生物肥料对棉田土壤生态与棉花生长的影响[J]. 中国生态农业学报, 2005, 13(3): 54-56 (  0) 0) |
| [13] |
Knudson L L, Tibbitts T W, Edwards G E. Measurement of ozone injury by determination of leaf chlorophyll concentration[J]. Plant Physiology, 1977, 60(4): 606-608 DOI:10.1104/pp.60.4.606 (  0) 0) |
| [14] |
李合生. 植物生理生化实验原理和技术[M]. 北京: 高等教育出版社, 2000: 167-169
(  0) 0) |
| [15] |
Heath R L, Packer L. Photoperoxidation in isolated chloroplasts. Ⅰ. Kinetics and stoichiometry of fatty acid peroxidation[J]. Archives Biochemistry and Biophysics, 1968, 125(1): 189-198 DOI:10.1016/0003-9861(68)90654-1 (  0) 0) |
| [16] |
Shi Q H, Zhu Z J. Effects of exogenous salicylic acid on manganese toxicity, element contents and antioxidative system in cucumber[J]. Environmental and Experimental Botany, 2008, 63(3): 317-326 (  0) 0) |
| [17] |
何绍江, 陈雯莉. 微生物实验[M]. 北京: 中国农业出版社, 2007: 45-48
(  0) 0) |
| [18] |
鲍士旦. 土壤农化分析[M]. 北京: 中国农业出版社, 2005: 14-114
(  0) 0) |
| [19] |
关松荫. 土壤酶及其研究法[M]. 北京: 农业出版社, 1986: 294-297
(  0) 0) |
| [20] |
陈梅梅, 陈保冬, 王新军, 等. 不同磷水平土壤接种丛枝菌根真菌对植物生长和养分吸收的影响[J]. 生态学报, 2009, 29(4): 1980-1986 DOI:10.3321/j.issn:1000-0933.2009.04.043 (  0) 0) |
| [21] |
王其传, 孙锦, 束胜, 等. 微生物菌剂对日光温室辣椒生长和光合特性的影响[J]. 南京农业大学学报, 2012, 35(6): 7-12 (  0) 0) |
| [22] |
弓新国, 胡晓峰, 陈俊秋, 等. 不同时期施用微生物菌剂对烤烟生长和产量质量的影响[J]. 中国土壤与肥料, 2014(6): 106-110 (  0) 0) |
| [23] |
陈慧君.微生物肥料菌种应用与效果分析[D].北京: 中国农业科学院, 2013.
(  0) 0) |
| [24] |
Vessey J K. Plant growth promoting rhizobacteria as biofertilizers[J]. Plant soil, 2003, 255(2): 571-586 DOI:10.1023/A:1026037216893 (  0) 0) |
| [25] |
何瑞成, 吴景贵. 有机物料对原生盐碱地土壤生物学性质的影响[J]. 土壤学报, 2018, 55(3): 774-782 (  0) 0) |
| [26] |
常娜, 张雪娇, 马璐璐, 等. 微生物菌剂对小麦生长及土传病害预防效果的影响[J]. 作物杂志, 2017, 176(1): 155-160 (  0) 0) |
| [27] |
陈冲, 王小东, 郭传滨, 等. 微生物菌剂不同用量对烤烟生长和叶片关键酶活性的影响[J]. 山东农业科学, 2015, 47(9): 73-76 (  0) 0) |
| [28] |
Ranieri A, Castagna A, Baldan B, et al. Iron deficiency differently affects peroxidase isoforms in sunflower[J]. Journal of Experimental Botany, 2001, 52, 354: 25-35 (  0) 0) |
| [29] |
Sevilla F, del Rio L A, Hellin E. Superoxide dismutases from a citrus plant: Presence of two iron-containing isoenzymes in leaves of lemon trees (Citrus limonum. L)[J]. Journal of Plant Physiology, 1984, 116(5): 381-387 DOI:10.1016/S0176-1617(84)80130-3 (  0) 0) |
| [30] |
丁传雨, 乔焕英, 沈其荣, 等. 生物有机肥对茄子青枯病的防治及其机理探讨[J]. 中国农业科学, 2012, 45(2): 239-245 DOI:10.3864/j.issn.0578-1752.2012.02.005 (  0) 0) |
| [31] |
常勃.微生物菌剂对矿区复垦土壤生物活性和油菜生长的影响[D].太原: 山西大学, 2013
(  0) 0) |
| [32] |
侯乐梅, 孟瑞青, 乜兰春, 等. 不同微生物菌剂对基质酶活性和番茄产量及品质的影响[J]. 应用生态学报, 2016, 27(8): 2520-2526 (  0) 0) |
| [33] |
麻耀华, 尹淑丽, 张丽萍, 等. 复合微生态制剂对黄瓜根际土壤微生物数量和酶活性的影响[J]. 植物保护, 2012, 38(2): 46-50 DOI:10.3969/j.issn.0529-1542.2012.02.009 (  0) 0) |
| [34] |
葛红莲, 李亚茹. 复合菌肥对黄瓜根际微生物区系的影响[J]. 农村经济与科技, 2017, 28(9): 60-61 DOI:10.3969/j.issn.1007-7103.2017.09.024 (  0) 0) |
| [35] |
孔庆宇, 秦嗣军, 张英霞, 等. EM菌剂对甜樱桃幼苗根际微生物区系及根系呼吸的影响[J]. 沈阳农业大学学报, 2013, 44(4): 409-412 DOI:10.3969/j.issn.1000-1700.2013.04.005 (  0) 0) |
| [36] |
尹淑丽, 张丽萍, 张根伟, 等. 复合微生态菌剂对黄瓜根际土壤微生物数量及酶活的影响[J]. 微生物学杂志, 2012, 32(1): 23-27 DOI:10.3969/j.issn.1005-7021.2012.01.005 (  0) 0) |
| [37] |
曹云, 宋修超, 郭德杰, 等. 棉隆熏蒸与微生物有机肥联用对西瓜枯萎病的防控研究[J]. 土壤, 2018, 50(1): 93-100 (  0) 0) |
| [38] |
陈剑山, 李鹏, 张曼丽, 等. 氨基酸水溶肥与微生物菌剂混用抑制豇豆枯萎病的效果[J]. 中国植保导刊, 2015, 35(8): 52-53 DOI:10.3969/j.issn.1672-6820.2015.08.015 (  0) 0) |
| [39] |
雷先德, 李金文, 徐秀玲, 等. 微生物菌剂对菠菜生长特性及土壤微生物多样性的影响[J]. 中国生态农业学报, 2012, 20(4): 488-494 (  0) 0) |
| [40] |
DeForest J L. The influence of time, storage temperature, and substrate age on potential soil enzyme activity in acidic forest soils using MUB-linked substrates and L-DOPA[J]. Soil Biology and Biochemistry, 2009, 41(6): 1180-1186 DOI:10.1016/j.soilbio.2009.02.029 (  0) 0) |
| [41] |
朱金峰, 王小东, 郭传滨, 等. 施用微生物菌剂对土壤关键酶活性和烤烟根系生长的影响[J]. 江西农业学报, 2015, 27(9): 31-35 DOI:10.3969/j.issn.1001-8581.2015.09.007 (  0) 0) |
| [42] |
曹慧, 孙辉, 杨浩, 等. 土壤酶活性及其对土壤质量的指示研究进展[J]. 应用与环境生物学报, 2003, 9(1): 105-109 DOI:10.3321/j.issn:1006-687X.2003.01.025 (  0) 0) |
| [43] |
杜广红, 周晓琳, 马鸣超, 等. 不同施肥处理对土壤微生物学特性和作物产量的影响[J]. 中国土壤与肥料, 2012(5): 22-26 (  0) 0) |
| [44] |
张美存, 程田, 多立安, 等. 微生物菌剂对草坪植物高羊茅生长与土壤酶活性的影响[J]. 生态学报, 2017, 37(14): 4763-4769 (  0) 0) |
| [45] |
曹恩珲, 侯宪文, 李光义, 等. 复合菌剂对盆栽番茄土壤理化性质及微生物活性的影响[J]. 生态环境学报, 2011, 20(5): 875-880 DOI:10.3969/j.issn.1674-5906.2011.05.016 (  0) 0) |
| [46] |
杨东伟, 章明奎, 张鹏启, 等. 水田改果园后土壤微生物学特性演变[J]. 土壤学报, 2018, 55(1): 182-193 (  0) 0) |
| [47] |
吴松芹, 汪成忠, 李梦莎. 模拟氮沉降对滨海湿地土壤微生物功能多样性的影响[J]. 土壤, 2017, 49(6): 1153-1158 (  0) 0) |
| [48] |
曹丹, 宗良纲, 肖峻, 等. 生物肥对有机黄瓜生长及土壤生物学特性的影响[J]. 应用生态学报, 2010, 21(10): 2587-2592 (  0) 0) |
2. Engineering & Technology Research Center of High Efficient Utilization of Humic Acid of Shandong Province, Taian, Shandong 271000, China;
3. College of Resources and Environment, Shandong Agricultural University, Taian, Shandong 271018, China;
4. College of Chemistry, Shandong Agricultural University, Taian, Shandong 271018, China
 2019, Vol. 51
2019, Vol. 51


