2. 西南大学资源环境学院,重庆 400715;
3. 甘肃省农业工程技术研究院甘肃省特种药源植物种质创新与安全利用重点实验室,甘肃武威 733006
砂姜黑土主要分布于黄淮海平原南部,是我国主要中低产土壤类型之一。土壤所含的以蒙脱石为主的黏土矿物所引起的一系列物理、化学等不良性状是砂姜黑土区粮食中低产的主要原因,其障碍因子表现为土壤质地黏重、结构性差、干缩湿胀、易旱易涝、耕性差,导致整地播种质量难以提高[1]。由于砂姜黑土发育于河湖相等沉积物,土层上部为黑色腐殖质胶膜包裹黏粒的黑土层,一部分古老的有机质被包裹在黏粒内部难以被释放利用。另一部分新的、活性的有机质往往通过长期的农艺措施(如秸秆还田、施用有机肥)耕作熟化而来形成[3-5]。因此,提升这一部分新形成的有机质对砂姜黑土改良及肥力提升具有重要意义。
土壤有机质形成的关键过程是:外源物质(如作物秸秆、有机粪肥等)进入土壤后,通过微生物的新陈代谢活动,被同化利用形成微生物生物量后,微生物生物量(通过微生物代谢分泌物质和微生物残体)的周转过程[6],亦称微生物生物量的“针眼”作用[7]。“针眼”作用就是外源物质经过微生物生物量的周转作用而转变为土壤有机质[7]。微生物碳利用率和微生物群落结构影响到微生物生物量的“针眼”作用。微生物碳利用率表示外源碳降解过程中转变成新的微生物生物量碳的比例,它反映了土壤中微生物同化外源碳的利用效率[8],其在很大程度上控制着土壤微生物生物量的产生,并直接贡献到稳定态土壤有机质的形成[9]。前人研究发现,在土壤中,微生物碳利用率的范围在0.10 ~ 0.80[10]。土壤微生物群落结构控制着有机物的分解途径,进而调节微生物碳利用率和微生物的生物量,影响有机质的形成[11]。
因此,调控微生物的碳利用率及群落结构组成对砂姜黑土有机质提升起到至关重要作用。迄今,砂姜黑土微生物碳利用率、群落结构及其与砂姜黑土有机质之间的关系尚不明确。本研究采集典型的苏北平原砂姜黑土,展开两方面研究:①定量砂姜黑土微生物碳利用率并明确砂姜黑土微生物群落结构组成;②探讨砂姜黑土有机质与微生物碳利用率及群落结构之间的关系。本研究为通过合理的农艺措施调控微生物特性来提升砂姜黑土有机质提供一定的理论基础。
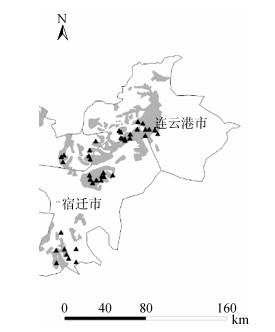
1 材料与方法 1.1 研究区概况本研究选择苏北平原典型的障碍性砂姜黑土(图 1)。研究区域地处我国东部沿海(118°10′ ~ 119°05′E,33°16′ ~ 34°32′N),气候为半干旱、暖温带半湿润季风气候,年均气温13.4 ℃,平均年降水量1 000 mm,年日照时数2 130 ~ 2 430 h,水热资源充沛。该区域的作物种植类型为小麦、玉米、棉花和花生等。该区域成土母质为黄土性古河沉积物,矿物类型主要以蒙脱石为主的2:1型黏土矿物,按美国制土壤分类命名为变性土。
|
图 1 苏北平原砂姜黑土区采样点分布情况 Fig. 1 Geographic location of sampling sites of lime concrete black soil in North Jiangsu Plain |
选取苏北平原砂姜黑土分布最广的4个典型县:东海、泗洪、沭阳、新沂,在农田100 m2样方内用土钻按网格取样方法采集10个0 ~ 20 cm耕层土壤的子样品,剔除可见石块及植物残体后混匀成一个样品,样品放入保鲜盒保存,按相同采样方式在每个县每隔4 km采样1次,每个县采10个土样。总共40个样品带回实验室进行分析。土壤样品分成3份,一份风干,供土壤养分测定;一份鲜样,过2 mm筛2 ~ 4 ℃保存,供土壤微生物指标测定;另一份-20 ℃保存,供土壤DNA测定。
1.3 土壤指标测定土壤有机碳采用重铬酸钾外加热法测定,土壤可溶性有机碳采用硫酸钾浸提法测定,土壤全氮采用元素分析仪测定(Flash-2000 Delta V ADVADTAGE,Thermo Fisher)。土壤微生物生物量碳采用氯仿熏蒸-硫酸钾浸提,然后用TOC仪测定(Vario TOC,Elementar)。
1.4 DNA提取和16S rRNA测序准确称取0.5 g鲜土样,按照FastDNA Spin Kit提取试剂盒(MP Biomedicals, Santa Ana, CA, USA)操作步骤,提取土样的DNA。经1%琼脂糖凝胶电泳测定DNA完整性,Mini Dorp测定DNA纯度和浓度。提取的DNA于-20 ℃保存、备用。将制取好的DNA样品送至百诺盛生物信息公司,完成16S rRNA基因测序。
1.5 土壤微生物碳利用率测定本文通过测定13C标记的微生物生物量及土壤呼吸的CO2,计算土壤微生物碳利用率[12-13]。称取20 g鲜土于250 ml三角瓶中,加入13C标记的谷氨酸后密封(添加标准为C 50 μg/g干土),同时设置只有添加13C标记的谷氨酸为对照组,在25 ℃培养22 h。培养结束后,用针管抽取瓶内CO2,分为两部分吸进已抽真空的顶针瓶中(25 ml)。一部分测取CO2浓度,另一部分用元素分析仪联用同位素比值质谱仪(EA-IRMS,Thermo Scientific)测定CO2-13C丰度。培养后的土壤称取两部分10 g,一部分用于氯仿熏蒸,另一部分不熏蒸,其他处理一样,放置相同的条件下培养24 h。K2SO4溶液浸提后的浸提液过0.45 mm滤膜,冷冻干燥。浸提组分13C丰度及浓度用EA-IRMS测定。
微生物呼吸的13C-CO2及微生物生物量中13C (13C-MBC)的含量用质量守恒公式算出。微生物碳利用率为:
| $ {\rm{CUE}} = \frac{{^{13}{\rm{C}} - {\rm{MBC}}}}{{^{13}{\rm{C}} - {\rm{MBC}}{ + ^{13}}{\rm{C}} - {\rm{C}}{{\rm{O}}_2}}} $ |
式中:CUE为微生物碳利用率,无量纲;13C-MBC为微生物生物量中13C的含量;13C-CO2为土壤呼吸释放CO2中13C的含量。
1.6 数据统计与分析数据采用SPSS 22.0统计软件进行描述性统计,采用ArcGIS 10.3及OriginPro 8.0制图。
2 结果 2.1 苏北平原砂姜黑土生化性质统计结果显示:土壤有机碳含量为10.63 ~ 19.60 g/kg,平均值为15.82 g/kg;土壤可溶性有机碳含量范围为13.00 ~ 52.01 mg/kg,平均值为29.13 mg/kg,可溶性有机碳含量与有机碳含量比例为2‰,这表明砂姜黑土有机质的碳活性较低,有机质质量较差。全氮含量介于1.00 ~ 1.98 g/kg,平均值为1.62 g/kg;土壤C/N在12.85 ~ 22.10之间,平均值为16.93。
土壤微生物生物量碳含量在135.55 ~ 393.26 mg/kg之间,平均值为255.82 mg/kg。土壤微生物丰度(OTUs)介于10 101 ~ 16 085之间,平均值为13 582;系统发育多样性(PD)范围为543.23 ~ 931.94,平均值为778.20。
根据反映数据离散程度的变异系数大小可以将土壤变异性进行分级(CV < 10%为弱变异性;CV=10% ~ 100%为中等变异性;CV > 100%为强变异性)[14]。从表 1描述性统计结果可知,指标的变异系数均在10% ~ 100%,属中等变异性。土壤养分含量发生变异主要与地域分布有关。
|
|
表 1 苏北平原砂姜黑土生化性质描述性统计 Table 1 Descriptive statistics of biochemical properties of lime concrete black soil in North Jiangsu Plain |
本研究调查发现(表 2):苏北平原砂姜黑土中变形菌门(Proteobacteria)、酸杆菌门(Acidobacteria)、放线菌门(Actinobacteria)和绿弯菌门(Chloroflexi)菌类在土壤细菌中相对丰度较高,且相对丰度大小为变形菌门(22.00%) > 绿湾菌门(9.31%) > 酸杆菌门(8.18%) > 放线菌门(8.04%)。可见,变形菌门是该研究区土壤中的优势菌群。进一步在科的水平对土壤微生物组进行分类后,发现砂姜黑土中9个细菌类群相对丰度较大,分别为黄单胞菌科(6.54%)、Gaiellaceae (2.96%)、酸杆菌科(2.77%)、Koribacteraceae(2.52%)、微球菌科(2.31%)、生丝微菌科(1.63%)、丛毛单胞菌科(1.60%)、红螺菌科(1.46%)以及中华杆菌科(1.14%),其多数属于变形菌门。
|
|
表 2 苏北平原砂姜黑土微生物群落结构 Table 2 Microbial community structures of lime concrete black soil in North Jiangsu Plain |
微生物碳利用率反映了土壤中微生物同化碳的利用效率,是微生物净固定碳的一个重要指标,其大小与土壤微生物群落结构、有机碳含量密切相关。本研究统计结果显示:13C-MBC含量在0.40 ~ 2.43 mg/kg之间,平均值为1.43 mg/kg;土壤中13C矿化量介于8.35 ~ 37.15 mg/kg,平均值为30.18 mg/kg;微生物碳利用率范围为0.07 ~ 0.20,平均值为0.14。
|
|
表 3 苏北平原砂姜黑土微生物碳利用率 Table 3 Microbial carbon use efficiency of lime concrete black soil in North Jiangsu Plain |
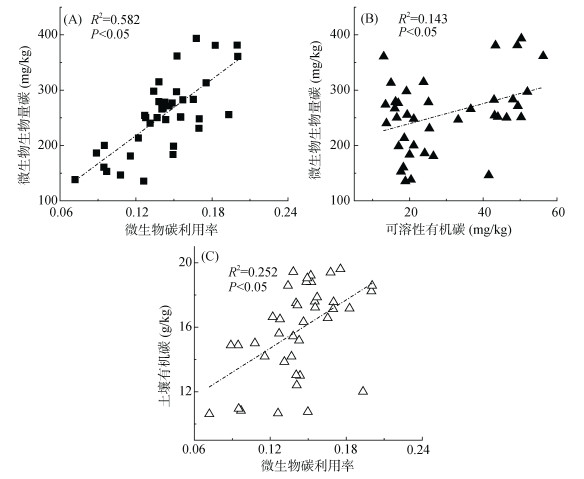
由图 2可知,砂姜黑土有机碳、微生物生物量碳与微生物碳利用率的变化规律一致,且微生物生物量碳也与可溶性有机碳具有相同的变化趋势。砂姜黑土微生物生物量碳与微生物碳利用率呈现正相关(图 2A,P < 0.05),即微生物生物量碳含量越大,微生物碳利用率就越高;此外,微生物生物量碳含量也随着可溶性有机碳含量的增加而增加(图 2B,P < 0.05)。由图 2C可以看出,砂姜黑土有机碳含量与微生物碳利用率呈现正相关(P < 0.05)。这表明砂姜黑土中微生物碳利用率与微生物生物量碳、有机碳及可溶性有机碳密切相关,土壤中微生物生物量碳、有机碳和可溶性有机碳含量越高,微生物碳利用率就越大。
|
图 2 砂姜黑土有机碳、可溶性有机碳及微生物生物量碳与微生物碳利用率之间相互关系 Fig. 2 Relationship between soil organic C, dissolved organic C, microbial biomass C and microbial carbon use efficiency of lime concrete black soil |
本研究对苏北平原砂姜黑土调查表明,该地区土地利用方式为旱田,可溶性有机碳含量较低,仅为有机碳含量的2‰,有机质的活性较低,这与高学振等[2]研究一致。这是由砂姜黑土土壤结构造成的。砂姜黑土黏土矿物以2:1型的膨胀性蒙脱石为主,胀缩性较强,表现为干收缩土壤坚实板结,湿膨胀土壤黏闭,使得有机质包裹在土壤内部,有机质中的碳难以释放到土壤中,不利于农作物、土壤微生物利用;另一方面,砂姜黑土容重较大,总孔隙度较小,土壤通气状况较差,使得土壤微生物活性不高,降解外来碳源转化为土壤有机碳过程较为困难。这可能是砂姜黑土区作物产量较低的原因之一。
本研究表明,苏北平原砂姜黑土优势菌群是变形菌,放线菌次之,以黄单胞菌科、Gaiellaceae、酸杆菌科为优势科,相对丰度分别为6.54%、2.96%、2.77%,这与贵州喀斯特溶洞中土壤细菌多样性的研究结果一致[15],这表明中低产区土壤微生物群落结构相似。但焦晓光等[16]研究发现高产的黑土中以对a-丁酮酸、腐胺、D, L-a-甘油利用能力较高的细菌科为主;林先贵等[17]研究发现高产的潮土优势细菌为酸杆菌纲和放线菌。这种土壤中微生物的差异性可能是高产土壤与低产土壤肥力高低差异的关键原因。前人研究发现黄单胞菌科和Gaiellaceae在土壤中碳转化过程起着关键作用[18]。黄单胞菌科中黄单胞菌属能够利用葡萄糖等简单有机碳源合成复杂有机碳,但其在纤维素、木质素等大分子有机物降解过程中作用微小[19];另一方面,由于砂姜黑土特有的土壤结构,土壤中葡萄糖等可溶性碳含量较低[3],这大大限制了黄单胞菌属利用土壤小分子有机碳合成大分子有机碳。因此,改善砂姜黑土土壤结构有利于有机质的积累[20]。Albuquerque等[21]研究发现Gaiellaceae能够利用土壤中无机碳合成多种有机化合物,这对砂姜黑土中有机碳的积累有重大意义。因此,以后可以通过改变微生物群落结构,来提高Gaiellaceae等菌群的相对丰度,或添加微生物菌肥或菌剂,增加纤维素、木质素类降解菌的生长繁殖,以提升砂姜黑土养分转化及有机质的形成。
本研究表明,砂姜黑土中有机碳、微生物生物量碳均存在随微生物碳利用率增大而增大的趋势,且微生物生物量碳也随着土壤可溶性有机碳的增大而增大(图 2)。这与前人研究结果一致。Kallenbach等[22]研究表明微生物碳利用率和有机碳之间存在很好的相关性,土壤微生物碳利用率越高,有机碳含量就越大。Spohn等[23]研究表明在森林土壤中,土壤微生物碳利用率与有机碳含量在同一土层呈现相同的变化趋势。Jones等[24]研究发现在潮湿或极度干旱条件下,当土壤微生物生物量碳较低时,微生物碳利用率低。王传杰等[25]和刘钊等[26]分别研究表明土壤可溶性有机碳含量与微生物生物量碳显著相关。
土壤微生物的碳利用率与有机质质量密切相关。微生物碳利用率越高,土壤有机质质量越好[11, 22, 27]。本研究调查发现,苏北平原砂姜黑土微生物的碳利用率普遍较低,其值为0.07 ~ 0.20,低于森林土壤的微生物碳利用率[23]。这主要与砂姜黑土的结构性差、干缩湿胀、蒙脱石含量高、土壤通透性较差有关。不良的土壤构造、较强的胀缩性以及较差的土壤透气性使得砂姜黑土微生物的活性较低[28-29],微生物不能很好地利用碳源,微生物碳利用率较低。当有较好的外源物质输入时,砂姜黑土微生物不能很好地利用,有机质形成缓慢。所以在秸秆还田或有机肥施用条件下,土壤中的微生物不能很好地利用,进而影响了有机质的形成,这也是砂姜黑土贫瘠的主要原因之一。因此,通过秸秆还田或施有机肥增加外源碳的输入,配合合理的耕作措施(如深翻耕、深松)等改善土层结构和通透性,进而提高微生物活性和碳利用率,促进砂姜黑土有机质的形成与提升。
4 结论苏北平原砂姜黑土有机质活性较低,可溶性有机质含量只占有机质的2‰。砂姜黑土微生物碳利用率较低,其值在0.07 ~ 0.20,且微生物碳利用率与砂姜黑土有机碳、可溶性有机碳含量呈显著正相关(P < 0.05),因此提升土壤微生物碳利用率成为砂姜黑土有机质提升的重要过程。苏北平原砂姜黑土优势菌群是变形菌门,其中黄单胞菌科、Gaiellaceae和酸杆菌科是优势科。调控砂姜黑土有机质形成及养分转化真正起作用的关键微生物菌群(如Gaiellaceae)的生长,有利于砂姜黑土有机质的形成与提升。
| [1] |
詹其厚, 袁朝良, 张效朴. 有机物料对砂姜黑土的改良效应及其机制[J]. 土壤学报, 2003, 40(3): 420-425 DOI:10.3321/j.issn:0564-3929.2003.03.015 (  0) 0) |
| [2] |
Wolf B, Snyder G H. Sustainable soils: The place of organic matter in sustaining soils and their productivity[M]. New York: Food Products Press of the Haworth Press, 2003
(  0) 0) |
| [3] |
高学振, 张丛志, 张佳宝, 等. 生物炭、秸秆和有机肥对砂姜黑土改性效果的对比研究[J]. 土壤, 2016, 48(3): 468-474 (  0) 0) |
| [4] |
王晓波, 车威, 纪荣婷, 等. 秸秆还田和保护性耕作对砂姜黑土有机质和氮素养分的影响[J]. 土壤, 2015, 47(3): 483-489 (  0) 0) |
| [5] |
赵占辉, 张丛志, 蔡太义, 等. 不同稳定性有机物料对砂姜黑土理化性质及玉米产量的影响[J]. 中国生态农业学报, 2015, 23(10): 1228-1235 (  0) 0) |
| [6] |
Kallenbach C M, Grandy A S, Frey S D, et al. Microbial physiology and necromass regulate agricultural soil carbon accumulation[J]. Soil Biology & Biochemistry, 2015, 91: 279-290 (  0) 0) |
| [7] |
Paterson E, Midwood A J, Millard P. Through the eye of the needle: A review of isotope approaches to quantify microbial processes mediating soil carbon balance[J]. New Phytologist, 2009, 184: 19-33 DOI:10.1111/j.1469-8137.2009.03001.x (  0) 0) |
| [8] |
Johannes R, Erl B. Growth of saprotrophic fungi and bacteria in soil[J]. Fems Microbiology Ecology, 2011, 78(1): 17-30 (  0) 0) |
| [9] |
Kallenbach C M, Frey S D, Grandy A S. Direct evidence for microbial-derived soil organic matter formation and its ecophysiological controls[J]. Nature Communications, 2016, 7: 13630 DOI:10.1038/ncomms13630 (  0) 0) |
| [10] |
Manzoni S, Taylor P, Richter A, et al. Environmental and stoichiometric controls on microbial carbon-use efficiency in soils[J]. New Phytologist, 2012, 196(1): 79 DOI:10.1111/j.1469-8137.2012.04225.x (  0) 0) |
| [11] |
Brant J B, Sulzman E W, Myrold D D. Microbial community utilization of added carbon substrates in response to long-term carbon input manipulation[J]. Soil Biology & Biochemistry, 2006, 38(8): 2219-2232 (  0) 0) |
| [12] |
Brant J B, Sulzman E W, Myrold D D. Microbial community utilization of added carbon substrates in response to long-term carbon input manipulation[J]. Soil Biology and Biochemistry, 2006, 38: 2219e2232 (  0) 0) |
| [13] |
Frey S D, Lee J, Melillo J M, et al. The temperature response of soil microbial efficiency and its feedback to climate[J]. Nature Climate Change, 2013, 3: 395e398 (  0) 0) |
| [14] |
李鹏, 关强, 邬梦成, 等. 我国旱地两熟区土壤养分时空变异的调查研究[J]. 土壤通报, 2017, 48(2): 380-386 (  0) 0) |
| [15] |
Zhou J P, Gu Y Q, Zou C S. Phylogenetic diversity of bacteria in an earth-cave in Guizhou Province, southwest of China[J]. J. Microbiol., 2007, 45(2): 105-112 (  0) 0) |
| [16] |
焦晓光, 高崇升, 隋跃宇, 等. 不同有机质含量农田土壤微生物生态特征[J]. 中国农业科学, 2011, 44(18): 3759-3767 DOI:10.3864/j.issn.0578-1752.2011.18.007 (  0) 0) |
| [17] |
林先贵, 冯有智. 潮土农田微生物研究进展[J]. 中国生态农业学报, 2016, 24(4): 416-434 (  0) 0) |
| [18] |
梁爽.吉林西部盐碱农田土壤酶和微生物对有机碳和无机碳变化的作用研究[D].长春: 吉林大学, 2016 http://cdmd.cnki.com.cn/Article/CDMD-10183-1016094035.htm
(  0) 0) |
| [19] |
周育.中华杆菌科和中华单胞菌属多相分类学研究[D].南京: 南京农业大学, 2008 http://cdmd.cnki.com.cn/article/cdmd-10307-2009076987.htm
(  0) 0) |
| [20] |
谢迎新, 靳海洋, 孟庆阳, 等. 深耕改善砂姜黑土理化性状提高小麦产量[J]. 农业工程学报, 2015, 31(10): 167-173 DOI:10.11975/j.issn.1002-6819.2015.10.022 (  0) 0) |
| [21] |
Albuquerque L, Costa M S D. The family gaiellaceae//Rosenberg E, DeLong E F, Lory S, et al. The Prokaryotes[M]. Berlin, Heidelberg: Springer, 2014
(  0) 0) |
| [22] |
Kallenbach C M, Grandy A S, Frey S D, et al. Microbial physiology and necromass regulate agricultural soil carbon accumulation[J]. Soil Biology & Biochemistry, 2015, 91: 279-290 (  0) 0) |
| [23] |
Spohn M, Klaus K, Wanek W, et al. Microbial carbon use efficiency and biomass turnover times depending on soil depth-Implications for carbon cycling[J]. Soil Biology & Biochemistry, 2016, 96: 74-81 (  0) 0) |
| [24] |
Jones D L, Olivera-Ardid S, Klumpp E, et al. Moisture activation and carbon use efficiency of soil microbial communities along an aridity gradient in the Atacama Desert[J]. Soil Biology & Biochemistry, 2018, 117: 68-71 (  0) 0) |
| [25] |
王传杰, 王齐齐, 徐虎, 等. 长期施肥下农田土壤-有机质-微生物的碳氮磷化学计量学特征[J]. 生态学报, 2018, 38(11): 3848-3858 (  0) 0) |
| [26] |
刘钊, 魏天兴, 朱清科, 等. 黄土丘陵沟壑区典型林地土壤微生物、酶活性和养分特征[J]. 土壤, 2016, 48(4): 705-713 (  0) 0) |
| [27] |
Arcand M M, Levybooth D J, Helgason B L. Resource legacies of organic and conventional management differentiate soil microbial carbon use[J]. Frontiers in Microbiology, 2017, 8: 2293 DOI:10.3389/fmicb.2017.02293 (  0) 0) |
| [28] |
吴云当, 李芳柏, 刘同旭. 土壤微生物-腐殖质-矿物间的胞外电子传递机制研究进展[J]. 土壤学报, 2016, 53(2): 277-291 (  0) 0) |
| [29] |
荣兴民, 黄巧云, 陈雯莉, 等. 土壤矿物与微生物相互作用的机理及其环境效应[J]. 生态学报, 2008, 28(1): 376-387 DOI:10.3321/j.issn:1000-0933.2008.01.044 (  0) 0) |
2. College of Resources and Environment, Southwest University, Chongqing 400715, China;
3. Key Laboratory of the Special Medicine Source Plant for Germplasm Innovation and Safety Utilization, Gansu Academy of Agri-engineering Technology, Wuwei, Gansu 733006, China
 2019, Vol. 51
2019, Vol. 51


