2. 南京市蔬菜科学研究所,南京 210042;
3. 淮安柴米河农业科技发展有限公司,江苏淮安 223001
随着设施蔬菜产业的发展,番茄种植面积日益扩大[1],而番茄青枯病是严重制约设施番茄可持续生产的主要土传病害之一[2]。番茄青枯病是由茄科劳尔氏菌(Ralstonia solanacearum)引起的一种细菌病害,其侵染范围广,分布具全球性,难以防治且一旦爆发对作物经济产生毁灭性影响[3-4]。国内外研究者发现,通过土壤化学熏蒸,向土壤中添加有机物质、施用微量元素肥料、生物防控方法等均能降低青枯病发病率[5-8],但防控效果大多不具稳定性[9-11]。
生物有机肥是一种包含特定功能微生物菌种的特殊有机肥料[12],功能微生物与有机物质相结合能有效提高功能微生物的活性和病害防控能力[13]。国内外研究均表明,施用生物有机肥可促进植株产量的增加和品质的提升[14],同时能一定程度上保护作物不受病原菌侵染,从而有效抑制土传病害的发生[15-17]。已有大量研究证实,生物有机肥能够有效控制青枯病的发生[18-19];同时研究证实,生物有机肥发挥作用的关键在于有益微生物在植物根际的定殖[20-21]。因此,如能够将生物有机肥中的有益菌在苗期提前定殖于植物根际,预计能够有效促进作物的产量。已有研究表明,利用芽孢杆菌制成生物基质育苗,能够促使功能菌苗期定殖于根际,从而提高西瓜的田间生物量和产量[22];孙跃跃等[23]研究结果也表明将生防放线菌等菌剂加入育苗基质育苗,可显著提高甜瓜的生物量及抗逆性。然而,将生物育苗基质和生物有机肥联合田间施用,对防控作物土传病害的研究还少有报道,尤其是连续应用的效果,还缺少研究。
本研究采用连续3季田间试验,以生物有机肥为底肥,评估了在育苗基质中添加有益菌T-5促使其在移栽大田前定殖于番茄根际,对番茄青枯病防控及产量增加的影响,以期为设施番茄高产高效栽培提供实际指导和理论支撑。
1 材料与方法 1.1 供试材料供试番茄品种为“世纪红冠”。供试菌株解淀粉芽孢杆菌T-5,由江苏省固体有机废弃物资源化高技术研究重点实验室提供,该菌株能够定殖于番茄根际,从而有效防控青枯病的发生[24-25]。
供试生物有机肥由本实验室自行研制[26],产品中菌株T-5含量为6 × 108 cfu/g(以干物质量计)。
供试普通育苗基质由南京市蔬菜科学研究所提供。
1.2 试验设计田间试验于2014年3月至2015年6月(共3季)在南京市蔬菜科学研究所大棚内进行。供试土壤为黄壤土,基本理化性质为:pH 6.33、有机质43.56 g/kg、全氮1.89 g/kg、有效磷138.66 mg/kg、速效钾464.81 mg/kg。
田间试验共设置2个处理:①施用生物有机肥并移栽普通育苗基质所育种苗(BIO)处理,生物有机肥的施肥量为5 997 kg/hm2;②施用生物有机肥并移栽生物育苗基质所育种苗(BIONS)处理,生物有机肥的施入量同BIO处理。番茄全生育期所需其余养分用化肥补齐。每个处理设置3个重复,每个重复小区面积为10 m2,种植密度为每个小区32棵番茄,每季番茄种植时间为3个月。
本试验生物育苗基质的制备及育苗步骤为:将解淀粉芽孢杆菌T-5在LB培养基中发酵以制备菌液[27];将菌液按5% (V/W, W为干物质量)比例与普通基质混合均匀制成生物育苗基质[22]。将番茄种子进行表面消毒后浸种催芽,待种子露白后分别埋于普通育苗基质和生物育苗基质;待番茄幼苗长出第二片真叶时移栽至田间。普通育苗基质所育种苗移栽于BIO处理,生物育苗基质所育种苗移栽于BIONS处理。
1.3 样品采集及测定1) 产量和发病率统计。在番茄进入收获期后,采摘番茄全部果实记产量,并统计番茄发病率,发病率表示为具青枯病症状植株占总植株数的百分比。
2) 土壤样品的采集。于番茄收获期,各小区随机选择3株健康植株,连根带土采集完后送至实验室进行土体和根际土壤样品的分离[28],各小区内土体和根际样品分别进行合并为该小区代表性样品,保存于超低温冰箱中备用。
3) DNA的提取及测定。称取0.25 g土壤样品,用土壤DNA提取试剂盒(Mo Bio Laboratories, Inc., Carlsbad, CA, USA),按操作说明提取土壤DNA。采用实时荧光定量PCR方法测定土壤样品中病原菌、总细菌、总真菌数量。病原菌扩增引物选用flic F (5’- GAACGCCAACGGTGCGAACT-3’)和flic R (5’-GGCGGCCTTCAGGGAGGTC-3’) [29];细菌扩增引物选用338F(5’-ACTCCTACGGGAGGCAGCAG-3’)和518R (5’-ATTACCGCGGCTG CTGG-3’)[30];真菌扩增引物选用ITS1f(5’-TCCGTAGGTGAACCTGCGG-3’)和5.8S(5’-CGCTGCGTTCTTCATCG-3’)[30]。定量使用仪器为ABI PRISM® 7500 Real-time PCR system,反应体系见表 1。反应程序为:95 ℃预变性30 s,95 ℃变性5s,53 ℃退火和延伸34 s (病原菌的退火和延伸温度为56 ℃),循环30次。每个样品设置3次重复,用无菌超纯水替代DNA模板设置阴性对照。根据样品阈值(Ct)计算每克土中的拷贝数,结果以拷贝数取对数后表示(log (Copies/g,以干物质量计))。
|
|
表 1 定量PCR扩增体系 Table 1 Quantitative PCR amplification system |
4) 土壤基本理化性质的测定。土壤理化性质的测定参照《土壤农化分析》[31]进行。
1.4 数据统计与分析使用Microsoft Excel 2007对数据进行处理;用SPSS软件(20.0, SPSS Inc. Chicago, IL)进行独立样本T检验来分析两处理之间的差异;用R(version 3.2.0)软件进行土壤微生物数量、基本理化性质与番茄发病率和产量间的Spearman相关性分析,显著水平设定为P<0.05。
2 结果与分析 2.1 连续3季移栽生物育苗基质所育种苗对设施番茄产量的影响由表 2可知,3季田间试验,施用生物有机肥后,移栽根际定殖功能菌的种苗处理(BIONS)单株产量均高于单施生物有机肥处理(BIO),但两处理间均无显著差异。每公顷产量BIONS处理均显著高于BIO处理。第一季BIONS处理比BIO处理显著增产18 695.44 kg/hm2,增产幅度达38.86%;第二季显著增产19 578.39 kg/hm2,增产幅度达47.87%;第三季显著增产14 510.63 kg/hm2,增产幅度达34.60%。
|
|
表 2 不同处理对番茄产量的影响 Table 2 Effects of different treatments on tomato yield |
|
|
表 3 不同处理对土壤理化性质的影响 Table 3 Effects of different treatments on soil properties |
由图 1可知,单施生物有机肥处理(BIO)3季田间番茄青枯病发病率分别为34.38%、34.46%和40.00%,移栽生物育苗基质所育种苗处理(BIONS)的发病率分别为15.63%、16.11%和25.00%,与BIO处理相比,BIONS处理显著降低了3季番茄青枯病的发病率,分别达到了54.55%、53.25%和37.50%的田间防控效果。
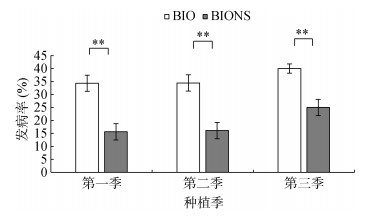
|
(**表示两处理在P < 0.01水平差异显著) 图 1 不同处理对番茄青枯病发病率的影响 Fig. 1 Effects of different treatments on incidence of tomato bacterial wilt disease |
由图 2A和2B可知,在第一季和第三季田间试验中,移栽生物育苗基质所育种苗处理(BIONS)和单施生物有机肥处理(BIO)的土体土壤病原菌数量无显著性差异,第二季BIONS处理土体土壤中病原菌数量显著低于BIO处理。第一季和第二季BIONS处理番茄根际土壤中病原菌数量高于BIO处理但无显著性差异,第三季BIONS处理根际病原菌数量极显著低于BIO处理。
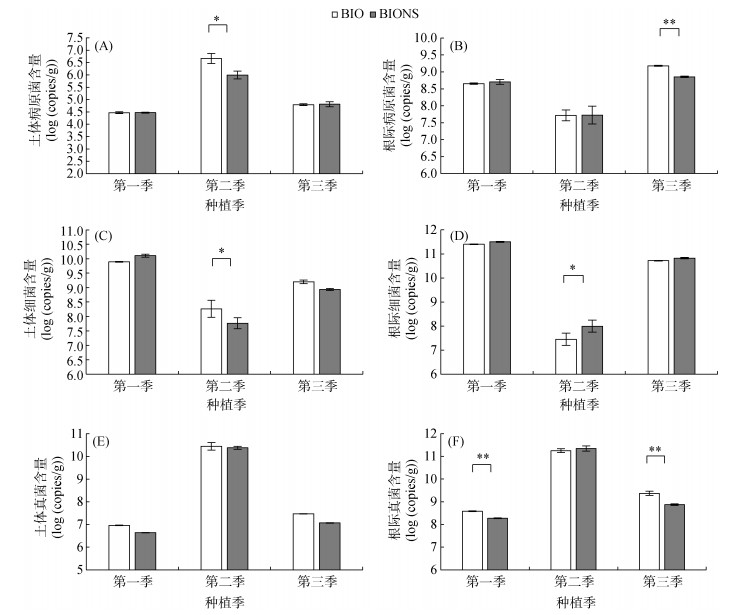
|
(图A、C、E为土体土指标,B、D、F为根际土指标;*、**分别表示两处理在P < 0.05、P < 0.01水平差异显著) 图 2 不同处理对微生物数量的影响 Fig. 2 Effects of different treatments on microbial biomass |
由图 2C和2D可知,第一季BIONS处理土体总细菌数量高于BIO处理但无显著性差异,第二季和第三季均低于BIO处理,且在第二季两处理间具有显著性差异。BIONS处理根际总细菌数量在3季田间试验中均高于BIO处理,第二季两处理间具有显著性差异。
由图 2E和2F可知,3季BIONS处理土体总真菌数量均低于BIO处理,但不具有显著性差异。第一季和第三季BIONS处理的根际总真菌数量极显著低于BIO处理。
2.4 生物育苗基质联合生物有机肥连续施用对土壤基本理化性质的影响由表 3可知,在第一季田间试验中,生物有机肥处理(BIO)的pH显著高于移栽生物育苗基质所育种苗处理(BIONS),BIO处理的铵态氮含量显著低于BIONS处理,两处理土壤在其余基本理化性质上无显著性差异。第二季,BIO处理的速效钾含量和硝态氮含量显著低于BIONS处理。第三季,土壤基本理化性质在两处理间无显著差异。从总体上看,连续三季田间试验BIO处理的硝态氮含量和铵态氮含量均低于BIONS处理,其余土壤理化性质无变化规律。
2.5 土壤微生物及理化指标与番茄产量的相关性如表 4所示,番茄发病率与产量呈显著负相关(rho= -0.46,P=0.000 10),细菌数量与产量呈显著正相关(rho=0.40,P=0.002 6),真菌数量与产量呈显著负相关(rho= -0.32,P=0.019)。土壤基本理化性质中,pH、速效钾含量、有效磷含量、硝态氮含量和铵态氮含量均与产量呈正相关,其中pH、有效磷含量和硝态氮含量与产量呈显著正相关(rho=0.32,P=0.020;rho=0.33,P=0.014;rho=0.28,P=0.039,电导率与产量呈负相关,但相关性不显著。
|
|
表 4 土壤微生物数量及基本理化性质与番茄产量的Spearman相关性 Table 4 Spearman's correlations between tomato yield with tomato bacterial wilt disease incidence, soil microbial populations and physiochemical characteristics |
如表 5所示,3季田间试验,病原菌数量与番茄青枯病发病率呈显著正相关(rho=0.32, P=0.019),其余无显著相关性。土壤理化性质中,pH、电导率、有效磷含量、硝态氮含量和铵态氮含量均与番茄青枯病发病率呈负相关,但只有硝态氮和铵态氮含量与青枯病发病率呈显著负相关(rho= -0.38,P=0.004 9;rho= -0.51,P=0.000 10),速效钾含量与青枯病发病率呈正相关,但相关性不显著。
|
|
表 5 土壤微生物数量及基本理化性质与番茄青枯病发病率的Spearman相关性 Table 5 Spearman's correlations between tomato bacterial wilt disease incidence with soil microbial populations and physiochemical characteristics |
3季田间试验BIONS处理的产量均显著高于BIO处理,但单株产量两处理间无显著差异。已有研究表明生物育苗基质可培育出优质辣椒和番茄优质种苗,在移栽至大田后能有效提高辣椒和番茄的生物量和产量[32-33],但本研究中单株产量虽有增加,但两处理间差异无显著性,且Spearman相关性分析表明番茄产量与田间青枯病发病率和土壤真菌数量呈显著负相关,与土壤细菌数量和硝态氮含量呈显著正相关,因此,推测增产主要在于番茄青枯病的防控。
相比BIO处理,BIONS处理显著降低了番茄青枯病的发病率,Spearman相关性分析表明青枯病发病率与病原菌数量呈显著负相关,且连续种植3季后,BIONS处理根际病原菌数量显著低于BIO处理。与本研究结果类似,张钰等[34]研究表明利用微生物菌剂制备的育苗基质育苗,能降低黄瓜根际枯萎病病原菌数量,进而显著降低黄瓜枯萎病的发病率;本实验室前期研究同样表明,施用生物有机肥能够有效防控番茄病害[35]。本研究基于此进一步证实了,在施用生物有机肥基础上,进一步移栽利用生物育苗基质所育根际定殖功能菌的番茄苗能够进一步降低根际病原菌数量,进而有效防控青枯病的发生,增加作物产量。
土壤微生物与植物病害息息相关[36],通过调控土壤微生物区系来增强土壤抑病能力,能有效防控土传病害的发生[37]。在本研究中,根际细菌数量BIONS处理3季均高于BIO处理,而根际真菌数量第一季和第三季显著低于BIO处理。Ling等[38]研究发现,连续施用生物有机肥有能效防控西瓜枯萎病的发生,与根际细菌群落出现显著变化有关。何欣等[39]在香蕉幼苗期育苗和移栽时均施用结合SQR21和T37复合拮抗菌剂堆制生物有机肥,有效防控了香蕉枯萎病的发生,同时发现根际微生物组成发生了变化,其显著增加了根际细菌数量同时真菌数量显著降低。Shen等[28]研究表明施用生物有机肥能有效防控香蕉枯萎病的发生,同时能优化其土壤微生物区系,增加其中细菌和放线菌等的数量。钟书堂等[40]的研究也得到了相同的结果。本研究与以上结果一致,番茄根际预定殖有益微生物同时联用生物有机肥优化了根际微生物群落。
从总体上看,连续3季田间试验,BIO处理的土壤硝态氮和铵态氮含量均低于BIONS处理,且其含量与番茄青枯病发病率呈显著负相关,同时硝态氮含量与番茄产量呈显著正相关。氮素对植物的生长至关重要,影响着植物病害和抗性[41-42],不同氮素形态对病害的防治作用也不同[43-44]。有研究表明铵态氮能有效降低尖孢镰刀菌番茄专化型病原菌的致病力[45],Elmer等[46]的研究也同样表明铵态氮能一定程度上降低草莓黑腐病的发病率。董鲜等[47]研究表明硝态氮能通过诱导香蕉幼苗木质素的形成进而提高其抗病性,有效防控香蕉枯萎病的发生。本研究结果显示,连续3季BIONS处理中硝态氮和铵态氮含量均高于BIO处理,这可能也是根际定殖功能菌T-5降低番茄青枯病发生的原因。
综上,本研究表明生物有机肥与生物育苗基质联用能显著提高番茄产量,且有效防控番茄青枯病的发生,研究结果能够为生物育苗基质的研发及番茄青枯病的防御提供新思路。
4 结论相比于单施生物有机肥处理(BIO),育苗基质和生物有机肥联合处理(BIONS)能显著降低番茄青枯病发病率,提高番茄产量;BIONS处理番茄青枯病发病率显著降低,与番茄根际病原菌数量降低和土壤硝态氮含量和铵态氮含量较高等显著相关;番茄青枯病的有效防控导致BIONS处理番茄产量的有效增加。
| [1] |
葛晓颖, 孙志刚, 李涛, 等. 设施番茄连作障碍与土壤芽孢杆菌和假单胞菌及微生物群落的关系分析[J]. 农业环境科学学报, 2016, 35(2): 514-523 (  0) 0) |
| [2] |
蔡祖聪, 黄新琦. 土壤学不应忽视对作物土传病原微生物的研究[J]. 土壤学报, 2016, 53(2): 305-310 (  0) 0) |
| [3] |
Caruso P, Palomo J L, Bertolini E, et al. Seasonal variation of Ralstonia solanacearum biovar 2 populations in a Spanish river: Recovery of stressed cells at low temperatures[J]. Applied and Environment Microbiology, 2005, 71(1): 140-148 DOI:10.1128/AEM.71.1.140-148.2005 (  0) 0) |
| [4] |
Allen C, Prior P, Hayward A C, et al. Bacterial wilt disease and the Ralstonia solanacearum species complex[J]. Bacterial Wilt Disease & the Species Complex, 2005 (  0) 0) |
| [5] |
Hsu S T. Ecology and control of Pseudomonas solanacearum in Taiwan[J]. Plant Protection Bulletin Taiwan, 1991, 33: 72-79 (  0) 0) |
| [6] |
Bailey K L, Lazarovits G. Suppressing soil-borne diseases with residue management and organic amendments[J]. Soil and Tillage Research, 2003, 72: 169-180 DOI:10.1016/S0167-1987(03)00086-2 (  0) 0) |
| [7] |
Kiirika L M, Stahl F, Wydra K. Phenotypic and molecular characterization of resistance induction by single and combined application of chitosan and silicon in tomato against Ralstonia solanacearum[J]. Physiological and Molecular Plant Pathology, 2013, 81: 1-12 DOI:10.1016/j.pmpp.2012.11.002 (  0) 0) |
| [8] |
Ma Y, Gentry T, Hu P, et al. Impact of brassicaceous seed meals on the composition of the soil fungal community and the incidence of Fusarium wilt on chili pepper[J]. Applied Soil Ecology, 2015, 90: 41-48 DOI:10.1016/j.apsoil.2015.01.016 (  0) 0) |
| [9] |
Gamliel A, Austerweil M, Kritzman G. Non-chemical approach to soilborne pest management-organic amendments[J]. Crop Protection, 2000, 19: 847-853 DOI:10.1016/S0261-2194(00)00112-5 (  0) 0) |
| [10] |
Bailey K L, Lazarovits G. Suppressing soil-borne diseases with residue management and organic amendments[J]. Soil and Tillage Research, 2003, 72: 169-180 DOI:10.1016/S0167-1987(03)00086-2 (  0) 0) |
| [11] |
陈志龙, 陈杰, 许建平, 等. 番茄青枯病生物防治研究进展[J]. 江苏农业科学, 2013, 41(8): 131-134 DOI:10.3969/j.issn.1002-1302.2013.08.050 (  0) 0) |
| [12] |
杨兴明, 徐阳春, 黄启为, 等. 有机(类)肥料与农业可持续发展和生态环境保护[J]. 土壤学报, 2008, 45(5): 925-932 DOI:10.3321/j.issn:0564-3929.2008.05.019 (  0) 0) |
| [13] |
Kavino M, Harish S, Kumar N, et al. Effect of chitinolytic PGPR on growth, yield and physiological attributes of banana (Musa, spp.) under field conditions[J]. Applied Soil Ecology, 2010, 45(2): 71-77 DOI:10.1016/j.apsoil.2010.02.003 (  0) 0) |
| [14] |
韦巧婕, 郑新艳, 邓开英, 等. 黄瓜枯萎病拮抗菌的筛选鉴定及其生物防效[J]. 南京农业大学学报, 2013, 36(1): 40-46 (  0) 0) |
| [15] |
Qiu M H, Zhang R F, Xue C, et al. Application of bio-organic fertilizer can control Fusarium wilt of cucumber plants by regulating microbial community of rhizosphere soil[J]. Biology & Fertility of Soils, 2012, 48(7): 807-816 (  0) 0) |
| [16] |
Shen Z Z, Wang B B, Lv N N, et al. Effect of the combination of bio-organic fertilizer with Bacillus amyloliquefaciens NJN-6 on the control of banana fusarium wilt disease, crop production and banana rhizosphere culturable microflora[J]. Biocontrol Science and Technology, 2015, 25(6): 716-731 DOI:10.1080/09583157.2015.1010482 (  0) 0) |
| [17] |
Saravanan T, Muthusamy M, Marimuthu T. Development of integrated approach to manage the fusarial wilt of banana[J]. Crop Protection, 2003, 22: 1117-1123 DOI:10.1016/S0261-2194(03)00146-7 (  0) 0) |
| [18] |
丁传雨, 乔焕英, 沈其荣, 等. 生物有机肥对茄子青枯病的防治及其机理探讨[J]. 中国农业科学, 2012, 45(2): 239-245 DOI:10.3864/j.issn.0578-1752.2012.02.005 (  0) 0) |
| [19] |
袁英英, 李敏清, 胡伟, 等. 生物有机肥对番茄青枯病的防效及对土壤微生物的影响[J]. 农业环境科学学报, 2011, 30(7): 1344-1350 (  0) 0) |
| [20] |
年洪娟, 陈丽梅. 土壤有益细菌在植物根际竞争定殖的影响因素[J]. 生态学杂志, 2010, 29(6): 1235-1239 (  0) 0) |
| [21] |
李文英, 彭智平, 杨少海, 等. 植物根际促生菌对香蕉幼苗生长及抗枯萎病效应研究[J]. 园艺学报, 2012, 39(2): 234-242 (  0) 0) |
| [22] |
张杨, 王甜甜, 孙玉涵, 等. 西瓜根际促生菌筛选及生物育苗基质研制[J]. 土壤学报, 2017, 54(3): 703-712 (  0) 0) |
| [23] |
孙跃跃, 马军妮, 李玉龙, 等. 功能性育苗基质中生防菌及腐植酸钾对甜瓜穴盘苗的促生作用[J]. 西北农林科技大学学报(自然科学版), 2016, 44(9): 174-180 (  0) 0) |
| [24] |
Tan S, Yang C, Mei X, et al. The effect of organic acids from tomato root exudates on rhizosphere colonization of Bacillus amyloliquefaciensT-5[J]. Applied Soil Ecology, 2013, 64(1): 15-22 (  0) 0) |
| [25] |
Tan S, Jiang Y, Song S, et al. Two Bacillus amyloliquefaciens strains isolated using the competitive tomato root enrichment method and their effects on suppressing Ralstonia solanacearum and promoting tomato plant growth[J]. Crop Protection, 2013, 43: 134-140 DOI:10.1016/j.cropro.2012.08.003 (  0) 0) |
| [26] |
Huang Y, Sun L, Zhao J S, et al. Utilization of different waste proteins to create a novel PGPR-containing bio-organic fertilizer[J]. Scientific Reports, 2015, 5(7766): 1-11 (  0) 0) |
| [27] |
Tan S, Gu Y, Yang C, et al. Bacillus amyloliquefaciens T-5 may prevent Ralstonia solanacearum infection through competitive exclusion[J]. Biology & Fertility of Soils, 2016, 52(3): 341-351 (  0) 0) |
| [28] |
Shen Z Z, Zhong S T, Wang Y G, et al. Induced soil microbial suppression of banana fusarium wilt disease using compost and biofertilizers to improve yield and quality[J]. European Journal of Soil Biology, 2013, 57(4): 1-8 (  0) 0) |
| [29] |
Schönfeld J, Heuer H, Van E J, et al. Specific and sensitive detection of Ralstonia solanacearum in soil on the basis of PCR amplification of fliC fragments[J]. Applied and Environmental Microbiology, 2003, 69(12): 7248-7256 DOI:10.1128/AEM.69.12.7248-7256.2003 (  0) 0) |
| [30] |
Fierer N, Jackson J A, Vilgalys R, et al. Assessment of soil microbial community structure by use of taxon-specific quantitative PCR assays[J]. Applied and Environmental Microbiology, 2005, 71(7): 4117-4120 DOI:10.1128/AEM.71.7.4117-4120.2005 (  0) 0) |
| [31] |
鲍士旦. 土壤农化分析[M].
中国农业出版社, 北京, 2000
(  0) 0) |
| [32] |
文春燕, 高琦, 张杨, 等. 含PGPR菌株LZ-8生物育苗基质的研制与促生效应研究[J]. 土壤, 2016, 48(2): 414-417 (  0) 0) |
| [33] |
张杨, 文春燕, 赵买琼, 等. 辣椒根际促生菌的分离筛选及生物育苗基质研制[J]. 南京农业大学学报, 2015, 38(6): 950-957 (  0) 0) |
| [34] |
张钰, 孙锦, 郭世荣. 基质中添加微生物制剂对黄瓜幼苗生长和枯萎病抗性的影响[J]. 西北植物学报, 2013, 33(4): 780-786 DOI:10.3969/j.issn.1000-4025.2013.04.020 (  0) 0) |
| [35] |
Liu H, Xiong W, Zhang R, et al. Continuous application of different organic additives can suppress tomato disease by inducing the healthy rhizospheric microbiota through alterations to the bulk soil microflora[J]. Plant and Soil, 2018, 423: 229-240 DOI:10.1007/s11104-017-3504-6 (  0) 0) |
| [36] |
Elsas J D V, Garbeva P, Salles J. Effects of agronomical measures on the microbial diversity of soils as related to the suppression of soil-borne plant pathogens[J]. Biodegradation, 2002, 13(1): 29-40 DOI:10.1023/A:1016393915414 (  0) 0) |
| [37] |
刘金光, 李孝刚, 王兴祥. 连续施用有机肥对连作花生根际微生物种群和酶活性的影响[J]. 土壤, 2018, 50(2): 305-311 (  0) 0) |
| [38] |
Ling N, Deng K, Song Y, et al. Variation of rhizosphere bacterial community in watermelon continuous mono- cropping soil by long-term application of a novel bioorganic fertilizer[J]. Microbiological Research, 2014, 169(7): 570-578 (  0) 0) |
| [39] |
何欣, 郝文雅, 杨兴明, 等. 生物有机肥对香蕉植株生长和香蕉枯萎病防治的研究[J]. 植物营养与肥料学报, 2010, 16(4): 978-985 (  0) 0) |
| [40] |
钟书堂, 沈宗专, 孙逸飞, 等. 生物有机肥对连作蕉园香蕉生产和土壤可培养微生物区系的影响[J]. 应用生态学报, 2015, 26(2): 481-489 (  0) 0) |
| [41] |
Marschner H. Book Reviews: Mineral nutrition in higher plants[J]. Plant, cell & Environment, 1988, 11: 147-148 (  0) 0) |
| [42] |
Dordas C. Role of nutrients in controlling plant diseases in sustainable agriculture: A review[J]. Agronomy for Sustainable Development, 2008, 28(1): 33-46 (  0) 0) |
| [43] |
Huber D M, Haneklaus S. Managing nutrition to control plant disease[J]. Landbauforschung Volkenrode, 2007, 4(4): 313-322 (  0) 0) |
| [44] |
Borrero C, Trillas M I, Delgado A, et al. Effect of ammonium/nitrate ratio in nutrient solution on control of Fusarium wilt of tomato by Trichoderma asperellum, T34[J]. Plant Pathology, 2012, 61(1): 132-139 DOI:10.1111/j.1365-3059.2011.02490.x (  0) 0) |
| [45] |
Lópezberges M S, Rispail N, Pradosrosales R C, et al. A nitrogen response pathway regulates virulence functions in Fusarium oxysporum via the Protein Kinase TOR and the b ZIP Protein MeaB[J]. Plant Cell, 2010, 22(7): 2459-2475 DOI:10.1105/tpc.110.075937 (  0) 0) |
| [46] |
Elmer W H, LaMondia J A. Influence of ammonium sulfate and rotation crops on strawberry black root rot[J]. Plant Disease, 1999, 83(83): 119-123 (  0) 0) |
| [47] |
董鲜, 郑青松, 王敏, 等. 铵态氮和硝态氮对香蕉枯萎病发生的比较研究[J]. 植物病理学报, 2015, 45(1): 73-79 (  0) 0) |
2. Nanjing Institute of Vegetable Science, Nanjing 210042, China;
3. Huaian Chaimihe Agricultural Technology Development Co. Ltd., Huaian, Jiangsu 223001, China
 2019, Vol. 51
2019, Vol. 51


