2. 江苏省农业技术推广总站,南京 210036;
3. 江苏省农业科学院农业资源与环境研究所,南京 210014;
4. 句容蓝天碧水生物科技有限公司,江苏句容 212402
我国是一个农业大国,每年产生的秸秆达到7.5亿t,其中直接焚烧或废弃的秸秆达到3.14亿t[1],造成严重的环境污染和资源浪费。秸秆直接还田作为保护性耕作的一种,既可以解决秸秆处理难的问题且成本较低,又可以改善土壤理化性质。但是秸秆中的木质纤维素尤其是木质素在自然条件下很难降解[2],秸秆腐熟较慢,养分难以释放,这严重阻碍了下季作物种子发芽和根的生长。不能分解的秸秆还可能增加病害[3],降低作物产量[4]。
为使还田秸秆快速降解,很多研究者对这一问题进行了研究,Han和He[5]向土壤中施加外源纤维素酶促进还田秸秆的降解,改善土壤肥力和促进作物生长,虽然添加纤维素酶可以在一定程度上促进秸秆降解[6],但纤维素酶成本较高,不利于农业推广。微生物具有相应的高效的酶系统,因此向还田秸秆中添加微生物菌剂也研究较多[7-8]。Lopez等[9]为使园艺作物秸秆加快降解,接种了由3种真菌(Coriolus versicolor, Phanerochaete flavidoalba和Trichoderma koningii)组成的菌剂促进秸秆中木质素的降解和腐殖质的形成,Gaind和Nain[10]将两种真菌(Aspergillus awamori和Trichoderma reesei)接种到还田秸秆中,发现可以在一定程度上促进秸秆降解,改善土壤健康状况。然而,由于需应用在不同土壤环境下,效率较高的腐熟剂菌种组合仍需要进一步研究。
本实验室在先前的研究中发现,内生真菌B3具有产生漆酶的能力,内生真菌YY11具有产生纤维素酶的能力。因此,我们在前期工作基础上,从真菌和细菌中复配了两个菌种组合,每个组合分别制成液体、固体两种剂型。本文旨在评价这4种菌剂的秸秆促腐效率、土壤改良作用和对作物生产力的影响,以提出一种效率较高的菌剂复配方案。
1 材料与方法 1.1 菌种试验所用菌剂为实验室自主研发配制,所用菌种为实验室保藏菌种,包括内生真菌枫香拟茎点霉(Phomopsis liquidambari,B3)、茎点霉(Phoma sp.,YY11)、丝状真菌绿色木霉(Trichoderma viride)、里氏木霉(Trichoderma reesei)、根霉(Rhizopus)和黑曲霉(Aspergillus niger),以及细菌蜂房芽孢杆菌(Bacillus alvei),7个菌株间均无拮抗效果,且菌株发酵液对种子发芽率无不良影响。真菌培养基为马铃薯葡萄糖培养基(PDA),细菌培养基为牛肉膏蛋白胨培养基(肉汤培养基)。
接种与发酵:真菌(B3、YY11、绿色木霉、里氏木霉、根霉和黑曲霉)分别接种在PDA斜面上,26 ℃培养4 d后,斜面上倒入无菌水,刮取菌丝,转移入PDA液体培养基,26 ℃ 150 r/min震荡培养3 d,获得种子液。细菌(蜂房芽孢杆菌)接种在牛肉膏蛋白胨斜面上,30 ℃培养2 d后,接种环挑单菌落转移入牛肉膏蛋白胨液体培养基,30 ℃ 220 r/min震荡培养2 d,获得种子液。将各菌株种子液按接种量5%转移到相应的液体培养基进行放大培养,培养条件同种子液发酵条件,获得发酵液。
固体发酵:固体发酵培养基配制,将麸皮、糠和稻壳按照6︰3︰1的比例混匀,按照固体物与水的质量比1︰1.2,加入20 g/kg的(NH4)2SO4,加入后搅拌均匀,分装入500 ml三角锥形瓶,每瓶分装200 g,121 ℃,灭菌1 h备用。将各菌株种子液按接种量100 g/kg接到固体培养基中,用灭菌玻璃棒搅拌均匀,8层纱布密封,27 ℃静止培养10 d后,获得各菌株的固体发酵物。
1.2 秸秆降解盆栽试验小麦秸秆取自南京师范大学植物园,70 ℃烘干,将小麦秸秆剪成2 ~ 3 cm长小段。各菌株间等比复配成的4种菌剂如下。菌剂A:4个菌种(绿色木霉、B3、YY11和蜂房芽孢杆菌)发酵的液体剂型;菌剂B:4个菌种(绿色木霉、B3、YY11和蜂房芽孢杆菌)发酵的固体剂型;菌剂C:7个菌种(绿色木霉、B3、YY11、蜂房芽孢杆菌、里氏木霉、根霉和黑曲霉)发酵的液体剂型;菌剂D:7个菌种(绿色木霉、B3、YY11、蜂房芽孢杆菌、里氏木霉、根霉和黑曲霉)发酵的固体剂型。
试验设7个处理组,每个处理6个重复。其中A、B、C、D处理分别施加菌剂A、B、C、D,E处理施加购买的秸秆腐熟剂,F处理施加灭菌的固体发酵基质作对照,G处理为完全空白对照。每种发酵物微生物数量约为105 cfu/ml,市购秸秆腐熟剂微生物数量为2×107 cfu/g,使所用复合菌剂处理和秸秆腐熟剂处理的微生物总量相等。试验土壤来自南京师范大学植物园的林下土壤,为黄棕壤,土壤基本理化性质如下。有机质45.38 g/kg,全氮2.61 g/kg,全磷1.30 g/kg,全钾24.39 g/kg,碱解氮168.7 mg/kg,有效磷116.3 mg/kg,速效钾879.1 mg/kg,pH 6.75。
花盆直径23 cm,高22 cm,每盆装土5 kg,用涤纶布袋装2 g烘干的小麦秸秆,喷洒10 ml发酵菌悬液或10 g湿重的固体发酵物,埋深5 cm,每盆埋3袋。分别于15、30、60、80和120 d进行破坏性取样,一个处理每次取样3个,烘干后对其进行干物质量、纤维素、半纤维素和木质素变化测定[11]。
1.3 玉米盆栽模拟试验试验各处理设计、花盆规格与土壤装填同1.2,秸秆量按每亩500 kg施加,即每盆施加30 g,与花盆内土壤表层0 ~ 15 cm土混合,处理A、B、C和D在播种前每盆施加菌剂湿重200 g或200 ml(总微生物数量保持一致,约为108 cfu),E处理按照其用量标准每亩2 kg施用(微生物总量为108 cfu,与4个菌剂处理一致)。处理F加入200 g灭菌固体培养基,以去除固体发酵制剂加入的固体培养基营养成分的影响,G处理加入200 ml灭菌蒸馏水,作为完全空白对照。玉米品种为苏玉20,2010年6月20日播种,每盆播种3 ~ 5粒,播深5 cm,3叶期间苗,苗期定苗一棵。常规水肥管理。
1.4 样品采集与测定 1.4.1 土壤样品采集分别在2010年7月5日玉米苗期、2010年7月20日玉米拔节期、2010年8月19日玉米抽雄期、2010年9月8日玉米开花期、2010年9月28日玉米收获期,用土钻从土壤0 ~ 15 cm垂直取样,每个处理取200 g左右,装入聚乙烯袋,放在4 ℃冰箱保存备用,测定酶活性的土样放在阴凉处风干,过1 mm筛,放4 ℃冰箱备用。
1.4.2 土壤样品测定采用稀释平板法对土壤样品进行微生物计数,细菌用牛肉膏蛋白胨培养基,放线菌用改良高氏一号培养基,真菌用虎红培养基[12]。
土壤中蔗糖酶活性和纤维素酶活性采用3,5-二硝基水杨酸比色法测定,脲酶活性用靛酚比色法测定,分别以C6H6O6 mg/(10g·72 h)和NH3-N mg/(g·24 h)来表示[13]。
土壤中有机质采用外加热法测定,全氮采用开氏法测定,全磷采用比色法测定,全钾采用火焰光度法测定,碱解氮采用扩散吸收法测定,有效磷采用比色法测定,速效钾采用火焰光度法测定,pH采用酸度计法测定[14]。
1.4.3 玉米叶片采集与农艺学指标测定在玉米拔节期取样,选取玉米植株顶部展开叶,为了试验的精确性,在取样时仅取每片叶的中间部分,用蒸馏水洗净,去除叶柄和中脉,用吸水纸将叶片表面水分吸干,用于叶绿素含量的测定,采用乙醇浸提-分光光度计法测定[15]。玉米成熟后,收获整个植株,洗净泥土后,测定植株茎高、茎粗和鲜重,晒干,测定每个植株干重,将玉米穗摘下,测定每个玉米穗的穗长、穗径和秃尖长,将每个穗的玉米粒脱下,测定每个玉米穗的百粒重以及总产量。
1.5 统计分析试验结果采用SPSS 16.0进行方差(ANOVA)分析。
2 结果 2.1 不同处理对小麦秸秆降解速率的影响在小麦秸秆降解过程中,秸秆干物质、纤维素、半纤维素以及木质素降解率如表 1。结果表明,在整个秸秆降解过程中,加菌组和秸秆腐熟剂组都可以显著促进秸秆降解,秸秆的纤维素、半纤维素和木质素都是在前15 d降解速率最快,降解最快的是B组。接菌组与市售腐熟剂组和空白对照组相比,显著促进秸秆三素的降解,其中尤其以木质素降解率提高最为显著。表明菌剂组在玉米生长早期木质素降解方面具有极大的优势。
|
|
表 1 不同处理后秸秆主要成分(干物质、纤维素、半纤维素和木质素)的降解率(%) Table 1 Effects of different treatments on degradation of main components of corn straws (dry matter, cellulose, hemicellulose, and lignin) |
分别在玉米的苗期、拔节期、抽雄期、开花期和成熟期取样,测定不同处理不同时期土壤中可培养的细菌、放线菌和真菌数量,结果如表 2所示。
|
|
表 2 不同取样时期不同处理可培养细菌(×106 cfu/g)、放线菌(×105 cfu/g)和真菌(×104 cfu/g)的数量变化 Table 2 Effects of different treatments on numbers of cultivated soil bacteria, actinomycetes and fungi |
在苗期,菌剂组与市购秸秆腐熟剂E相比均显著增加了土壤中的细菌数量,其中菌剂D处理下土壤细菌数量最多,其次是菌剂B。在拔节期,菌剂D处理下的土壤细菌数量最多,菌剂B处理下的土壤细菌数量也很高,分别比处理E和G高234.87%和350.37%。抽雄期,菌剂B处理的细菌数量最高,分别比E、F、G处理高281.75%、13.04%和218.90%,菌剂A、C与对照E和G差异不显著。开花期,仅菌剂B、D的细菌数量要大于G组。在玉米成熟期,菌剂B的细菌数量最多,菌剂C与E、G组细菌数量没有显著性差异。说明固体菌剂B、D对土壤细菌数量有较显著的积极影响。液体菌剂A、C处理的效果持续时间较短。随着时间推移,各处理差异渐小。
2.2.2 不同处理对土壤可培养放线菌数量的影响在苗期,固体菌剂B、D增加了土壤的放线菌数量,液体菌剂A和C与对照E、G的放线菌数量差异不大。在拔节期,放线菌数量规律与苗期相似。在抽雄期,菌剂B、D和对照F的放线菌差异不大,但要显著高于A、C处理和对照E、G。在开花期,菌剂D的放线菌数量最多,其次是菌剂B,菌剂A、C都低于E处理。在成熟期,菌剂B的放线菌数量最多,显著大于E和G,菌剂C的放线菌数量最少。
2.2.3 不同处理对土壤可培养真菌数量的影响在苗期,菌剂B处理的真菌数量最多,其次是菌剂D,菌剂A、C与各对照处理没有显著差异。在拔节期,真菌数量规律与苗期相似。在抽雄期、开花期和成熟期,仍是菌剂B、D处理的真菌数量最多,其他接菌处理与对照组E、G真菌数量差异不大。
2.3 不同处理对土壤酶活性的影响 2.3.1 不同处理对土壤纤维素酶活性的影响土壤纤维素酶活性如图 1。苗期和拔节期的纤维素酶活性较高,随着时间推移,纤维素酶活性逐渐降低。其中,苗期B处理的纤维素酶活性最高。固体菌剂组均显著高于对照。拔节期,菌剂B、D的纤维素酶活性迅速下降,但都要大于E组。抽雄期,菌剂B、C、D组与市购腐熟剂对照总体差异不大。在开花期与成熟期,各处理纤维素酶活性仍处于较低水平,其中开花期菌剂A、B、C处理显著较高,而成熟期市购秸秆腐熟剂组显著较高。
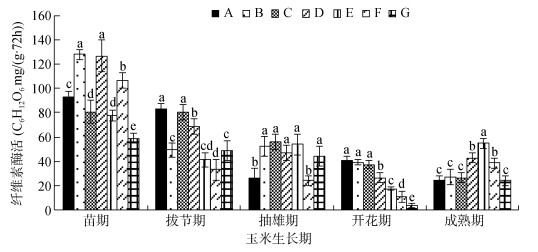
|
(图柱上方小写字母不同表示处理间差异达到P < 0.05显著水平,下图同) 图 1 不同处理对土壤纤维素酶活性的影响 Fig. 1 Soil cellulase activities under different treatments |
玉米各生长期的土壤脲酶活性如图 2,在玉米的整个生长期内,土壤脲酶活性呈先升高后降低的趋势。在苗期,菌剂A的脲酶显著高于其他组。拔节期,菌剂D的脲酶活性最高,其次是菌剂A。抽雄期,菌剂C的脲酶活性最大,其次是菌剂A,菌剂B与对照差异不大。开花期,菌剂组普遍低于对照组。到成熟期时,菌剂A、B仍具有较高的脲酶活性,显著高于其他处理。

|
图 2 不同处理对土壤脲酶活性的影响 Fig. 2 Soil urease activities under different treatments |
不同处理对玉米各生长期内土壤蔗糖酶活性的影响如图 3,在玉米整个生育期内呈现先降低后略升高的趋势。菌剂A、B、D在苗期和拔节期具有较高的蔗糖酶活性,从抽雄期开始,固体菌剂B、D仍具有较高的蔗糖酶活性,均显著高于液体菌剂A、C处理。到成熟期,除固体菌剂B、D处理外各处理之间差异不显著。
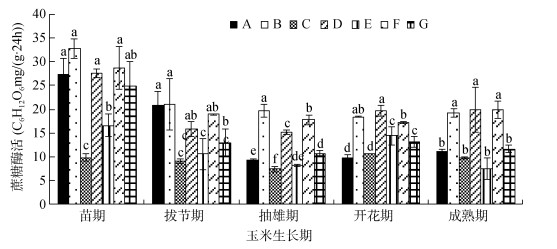
|
图 3 不同处理对土壤蔗糖酶活性的影响 Fig. 3 Soil invertase activities under different treatments |
总之,菌剂A、B、D在苗期和拔节期具有较高的蔗糖酶和纤维素酶活性,其中A、D菌剂的脲酶活性也较高,固体菌剂在玉米的整个生育期具有较长的作用时间,市购的秸秆腐熟剂在初期其酶活性均低于菌剂A、B、C、D,在玉米生长中后期才具有较高的酶活性。
2.4 不同处理对玉米拔节期叶绿素含量的影响7个处理的玉米拔节期叶绿素含量依次为2.62、3.15、2.69、2.51、2.47、2.61、2.58 mg/g。其中菌剂B、C组显著提高玉米叶绿素含量,其余加菌组对玉米叶绿素含量无显著影响,菌剂B、C组的叶绿素含量分别比市购秸秆腐熟剂E组高27.53%和8.91%。
2.5 不同处理对盆栽玉米土壤养分的影响在玉米苗期和成熟期取样测定土壤中各养分含量(表 3)。玉米苗期,4组加菌剂组都显著提高土壤有机质、全氮和速效钾含量,提高了土壤电导率,菌剂D处理显著提高土壤全钾含量,菌剂C处理显著提高土壤碱解氮含量,菌剂B处理显著提高土壤有效磷含量和土壤pH。到玉米成熟期时,菌剂B处理下土壤有机质、全氮、速效钾含量都显著大于市购秸秆腐熟剂处理,而几乎所有加菌组的全磷、全钾、速效钾含量,土壤电导率和pH都显著小于E组。
|
|
表 3 不同处理对盆栽玉米土壤养分的影响 Table 3 Soil nutrients of potting maizes under different treatments |
菌剂B处理下玉米的穗长、穗茎都最大,秃尖长最小,每盆平均产量最高;菌剂A处理提高玉米整体植株的生物量,菌剂B处理下玉米的百粒重最大,菌剂D处理使玉米茎粗增加,市购秸秆腐熟剂与空白相比可以提高玉米的农艺学性状,但效果不如菌剂B(表 4)。
|
|
表 4 不同处理对玉米收获期农艺学性状的影响 Table 4 Agronomic traits of maizes in maturation stage under different treatments |
从玉米植株组织块进行内生真菌重分离,7个处理组的分离菌数/组织块数值依次为:19/144、15/204、16/148、24/172、16/160、25/176、20/135。重分离菌株中均无内生真菌B3和YY11,说明内生真菌没有侵入植株体内发挥作用,只是与其他菌协同在土壤里发挥作用。
3 讨论 3.1 复合菌剂对秸秆降解速率和玉米农艺学性状的影响在不同处理对玉米秸秆的降解过程中,菌剂处理组可以显著加快秸秆的降解速率,其中秸秆在第15天时降解最快,此时是玉米生长中关键的发芽期,这段时间内秸秆降解的加快有利于作物出芽。在第15天时,菌剂处理组秸秆降解速率远远大于非处理组,其中尤以木质素的降解最为明显,复合菌剂其秸秆降解效果要优于市购的秸秆腐熟剂,可能是因为具有降解木质素的菌株B3,各个菌剂处理组中,菌剂B组(B3、YY11、绿色木霉和蜂房芽孢杆菌,固体剂型)的秸秆降解效果最好。
菌剂B处理可以显著提高玉米拔节期的叶绿素含量,提高玉米的光合作用,有利于玉米的生长发育。这可能是由于较好的秸秆降解作用可以为作物提供更多的养分[16]。
为模拟长期秸秆还田的高有机质环境,我们采集了植物园的林下土壤。菌剂处理在苗期都可以显著提高土壤中大部分养分含量,有利于植物的早期生长。在玉米成熟期,菌剂B、D(菌剂B处理基础上增加里氏木霉、根霉和黑曲霉,固体剂型)组仍有较高的养分含量但不及市购秸秆腐熟剂。菌剂B处理下玉米产量最高,可能是因为菌剂B处理的秸秆降解最快最彻底,为玉米生长提供了充分的营养。
内生真菌重分离试验结果表明,玉米植株组织块中没有分到复合菌剂中的两种内生真菌,说明这两种内生真菌只是在土壤中发挥作用[17],并没有定殖到植物体内,这可能是菌剂的施加量较少,也可能有少量定殖但没有被成功分离。
3.2 复合菌剂对土壤生物功能的影响土壤纤维素酶活性具有先降低再升高的趋势,这可能是因为微生物优先利用易利用的秸秆组分,在第15天时具有最高的纤维素酶活性,所以前15 d秸秆降解最快,当这些组分消耗完之后,菌剂中的微生物会和土壤中的土著微生物一起利用秸秆中难以降解的组分[18]。菌剂处理组与非处理组的土壤酶活性有显著差异,菌剂处理组可以显著增加土壤中的纤维素酶活性,因为菌剂中几乎所有的菌株都具有产生纤维素酶的能力。土壤中的脲酶活性呈现出先升高后降低的趋势,与Mahia等[19]的研究结果一致,菌剂处理组也增加了土壤脲酶活性,这是因为菌剂中含有丰富的微生物,施加化肥中的无机氮可以调节秸秆的碳氮比,为微生物的活跃生长和酶活性的提高创造了良好的条件[20]。我们的菌剂处理组在降解秸秆方面要显著优于市购腐熟剂对照组,这可能是因为菌剂处理组在微生物数量与酶活性方面都较高。秸秆降解加快,受其影响,土壤的微生物数量和酶活性也会相应增加。微生物数量增多可以加速土壤养分循环,有利于作物生长。随着时间的推移,微生物数量有逐渐减少的趋势,菌剂处理组和非处理组差异不大,这可能是因为微生物接种作用的消失[21],也有可能是因为秸秆中容易利用的组分被消耗完,而贫营养型的微生物是不可培养的。
3.3 菌剂复配方式与菌剂效果之间的联系各菌株酶组分之间的协同互补作用是菌剂发挥腐熟降解功能的关键。由于分解木质纤维素的酶是多酶体系,所以,混合菌株可以相互补充,从而促进木质纤维素类物质的分解。例如纤维素分解菌与木质素分解菌对稻草的联合分解能力明显高于任何一个单一菌株[22]。本试验所用的绿色木霉和里氏木霉,具有很高的纤维素酶活性,很多研究者也认为木霉属是纤维素酶活性较高的菌株,其中里氏木霉还具有β-1, 4木聚糖酶活性,可以降解半纤维素[23],绿色木霉作为一种生防菌,还可以拮抗多种病原菌,保护作物的健康生长[24]。根霉在自然界分布广泛,具有多种酶活性[25]。黑曲霉是公认的安全微生物,具有很高的纤维素酶和半纤维素酶活性[26],蜂房芽孢杆菌可以产生木聚糖酶,降解秸秆中半纤维素中的木聚糖[27]。本试验所用的复合菌剂选用两株植物内生真菌Pho mopsis liquidambari和Phoma sp.,也具有很高的漆酶[28]和滤纸酶[29]活性。
我们在菌剂A、B的4个菌株基础上增加了里氏木霉、根霉和黑曲霉3种可以高产纤维素酶和半纤维素酶的菌株,制成菌剂C、D。结果表明,相同剂型下增加菌种组成,菌剂的效率没有显著提高,这可能是添加的功能菌没有使原菌剂的协同作用得到显著增强。
剂型对复合菌剂效果也有显著的影响。之前我们有研究表明,复合菌剂可以显著改善土壤微生物数量、酶活性以及养分含量,有利于小麦的生长,但是也存在一些问题,如菌剂发挥作用不持久,小麦增产不明显。为了使菌剂施加到土壤中作用更加持久,我们增加了固体剂型,来研究改良菌剂施加到玉米盆栽中对土壤生态以及玉米生长的影响。施加菌剂后土壤中的可培养微生物的数量均有显著增加,尤其是固体剂型处理组B和D,说明固体剂型中的微生物的定殖能力更强,这与Gaind和Lata[30]的研究结果一致。这可能是因为固相载体为菌种提供了相对稳定的微环境,提高菌种施加后的存活率。而且固体剂型制作简单、价格低廉、施用方便、易于保存,相对于液体制剂有很大优势。
4 结论总之,我们制作的菌剂相比于对照组,对土壤的生物学特性、土壤养分和玉米生长均有较好促进作用,其效果要显著好于所购的市售秸秆腐熟剂。其中固体菌剂B(绿色木霉、B3、YY11和蜂房芽孢杆菌4个菌种发酵的固体剂型)在促进秸秆降解和玉米产量,改善土壤性质方面,效果最为显著。这些结果提供了一个有应用潜力的秸秆降解菌剂组合方式,并为秸秆降解后的农业生产和土壤生态的影响提供了更全面的认识。但是菌剂中的各类真菌和细菌究竟是如何进行协调促进的还需要进一步研究。
| [1] |
Wang XY, Yang L, Steinberger Y, et al. Field crop residue estimate and availability for biofuel production in China[J]. Renewable and Sustainable Energy Reviews, 2013, 27: 864-875 DOI:10.1016/j.rser.2013.07.005 (  0) 0) |
| [2] |
周桂香, 陈林, 张丛志, 等. 温度水分对秸秆降解微生物群落功能多样性影响[J]. 土壤, 2015, 47(5): 911-918 (  0) 0) |
| [3] |
李海燕, 苏媛, 齐永志, 等. 多功能土壤添加剂对小麦土传病害的防效及对玉米秸秆的腐解作用[J]. 河南农业科学, 2015, 44(6): 84-89 (  0) 0) |
| [4] |
成臣, 汪建军, 程慧煌, 等. 秸秆还田与耕作方式对双季稻产量及土壤肥力质量的影响[J]. 土壤学报, 2018, 55(1): 247-257 (  0) 0) |
| [5] |
Han W, He M. The application of exogenous cellulase to improve soil fertility and plant growth due to acceleration of straw decomposition[J]. Bioresource Technology, 2010, 101: 3724-3731 DOI:10.1016/j.biortech.2009.12.104 (  0) 0) |
| [6] |
詹长娟, 王翼, 王华, 等. 咪唑类离子液体辅助固定化纤维素酶降解小麦秸秆试验[J]. 黑龙江畜牧兽医, 2017(20): 208-210 (  0) 0) |
| [7] |
刘玉环, 赵静, 秦嘉海, 等. 功能性生物活性肥配方筛选及对土壤理化性质和马铃薯经济效益的影响[J]. 土壤, 2014, 46(3): 572-576 (  0) 0) |
| [8] |
邹芳, 赵娟, 雷燕萍, 等. 一株烟草秸秆降解菌的分离、鉴定及酶学性质研究[J]. 土壤, 2016, 48(5): 939-945 (  0) 0) |
| [9] |
Lopez M J, Vargas-Garcia M D C, Suarez-Estrella F, et al. Biodelignification and humification of horticultural plant residues by fungi[J]. International Biodeterioration & Biodegradation, 2006, 57: 24-30 (  0) 0) |
| [10] |
Gaind S, Nain L. Chemical and biological properties of wheat soil in response to paddy straw incorporation and its biodegradation by fungal inoculants[J]. Biodegradation, 2007, 18: 495-503 DOI:10.1007/s10532-006-9082-6 (  0) 0) |
| [11] |
Chen Y, Wang H W, Li L, et al. The potential application of the endophyte Phomopsis liquidambari to the ecological remediation of long-term cropping soil[J]. Applied Soil Ecology, 2013, 67(5): 20-26 (  0) 0) |
| [12] |
苏春沦, 王宏伟, 谢星光, 等. 内生真菌与苍术粉对连作花生根际微生物区系和微量元素的影响[J]. 生态学报, 2016, 36(7): 2052-2065 (  0) 0) |
| [13] |
关松荫. 土壤酶及其研究法[M].
农业出版社, 北京, 1986: 274-297
(  0) 0) |
| [14] |
Vargas Gil S, Meriles J, Conforto C, et al. Field assessment of soil biological and chemical quality in response to crop management practices[J]. World Journal of Microbiology & Biotechnology, 2009, 25: 439-448 (  0) 0) |
| [15] |
明华, 胡春胜, 张玉铭, 等. 浸提法测定玉米叶绿素含量的改进[J]. 玉米科学, 2007(4): 93-95, 99 DOI:10.3969/j.issn.1005-0906.2007.04.025 (  0) 0) |
| [16] |
杨滨娟, 黄国勤, 钱海燕. 秸秆还田配施化肥对土壤温度、根际微生物及酶活性的影响[J]. 土壤学报, 2014, 51(1): 150-157 (  0) 0) |
| [17] |
Wang H W, Dai C C, Zhu H, et al. Survival of a novel endophytic fungus Phomopsis liquidambari B3 in the indole-contaminated soil detected by real-time PCR and its effects on the indigenous microbial community[J]. Microbiological Research, 2014, 169: 881-887 DOI:10.1016/j.micres.2014.05.006 (  0) 0) |
| [18] |
Gaind S, Pandey A K, La ta. Biodegradation study of crop residues as affected by exogenous inorganic nitrogen and fungal inoculants[J]. Journal of Basic Microbiology, 2005, 45(4): 301-311 DOI:10.1002/jobm.200410483 (  0) 0) |
| [19] |
Mahia J, Martin A, Carballas T, et al. Atrazine degradation and enzyme activities in an agricultural soil under two tillage systems[J]. Science of the Total Environment, 2007, 378: 187-194 DOI:10.1016/j.scitotenv.2007.01.036 (  0) 0) |
| [20] |
唐晓雪, 刘明, 江春玉, 等. 不同秸秆还田方式对红壤性质及花生生长的影响[J]. 土壤, 2015, 47(2): 324-328 (  0) 0) |
| [21] |
于建光, 常志州, 黄红英, 等. 秸秆腐熟剂对土壤微生物及养分的影响[J]. 农业环境科学学报, 2010, 29(3): 563-570 (  0) 0) |
| [22] |
Gou C L, Wang Y Q, Zhang X Q, et al. Inoculation with a psychrotrophic-thermophilic complex microbial agent accelerates onset and promotes maturity of dairy manure- rice straw composting under cold climate conditions[J]. Bioresource Technology, 2017, 243: 339-346 DOI:10.1016/j.biortech.2017.06.097 (  0) 0) |
| [23] |
韩梦颖, 王雨桐, 高丽, 等. 降解秸秆微生物及秸秆腐熟剂的研究进展[J]. 南方农业学报, 2017, 48(6): 1024-1030 DOI:10.3969/j.issn.2095-1191.2017.06.14 (  0) 0) |
| [24] |
陆楚月, 马艳, 王巧, 等. 绿色木霉TV41对尖孢镰刀菌FW0在西瓜植株空间分布和枯萎病防控效果的影响[J]. 微生物学通报, 2015, 42(11): 2159-2167 (  0) 0) |
| [25] |
Dorsam S, Fesseler J, Gorte O, et al. Sustainable carbon sources for microbial organic acid production with filamentous fungi[J]. Biotechnology for Biofuels, 2017, 10: 242 DOI:10.1186/s13068-017-0930-x (  0) 0) |
| [26] |
焦有宙, 高赞, 李刚, 等. 不同土著菌及其复合菌对玉米秸秆降解的影响[J]. 农业工程学报, 2015, 31(23): 201-207 DOI:10.11975/j.issn.1002-6819.2015.23.027 (  0) 0) |
| [27] |
董明杰.大额牛粪便蜂房类芽孢杆菌来源纤维素酶的异源表达及酶学性质研究[D].昆明: 云南师范大学, 2016
(  0) 0) |
| [28] |
Zhou J, Kang L, Wang H W, et al. Liquid laccase production by Phomopsis liquidambari B3 accelerated phenolic acids degradation in long-term cropping soil of peanut[J]. Acta Agriculturae Scandinavica[J]. Section B-Soil & Plant Science, 2014, 64(8): 683-693 (  0) 0) |
| [29] |
Yang B, Ma H Y, Wang X M, et al. Improvement of nitrogen accumulation and metabolism in rice (Oryza sativa, l.) by the endophyte Phomopsis liquidambari[J]. Plant Physiology and Biochemistry, 2014, 82: 172-182 DOI:10.1016/j.plaphy.2014.06.002 (  0) 0) |
| [30] |
Gaind S, La ta. Chemical and biological properties of wheat soil in response to paddy straw incorporation and its biodegradation by fungal inoculants[J]. Biodegradation, 2007, 18: 495-503 DOI:10.1007/s10532-006-9082-6 (  0) 0) |
2. General Station of Jiangsu Agricultural Technology Extension, Nanjing 210036, China;
3. Institute of Agricultural Resources and Environment, Jiangsu Academy of Agricultural Sciences, Nanjing 210014, China;
4. Jurong Blue Sky Clearwater Biological Technology Co., Ltd. Jurong, Jiangsu 212402, China
 2019, Vol. 51
2019, Vol. 51


