2. 中国科学院大学, 北京 100049
化石燃料燃烧排放的氮氧化物(NOx)、农田施肥及集约畜牧业发展排放的氨(NHx), 致使大气中含氮化合物激增, 大气氮沉降量显著增加[1-5]。尽管氮沉降可作为土壤氮素损失的供给源, 但过多氮沉降对生态系统亦存在负面影响[2, 6-8]。由于1 mol NH4+-N在土壤中硝化可产生2 mol H+, 同时NO3--N淋失又会进一步导致盐基离子的淋溶, 土壤缓冲能力下降, 因此大气沉降NH4+-N对土壤的酸化影响较NO3--N更大[6, 9-10]。
在酸性土壤中, 输入的NH4+-N如果被硝化, 就可能导致NO3--N大量向下迁移淋溶, 污染地下水体; 加速土壤酸化, 引起盐基离子淋溶, 导致土壤肥力下降; 甚至导致H+的直接淋溶, 进一步影响地下水体[11]。当前, 对中国广大热带和亚热带地区而言, 氨基氮肥的施用和大气沉降NH4+-N是活化氮输入土壤的主要途径[12]。关于温带土壤上的硝化和酸化已有不少研究, 但由于气候条件与成土母质等差异, 温带地区的土壤氮素转化特征不同于热带和亚热带地区土壤[6]。NH4+-N输入增加后, 热带和亚热带湿热多雨地区酸性土壤的硝化及其可能引发环境后果的研究格外重要。
以往, 对外源NH4+-N输入酸性土壤的研究大多通过短期和相对封闭的实验室培养进行, 其中心议题也都集中在提高的NH4+-N水平对土壤硝化和酸化的影响[13]。曾有一些原位研究结果表明, 土壤硝化强度与NO3--N淋洗存在一定的相关性[14-15]。但由于自然环境条件下, 影响土壤硝化作用的环境因子很多, 很难将NO3--N淋洗的不同归结于土壤硝化作用的差异, 而控制条件下的室内淋溶培养试验是行之有效的方法之一[16], 有利于揭示土壤硝化强度与氮淋溶及土壤酸化的关系。目前, 在长时间的土柱淋洗培养条件下研究外源NH4+-N输入对土壤硝化、NO3--N和盐基离子淋溶、土壤及淋出液酸化影响的报道尚不多见[16]。
因此, 本研究采集了热带和亚热带的4种不同类型酸性、微酸性土壤, 通过56 d的好气培养试验和123 d的土柱模拟淋溶试验, 研究了外源NH4+-N加入对酸性土壤硝化、盐基离子淋溶、土壤及淋出液酸化的影响, 分析了不同性质热带亚热带酸性土壤对提高的NH4+-N输入水平下其硝化、氮淋溶与水土酸化响应的差异及可能原因, 以期为全面评价日益增加的氨基氮肥施用和大气沉降NH4+-N在热带亚热带酸性土壤可能产生的生态环境效应提供基础性资料。
1 材料与方法 1.1 供试土壤试验选取4种不同区域的热带亚热带酸性土壤, 即采自花岗岩发育的海南林地砖红壤(HR)、玄武岩发育的云南林地砖红壤(YR)、第四纪红黏土发育的江西旱地红壤(RU)和第四纪下蜀黄土发育的江苏旱地黄棕壤(YU), 分别采集表层(0 ~ 20 cm)土壤, 风干、磨细过2 mm筛备用。采样地点基本情况及土壤理化性状等见表 1。
|
|
表 1 供试土壤基本信息 Table 1 Informations of tested soils |
相对封闭好气培养试验:用于土壤硝化能力测定。称取相当于15 g烘干土的风干土放入250 ml塑料广口瓶, 按40%田间持水量(WHC)加水, 置于30 ℃培养箱中预培养一周。之后, 均匀加入相当于N 4.5 mg的尿素溶液(N含量300 mg/kg, 处理代号U; 以不加NH4+-N处理作为对照(CK)), 按65% WHC加水后, 用橡皮筋将塑料袋扎上封口, 其上用针打2 ~ 3孔以满足好气培养条件, 置于30 ℃培养箱中培养。每周称重一次, 补加失去水分。
土柱模拟淋洗培养试验:研究外源NH4+-N加入对土壤盐基离子淋溶、土壤及淋出液酸化的影响。试验所用土柱为内径4.7 cm, 高60 cm的白色PVC塑料管。塑料管底部焊接有带多孔挡板的V型漏斗并接橡皮管以便收集淋洗液。将一定量的玻璃纤维、石英砂、多孔挡板依次放入压实, 总厚度为3 ~ 4 cm, 以防止土壤淋失和保证淋出液澄清。将各土壤样690 g(烘干基)与石英砂(2 mm)345 g按照重量比2:1混匀, 等分成3份, 依次装入土柱。每装入一份土样后放入一个直径0.5 cm的塑料垫环, 以尽量减少管壁效应的影响。土样填装完毕后, 再于表面放置一层石英砂并铺上滤纸以防止加水淋洗过程中破坏土柱表层土壤。用去离子水按照65% WHC调节水分后置于30 ℃恒温培养箱中培养。各土样均填装6个柱子。每个土样均设置不加NH4+-N对照(CK)和加NH4+-N处理(以尿素形式加入, N含量300 mg/kg, 处理代号U)两个处理, 3次重复。
1.3 样品采集及测定土壤基本理化性状:土壤有机碳用碳氮元素分析仪(德国Elementar)测定; 土壤阳离子交换量(CEC)和土壤交换性盐基离子通过乙酸铵交换法测定[17]; 土壤机械组成用LS230型激光粒度仪(美国Beckman)测定。
相对封闭好气培养试验:分别在培养后的0、7、14、21、28、42、56 d取样分析NH4+-N和NO3--N, NH4+-N含量用靛酚兰比色法测定, NO3--N用紫外分光光度计(日本岛津)比色测定。
土柱模拟淋洗培养试验:预培养一周后, 从土柱顶部加入去离子水150 ml, 平衡30 min后通过真空泵底部抽气形成负压, 使淋出液流出, 收集150 ml后停止, 所收淋洗液作为培养0 d样品。之后, 在各土样的其中3个柱子上分别加入10 ml含有207 mg N的尿素溶液, 作为加NH4+-N处理; 剩余3个加入10 ml去离子水代替, 作为不加NH4+-N对照处理。将所有土柱放入30 ℃恒温培养箱中培养。培养3 d后用同样方法淋洗并收集淋洗液。随后每周淋洗一次(除培养80 d样品和95 d样品分别间隔10 d和15 d外), 共淋洗18次。培养期间每隔3 d通过称重法补充因表面蒸发损失的水分。每次收集淋洗液后置于-20℃冰箱冷冻保存备测。每次收集淋洗液后直接用Φ255 pH/temp/mV meter测定淋洗液pH。取部分淋洗液过0.45 μm滤膜后测定NH4+-N、NO3--N及全氮(TN)浓度。TN通过碱性过硫酸钾氧化-紫外分光光度计法(日本岛津)测定; 可溶性有机氮(DON)通过TN浓度和无机氮浓度(NH4+-N + NO3--N)的差值求得。淋洗液中盐基离子(Ca2+、K+、Mg2+、Na+)用IRIS-advantage型等离子发射光谱仪器(美国Thermo Electron)进行测定。淋洗18次后按照高度将土柱平均分为上、中、下3层, 分层取土。各层土壤pH在加入去离子水25 ml后摇床震荡10 min, 静置后用Φ255 pH/temp/ mV meter测定。各层土壤风干过筛后通过凯氏消煮-蒸馏定氮法测定TN。
1.4 数据分析采用SPSS 18.0统计软件对数据进行Duncan单因素方差分析, 比较各处理之间的差异显著性(P < 0.05)。绘图采用Sigmaplot 12.5软件。文中各形态氮量均以纯N量计。
2 结果与分析 2.1 封闭好气培养条件下各土壤的硝化作用4种不同来源土壤在相对封闭好气培养条件下的硝化作用大小存在差异(图 1A)。在56 d培养期间, HR和YR土壤几乎没有发生硝化作用, 始终没有NO3--N净累积; 而YU土壤有明显的硝化作用, 56 d内NO3--N含量线形增加, 培养结束时的净硝化量可达60 mg/kg(以纯N量计, 下同)以上; RU土壤也有微弱的硝化。尿素的加入在不同程度促进了旱地土壤YU和RU的硝化, 但对林地土壤HR和YR的硝化并无促进作用。
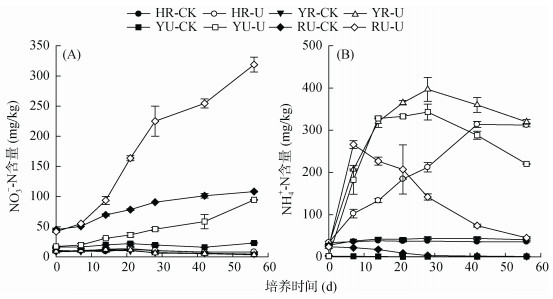
|
图 1 海南砖红壤(HR)、云南砖红壤(YR)、江西红壤(RU)和江苏黄棕壤(YU)的硝化作用特征 Fig. 1 Nitrification in HR, YR, RU and YU soils |
加入尿素后4种土壤中NH4+-N含量变化曲线也明显不同(图 1B)。对于HR土壤, 培养过程NH4+-N含量逐渐增加, 直至结束时才达最大; 对于YR土壤, NH4+-N含量在培养28 d时达到峰值; 而对于RU和YU土壤, NH4+-N含量分别在培养的14 d和7 d出现峰值, 之后便随着硝化的进行而逐渐降低。培养过程中NH4+-N含量变化的差异反映了尿素在4种土壤上水解能力的强弱。
2.2 不同土壤土柱模拟淋洗条件下的氮素淋溶特点各土壤淋出液在开始淋洗时均具有较高浓度的NO3--N, 之后慢慢降低, 这可能是由于干土效应[18]影响, 其中以RU和YU土壤最为明显。YU土壤培养0 d淋出液NO3--N含量高达100 mg/L以上, RU-U处理土壤NO3--N浓度也达30 mg/L以上(图 2A)。
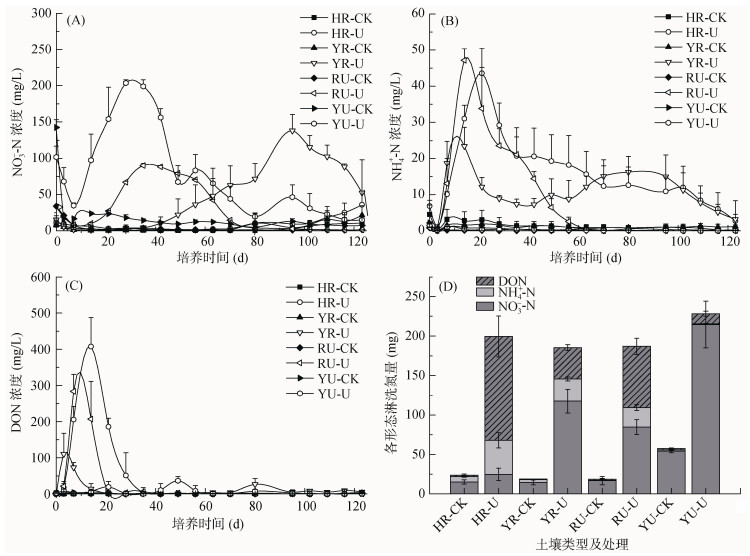
|
图 2 HR、YR、RU和YU土壤淋出液中NO3--N(A)、NH4+-N(B)、DON(C)浓度变化曲线及各形态氮素累积淋失量(D) Fig. 2 Concentrations of nitrate (A), ammonium (B), dissolved organic nitrogen (DON, C) and total leaching losses of various N forms (D) in leachates of HR, YR, RU and YU soils |
各土壤淋出液NO3--N浓度变化曲线在土柱培养条件下存在差异(图 2)。HR土壤淋出液中NO3--N浓度一直维持在较低水平, 直到培养末期才有微小增加。其他土壤NO3--N浓度则有明显的波动。除HR土壤外, 外源NH4+-N的加入促进了土壤硝化, NO3--N淋失量增加。各土壤淋出液的NO3--N浓度均呈现先增加后降低的趋势, 但NO3--N浓度出现峰值时间和大小各不相同。其中, YU土壤淋出液中NO3--N浓度达到峰值的时间最短(28 d), 峰值也最大(200 mg/L); RU土壤则分别为35 d和90 mg/L; YR土壤为95 d和140 mg/L (图 2A)。加NH4+-N处理下, NO3--N淋失量从大到小依次为YU-U (214 mg), YR-U(118 mg)、RU-U(85 mg)和HR-U(25 mg; 图 2D)。
HR-U、YR-U及RU-U处理NH4+-N的淋失相比CK有不同程度增加(图 2D)。HR、YR与RU土壤淋出液在培养3 d后即出现较高浓度的NH4+-N, 之后逐渐增加并达到峰值, 随后降低。其中, 以HR和RU土壤淋出液NH4+-N浓度峰值最大, 在40 ~ 50 mg/L范围内。相反, 对于YU土壤, 整个培养期间几乎没有NH4+-N淋出(图 2B)。加NH4+-N培养123 d后, HR-U处理NH4+-N淋失量最大, 之后依次为YR-U和RU-U处理, YU-U处理NH4+-N淋失量与CK水平相当(图 2D)。
CK处理下, 各土壤淋出液中DON浓度很低。加NH4+-N后, HR、YR和RU土壤淋出液中DON浓度在培养的前35 d均出现很高的峰值。与此相反, YU土壤淋出液的DON浓度很低, 在培养期间保持平稳(图 2C)。培养结束后, DON淋失总量规律与NH4+-N结果一致, 也以HR土壤最高, RU和YR土壤次之, YU土壤最低(图 2D)。
通过差减法计算得到了加NH4+-N处理下各土壤培养期间净淋失氮量及占加入氮量的百分比(表 2)。可以看出, HR、YR、RU和YU土壤外源氮的淋失量在167 ~ 176 mg, 占加入氮量的81% ~ 85%, 其中以HR土壤最高, 可占到加入氮量的85%。
|
|
表 2 HR、YR、RU和YU土壤净淋失氮量及占加氮量的百分比 Table 2 Net leaching losses of various N forms from HR, YR, RU and YU soils |
淋洗条件下, 土壤中盐基离子常常伴随着NO3--N一起淋出, 从而起到平衡电荷和缓冲酸度的作用。淋出液盐基离子总浓度曲线与NO3--N变化曲线相吻合, 两者之间存在显著的线性正相关关系(P < 0.01;图 4)。盐基离子总淋溶量大小与土壤盐基饱和度大小(表 1)一致, 各土壤表现为YU > YR > RU > HR。

|
(图中实线与虚线部分分别表示拟合曲线与95%置信区间) 图 3 HR、YR、RU和YU土壤淋出液盐基总浓度与NO3--N浓度的相关分析 Fig. 3 Correlation between concentrations of NO3--N and total base cation in leachates of HR, YR, RU and YU soils |
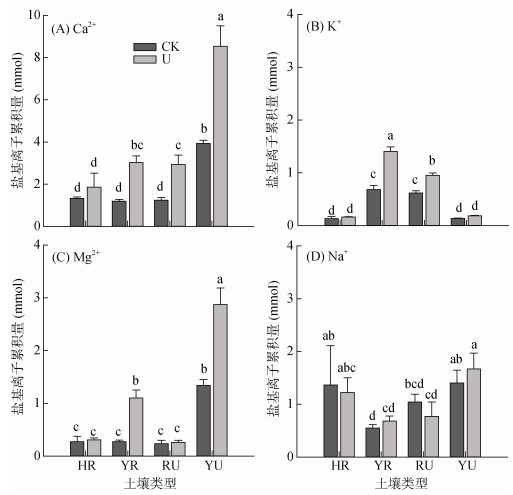
|
(图中小写字母不同表示处理间差异在P < 0.05水平显著) 图 4 HR、YR、RU和YU土壤淋出液中各盐基离子淋溶量 Fig. 4 Leaching losses of base cations from HR, YR, RU and YU soils |
各盐基离子淋溶量在不同土壤之间存在一定差异(图 5), 土壤中交换性盐基离子含量大小在一定程度可解释淋失量的大小。Ca2+是淋溶量最大的盐基离子, 除HR土壤外, 其他土壤中Ca2+淋溶量大小也与土壤交换性Ca2+含量大小相吻合(表 1)。YU土壤K+淋失量较低。RU土壤Mg2+淋失量很低, 且RU-U和RU-CK处理并无差异。与上述离子不同, 尽管整个培养过程中各土壤均有一定数量的Na+淋溶, 但加NH4+-N处理下其淋溶量和对照相比无明显差异。
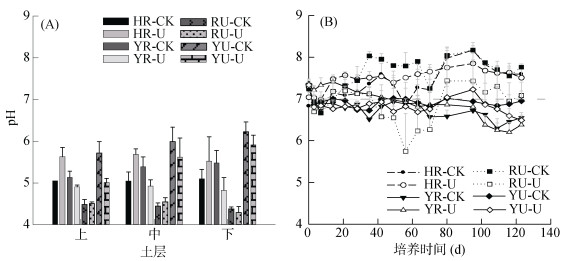
|
图 5 HR、YR、RU和YU土壤培养结束后各层土壤pH (A)和淋出液pH变化(B) Fig. 5 Changes of pH in three different layers in columns (A) and in leachates (B) of HR, YR, RU and YU soils |
在土柱模拟培养结束后, 对土柱上、中、下3层pH测定结果(图 5A)表明, 土柱各层pH变化因土壤而异。HR-U处理各层土壤pH要高于HR-CK, 以上和中层最为明显。相反, YR-U处理的各层土壤pH要低于YR-CK。由于大部分水解的NH4+-N被淋溶到底层而硝化, 使得加NH4+-N处理的土壤pH降幅随土壤深度增加而增大。培养结束时, RU土壤各层pH均在4.5左右, 低于其他土壤。对于YU土壤, YU-U处理土壤pH均低于YU-CK, 以上层最为显著。
土壤淋出液中, HR-CK和HR-U处理土壤pH均在7.0以上, 并无明显差异, 且随培养时间逐渐升高(图 5B)。在培养前期, YR-U处理的pH略低于YR-CK, 之后两者数值相当; 在整个培养过程中, 淋出液pH均呈逐渐降低趋势, 从开始时的7.3降低到试验结束时的6.5左右。RU-CK处理淋出液pH从7.3逐渐升高到8.0;RU-U处理淋出液pH与RU-CK相比在前21 d无明显差异, 但21 d之后突然下降, 显著低于RU-CK, 尽管在56 d后淋出液pH又有所增加, 但仍低于RU-CK并保持到培养结束。YU-U处理淋出液pH与YU-CK相似, 在整个培养过程中有缓慢下降的趋势, 培养结束时为6.5左右。
3 讨论土壤的硝化作用强弱是控制NO3--N淋溶的主要因子[16]。YU、RU和HR土壤的NO3--N淋溶在淋洗培养试验中均与封闭好气培养试验中土壤硝化作用大小有关。YU土壤硝化作用强烈, YU-U处理封闭好气培养56 d后的硝化率(硝态氮占矿质氮含量的百分数)可达88%(图 1A), 而淋洗培养过程中其NO3--N淋溶量可占到加入氮量的77%(表 2); RU土壤也有一定的硝化作用, 加NH4+-N封闭好气培养56 d后的硝化率为30%(图 1A), 淋洗培养试验中其NO3--N淋溶量也占到加入氮量的33%(表 2); HR土壤几乎没有发生硝化(图 1A), 因此整个淋洗培养期间其NO3--N淋溶很少(表 2)。与上述不同, YR土壤在相对封闭的好气培养试验中并未有明显硝化作用, 尿素加入也未促进其硝化, 但在淋溶培养试验中, YR土壤发生很强的硝化作用并出现相当数量的NO3--N淋失(103 mg)。这可能是56 d的好气培养不足以恢复其硝化微生物的活性, 而淋洗培养时间较长, 加之底部抽气带入O2, 硝化活性在培养的中后期逐渐增强的缘故。
提高的NH4+-N水平对热带亚热带酸性土壤硝化能力的影响因土壤类型与土地利用方式不同而存在很大差异。对于微酸性黄棕壤(YU), NH4+-N的添加极大地促进了硝化作用(图 1A), 这与Dancer等[19]发现在微酸性(pH 5.3 ~ 6.6)环境下土壤更倾向于硝化的结果一致。与此相反, 砖红壤(HR)几乎不发生硝化(图 1A), 可能的原因是土壤中较低的全碳含量与较高的黏粒含量(表 1)导致土壤微生物代谢活性降低[20]。尽管土壤酸度被认为是热带和亚热带酸性土壤硝化作用的主要影响因素之一[13, 21], 但在好气培养研究中, 加入NH4+-N促进了较低pH(4.18)旱地土壤(RU)的硝化作用(图 1A), 而并未促进酸性(pH 4.97)林地土壤(YR)的硝化。这可能是因为RU土壤长期的耕种改善了微生物群落结构, 在一定程度促进了微生物活性, 从而提升了硝化能力。
盐基离子在本研究中表现出与NO3--N相同的淋溶趋势, 淋出液中盐基离子浓度与NO3--N浓度显著正相关(图 4)。不同土壤类型及盐基离子本性差异会影响盐基离子向下迁移淋溶的表现[22-23]。根据盐基离子和土壤胶体之间的静电作用大小, 土壤胶体对盐基离子的吸附强度一般为Ca2+ > Mg2+ > K+ > Na+[24], 但从离子迁移量来看, 所有土壤盐基离子淋溶量均以Ca2+最大, 加NH4+-N处理下Ca2+淋溶显著增加(图 5), 表明Ca2+在缓冲土壤硝化致酸和平衡NO3--N淋失所携带负电荷方面的重要作用。与此不同, 在所有土壤上加NH4+-N对Na+淋溶量影响很小。这是因为所研究的4种土壤均为酸性淋溶土壤, 根据元素迁移的地球化学原理, Na+是最易迁移的元素[25]。Na+的强烈淋溶致使土壤本身含量很低(表 1), 所以Na+在上述酸性土壤缓冲H+和平衡NO3--N淋失所带负电荷中并未起重要作用。Hartikainen[26]指出, 土壤中外源H+增加使二价盐基离子淋溶量大大增加, 而对一价阳离子淋溶的影响要小得多。
土壤酸化的基本原因是土壤中产生H+, 通常土壤中的H+来源于酸沉降、微生物分解有机质和NH4+-N在土壤中的硝化作用等途径[27-28]。本研究中外源NH4+-N在土壤的硝化作用是产生H+和加速土壤酸化的最主要途径。一般情况下, 土壤可通过土壤胶体盐基离子的释放(盐基离子与H+交换)来实现缓冲硝化作用产生H+的目的。但大量盐基离子的释放和淋失必然使土壤缓冲性能降低, 造成土壤酸化[29]。YU土壤CEC很高, 且富含盐基离子(表 1), 但由于外源NH4+-N的强烈硝化, 大量盐基离子(以Ca2+和Mg2+为主)随NO3--N一起淋失, 致使培养结束时土壤pH比对照处理降低, 上层土壤pH降低更为明显(图 5)。由于硝化作用的进行, YR土壤的pH在培养结束时也比对照有所降低(图 5), 以下层最为明显, 这可能是YR土壤硝化作用启动较慢(图 2), 加入的氮绝大多数被淋洗至下层发生硝化作用的缘故。与此相反, 加入的NH4+-N在HR土壤几乎不发生硝化, 也不产生H+, 至培养结束时, 其土壤pH与对照相比反而有所增加(图 5), 其原因可能是加入尿素水解提高了土壤pH的缘故。对于RU土壤, 尽管加入的尿素水解为NH4+-N后部分被硝化, 但至培养结束土壤pH与对照相比并无明显差异(图 5), 这可能是因为尿素水解引起土壤pH上升抵消了硝化对土壤酸化的影响。
土壤淋出液是否呈酸性主要取决于土壤中是否发生H+的淋溶, 而H+的淋溶与土壤CEC和盐基饱和度有很大关系[30-31]。如果土壤盐基饱和度高, 缓冲酸的能力强, H+被充分交换, 那么H+的淋溶就很少发生, 土壤淋出液也不会酸化; 反之, 则淋出液酸化。总体来看, YU土壤CEC很高, 盐基离子总量大, 外源NH4+-N加入后, 尽管土壤硝化作用显著提高, NO3--N淋溶增加, 但盐基离子可充分交换因硝化产生的大量H+, 并且伴随NO3--N淋溶而淋溶, 整个过程H+都保持在土壤内部, 淋溶很少, 因此至培养结束时土壤酸化而淋出液并不酸化。这一结果与Watanable等[32]的结果类似, 他们发现阳离子交换反应在热带土壤中占主导地位。对于RU土壤, 其CEC和盐基离子含量很低, 盐基离子淋溶不足以平衡外源NH4+-N硝化产生的NO3--N淋溶所携带的负电荷, 最终导致吸附能力较强的NH4+-N甚至是H+淋溶, 因此淋出液pH较对照低。YR土壤CEC和盐基饱和度介于上述两者之间, 盐基离子和NH4+-N的淋溶可平衡外源NH4+-N硝化产生的NO3--N淋溶所携带的负电荷, 整个过程H+的淋溶很少, 淋出液并不酸化。与上述情况不同, HR土壤外源NH4+-N硝化很弱, H+产生量很少, 整个过程对淋出液致酸影响微弱。
4 结论综合来看, 外源NH4+-N加入对热带亚热带酸性土壤NO3--N及盐基离子淋溶、土壤及淋出液酸化的影响因土壤硝化作用强度而异。对于硝化作用较强、养分丰富的耕地土壤(如YU), 长期施用氨基氮肥和日益增加的NH4+-N沉降对土壤NO3--N、盐基离子淋溶及土壤酸化的影响不容忽视。对于硝化作用很弱、养分贫瘠的酸性土壤(如HR), 尽管提高的NH4+-N水平不会进一步导致土壤及淋出液酸化, 但过量输入的NH4+-N在土壤中会导致NH4+-N直接淋溶, 进而污染水体, 因此也应予以关注。在阳离子交换量小、盐基饱和度低的土壤(如RU)上, 外源NH4+-N的硝化和淋失不仅导致盐基离子淋失, 而且引发NH4+-N、甚至是H+淋失。4种热带亚热带地区酸性土壤在强热淋溶条件下, 加入氮的淋失率均达到80%以上, 在一定程度上反映, 与大多数氮限制的温带森林生态系统相比, 在热带亚热带湿热多雨地区土壤上外源氮输入的增加可能会在更短的时间内导致氮素向系统外的流失, 引发环境问题。
| [1] |
Bartnicki J, Alcamo J. Calculating nitrogen deposition in Europe[J]. Water Air and Soil Pollution, 1989, 47(1/2): 101-123 (  0) 0) |
| [2] |
Vitousek P M, Aber J D, Howarth R W, et al. Human alteration of the global nitrogen cycle: Sources and consequences[J]. Ecological applications, 1997, 7(3): 737-750 (  0) 0) |
| [3] |
Wright R F, Rasmussen L. Introduction to the NITREX and EXMAN projects[J]. Forest Ecology and Management, 1998, 101(1/2/3): 1-7 (  0) 0) |
| [4] |
Galloway J N, Aber J D, Erisman J W, et al. The nitrogen cascade[J]. BioScience, 2003, 53(4): 341-356 DOI:10.1641/0006-3568(2003)053[0341:TNC]2.0.CO;2 (  0) 0) |
| [5] |
Berendse F, Van Breemen N, Rydin H, et al. Raised atmospheric CO2 levels and increased N deposition cause shifts in plant species composition and production in sphagnum bogs[J]. Global Change Biology, 2001, 7(5): 591-598 DOI:10.1046/j.1365-2486.2001.00433.x (  0) 0) |
| [6] |
Matson P A, McDowell W H, Townsend A R, et al. The globalization of N deposition: Ecosystem consequences in tropical environments[J]. Biogeochemistry, 1999, 46(1/2/3): 67-83 (  0) 0) |
| [7] |
Choudhary S, Blaud A, Osborn A M, et al. Nitrogen accumulation and partitioning in a high arctic tundra ecosystem from extreme atmospheric N deposition events[J]. Science of the Total Environment, 2016, 554: 303-310 (  0) 0) |
| [8] |
方华军, 程淑兰, 于贵瑞, 等. 森林土壤氧化亚氮排放对大气氮沉降增加的响应研究进展[J]. 土壤学报, 2015, 52(2): 262-271 (  0) 0) |
| [9] |
Bergkvist B, Folkeson L. Soil acidification and element fluxes of a Fagus-sylvatica forest as influenced by simulated nitrogen deposition[J]. Water Air and Soil Pollution, 1992, 65(1-2): 111-133 DOI:10.1007/BF00482753 (  0) 0) |
| [10] |
Skeffington R A. Accelerated nitrogen inputs - A new problem or a new perspective[J]. Plant and Soil, 1990, 128(1): 1-11 (  0) 0) |
| [11] |
王敬, 张金波, 蔡祖聪. 太湖地区稻麦轮作农田改葡萄园对土壤氮转化过程的影响[J]. 土壤学报, 2016, 53(1): 166-176 (  0) 0) |
| [12] |
曹彦圣, 付子轼, 孙会峰, 等. 施氮水平对水稻氮肥利用率和径流负荷的影响[J]. 土壤, 2016, 48(5): 868-872 (  0) 0) |
| [13] |
蔡祖聪, 赵维. 土地利用方式对湿润亚热带土壤硝化作用的影响[J]. 土壤学报, 2009, 46(5): 795-801 DOI:10.3321/j.issn:0564-3929.2009.05.006 (  0) 0) |
| [14] |
Christ M J, Peterjohn W T, Cumming J R, et al. Nitrification potentials and landscape, soil and vegetation characteristics in two central Appalachian watersheds differing in NO3- export[J]. Forest Ecology and Management, 2002, 159(3): 145-158 DOI:10.1016/S0378-1127(00)00725-8 (  0) 0) |
| [15] |
Chen X Y, Mulder J. Indicators for nitrogen status and leaching in subtropical forest ecosystems, South China[J]. Biogeochemistry, 2007, 82(2): 165-180 DOI:10.1007/s10533-006-9061-3 (  0) 0) |
| [16] |
Qian C, Cai Z. Leaching of nitrogen from subtropical soils as affected by nitrification potential and base cations[J]. Plant and Soil, 2007, 300(1/2): 197-205 (  0) 0) |
| [17] |
鲁如坤. 土壤农业化学分析方法[M].
中国农业科技出版社, 北京, 2000
(  0) 0) |
| [18] |
Lado-Monserrat L, Lull C, Bautista I, et al. Soil moisture increment as a controlling variable of the "birch effect". Interactions with the pre-wetting soil moisture and litter addition[J]. Plant and Soil, 2014, 379(1-2): 21-34 DOI:10.1007/s11104-014-2037-5 (  0) 0) |
| [19] |
Dancer W S, Peterson L A, Chesters G. Ammonification and nitrification of N as influenced by soil pH and previous n treatments[J]. Soil Science Society of America Journal, 1973, 37(1): 67-69 DOI:10.2136/sssaj1973.03615995003700010024x (  0) 0) |
| [20] |
Li L M. Nitrification[M]//Zhu Z L, Wen Q, Freney J R. Nitrogen in soils of China. Netherland: Springer, 1997.
(  0) 0) |
| [21] |
Faeflen J S, Li S W, Xin X P, et al. Autotrophic and heterotrophic nitrification in a highly acidic subtropical pine forest soil[J]. Pedosphere, 2016, 26(6): 904-910 DOI:10.1016/S1002-0160(15)60095-9 (  0) 0) |
| [22] |
姜林, 耿增超, 李珊珊, 等. 祁连山西水林区土壤阳离子交换量及盐基离子的剖面分布[J]. 生态学报, 2012, 32(11): 3368-3377 (  0) 0) |
| [23] |
庄翔宇, 杨金玲, 张甘霖, 等. 亚热带花岗岩地区土壤矿物风化过程中盐基离子的释放特征[J]. 土壤, 2016, 48(2): 374-380 (  0) 0) |
| [24] |
Robison A L, Scanlon T M, Cosby B J, et al. Roles of sulfate adsorption and base cation supply in controlling the chemical response of streams of Western Virginia to reduced acid deposition[J]. Biogeochemistry, 2013, 116(1-3): 119-130 DOI:10.1007/s10533-013-9921-6 (  0) 0) |
| [25] |
Guicharnaud R, Paton G I. An evaluation of acid deposition on cation leaching and weathering rates of an andosol and a cambisol[J]. Journal of Geochemical Exploration, 2006, 88(1-3): 279-283 DOI:10.1016/j.gexplo.2005.08.056 (  0) 0) |
| [26] |
Hartikainen H. Soil response to acid percolation: Acid-base buffering and cation leaching[J]. Journal of Environmental Quality, 1996, 25(4): 638-645 (  0) 0) |
| [27] |
Tian D S, Niu S L. A global analysis of soil acidification caused by nitrogen addition[J]. Environmental Research Letters, 2015, 10(2): 024019 DOI:10.1088/1748-9326/10/2/024019 (  0) 0) |
| [28] |
Zhao W, Cai Z C, Xu Z H. Does ammonium-based n addition influence nitrification and acidification in humid subtropical soils of China?[J]. Plant and Soil, 2007, 297(1-2): 213-221 DOI:10.1007/s11104-007-9334-1 (  0) 0) |
| [29] |
Zhang Y T, He X H, Liang H, et al. Long-term tobacco plantation induces soil acidification and soil base cation loss[J]. Environmental Science and Pollution Research, 2016, 23(6): 5442-5450 DOI:10.1007/s11356-015-5673-2 (  0) 0) |
| [30] |
Xu R K, Coventry D R, Farhoodi A, et al. Soil acidification as influenced by crop rotations, stubble management, and application of nitrogenous fertiliser, Tarlee, South Australia[J]. Australian Journal of Soil Research, 2002, 40(3): 483-496 DOI:10.1071/SR00104 (  0) 0) |
| [31] |
Noble A D, Gillman G P, Ruaysoongnern S. A cation exchange index for assessing degradation of acid soil by further acidification under permanent agriculture in the tropics[J]. European Journal of Soil Science, 2000, 51(2): 233-243 (  0) 0) |
| [32] |
Watanabe T, Ogawa N, Funakawa S, et al. Relationship between chemical and mineralogical properties and the rapid response to acid load of soils in humid Asia: Japan, Thailand and Indonesia[J]. Soil Science and Plant Nutrition, 2008, 54(6): 856-869 DOI:10.1111/j.1747-0765.2008.00316.x (  0) 0) |
2. University of Chinese Academy of Sciences, Beijing 100049, China
 2020, Vol. 52
2020, Vol. 52

