2. 南通穗邦农业科技发展有限公司,江苏海安 226633
盐碱地是地球上广泛分布的一种低产土地类型。由于人类不合理利用,土壤盐渍化问题日益突出,严重制约了农业发展,成为一个广受关注的全球性问题[1]。随着全世界盐渍土面积扩大,可利用耕地面积日益缩减,开发利用盐碱地以补充耕地迫在眉睫[2]。大面积种植耐盐碱植物是可持续改良利用盐碱地的经济有效措施之一[3]。目前我国约有盐碱地3 600 hm2[4],而江苏沿海滩涂总面积达68.7万hm2以上,居全国首位。江苏省每年仍有海岸淤积成为新的滩涂陆地,成为江苏省沿海农业发展的重要后备土地资源[5]。种植耐盐碱经济作物对江苏农业具有重要意义。
藜麦(Chenopodium quinoa)是一种一年生的苋科藜亚科(Chenopodiaceae)藜属双子叶自花授粉植物[6]。主产于秘鲁、玻利维亚和厄瓜多尔,距今已有5 000 ~ 7 000多年的食用种植历史。其籽粒营养丰富,食用价值高,被现代营养学家称为“丢失在远古的营养黄金”[7]。藜麦养育了印加民族,被古代印加人称为“粮食之母”[8]。藜麦具有耐寒、耐旱、耐盐碱、耐瘠薄[9]等特性,对温度和光照条件要求较低[10],具有较高的适应性和丰富的基因多样性,目前已被引种到全球各个不同的气候区[11],我国山西、河北、贵州、青海、甘肃、陕西、浙江等地均有引种栽培。
研究发现,很多藜麦品种能够在类似海水盐度(约30 g/L)的环境下生长,这一特性使得藜麦有望在盐渍化问题严重地区规模化种植[12]。目前,国内对藜麦的研究尚处于起步阶段,研究主要集中于中性盐胁迫,而盐碱混合胁迫方面鲜有报道[4]。本研究旨在阐明混合盐碱胁迫(NaCl和NaHCO3)对不同藜麦品种生长和生理变化的影响,比较其耐盐碱能力差异,为藜麦品种选育以及在江苏滨海盐碱地适应性种植提供理论依据。
1 材料与方法 1.1 供试材料本试验以黑色藜麦品种(YQ001-1)和黄色藜麦品种(HQ01)为试验材料。黑色藜麦种子购自山西太原雨琦生态农业科技有限公司,黄色藜麦种子购自山西华青藜麦产品开发有限公司。
1.2 试验设计选取黑色和黄色藜麦品种饱满种子各100粒。用75%酒精消毒2 ~ 3 min后再用自来水冲洗干净,最后用蒸馏水漂洗2 ~ 3遍,置于垫有湿润滤纸的培养皿中。等到萌芽后(以胚根伸出种皮2 mm为萌芽标准)播种到装有基质,直径10 cm、高10 cm的塑料盆钵中。每盆3穴,每穴3颗种子,正常浇水,待幼苗长至20 cm左右时进行移苗。每品种挑选长势均一的27棵藜麦幼苗转移至容量5 L的塑料桶中进行水培试验,培养液为pH 6.0的IRRI营养液,植株有泡沫板固定。移苗一周后进行盐碱胁迫处理。
盐碱胁迫处理:试验采用完全随机的设计(CRD),每个处理重复3次,处理方式如表 1。为避免盐度冲击效应,以50 mmol/L等分逐步提高NaCl、NaHCO3浓度,每两天一增,直至最终浓度。营养液每2 d更换一次。温室昼夜温度分别控制在(25±1)℃和(20±1) ℃,光照周期为12 h。处理30 d后取全株进行形态指标和生理生化指标测定。
|
|
表 1 处理设计 Table 1 Treatment design |
盐碱胁迫处理30 d后,取出植株,洗净根部,用吸水纸吸干根部和叶片上的水分,将每株植株分为地上部和地下部,分别测定其株高、根长、地上部和地下部分鲜重。然后放置于110 ℃烘箱中杀青10 min,于75 ℃烘至恒重,称其干重。每个指标重复测定3次。
1.3.2 生理生化指标过氧化氢酶(CAT)活性及总抗氧化能力(T-AOC)的测定采用上海索桥生物科技有限公司提供的试剂盒[13-14];离子浓度的测定采用混酸HNO3:HClO4消煮,用ICP测定。每个指标重复3次。
1.4 数据处理与分析所有数据采用SPSS 25.0以及Microsoft Excel 2016软件进行处理、作图和统计分析,数据均为“平均数±标准差”格式。采用邓肯(Duncan)新复极差法进行显著性检验(Two-way ANOVA),不同字母表示在P < 0.05统计差异,采用曲线回归对两藜麦品种进行耐盐碱敏感性分析。
2 结果与分析 2.1 盐碱胁迫对藜麦生长的影响盐碱胁迫明显抑制了天然型藜麦品种生长,主要表现为株高和含水率降低(表 2)。NaCl胁迫下,与对照相比,黑色藜麦株高降低了13.7%、12.1%,黄色藜麦降低了8.9%、21.7%;NaHCO3胁迫下,黑色藜麦株高降低了26.6%、31.5%,黄色藜麦降低了23.0%、30.4%;盐碱混合胁迫下,黑色藜麦株高降低了16.9%、33.1%、23.4%、35.5%,黄色藜麦降低了19.6%、30.4%、19.6%、31.0%,表明黄色藜麦株高受盐碱胁迫抑制作用小于黑色藜麦品种。
|
|
表 2 盐碱胁迫对藜麦幼苗生长的影响 Table 2 Effects of salt-alkali stress on growth of quinoa seedlings |
NaCl胁迫下,黑色藜麦含水率较对照无显著性差异(P > 0.0 5);黄色藜麦含水率则随着盐浓度的上升而升高。NaHCO3胁迫下,黑色藜麦含水率随浓度升高有降低的趋势,分别降低7.76%、15.75%;黄色藜麦含水率和对照无显著性差异(P > 0.05)。混合盐碱胁迫下,黄色藜麦含水率高于黑色藜麦品种。相比于对照,黑色藜麦在S1A2、S2A2处理下分别降低了16.38%、20.16%,黄色藜麦分别降低了7.89%、14.06%,表明盐碱胁迫对黄色藜麦含水率的影响小于黑色藜麦,NaHCO3的胁迫作用大于NaCl。
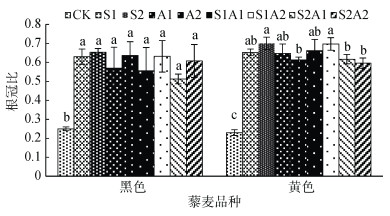
盐碱处理下,两藜麦品种根冠比均显著大于对照(P < 0.05)(图 1)。藜麦根冠比结果表明,盐碱胁迫下,藜麦地上部生长受到的抑制程度明显大于地下部,且黄色藜麦品种较黑色藜麦品种能保持较高的根冠比。
|
(图中小写字母不同表示同一藜麦品种不同处理间差异达到显著水平(P < 0.05),下图同) 图 1 盐碱胁迫对藜麦幼苗根冠比的影响 Fig. 1 Effects of salt-alkali stress on root ratios of quinoa seedlings |
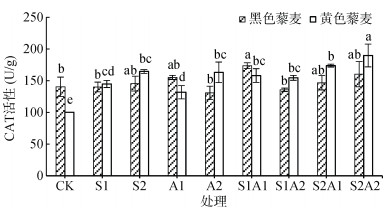
不同盐碱处理对藜麦幼苗CAT活性影响如图 2所示。对照处理中黑色藜麦CAT活性显著高出黄色藜麦40.34%(P < 0.0 5)。NaCl胁迫下,两藜麦品种CAT活性均随盐浓度升高而升高,且黄色藜麦CAT活性更高。NaHCO3胁迫下,黑色藜麦CAT活性随碱浓度上升而降低,而黄色藜麦则相反。在100 mmol/L NaHCO3处理下,黄色藜麦CAT活性显著高于黑色藜麦24.74% (P < 0.05)。盐碱混合胁迫下,黑色藜麦CAT活性在S1A1处理下达到最大值173.73 U/g,是对照的1.24倍,其余处理下均与对照无明显差异(P > 0.05)。黄色藜麦CAT活性在高浓度混合盐碱胁迫下均高于黑色藜麦,在S2A2处理下达到最大值189.77 U/g,是对照的1.90倍,表明黑色藜麦在盐碱胁迫下CAT活性变化不显著(除S1A1处理)(P > 0.05),而黄色藜麦CAT活性显著提高。
|
图 2 盐碱胁迫对藜麦幼苗CAT活性的影响 Fig. 2 Effects of salt-alkali stress on CAT activities of quinoa seedlings |
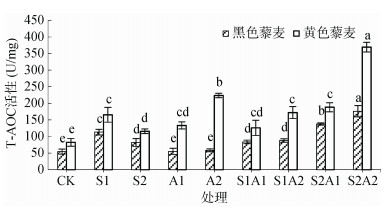
两藜麦品种T-AOC活性与各处理关系如图 3所示。NaCl胁迫下,两藜麦品种T-AOC活性显著高于对照(P < 0.05),随盐浓度上升而降低。黄色藜麦在NaCl浓度梯度下分别高于黑色藜麦46.14%、41.19%。NaHCO3胁迫下,黑色藜麦T-AOC活性相比于NaCl胁迫下明显降低(P < 0.05),但与对照无明显差异(P > 0.05);黄色藜麦T-AOC活性随浓度梯度上升,显著高于黑色藜麦(P < 0.05)。盐碱混合胁迫下,两藜麦品种T-AOC活性均呈现上升趋势,且显著高于对照,S2A2处理T-AOC活性最高,黄色藜麦是黑色藜麦的2.10倍,表明黄色藜麦总抗氧化能力强于黑色藜麦。
|
图 3 盐碱胁迫对藜麦幼苗T-AOC活性的影响 Fig. 3 Effects of salt-alkali stress on T-AOC activities of quinoa seedlings |
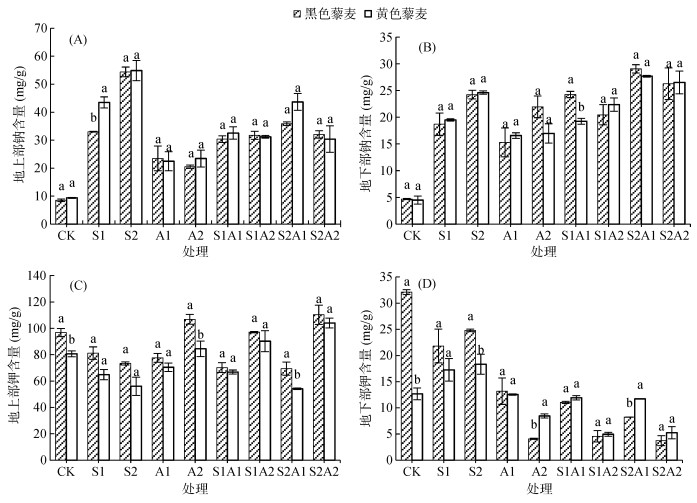
两藜麦品种地上部和地下部Na+浓度如图 4A和4B所示。盐碱处理下,Na+浓度显著上升,且大部分处理下两藜麦品种之间Na+浓度无明显差异(P > 0.05)。NaCl胁迫下,两藜麦品种地上部和地下部Na+浓度均随NaCl浓度上升而上升,且地上部分Na+浓度明显高于地下部分。NaHCO3胁迫下,两藜麦品种地上部Na+浓度随NaHCO3浓度变化不明显。黑色藜麦地上部Na+浓度分别是地下部的1.53倍、1.03倍;黄色藜麦地上部Na+浓度分别是地下部的1.35倍、1.38倍。盐碱混合胁迫下,两藜麦品种地上部Na+浓度随浓度变化不明显,地下部Na+浓度变化幅度也较小。黑色藜麦地上部Na+浓度分别是地下部的1.25倍、1.55倍、1.23倍、1.22倍;黄色藜麦地上部Na+浓度分别是地下部的1.69倍、1.40倍、1.57倍、1.14倍。盐碱胁迫下,两藜麦品种地上部Na+一直高于地下部,表明藜麦的耐盐性与Na+由地下部向地上部的运输有关,保持根部离子平衡有助于提高藜麦耐盐性。
|
(图中小写字母不同表示同一处理不同藜麦品种间差异显著(P < 0.05),下图同) 图 4 盐碱胁迫对藜麦幼苗离子分布的影响 Fig. 4 Effects of salt-alkali stress on ion content distribution in quinoa seedlings |
两藜麦品种地上部和地下部K+浓度变化趋势一致,如图 4C和4D所示。对照处理,两藜麦品种地上部K+含量存在显著性差异(P < 0.05),黑色藜麦比黄色藜麦高20.05%。NaCl处理下,两藜麦品种地上部K+浓度均随NaCl浓度上升而降低,且两品种间无明显差异(P > 0.05);地下部K+浓度随NaCl浓度上升而上升。NaHCO3处理下,两藜麦品种地上部K+浓度随浓度梯度上升,地下部分K+浓度随浓度梯度降低。相比于对照处理,NaHCO3处理下,黑色藜麦地下部分K+浓度分别降低58.93%、87.27%,黄色藜麦分别降低0.93%、33.28%。盐碱混合胁迫下,黑色藜麦地上部K+浓度仅在S2A1下明显高出黄色藜麦28.09%(P < 0.05),其余处理下均无明显差异;地下部两藜麦品种K+都处于较低的浓度。由此表明,低盐胁迫下,藜麦耐盐的关键是保证地下部K+浓度,在高浓度胁迫下,藜麦耐盐的关键是保证地下部往地上部转运K+。
盐碱胁迫下两藜麦品种的K+/Na+如图 5所示。盐碱处理后,两藜麦品种K+/Na+均显著降低,且地上部K+/Na+高于地下部。对照处理黑色藜麦K+/Na+显著高于黄色藜麦(P < 0.05),地上部和地下部分别是黄色藜麦的1.59倍、2.31倍。NaCl处理下,两藜麦品种地上部K+/Na+随浓度上升而降低。100 mmol/L NaCl处理下,黑色藜麦地上部和地下部K+/Na+分别是黄色藜麦1.48倍和1.26倍,这一差异相比于两藜麦品种在对照处理下的K+/Na+明显缩小。NaHCO3处理下,两藜麦品种地上部K+/Na+随浓度梯度上升,且品种间差异不明显(P > 0.05);地下部在A2处理下存在显著性差异(P < 0.05),黄色藜麦是黑色藜麦的2.56倍。盐碱混合处理下,两藜麦品种K+/Na+总体无明显差异(P > 0.05),黄色藜麦地上部K+/Na+在高盐碱浓度的S2A2处理下明显高于黑色藜麦41.18%(P < 0.05),表明相比于对照处理,黄色藜麦K+/Na+降低幅度较黑色藜麦小。
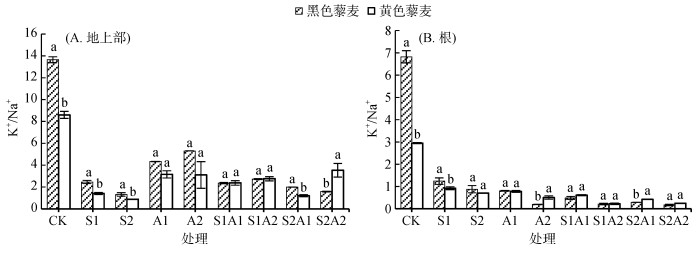
|
图 5 盐碱胁迫对藜麦幼苗离子K+/Na+的影响 Fig. 5 Effects of salt-alkali stress on K+/Na+ in quinoa seedlings |
将所有处理按1到9排序,对两藜麦品种某些指标在不同浓度下的数值做曲线回归分析,并用Excel 2016做趋势线分析。
由图 6A可知,两藜麦品种根冠比在各处理下呈乘幂变化。黑色藜麦(P=0.046)在盐碱处理后整体低于黄色藜麦(P =0.041),表明盐碱处理后黄色藜麦根系活力强于黑色藜麦。由图 6B可知,两藜麦品种T-AOC活性在各处理下呈多项式变化。各处理黑色藜麦(P =0.021)T-AOC活性整体低于黄色藜麦(P =0.040),表明黄色藜麦总抗氧化能力强于黑色藜麦;由图 6C可知,各处理两藜麦品种地下部Na+浓度呈线性关系。黑色藜麦(P =0.020)斜率为1.98,黄色藜麦(P =0.027)斜率为1.85,可见黄色藜麦根部拒盐效应强于黑色藜麦;由图 6D可知,两藜麦品种地下部K+/Na+在各处理下均呈线性关系。黑色藜麦(P = 0.0050)斜率为–0.518 9,黄色藜麦(P =0.024)斜率为–0.224 1,表明黄色藜麦在盐碱处理下地下部K+/Na+变化缓慢,更为稳定。
由此可知,黑色藜麦品种的根冠比、T-AOC、Na+浓度、K+/Na+对盐碱胁迫敏感性强于黄色藜麦品种,黄色藜麦耐盐碱性较黑色藜麦品种强。
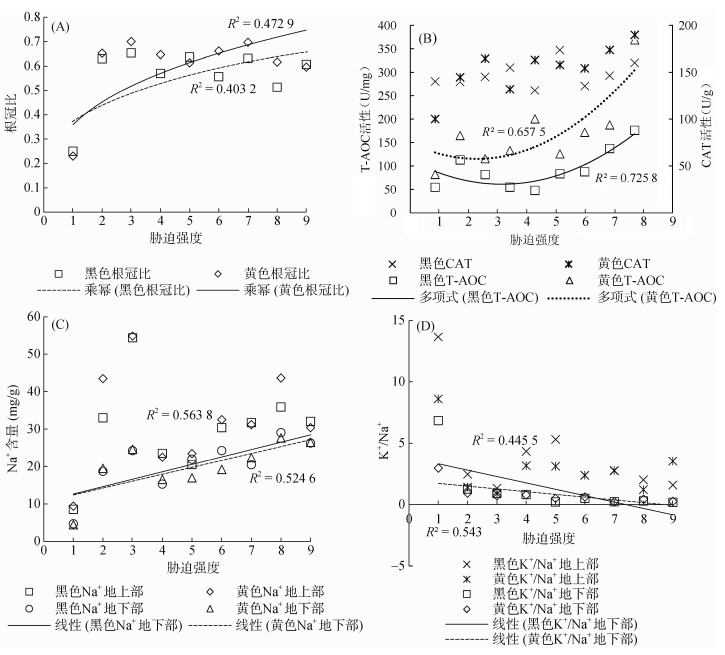
|
图 6 两藜麦品种对盐碱胁迫敏感性分析 Fig. 6 Sensitivities of two quinoa varieties to saline-alkali stress |
植物能否在盐渍环境下建植成功的关键在于其幼苗生长阶段能否适应盐碱环境[15-17]。为应对盐渍逆境,植物一般会通过减缓生长,改变形态、生物量分配格局来维持自身存活[18-21]。目前研究较多的植物种类为小麦[22]、大豆[23]、油菜[24]和一些盐生植物[25]等,对藜麦的研究较少。在本研究中,两藜麦品种的株高均受到盐碱胁迫抑制。黑色藜麦株高最多降低35.5%,黄色藜麦株高最多降低31.0%。这是因为藜麦为应对盐碱胁迫,消耗了大量能量来调节体内的物质代谢,导致用于组织、器官细胞合成的基本能耗不足,结果就是植物地上部生长受到抑制。两藜麦品种根的生长均受到促进作用,这与Jallel等人[26]的发现一致。他们认为这可能是藜麦为了应对高浓度的渗透胁迫而产生的一种应激反应。通过促进根系的生长来增加吸水面积,用以维持地上部的生长[27]。杨发荣等人[28]也发现当盐浓度低于200 mmol/L时会促进藜麦根的生长。
水对植物生命活动有着重要作用,植物水分含量变化可以反映出植物生理状况。本研究中,两藜麦品种各处理下含水率均低于空白处理(NaCl胁迫下与空白处理无明显差异)。因为在盐碱胁迫下,藜麦的水分、离子平衡被改变,地下部分水势降低,水分吸收受阻。此外,在高浓度的盐碱混合胁迫下,藜麦含水率降低较为明显,这与黄瓜[29]等其他作物对盐胁迫的反应类似。
根冠比能够反映植物地上、地下部对盐碱环境的适应性,与植物不同部位的抗性有着密切关系。因此根冠比可以作为藜麦对盐碱胁迫环境适应性的一个重要指标[30]。一般情况下,植物在盐胁迫下根部受到的影响要小于地上部[31],本研究中藜麦根部的生长也验证了这一观点。有研究发现盐胁迫下根冠比的上升是根系对周围环境水势降低的一种反应[32]。在本试验中,两藜麦品种根冠比随着胁迫浓度的上升变化不明显,但显著高于空白处理。这表明相比于地上部,藜麦根部对盐碱胁迫的抗性更强。黄色藜麦品种在盐碱处理下,根冠比高于黑色藜麦,表明黄色藜麦能保持较高的根系活力和体内的水分平衡以适应盐碱环境。
3.2 藜麦抗氧化酶活性对盐碱胁迫的响应在正常情况下,植物体内活性氧(ROS)的产生和清除处于一种动态平衡的状态。逆境胁迫下,植物会积累大量的ROS,如O2–、–OH、H2O2等[33],打破体内自由基的动态平衡[34]。当ROS浓度超过一定范围,就会氧化细胞膜,破坏蛋白质、核酸等,影响植物细胞的正常代谢[35]。因此,植物必须产生有效的抗氧化系统来对抗逆境造成的氧化胁迫。抗氧化酶系统是植物在逆境胁迫下防御自由基氧化损伤最重要的酶促系统[36]。SOD、CAT是植物抗氧化系统中两种重要的保护酶,表征着植物的抗氧化能力,与植物抗性和生态适应性直接相关。相比于非盐生植物,耐盐植物在胁迫环境下的抗氧化酶活性会相对较高[37-38]。谭舒心[39]研究发现,在盐碱胁迫下,随着胁迫浓度的变化,藜麦的SOD活性与对照组并没有显著性差异。而且SOD往往是与CAT协同作用的,所以本文并未对SOD做深入研究。
CAT是植物体内的活性氧清除剂[40].,能够催化H2O2发生歧化反应,降低ROS对细胞的危害作用[41]。本研究中,低浓度盐胁迫下,两藜麦品种CAT活性均随浓度升高而升高以适应盐胁迫。在高浓度的碱胁迫和混合盐碱胁迫下,黑色藜麦品种CAT活性开始下降,但仍高于空白对照,而黄色藜麦品种CAT活性仍处于较高的状态。这一发现与谭舒心[39]的发现一致,她发现在低浓度胁迫下,藜麦可以通过提高CAT的活性来清除H2O2,减少膜脂过氧化物MDA的积累,从而保证细胞正常的生理功能。在高浓度的混合盐碱胁迫下,CAT活性会降低。黑色藜麦品种在高浓度的碱胁迫和盐碱混合胁迫下,CAT活性并没有上升可能就是胁迫程度已经超过了黑色藜麦的忍受阈值,体内的核酸和蛋白质开始被ROS破坏,CAT活性受到了抑制。黄色藜麦CAT活性持续升高表明黄色藜麦对混合盐碱胁迫的忍受阈值较高。
植物总抗氧化能力(T-AOC)代表了植物中各种抗氧化物质和抗氧化酶等构成的总抗氧化水平。本研究中,两藜麦品种各处理下的T-AOC均高于空白处理或与空白处理无明显差异。表明盐碱胁迫下两藜麦体内各种抗氧化物质和抗氧化酶被激活,这与刘建新等[42]和张永峰等[43]分别对燕麦和苜蓿苗期进行胁迫处理得出的结果一致。而黄色藜麦T-AOC高于黑色藜麦也表明黄色藜麦总抗氧化能力较黑色藜麦高。
3.3 藜麦幼苗离子吸收对盐碱胁迫的响应离子毒害一般都是由于Na+积累导致的,会影响作物生长和产量。Na+同时又是众多盐生植物的必需元素,与其抗盐能力密切相关。本研究中,NaCl胁迫下,藜麦吸收大量的Na+,而株高却没受到很大影响,与低浓度胁迫能够促进作物生长[44]这一观点一致。此外,本研究还发现藜麦地上部分的Na+浓度高于地下部分,这一研究结果与谭舒心[39]的发现一致,说明藜麦有严格的控制机制调节Na+的吸收、运输和区域化。低浓度盐胁迫下,两藜麦品种将Na+往地上部运输,而在高浓度的盐碱混合胁迫下,两藜麦品种根部大量积累Na+,表明藜麦在低浓度下将Na+隔离区化于地上部中以保证根部正常生长,而在高浓度盐碱胁迫下将Na+隔离于根部以保证地上部正常生长。
K+是维持植物生长发育的必需元素,也是重要的渗透调节离子,参与多种酶的激活[45]。正常情况下,植物细胞维持较高的K+以保证细胞正常生理功能。本研究中,低浓度胁迫处理下,藜麦地上部K+浓度降低,与低浓度处理下的Na+浓度升高相反;在高浓度的盐碱混合胁迫下,藜麦根部的Na+浓度高于K+浓度。表明藜麦体内Na+和K+存在竞争关系,这主要是因为Na+和K+具有相似的物理化学性质。为避免Na+积累过多而产生的离子毒害作用,维持代谢稳定,细胞质中必须保持低Na+高K+ [46]。在盐碱环境下,大多数植物吸收Na+的同时会抑制K+向地上部分的转运,而盐生植物则不会,其耐盐性与K+/Na+相对浓度有关,因此可以用K+/Na+来衡量藜麦的耐盐碱性[47-48]。本研究中,两藜麦品种在各处理下的K+/Na+虽然显著降低,但地上部分K+/Na+仍然大于1。而在正常情况下,植物胞质中的K+/Na+最小值大约为1[49],可见两藜麦品种在盐碱处理下,均能维持正常的K+/Na+。且在各处理下,两藜麦品种K+/Na+变化幅度均较小。表明两藜麦品种均具有良好的调节机制用以维持细胞内最佳的K+/Na+,这可能是藜麦具有耐盐能力最重要的特征之一[50]。比较地上部分和地下部分的K+/Na+发现,地上部分K+/Na+高于地下部,这有利于满足地上部分的新陈代谢需求。而黄色藜麦更为稳定的K+/Na+数值(降低幅度小于黑色藜麦)表明黄色藜麦拥有更强的离子平衡能力。
4 结论通过研究比较黑、黄两藜麦品种在盐碱胁迫下的生长指标、抗氧化酶系统、无机渗透调节离子的变化,发现两藜麦品种均有耐盐碱能力。黄色藜麦品种在盐碱胁迫下的生长状况、抗氧化酶活性、无机渗透调节机制均优于黑色藜麦品种,所以其耐盐碱能力强于黑色藜麦。这一结论为利用盐碱地种植藜麦以推动盐土农业发展提供了理论依据。
| [1] |
Garcia A. The effects of selection for sodium transport and of selection for agronomic characteristics upon salt resistance in rice (Oryza sativa L.)[J]. Theoretical & Applied Genetics, 1995, 90(7/8): 1106-1111 (  0) 0) |
| [2] |
吕晓, 徐慧, 李丽, 等. 盐碱地农业可持续利用及其评价[J]. 土壤, 2012, 44(2): 203-207 DOI:10.3969/j.issn.0253-9829.2012.02.005 (  0) 0) |
| [3] |
李彬, 王志春, 孙志高, 等. 中国盐碱地资源与可持续利用研究[J]. 干旱地区农业研究, 2005, 23(2): 154-158 DOI:10.3321/j.issn:1000-7601.2005.02.032 (  0) 0) |
| [4] |
杨劲松. 中国盐渍土研究的发展历程与展望[J]. 土壤学报, 2008, 45(5): 837-845 DOI:10.3321/j.issn:0564-3929.2008.05.010 (  0) 0) |
| [5] |
刘友兆, 吴春林, 马欣. 江苏滩涂资源开发利用研究[J]. 中国农业资源与区划, 2004, 25(3): 6-9 DOI:10.3969/j.issn.1005-9121.2004.03.002 (  0) 0) |
| [6] |
王晨静, 赵习武, 陆国权, 等. 藜麦特性及开发利用研究进展[J]. 浙江农林大学学报, 2014, 31(2): 296-301 (  0) 0) |
| [7] |
White P, Alvistur E, Diaz C, et al. Nutrient content and protein quality of quinoa and cafiihua, edible seed products of the Andes Mountais[J]. Agricultural and Food Chemistry, 1955, 3(6): 351-355 (  0) 0) |
| [8] |
杨发荣. 藜麦新品种陇藜1号的选育及应用前景[J]. 甘肃农业科技, 2015(12): 1-5 DOI:10.3969/j.issn.1001-1463.2015.12.001 (  0) 0) |
| [9] |
肖正春, 张广伦. 藜麦及其资源开发利用[J]. 中国野生植物资源, 2014, 33(2): 62-66 DOI:10.3969/j.issn.1006-9690.2014.02.015 (  0) 0) |
| [10] |
李进才. 藜麦的生物学特性及栽培技术[J]. 天津农林科技, 2016(3): 23-26 DOI:10.3969/j.issn.1002-0659.2016.03.011 (  0) 0) |
| [11] |
Sun Y, Jacobsen S E. Quinoa: A multipurpose crop with the ability to withstand extreme conditions in the field[J]. 2013, 8(30): 10.
(  0) 0) |
| [12] |
Prado F E, Boero C, Gallardo M, et al. Effect of NaCl on germination, growth, and soluble sugar content in Chenopodium quinoa Willd. seeds[J]. Botanical Bulletin of Academia Sinica, 2000, 41(1): 27-34 (  0) 0) |
| [13] |
李仕飞, 刘世同, 周建平, 等. 分光光度法测定植物过氧化氢酶活性的研究[J]. 安徽农学通报, 2007, 13(2): 72-73 DOI:10.3969/j.issn.1007-7731.2007.02.031 (  0) 0) |
| [14] |
李培源, 霍丽妮, 苏炜, 等. 总抗氧化能力检测试剂盒(ABTS)法测定江南星蕨的抗氧化活性[J]. 中国实验方剂学杂志, 2011, 17(1): 162-164 DOI:10.3969/j.issn.1005-9903.2011.01.048 (  0) 0) |
| [15] |
马红媛, 梁正伟, 孔祥军, 等. 盐分、温度及其互作对羊草种子发芽率和幼苗生长的影响[J]. 生态学报, 2008(10): 98-105 (  0) 0) |
| [16] |
渠晓霞, 黄振英. 盐生植物种子萌发对环境的适应对策[J]. 生态学报, 2005(9): 261-270 (  0) 0) |
| [17] |
韩润燕, 陈彦云, 周志红, 等. NaCl胁迫对草木樨种子萌发及幼苗生长的影响[J]. 干旱地区农业研究, 2014, 32(5): 78-83 (  0) 0) |
| [18] |
Alaoui-Sossé B, Sehmer L, Barnola P, et al. Effect of NaCl salinity on growth and mineral partitioning in Quercus robur, L., a rhythmically growing species[J]. Trees, 1998, 12(7): 424-430 (  0) 0) |
| [19] |
Grotkopp E, Rejmánek M, Rost T L. Toward a causal explanation of plant invasiveness: Seedling growth and life-history strategies of 29 pine (Pinus) species[J]. American Naturalist, 2002, 159(4): 396-419 DOI:10.1086/338995 (  0) 0) |
| [20] |
Grundmann O, Nakajima J, Seo S, et al. Anti-anxiety effects of Apocynum venetum L. in the elevated plus maze test[J]. Journal of Ethnopharmacology, 2007, 110(3): 406-411 DOI:10.1016/j.jep.2006.09.035 (  0) 0) |
| [21] |
刘正祥, 张华新, 杨升, 等. NaCl胁迫对沙枣幼苗生长和光合特性的影响[J]. 林业科学, 2014, 50(1): 32-40 (  0) 0) |
| [22] |
Datta J K, Nag S, Banerjee A, et al. Impact of salt stress on five varieties of Wheat (Triticum aestivum L.) cultivars under laboratory condition[J]. Journal of Applied Sciences and Environmental Management, 2009, 13(3): 93-97 (  0) 0) |
| [23] |
Dolatabadian A, Sanavy S A M M, Ghanati F. Effect of salinity on growth, xylem structure and anatomical characteristics of soybean[J]. Notulae Scientia Biologicae, 2011, 3(1): 41-45 DOI:10.15835/nsb315627 (  0) 0) |
| [24] |
Tunütürk M, Tunütürk R, Yıldırım B, et al. Effect of salinity stress on plant fresh weight and nutrient composition of some Canola (Brassica napus L.) cultivars[J]. African Journal of Biotechnology, 2013, 10(10): 1827-1832 (  0) 0) |
| [25] |
Adel S, Davoud A, Mohammad P. Studying the effects of salinity stress on the growth of various halophytic plant species (Agropyron elongatum, Kochia prostrata and Puccinellia distans)[J]. World Applied Sciences Journal, 2013, 17(10): 998-1003 (  0) 0) |
| [26] |
Jaleel C A, Gopi R, Sankar B, et al. Studies on germination, seedling vigour, lipid peroxidation and proline metabolism in Catharanthus roseus, seedlings under salt stress[J]. South African Journal of Botany, 2007, 73(2): 190-195 DOI:10.1016/j.sajb.2006.11.001 (  0) 0) |
| [27] |
宋旭丽, 侯喜林, 胡春梅, 等. NaCl胁迫对超大甜椒种子萌发及幼苗生长的影响[J]. 西北植物学报, 2011, 31(3): 569-575 (  0) 0) |
| [28] |
杨发荣, 刘文瑜, 黄杰, 等. 不同藜麦品种对盐胁迫的生理响应及耐盐性评价[J]. 草业学报, 2017, 26(12): 77-88 DOI:10.11686/cyxb2016412 (  0) 0) |
| [29] |
Stepien P, Kobus G. Water relations and photosynthesis in Cucumis sativus L. leaves under salt stress[J]. Biologia Plantarum, 2006, 50(4): 610 DOI:10.1007/s10535-006-0096-z (  0) 0) |
| [30] |
王忠. 植物生理学[M].
中国农业出版社, 北京, 2002
(  0) 0) |
| [31] |
Cheeseman J M. Mechanisms of salinity tolerance in plants[J]. Plant Physiology, 1988, 87(3): 547-550 DOI:10.1104/pp.87.3.547 (  0) 0) |
| [32] |
Levitt J. Responses of plants to environmental stresses[M].
Academic Press, New York, 1980: 3642-3645
(  0) 0) |
| [33] |
张怀山, 赵桂琴, 栗孟飞, 等. 中型狼尾草幼苗对PEG、低温和盐胁迫的生理应答[J]. 草业学报, 2014, 23(2): 180-188 (  0) 0) |
| [34] |
刘海波, 魏玉清, 周维松, 等. NaCl胁迫对萌发期甜高粱和春小麦生理生化特性的影响[J]. 江苏农业科学, 2016, 44(8): 106-111 (  0) 0) |
| [35] |
樊瑞苹, 周琴, 周波, 等. 盐胁迫对高羊茅生长及抗氧化系统的影响[J]. 草业学报, 2012, 21(1): 112-117 (  0) 0) |
| [36] |
Hernández J A, Jiménez A, Mullineaux P, et al. Tolerance of pea (Pisum sativum L.) to long-term salt stress is associated with induction of antioxidant defences[J]. Plant Cell & Environment, 2000, 23(8): 853-862 (  0) 0) |
| [37] |
Hernández J A, Corpas F J, Gómez M, et al. Salt-induced oxidative stress mediated by activated oxygen species in pea leaf mitochondria[J]. Physiologia Plantarum, 1993, 89(1): 103-110 (  0) 0) |
| [38] |
Gueta D Y, Yaniv Z, Zilinskas B A, et al. Salt and oxidative stress: Similar and specific responses and their relation to salt tolerance in Citrus[J]. Planta, 1997, 203(4): 460-469 DOI:10.1007/s004250050215 (  0) 0) |
| [39] |
谭舒心.混合盐胁迫下藜麦生理特性的研究[D].长春: 东北师范大学, 2017.
(  0) 0) |
| [40] |
陈宝悦, 曹玲, 王艳芳, 等. NaCl胁迫对芹菜生长、生理生化特性及品质的影响[J]. 华北农学报, 2014, 29(s1): 218-222 (  0) 0) |
| [41] |
李波, 赵洪波, 杨蔚然, 等. NaHCO3胁迫对苜蓿苗期适应性的影响[J]. 种子, 2010, 29(2): 22-25 (  0) 0) |
| [42] |
刘建新, 王金成, 王瑞娟, 等. 燕麦幼苗活性氧代谢和渗透调节物质积累对NaCl胁迫的响应[J]. 生态学杂志, 2012, 31(9): 2255-2260 (  0) 0) |
| [43] |
张永峰, 殷波. 混合盐碱胁迫对苗期紫花苜蓿抗氧化酶活性及丙二醛含量的影响[J]. 草业学报, 2009, 18(1): 46-50 DOI:10.3321/j.issn:1004-5759.2009.01.007 (  0) 0) |
| [44] |
Zhu J K. Regulation of ion homeostasis under salt stress[J]. Current Opinion in Plant Biology, 2003, 6(5): 441-445 DOI:10.1016/S1369-5266(03)00085-2 (  0) 0) |
| [45] |
Marschner H. 16-Adaptation of plants to adverse chemical soil conditions[J]. Mineral Nutrition of Higher Plants, 1995, 596-680 (  0) 0) |
| [46] |
Von C S. Photosynthetic capacity is related to the cellular and subcellular partitioning of Na+, K+ and Cl- in salt-affected barley and durum wheat[J]. Plant Cell & Environment, 2006, 29(12): 2185-2197 (  0) 0) |
| [47] |
Shi D, Wang D. Effects of various salt-alkaline mixed stresses on Aneurolepidium chinense (Trin.) Kitag[J]. Plant & Soil, 2005, 271(1/2): 15-26 (  0) 0) |
| [48] |
Kaiser W M. Effects of water deficit on photosynthetic capacity[J]. Physiologia Plantarum, 1987, 71(1): 142-149 DOI:10.1111/j.1399-3054.1987.tb04631.x (  0) 0) |
| [49] |
乔慧萍, 李建设, 雍立华, 等. 植物盐胁迫生理及其适应性调控机制的研究进展[J]. 宁夏农林科技, 2007(3): 34-36 DOI:10.3969/j.issn.1002-204X.2007.03.016 (  0) 0) |
| [50] |
Shabala S, Cuin T A. Potassium transport and plant salt tolerance[J]. Physiology Plant, 2008, 133(4): 651-669 DOI:10.1111/j.1399-3054.2007.01008.x (  0) 0) |
2. Nantong Suibang Agricultural Science and Technology Development Co., Ltd., Haian, Jiangsu 226633, China
 2020, Vol. 52
2020, Vol. 52


