2. 南京农业大学资源与环境科学学院土壤生态实验室,南京 210095
随着全球化、信息化、智能化等人类文明进程模式的快速升级与更迭,大量尚未被安全化处置的人类家庭生活、医疗、化工、农业等生产运行过程中产生的毒害废弃物,会经过各种直接或间接途径进入土壤生态环境系统中[1-3],致使土壤成为滋生、残留和传播人畜共患致病细菌重要的源和汇[4-5],给人体健康、生态环境安全和社会经济可持续发展带来了极大的风险和隐患[6-7],是亟需解决的新型生物污染土壤问题[8-9],开展针对性的治理研究十分必要。由于细菌噬菌体(bacteriophage或phage)具有较为专一的寄生、捕食和裂解宿主细菌的特性[10-11],采用噬菌体疗法(phage therapy)靶向追踪削减土壤生态环境系统中多种致病细菌的方式是一种具有广泛应用潜力的绿色生物管控技术[12],目前已得到国内外学者的高度重视,正成为致病细菌生物污染土壤防治领域内新的研究热点。
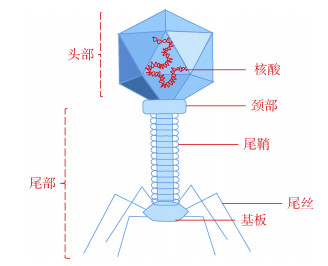
1 噬菌体疗法简介 1.1 噬菌体的分类细菌噬菌体(简称噬菌体)是一类较为专性“捕食”活细菌的生物体,分类上属于病毒的一种[13-14]。其生化结构主要由蛋白质衣壳(60%)和核酸(40%)组成,无完整成熟的细胞结构[15]。如图 1所示,噬菌体内核酸遗传物质存在于正多面体的蛋白头壳之中,通过颈圈的衔接将头壳与尾鞘、尾管相连,并在尾管底部形成基盘、尾丝与尾钉,用于噬菌体在环境中捕猎和侵染宿主细菌[16-18]。在透射电镜下观察,噬菌体长度通常在20 ~ 200 nm,同时噬菌体也是地球上物种丰度最高的微小生物体,在土壤、水、空气乃至人/动物体表或肠道内都广泛分布了大量种类繁多的噬菌体[19-20]。据估算其总数量约在1031数量级,总质量约109 t,每秒噬菌体侵染宿主细菌的数目约在1023 ~ 1025 CFU[21-23]。根据其形态结构特点,可将其划分为有尾噬菌体、无尾噬菌体和丝状噬菌体3种类型[24]。目前已知噬菌体的核酸类型主要为双链dsDNA(长度约由5×103 ~ 5×106碱基对组成),少部分遗传物质以单链ssDNA、双链dsRNA或单链ssRNA存在[25]。此外,根据噬菌体在侵染宿主过程中是否将自身DNA整合到细菌基因组上的差异,又可将噬菌体划分为烈性噬菌体(lytic phage)和温和噬菌体(temperate phage)[26]。其中烈性噬菌体会在环境迁移过程中识别宿主细菌细胞膜表面特异性结合位点并进行配对吸附,随后噬菌体尾鞘收缩,核酸通过空心的尾部将自身DNA注入宿主细菌体内,执行侵入过程,接着细菌染色体将会被水解酶迅速断裂水解,此时噬菌体DNA将利用宿主体内的核酸碱基对和能量物质,快速完成自身核酸复制和蛋白质合成,进而在细菌体内装配和增殖大量子代噬菌体,并释放细胞壁溶壁酶,致使宿主细菌破裂死亡,最终完成裂解释放的过程[27]。温和噬菌体在执行完上述DNA的侵入过程后,并不会迅速增殖或裂解宿主细菌,而是将自身DNA通过整合酶系统融合到宿主细菌的染色体上,或以质粒的形式存在于宿主体内,并伴随着宿主的复制和增殖,稳定遗传[28]。通常只有在受到外界环境介质中干扰因子(如:紫外线、高温、电离辐射、抗生素、重金属、丝裂霉素C、养分胁迫、氧化还原条件骤变)的影响下,才会再次转入烈性噬菌体的增殖循环过程[29]。
|
图 1 常见烈性噬菌体结构示意图 Fig. 1 The structural sketch of bacteriophage |
由于世界范围内存在抗生素的滥用及其他共存污染物(如:重金属、农药、消毒剂、氧化剂、过量氮/磷元素等)的同步筛选作用(co-selection)[11-14, 17],土壤环境已成为抗生素抗性细菌(antibiotic resistance bacteria,ARB)和抗性基因(antibiotic resistance genes,ARGs)重要的“源”和“汇”[30-32]。由于ARGs具有快速传播和扩散的能力,土壤生态环境系统中致病细菌获得并表达抗性的频率显著增加[33-35];当前由于新型抗生素药物的研发周期远落后于环境中抗性致病细菌自然突变和进化的速率,甚至土壤环境中已检测出多重抗药性(multidrug resistant, MDR)的超级耐药细菌,这使得抗性致病细菌在土壤-微生物-植物(作物)-动物-人类等多元食物网中的传播扩散风险日益严重[36-38]。因而,噬菌体疗法获得了医学和生态环境领域内科学家的极高重视。噬菌体疗法是指通过筛选、纯化和富集特定宿主致病细菌的专属性烈性噬菌体,向致病细菌污染的生态环境介质(土壤、水体或植物)中添加特定噬菌体菌液,定向侵染并灭活致病细菌的治疗方式[10-12]。由于噬菌体具有相对特异性侵染某一种(species)或同一属内(genus)几种高度同源性宿主细菌的特点,因而噬菌体疗法具备天然的靶向性和追踪性,不会对目标致病细菌以外的其他健康细菌群落产生直接或迅速的灭活作用,这也是相较于传统广谱性抗生素疗法的优点之一[13-15, 39-40]。此外,噬菌体疗法往往采用最佳感染复数值来灭活目标致病细菌,而在最佳感染复数条件下活体噬菌体的初始接种量通常是目标致病细菌数量的0.01% ~ 10%,并且由于单个噬菌体主要在宿主细菌体内完成增殖、裂解和指数倍释放子代噬菌体的生理过程,因而噬菌体疗法的初始接种量一般较低[23-28]。同时由于噬菌体疗法还兼具一定的自限性,即当目标致病细菌被噬菌体灭活至在整个细菌群落中不显著表达致病能力或不占据主导生态位时,噬菌体的数量也将随之锐减,仅保留部分低丰度活性的噬菌体,用于维持对目标致病细菌的持续灭活压力和维持噬菌体的生物多样性[17-24]。
2 噬菌体疗法在土壤环境系统中靶向灭活致病细菌的应用 2.1 功能噬菌体的分离、筛选、鉴定和生物学特性表征针对特定的致病细菌分离和筛选专属高效烈性噬菌体,是噬菌体疗法在生物污染土壤环境系统中应用的前提条件。针对目标致病细菌,从土壤中分离筛选专属性噬菌体的方法主要是先富集培养并提取土壤中总微生物溶液,随后经过细菌滤器的过滤分离,采用双层琼脂平板法进行粗筛,以平板上出现噬菌斑(plaque)为依据,挑选直径较大、菌斑清晰、中间透明、边缘均匀的单斑,进行重复多次纯化和富集,获得纯度较高的噬菌体溶液[13-16],最后对获得的噬菌体进行表型和基因型的定性定量鉴定表征。通常使用磷钨酸负染法,在透射电镜下观察噬菌体形态,并依据2016年国际病毒分类委员会(International Committee on Taxonomy of Viruses)第十次报告中噬菌体分类与命名标准,结合形态特征初步定性划分至“科”级别[41]。接着对噬菌体核酸进行提取,使用多种核酸限制性内切酶,判断噬菌体核酸是单链或双链DNA或RNA类型,并估算噬菌体基因组大小[23-25]。再进一步通过鸟枪法对噬菌体DNA进行文库构建,并通过高通量全基因组测序技术获得噬菌体碱基序列,随后在美国国立卫生研究院网站上利用开放阅读框(open reading frame, ORF)查询软件对ORF中潜在基因长度、密度和功能进行分析和预测,完成系统发育树的鉴定和描绘,进而更为准确地鉴定噬菌体基因型分类特征[14-19]。
此外,噬菌体裂解目标宿主致病细菌的生物学特性也是其能否合适于噬菌体疗法应用的重要参考。外界环境因子(pH、离子浓度、温度和光照条件等)可能会对噬菌体裂解宿主细菌的活性产生影响,并且噬菌体的最佳感染复数值(即:在纯培养条件下,可获得最多子代噬菌体,而确定的噬菌体与宿主细菌最佳接种数量比例)需要进行优化探明[42-43],同时测定噬菌体一步生长曲线,明确噬菌体潜伏期、裂解期和稳定期的时长及宿主细菌抗逆噬菌体的突变频率,再以目标致病细菌的灭活数量级来综合表征噬菌体的裂菌效果[44]。通常选取对环境因子耐受性强、灭活宿主细菌能力高、不含有毒力因子,且宿主细菌抗逆突变频率低的噬菌体作为实际应用中的备选生物材料[45]。
2.2 噬菌体疗法在土壤-植物体系中灭活致病细菌的应用噬菌体疗法最初主要应用在医学领域中人类感染相关致病细菌而进行的疾病治疗。近来年在土壤-植物(作物/蔬菜/果树)体系中引入“农业噬菌体疗法”(agricultural phage therapy)的概念来灭活致病细菌的研究也得到了长足发展。使用农业噬菌体疗法在土壤-植物体系中靶向灭活青枯雷尔氏菌(Ralstonia solanacearum)的研究已有较多报道[46-48]。Askora等[43]从农田土壤中分离纯化得到4株专性针对青枯雷尔氏菌的噬菌体(φRSL,φRSA,φRSM和φRSS),随后将噬菌体原液在植物根系周边土壤中直接进行灌根处理或在距离土壤表面1 cm内的植物主茎中注入噬菌体原液,发现处理后西红柿和烟草生长过程中青枯菌发病概率和病害程度显著降低,有效消减了青枯菌残留丰度;Fujiwara等[47]将西红柿种子在分离筛选出的高效噬菌体φRSL1原液中进行浸泡预处理后发现,在西红柿生长期的4个月内,土壤根区中噬菌体φRSL1可显著抑制根区土壤中青枯雷尔氏菌向西红柿根系的侵染过程,并且在西红柿茎叶中也检测到稳定丰度和活性的噬菌体φRSL1,说明噬菌体疗法在土壤-植物体系病害细菌防治过程中具有一定的自主靶向迁移性,接种至土壤中的噬菌体不仅可以有效抑制植物根系周边致病细菌爆发的风险,而且还可以进入植物组织内部长期维持追踪灭活植物内生致病细菌的能力。Frampton等[49]从猕猴桃果园土壤中分离筛选出275株有尾噬菌目(Caudovirales)噬菌体,并通过进一步基因组鉴定,确定其主要隶属于肌尾噬菌科(Myoviridae)、短尾噬菌科(Podoviridae)和长尾噬菌科(Siphoviridae)噬菌体,发现这些噬菌体大多具有专性灭活猕猴桃果树中植物病害菌丁香假单胞菌(Pseudomonas syringae pv. actinidiae)的能力。Meczker等[50]从已受到解淀粉欧文菌(Erwinia amylovora)毒害作用的苹果园土壤中,分离筛选出多种长尾科(Siphoviridae)家族的噬菌体,并进行了全基因测序和亲缘分析,指出在果树病害爆发的土壤中就近筛选目标噬菌体,可以为靶向灭活植物病害细菌提供巨大的“武器”资源库。Chae等[51]从淹水水稻土中分离筛选出34株噬菌体,其中29株属于肌尾噬菌科(Myoviridae)家族,并研发出使用脱脂奶粉负载噬菌体喷施在水稻表面的方式,既可以有效杀灭水稻中细菌性叶疫病菌(Xanthomonas oryzae pv. oryzae),又可以减少自然条件下日光紫外线对噬菌体疗法效果的负面作用。
在农业噬菌体疗法的规模化运用上,西方国家大多制定了较为严苛的法律条文,但在一些特殊法案的规定下,噬菌体疗法公司近年来也得到了显著发展。在美国部分州市地方政府的授权下,盐湖城市、圣地亚哥市、巴提摩尔市、帕罗奥图市都已探索性成立并专营产业化的“噬菌体疗法”生物公司(AmpliPhi公司、Intralytix公司、Omnilytics公司、Gangagen公司等),他们根据在土壤上种植西红柿、辣椒、葡萄等过程中出现的典型病害细菌,研发了“从农场土壤到科技公司,再回归到农场作物”的及时诊断、量身研发、针对性治疗的运营模式,在使用噬菌体疗法防治土壤-作物体系中病害细菌问题的解决方案上积累了许多成功的经验。此外,针对某些人类治病细菌在作物生长过程中也会从土壤介质不断迁移定殖在作物组织内的风险,此类科技公司也研发了可以定向灭活作物组织中大肠杆菌(E. coli)、沙门氏细菌(Salmonella)、志贺氏杆菌(Shigella)、李斯特菌(Lysteria)、铜绿假单胞菌(Pseudomonas aeruginosa)、肠球菌(Enterococcus)、链球菌(Streptococcus)等人类致病细菌的噬菌体疗法田间技术与产品。此外,由于医疗理念和学科发展的不同,相较于西方国家,俄罗斯和格鲁吉亚关于农业噬菌体疗法的应用研究和公司运营及发展现状则更为活跃。如俄罗斯Immunopreparat Research Productive Association公司、格鲁吉亚Biochimpharm公司和Phage Therapy Center等都是世界著名的农业噬菌体疗法中心。
然而,在我国噬菌体疗法大多仍处于实验室或田间的基础研究阶段,尚未有专营的公司进行市场化或规模化的应用实例。农业噬菌体疗法在我国土壤-植物领域内的研究和应用早在20世纪80年代就已有科学家进行相关探索和尝试。许志纲等[52]从水田中成功分离获得24株针对水稻细菌性叶疫病菌的噬菌体,堵鹤鸣等[53]从桑树病田土壤中分离筛选出29株针对桑叶疫病菌(Pseudomonas mori)的噬菌体,他们对分离出的噬菌体都进行了初步的生物学特性鉴定和表征。近年来苏靖芳等[28]、马超等[54]、刘俊丽[55]、高苗[56]也主要围绕土壤-植物(马铃薯、西红柿、烟草、果树、烟草)体系中青枯雷尔氏菌、猕猴桃溃疡病菌开展了一系列噬菌体疗法的生物防控研究工作。上述研究为开发我国土壤中噬菌体疗法的资源库存奠定了重要基础。
2.3 噬菌体疗法在土壤-动物体系中灭活致病细菌的应用早在科学家Felix d’ Herelle首次发现噬菌体后,科学界就一直尝试将其用于动物细菌性感染的治疗,但由于当时对噬菌体的特征及本质缺乏了解,早期的动物噬菌体疗法研究结果混乱,重复性也较差,并未受到其他医学同行的认可。直到20世纪80年代,随着细菌抗生素耐药性的日趋严重,噬菌体疗法才重新受到重视,美国FDA也在2006批准使用噬菌体控制肉类产品中的李斯特菌[57]。我国对于噬菌体疗法在动物细菌性疾病防治的研究主要从21世纪初开始,针对于不同动物细菌感染已有较多成功的报道,如利用噬菌体控制动物沙门氏菌、弯曲杆菌(Campylobacter)、大肠杆菌、产气荚膜梭菌(Clostridium perfringens)、金黄色葡萄球菌(Staphylococcus aureus)等[58]。同时,使用噬菌体疗法在土壤-动物体系中靶向灭活致病细菌的研究也有较多成功报道。张利军[59]从土壤中分离得到烈性噬菌体φ03Z-1,在30代传代培养之后仍对生物武器类碳疽芽孢杆菌(Bacillus anthracis)和短小芽孢杆菌(Microbacillus)有很好的裂解效应,同时发现φ03Z-1对于土壤样本中的类炭疽芽胞杀灭率可达到60.3% ~ 92.1%。李存香[60]从我国云南省鼠疫疫源地土壤中分离出肌尾科鼠疫噬菌体φYL060,对其宿主鼠疫疫苗株EV76具有很好的裂解效果。针对牛类细菌感染的噬菌体疗法研究主要集中在金黄色葡萄球菌感染导致的牛乳腺病以及分枝杆菌感染引起的牛结核病等。苏胜兵[61]从12头感染牛和6头健康牛的唾液和鼻黏液及50份土壤样本中分离纯化得到18株噬菌体,其中一株噬菌体CJAUS9能够以模式菌株耻垢分枝杆菌(Mycobacterium smegmatis)mc2155为宿主菌,具有治疗土壤及牛体内结核致病细菌的潜在效应。
2.4 噬菌体疗法在土壤-地下水体系中灭活致病细菌的应用土壤-地下水系统是指包括从地表土壤顶部延伸至地下水位的非饱和区(vadose zone)及包气带下边缘地下水的饱和区(phreatic zone)。它是一个非均质组成、非均相渗透性的体系,非饱和区具有土壤层理化性质,上连大气,下接饱和区,有较好的连通性,因而致病细菌可以在土壤-地下水系统中迁移扩散并滋生定殖。Forslund等[62-63]发现,使用含有沙门氏细菌(Salmonella Senftenberg)、空肠弯曲杆菌(Campylobacter jejuni)、大肠杆菌(Escherichia coli O157:H7)的地下水进行农田回溉时,土豆食品安全会受到致病细菌的污染,但如果在滴灌水系统中添加特异性噬菌体不仅可以有效监测3类宿主细菌在农田土壤-地下水中的迁移及赋存状态,评估污染状况,还可以在土壤中靶向灭活致病细菌,大幅减少致病细菌向地下水的迁移扩散风险。
3 噬菌体疗法对土壤生态环境系统的影响噬菌体是严格的细菌内寄生生物体,其复制循环对于土壤宿主种群、群落相互作用、元素循环、抗生素抗性基因传播扩散等都有重要影响。但目前对于噬菌体对生态系统功能的影响主要集中在海洋生态系统中,对于土壤环境的研究还较为缺乏。
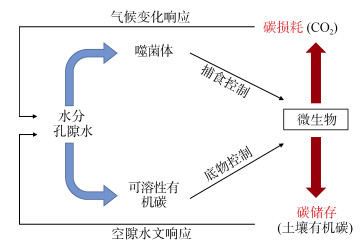
3.1 噬菌体疗法对土壤微生物群落及养分循环的影响土壤噬菌体群落动态非常活跃,且对宿主菌的变化动态反应迅速。由于具备这些特性,噬菌体对于土壤微生物种群具有潜在的由上而下的控制,从而进一步影响由微生物调控的土壤养分循环过程[57]。水体环境中10% ~ 50%的细菌死亡是由噬菌体裂解引发的,且裂解后的产物会被活细菌利用来刺激自身生长,因而噬菌体数量的增加通常伴随着细菌的生长速率提高。土壤环境中由噬菌体裂解释放驱动的碳循环,主要遵循图 1中“细菌-噬菌体-溶解性有机碳循环”规律,即所谓的噬菌体回路。如图 2所示,可分解碳循环过程能够将溶解性有机碳持留在水体表面,否则可能会导致溶解性有机碳转化成为大气CO2。类似循环也会发生在土壤环境中,大气CO2由植物光合作用固定后变成新鲜的有机碳输入到土壤中,随后这些有机碳被土壤微生物矿化,通过细胞呼吸作用转化为生物量碳或部分转化为惰性更强的矿物结合态。通过裂解作用,土壤噬菌体可以增加易分解碳的含量并降低其他矿质结合态有机质组分的比例。
|
图 2 土壤中碳转化的top-down(噬菌体捕食)及bottom-up(物理基质有效性)控制途径概念模型 Fig. 2 Conceptual models of control pathways of top-down (phage predation) and bottom-up (physical substrate availability) in soil carbon transformat ion |
除了碳循环之外,土壤环境中噬菌体对其他营养元素的循环过程可能也有重要影响,如氮元素(蛋白质及核酸)、硫元素(蛋白质)、磷元素(多磷酸盐、细胞膜、核酸)[57, 64]。其中根瘤菌噬菌体对于豆科-根瘤菌共生的影响可能会间接影响到土壤氮元素的流通量。研究发现[65-66],根瘤菌噬菌体添加到农田土壤中后会显著降解噬菌体敏感根瘤菌的结瘤效果,且不同噬菌体根瘤菌-宿主菌相互作用对不同土壤中根瘤菌种群的影响并不一致,如固氮根瘤菌的定殖、结瘤的成败、共生效果及固氮率。因而为了建立更加精确的全球元素循环概念模型,很有必要探明烈性噬菌体对于土壤中养分转化速率的贡献。
除了烈性噬菌体,土壤中还存在大量的溶原性细菌,即温和噬菌体将DNA整合到宿主菌基因组中与宿主菌共存的现象。已有数据表明至少40%的土壤细菌体内含有前噬菌体(prophages),因而温和噬菌体与宿主菌共生的现象在土壤环境中广泛存在[67-68]。通过寄生在宿主菌细胞内,温和噬菌体可以调节宿主菌的代谢,例如温和噬菌体能够编码转录的调节蛋白,使噬菌体裂解基因表达沉默,这一蛋白能够与宿主染色体上的同源基因结合,使宿主细菌的代谢功能下调从而降低能量消耗[69]。当土壤中养分供应不足时,这一过程会直接影响到宿主的生存。此外,其他一些前噬菌体编码基因能够保护宿主菌免受其他噬菌体的侵染,或通过改变宿主表型(溶原性转变)来改变宿主的适应能力[70]。
3.2 噬菌体疗法对土壤环境中抗性基因扩散传播的影响由于抗生素在医疗和畜禽养殖业的广泛使用,大量残留抗生素进入土壤环境中,造成土壤中抗生素抗性细菌(ARB)和抗性基因(ARGs)的产生,会加速ARGs的传播和扩散,并可通过食物链传递作用,对人体健康和生态环境安全带来巨大威胁。接合、转导及转化是导致土壤环境中ARGs水平转移及扩散的主要机制,其中的转导作用是由噬菌体所介导产生的。越来越多的研究者开始关注噬菌体在土壤环境ARGs传播扩散中所起的重要作用[71-72]。
产志贺毒素的大肠杆菌(Shiga toxin-producing Escherichia, STEC)O157:H7是一种重要的食源性致病菌,国际上已有多起食用O157:H7感染食物所导致的中毒事件报道[72]。已有研究发现从畜禽养殖场中分离的STEC菌株中能够监测到多种如链霉素、磺胺类、四环素类、氨苄青霉素类的ARGs等[73-74]。已有实验室研究发现大肠杆菌中ARGs能够在噬菌体介导的转导作用下进行快速水平转移。例如Shousha等[75]研究了从零售鸡肉中分离的243株大肠杆菌噬菌体,发现其中24.7%的噬菌体,能够将至少1种ARGs转导至大肠杆菌ATCC13706细胞内。虽然现有研究尚未观察到ARGs在噬菌体介导作用下在STEC之间发生水平转移,但已有结果明确证实了Stx噬菌体能够将抗生素敏感大肠杆菌转化为抗性菌体[72]。因此,可以合理推测出噬菌体介导的转导作用能够促使ARGs在不同产Stx大肠杆菌血清型中进行水平转移。
此外,前人研究发现噬菌体类型通常能够与ARGs类型对应起来[76-79]。例如Ziebell等[76]对加拿大的187株STEC O157:H7特征进行研究,发现其中45株具有对链霉素、磺胺、四环素的抗性;而在这45株抗性菌株中,43株O157:H7的噬菌体属于以下3种噬菌体类型:PT23、PT45、PT67,初步证明了噬菌体在ARGs扩散传播中发挥了潜在强化的作用。Köhler等[77]在实验室研究中发现,猪养殖业的抗菌素卡巴多司(0.5 ~ 8 mg/kg)能够使大肠杆菌C600诱导产生溶原性Stx-噬菌体933W,由于溶原性Stx-噬菌体933W能够通过转导作用对四环素抗性基因产生水平传播,因此卡巴多司的使用引起了广泛的关注。上述溶原性噬菌体一旦释放到环境后,很有可能将其携带的ARGs转移至牛或猪肠道的致病菌中,如O157:H7或沙门氏菌,从而进一步污染环境中的农作物,并最终威胁到人体健康。
在过去20年间,全球范围鼠伤寒沙门氏菌多重抗药性的检出率逐渐上升,由1994年的27%上到2010年的58%[78]。与此同时,以鼠伤寒沙门氏菌DT104为宿主的噬菌体,其多重抗性比例也呈现出指数增长。研究人员发现噬菌体PDT17和ES18均能通过转导作用将ARGs由抗性DT104转导进入抗生素敏感DT104菌株中[79]。Bearson等[80]同样发现卡巴多司能够诱导沙门氏菌产生噬菌体,使其由抗生素敏感菌株转变为抗性菌株。此外,Zhang等[81]研究发现沙门氏菌P24噬菌体能够作为载体将多重抗药基因从海德堡沙门氏菌(S. heidelberg)(S25)转导进入鼠伤寒沙门氏菌(S. typhimurium)中。上述研究证实了噬菌体介导的转导作用在抗性基因扩散传播过程中具有一定作用,考虑到噬菌体在土壤中的高丰度,可作为ARGs重要的储存库所,其介导的转导作用对于ARGs扩散传播作用依然不可忽视。因此,今后在运用噬菌体疗法的同时应考虑如何降低对ARGs转导作用的扩散风险。
3.3 影响噬菌体疗法在土壤生态环境中应用效果的因素 3.3.1 土壤温度根据最适生长/致死温度,土壤细菌通常分为嗜冷菌、嗜热菌和中温菌。与此对应,土壤中噬菌体的存活/失活也同样与温度密切相关,但并非一定与其宿主细菌生存温度一一对应。根据前人研究结果,温度是土壤中噬菌体能否存活的决定性因素,例如土壤中嗜热脂肪芽胞杆菌(Geobacillus stearothermophilus)噬菌体在45℃时丰度最高,而在55℃时其繁殖显著降低[82]。此外,Tan和Reanney[83]在土培试验中发现与30℃、37℃、55℃相比,环状芽胞杆菌(Bacillus circulans)噬菌体在45℃条件下生长状况最好。而Moce-Llivina等[84]研究发现脆弱拟杆菌(Bacteroides fragilis) RYC 2056噬菌体比其宿主对于温度的抵抗能力更高,甚至能在60 ~ 80℃条件下存活。
3.3.2 土壤pH土壤pH不仅影响宿主细菌的生长,还会影响噬菌体的存活状况。Sykes等[85]从不同pH土壤中分离出5种嗜中性链霉菌(Streptomyces neutrophilus)和3种嗜酸性链霉菌(Streptomycetes acidophilic)为宿主菌的噬菌体,发现当土壤pH < 6.0时,尽管嗜酸性链霉菌仍然存在,却无法分离出以其作为宿主的噬菌体。Sykes和Williams[86]研究还发现一株自由态放线菌噬菌体在pH 4.9时会失去对其宿主菌的侵染能力,认为土壤环境酸度升高会显著影响噬菌体-宿主相互作用过程的吸附、穿透和潜伏期长度。此外,土壤pH对于噬菌体的存活还有间接的影响效果。土壤固体颗粒对于噬菌体的常见吸附作用会导致其存活期变长,这是由于作为疏水性胶状物质的噬菌体在土壤固体颗粒上的吸附行为,是由土壤表面电位性质及体系pH决定的。
3.3.3 土壤质地通常认为黏土矿物能够保护噬菌体免受土壤生物及生物因素的干扰而失去活性,从而即使在缺乏宿主菌的情况下仍能存活较长时间。Straub等[87]将噬菌体φMS2及PRD-1连同活性污泥一起施入亚利桑那的沙漠土壤中发现,在黏壤中两种噬菌体的存活时间显著大于砂壤。Babich和Stotzky[88]在自然条件、灭菌及过滤处理下,对湖水中金黄色葡萄球菌RN450噬菌体φ11M15的灭活效果进行研究,发现凹凸棒和蛭石存在时,噬菌体的灭活效果远低于蒙脱石及高岭石存在时的效果,说明黏土矿物的类型及含量对于噬菌体的存活具有显著的响应。此外,Roper等[89]研究还发现蒙脱石的粒径大小对于噬菌体的侵染能力也有显著影响,发现只有当蒙脱石粒径 > 0.6 μm时才能使得噬菌体完全失去裂解大肠杆菌的能力。由上述前人研究可知,黏土矿物的类型及粒径大小均对噬菌体在土壤中的存活、侵染及裂解宿主的能力有显著影响。
3.3.4 有机质含量(营养状况)Delisle和Levin[90]研究了培养基成分对腐败假单胞菌(Pseudomonas putrefaciosa)噬菌体噬菌斑形成的影响,发现在TSB培养基中添加草酸盐能够抑制噬菌体的形成,说明营养成分,如土壤类型会显著影响噬菌体对宿主菌的侵染能力及宿主菌的敏感性。宿主细胞对噬菌体侵染的抵抗原因之一是改变其细胞表面性质,例如,在磷酸盐缺乏条件下枯草芽孢杆菌(B. subtilis)W23的细胞壁会缺失磷壁酸,从而无法完成噬菌体SP50侵染的第一步——噬菌体的识别吸附[91]。Wellington和Williams[92]研究发现链霉菌的多价噬菌体也能够侵染G1放线菌,却不能侵染GII、GIII、GIV、GIV组内的任何菌株。由于土壤环境中的底物通常较为贫瘠,土著细菌可能处于对于噬菌体的侵染并不敏感的状态。例如,土壤中通常很难检测出球形节杆菌(Arthrobacter globiformis)的噬菌体,但在添加营养元素后可以大量检出,甚至不需要添加宿主细菌,说明土壤中噬菌体可能处于未被激活的状态。
3.3.5 土壤含水量土壤含水量对于噬菌体的活性具有非常显著的影响。Straub等[87]研究污泥施用对沙漠农田土壤中大肠杆菌噬菌体MS2及鼠伤寒沙门氏菌噬菌体PRD-1活性的影响,发现土壤含水量降低至小于50 g/kg时两种噬菌体的侵染能力相比于含水量未降低土壤显著降低,且水分挥发会使两种噬菌体活性完全丧失。Williamson等[93]使用荧光显微镜对美国特拉华州6种土壤中的病毒颗粒进行检测,发现其丰度与土壤含水量存在显著的正相关关系。
3.3.6 其他因素其他土壤因素如污染状况、通气状况、离子强度等也被证明会显著影响土壤中噬菌体的活性及侵染效果[94]。Babich和Stotzky[88]研究发现,Zn2+与NaCl的存在通常会显著影响土壤中大肠杆菌噬菌体T1、T7、P1、φ1的活性。与此相反,HgCl- 3/HgCl2- 4复合体对金黄色葡萄球菌噬菌体φ11M15及大肠杆菌噬菌体P1的毒性却显著小于相同离子浓度的Hg2+ [95]。厌氧条件会使产钠弧菌(Vibrio natriegens)噬菌体φnt-1和φnt-6的潜伏期显著变长[96]。
4 展望由于噬菌体疗法可以在土壤生态环境系统中靶向追踪灭活特定种类的宿主细菌,因而具有较为广泛的应用前景,同时也很有必要从全局角度了解噬菌体疗法对土壤微生物生态系统功能的综合影响。噬菌体作为土壤丰度最高的生物体,噬菌体疗法在土壤生态环境系统中应用研究的热点将集中于以下几方面:①研发和筛选更加环境友好、成本低廉和广宿主型的噬菌体作为治疗制剂,或进行多种专一型噬菌体混合“鸡尾酒”疗法的研制,从而保证噬菌体在土壤中对宿主致病细菌高效灭活的持久效率;②探明噬菌体疗法对于土壤微生物群落结构、功能及养分循环的影响,保障噬菌体疗法应用过程中对土壤生态系统的安全性,维持土壤微生物群落结构的稳定性与多样性;③建立噬菌体疗法在土壤环境中应用的风险评估模型及评价方式,建立高效无害化土壤环境噬菌体疗法的运行监管机制。
| [1] |
Bloem E, Albihn A, Elving J, et al. Contamination of organic nutrient sources with potentially toxic elements, antibiotics and pathogen microorganisms in relation to P fertilizer potential and treatment options for the production of sustainable fertilizers: A review[J]. Science of the Total Environment, 2017, 607/608: 225-242 DOI:10.1016/j.scitotenv.2017.06.274 (  0) 0) |
| [2] |
Kalily E, Hollander A, Korin B, et al. Adaptation of salmonella enterica serovar senftenberg to linalool and its association with antibiotic resistance and environmental persistence[J]. Applied and Environmental Microbiology, 2017, 83(10): 03398-16 (  0) 0) |
| [3] |
Hénault-Ethier L, Martin V J, Gélinas Y. Persistence of Escherichia coli in batch and continuous vermicomposting systems[J]. Waste Management, 2016, 56: 88-99 DOI:10.1016/j.wasman.2016.07.033 (  0) 0) |
| [4] |
Zipperer A, Konnerth M C, Laux C, et al. Human commensals producing a novel antibiotic impair pathogen colonization[J]. Nature, 2016, 535(7613): 511-516 DOI:10.1038/nature18634 (  0) 0) |
| [5] |
Ongeng D, Geeraerd A H, Springael D, et al. Fate of Escherichia coli O157:H7 and Salmonella enterica in the manure-amended soil-plant ecosystem of fresh vegetable crops: A review[J]. Critical Reviews in Microbiology, 2015, 41: 273-294 DOI:10.3109/1040841X.2013.829415 (  0) 0) |
| [6] |
Zhang Y, Sallach JB, Hodges L, et al. Effects of soil texture and drought stress on the uptake of antibiotics and the internalization of Salmonella in lettuce following wastewater irrigation[J]. Environment Pollution, 2016, 208(Pt B): 523-531 (  0) 0) |
| [7] |
Gurtler J B. Pathogen decontamination of food crop soil: A review[J]. Journal of Food Protection, 2017, 80: 1461-1470 DOI:10.4315/0362-028X.JFP-17-040 (  0) 0) |
| [8] |
Ongeng D, Haberbeck L U, Mauriello G, et al. Modeling the fate of Escherichia coli O157:H7 and Salmonella enterica in the agricultural environment: Current perspective[J]. Journal of Food Science, 2014, 79: 421-427 DOI:10.1111/1750-3841.12392 (  0) 0) |
| [9] |
Maciejewska B, Olszak T, Drulis-Kawa Z. Applications of bacteriophages versus phage enzymes to combat and cure bacterial infections: An ambitious and also a realistic application[J]. Applied Microbiology and Biotechnology, 2018, 102: 2563-2581 DOI:10.1007/s00253-018-8811-1 (  0) 0) |
| [10] |
Gutiérrez D, Fernández L, Rodríguez A, et al. Are phage lytic proteins the secret weapon to kill staphylococcus aureus?[J]. MBio, 2018, 9(1): 01923-17 (  0) 0) |
| [11] |
Watts G. Phage therapy: Revival of the bygone antimicrobial[J]. Lancet, 2017, 390: 2539-2540 DOI:10.1016/S0140-6736(17)33249-X (  0) 0) |
| [12] |
Yu L, Wang S, Guo Z, et al. A guard-killer phage cocktail effectively lyses the host and inhibits the development of phage-resistant strains of Escherichia coli[J]. Applied Microbiology and Biotechnology, 2018, 102: 971-983 DOI:10.1007/s00253-017-8591-z (  0) 0) |
| [13] |
Lyon J. Phage therapy's role in combating antibiotic-resistant pathogens[J]. Jama the Journal of the American Medical Association, 2017, 318: 1746-1748 DOI:10.1001/jama.2017.12938 (  0) 0) |
| [14] |
Pires D P, Melo L, Vilas Boas D, et al. Phage therapy as an alternative or complementary strategy to prevent and control biofilm-related infections[J]. Current Opinion in Microbiology, 2017, 39: 48-56 DOI:10.1016/j.mib.2017.09.004 (  0) 0) |
| [15] |
Colavecchio A, Cadieux B, Lo A, et al. Bacteriophages contribute to the spread of antibiotic resistance genes among foodborne pathogens of the enterobacteriaceae family -A review[J]. Frontiers in Microbiology, 2017, 8: 1108 DOI:10.3389/fmicb.2017.01108 (  0) 0) |
| [16] |
Álvarez B, Biosca E G. Bacteriophage based bacterial wilt biocontrol for an environmentally sustainable agriculture[J]. Frontiers in Plant Science, 2017, 8: 1218 DOI:10.3389/fpls.2017.01218 (  0) 0) |
| [17] |
Dewangan G, Kashyap D K, Giri D K. Bacteriophage and their applications: A review[J]. Journal of Cell and Tissue Research, 2017, 17: 6165-6169 (  0) 0) |
| [18] |
Doss J, Culbertson K, Hahn D, et al. A review of phage therapy against bacterial pathogens of aquatic and terrestrial organisms[J]. Viruses, 2017, 9(3): 50 DOI:10.3390/v9030050 (  0) 0) |
| [19] |
Williamson K E, Fuhrmann J J, Wommack K E. Viruses in soil ecosystems: An unknown quantity within an unexplored territory[J]. Annual Review of Virology, 2017, 4: 201-219 DOI:10.1146/annurev-virology-101416-041639 (  0) 0) |
| [20] |
徐嘉良, 阚飙. 细菌的噬菌体感染抗性机制[J]. 生物技术通讯, 2013, 24(3): 409-413 DOI:10.3969/j.issn.1009-0002.2013.03.027 (  0) 0) |
| [21] |
李刚, 胡福泉. 噬菌体治疗的研究历程和发展方向[J]. 中国抗生素杂志, 2017, 42(10): 807-813 DOI:10.3969/j.issn.1001-8689.2017.10.001 (  0) 0) |
| [22] |
韩晗, 李雪敏, 王爽, 等. 噬菌体作抗菌剂使用的安全性评价研究进展[J]. 江苏农业科学, 2017, 45(22): 18-23 (  0) 0) |
| [23] |
付丽娜, 王丽丽, 李晓宇, 等. 噬菌体对三大耐药菌的防控作用研究进展[J]. 中国抗生素杂志, 2017, 42(10): 836-841 DOI:10.3969/j.issn.1001-8689.2017.10.005 (  0) 0) |
| [24] |
付丽娜, 徐永平, 李晓宇, 等. 噬菌体控制致病性大肠杆菌的研究进展[J]. 畜牧与兽医, 2017, 49(12): 140-144 (  0) 0) |
| [25] |
杨雨卉, 乐率. 铜绿假单胞菌噬菌体治疗的研究进展[J]. 中国抗生素杂志, 2017, 42(10): 814-820 DOI:10.3969/j.issn.1001-8689.2017.10.002 (  0) 0) |
| [26] |
江艳华, 李风铃, 王联珠, 等. 一株沙门氏菌裂解性噬菌体的分离鉴定及生物学特性[J]. 微生物学通报, 2015, 42: 534-542 (  0) 0) |
| [27] |
渠坤丽, 丛聪, 王丽丽, 等. 用噬菌体破解细菌生物被膜的研究进展[J]. 中国抗生素杂志, 2017, 42(10): 849-857 DOI:10.3969/j.issn.1001-8689.2017.10.007 (  0) 0) |
| [28] |
苏靖芳, 刘俊杰, 于浩, 等. 一株烟草青枯雷尔氏菌烈性噬菌体RS-PII-1的分离及全基因组分析[J]. 病毒学报, 2017, 33: 441-449 (  0) 0) |
| [29] |
傅强, 单文雅, 王兆飞, 等. 一株强裂解性大肠杆菌T1样噬菌体新成员的分离与鉴定[J]. 微生物学通报, 2017, 44: 2782-2794 (  0) 0) |
| [30] |
Ye M, Sun M, Feng Y, et al. Effect of biochar amendment on the control of soil sulfonamides, antibiotic-resistant bacteria, and gene enrichment in lettuce tissues[J]. Journal of Hazardous Materials, 2016, 309: 219-227 DOI:10.1016/j.jhazmat.2015.10.074 (  0) 0) |
| [31] |
Chen Q, An X, Li H, et al. Long-term field application of sewage sludge increases the abundance of antibiotic resistance genes in soil[J]. Environment International, 2016, 92/93: 1-10 DOI:10.1016/j.envint.2016.03.026 (  0) 0) |
| [32] |
He L Y, Ying G G, Liu Y S, et al. Discharge of swine wastes risks water quality and food safety: Antibiotics and antibiotic resistance genes from swine sources to the receiving environments[J]. Environment International, 2016, 92-93: 210-209 DOI:10.1016/j.envint.2016.03.023 (  0) 0) |
| [33] |
Peng S, Feng Y, Wang Y, et al. Prevalence of antibiotic resistance genes in soils after continually applied with different manure for 30 years[J]. Journal of Hazardous Materials, 2017, 340: 16-25 DOI:10.1016/j.jhazmat.2017.06.059 (  0) 0) |
| [34] |
Rahube T O, Marti R, Scott A, et al. Impact of fertilizing with raw or anaerobically digested sewage sludge on the abundance of antibiotic-resistant coliforms, antibiotic resistance genes, and pathogenic bacteria in soil and on vegetables at harvest[J]. Applied and Environmental Microbiology, 2014, 80: 6898-6907 DOI:10.1128/AEM.02389-14 (  0) 0) |
| [35] |
Sun M, Ye M, Jiao W, et al. Changes in tetracycline partitioning and bacteria/phage-comediated ARGs in microplastic-contaminated greenhouse soil facilitated by sophorolipid[J]. Journal of Hazardous Materials, 2018, 345: 131-139 DOI:10.1016/j.jhazmat.2017.11.036 (  0) 0) |
| [36] |
Xiang Q, Chen Q L, Zhu D, et al. Spatial and temporal distribution of antibiotic resistomes in a peri-urban area is associated significantly with anthropogenic activities[J]. Environmental Pollution, 2018, 235: 525-533 DOI:10.1016/j.envpol.2017.12.119 (  0) 0) |
| [37] |
Sun M M, Ye M, Liu K, et al. Dynamic interplay between microbial denitrification and antibiotic resistance under enhanced anoxic denitrification condition in soil[J]. Environmental Pollution, 2017, 222: 583-591 DOI:10.1016/j.envpol.2016.10.015 (  0) 0) |
| [38] |
Ye M, Sun M M, Feng Y F, et al. Calcined eggshell waste for mitigating soil antibiotic resistant bacteria/gene dissemination and accumulation in bell pepper[J]. Journal of Agricultural and Food Chemistry, 2016, 64: 5446-5453 DOI:10.1021/acs.jafc.6b00866 (  0) 0) |
| [39] |
Yu P, Mathieu J, Yang Y, et al. Suppression of enteric bacteria by bacteriophages: Importance of phage polyvalence in the presence of soil bacteria[J]. Environmental Science & Technology, 2017, 51: 5270-5278 (  0) 0) |
| [40] |
Yu P, Mathieu J, Li M, et al. Isolation of polyvalent bacteriophages by sequential multiple-host approaches[J]. Applied and Environmental Microbiology, 2015, 82: 808-815 (  0) 0) |
| [41] |
Tolstoy I, Kropinski A M, Brister J R. Bacteriophage taxonomy: An evolving discipline[J]. Methods in Molecular Biology, 2018, 1693: 57-71 (  0) 0) |
| [42] |
Kutin R K, Alvarez A, Jenkins D M. Detection of Ralstonia solanacearum in natural substrates using phage amplification integrated with real-time PCR assay[J]. Journal of Microbiological Methods, 2009, 76(3): 241-246 DOI:10.1016/j.mimet.2008.11.008 (  0) 0) |
| [43] |
Askora A, Kawasaki T, Fujie M, et al. Insights into the diversity of φRSM phages infecting strains of the phytopathogen Ralstonia solanacearum complex: Regulation and evolution[J]. Molecular Genetics and Genomics, 2014, 289: 589-598 DOI:10.1007/s00438-014-0835-3 (  0) 0) |
| [44] |
Yu J G, Lim J A, Song Y R, et al. Isolation and characterization of bacteriophages against pseudomonas syringae pv. actinidiae causing bacterial canker disease in kiwifruit[J]. Journal of Microbiology and Biotechnology, 2016, 26: 385-393 DOI:10.4014/jmb.1509.09012 (  0) 0) |
| [45] |
Quirós P, Muniesa M. Contribution of cropland to the spread of Shiga toxin phages and the emergence of new Shiga toxin-producing strains[J]. Scientific Reports, 2017, 7: 7796 DOI:10.1038/s41598-017-08169-6 (  0) 0) |
| [46] |
Bhunchoth A, Phironrit N, Leksomboon C, et al. Isolation of Ralstonia solanacearum infecting bacteriophages from tomato fields in Chiang Mai, Thailand, and their experimental use as biocontrol agents[J]. Journal of Applied Microbiology, 2015, 118: 1023-1033 DOI:10.1111/jam.12763 (  0) 0) |
| [47] |
Fujiwara A, Fujisawa M, Hamasaki R, et al. Biocontrol of Ralstonia solanacearum by treatment with lytic bacteriophages[J]. Applied and Environmental Microbiology, 2011, 77: 4155-4162 (  0) 0) |
| [48] |
Bae J Y, Wu J, Lee H J, et al. Biocontrol potential of a lytic bacteriophage PE204 against bacterial wilt of tomato[J]. Journal of Microbiology and Biotechnology, 2012, 22: 1613-1620 DOI:10.4014/jmb.1208.08072 (  0) 0) |
| [49] |
Frampton R A, Taylor C, Holguín Moreno A V, et al. Identification of bacteriophages for biocontrol of the kiwifruit canker phytopathogen Pseudomonas syringae pv. actinidiae[J]. Applied and Environmental Microbiology, 2014, 80: 2216-2228 DOI:10.1128/AEM.00062-14 (  0) 0) |
| [50] |
Meczker K, Dömötör D, Vass J, et al. The genome of the Erwinia amylovora phage PhiEaH1 reveals greater diversity and broadens the applicability of phages for the treatment of fire blight[J]. FEMS Microbiol Lett, 2014, 350: 25-27 DOI:10.1111/1574-6968.12319 (  0) 0) |
| [51] |
Chae J C, Hung N B, Yu S M, et al. Diversity of bacteriophages infecting Xanthomonas oryzae pv. oryzae in paddy fields and its potential to control bacterial leaf blight of rice[J]. Journal of Microbiology and Biotechnology, 2014, 24: 740-747 DOI:10.4014/jmb.1402.02013 (  0) 0) |
| [52] |
许志纲, 朱家琳, 卢其渝, 等. 水稻白叶枯病菌两类噬菌体性状的比较[J]. 植物病理学报, 1982, 12(2): 1-6 (  0) 0) |
| [53] |
堵鹤鸣, 李国喜, 卫书杰, 等. 桑疫病菌噬菌体的分离及其特性[J]. 病毒学报, 1987, 3(3): 59-65 (  0) 0) |
| [54] |
马超, 丛聪, 王丽丽, 等. 噬菌体控制植物细菌性疾病的研究进展[J]. 中国抗生素杂志, 2017, 42(9): 749-754 DOI:10.3969/j.issn.1001-8689.2017.09.006 (  0) 0) |
| [55] |
刘俊丽.马铃薯黑胫病病原菌的噬菌体分离、表征及防治研究[D].呼和浩特: 内蒙古大学, 2017. http://cdmd.cnki.com.cn/Article/CDMD-10126-1017110240.htm
(  0) 0) |
| [56] |
高苗.青枯雷尔氏菌噬菌体的分离鉴定及应用研究[D].北京: 中国农业科学院, 2015. http://www.wanfangdata.com.cn/details/detail.do?_type=degree&id=Y2787828
(  0) 0) |
| [57] |
Williamson K E, Fuhrmann J J, Wommack K E, et al. Viruses in soil ecosystems: An unknown quantity within an unexplored territory[J]. Annual Review of Virology, 2017, 4(1): 201-219 (  0) 0) |
| [58] |
王盛, 童贻刚. 噬菌体治疗研究进展[J]. 微生物学通报, 2009, 36(7): 1019-1024 (  0) 0) |
| [59] |
张利军.类炭疽芽胞杆菌噬菌体O3Z-1的生物学特性及裂菌效应研究[D].重庆: 第三军医大学, 2004. http://cdmd.cnki.com.cn/Article/CDMD-90025-2004130880.htm
(  0) 0) |
| [60] |
李存香.鼠疫噬菌体的分离和生物学特性研究[D].北京: 中国疾病预防控制中心, 2016. http://cdmd.cnki.com.cn/Article/CDMD-84501-1016282513.htm
(  0) 0) |
| [61] |
苏胜兵.分枝杆菌烈性噬菌体的分离鉴定及其裂解酶基因的克隆与序列分析[D].长春: 吉林农业大学, 2012.
(  0) 0) |
| [62] |
Forslund A, Plauborg F, Andersen M N, et al. Leaching of human pathogens in repacked soil lysimeters and contamination of potato tubers under subsurface drip irrigation in Denmark[J]. Water Research, 2011, 45(15): 4367-4380 DOI:10.1016/j.watres.2011.05.009 (  0) 0) |
| [63] |
Forslund A, Markussen B, Toennerklank L, et al. Leaching of Cryptosporidium parvum oocysts, Escherichia coli, and a Salmonella enterica serovar Typhimurium bacteriophage through intact soil cores following surface application and injection of slurry[J]. Applied and Environmental Microbiology, 2011, 77(22): 8129-8138 DOI:10.1128/AEM.05675-11 (  0) 0) |
| [64] |
Sharma R S, Mohmmed A, Babu C R. Diversity among rhizobiophages from rhizospheres of legumes inhabiting three ecogeographical regions of India[J]. Soil Biology and Biochemistry, 2002, 34: 965-973 DOI:10.1016/S0038-0717(02)00030-5 (  0) 0) |
| [65] |
Appunu C, Dhar B. Isolation and symbiotic characteristics of two Tn5-derived phage-resistant Bradyrhizobium japonicum strains that nodulate soybean[J]. Current microbiology, 2008, 57: 212-217 DOI:10.1007/s00284-008-9176-y (  0) 0) |
| [66] |
Jaiswal S K, Dhar B. Morphology and general characteristics of phages specific to Lens culinaris rhizobia[J]. Biology and Fertility of Soils, 2010, 46: 681-687 DOI:10.1007/s00374-010-0474-8 (  0) 0) |
| [67] |
Rokney A, Kobiler O, Amir A, et al. Host responses influence on the induction of lambda prophage[J]. Molecular Microbiology, 2008, 68: 29-36 DOI:10.1111/j.1365-2958.2008.06119.x (  0) 0) |
| [68] |
Ghosh D, Roy K, Williamson K E, et al. Acyl-homoserine lactones can induce virus production in lysogenic bacteria: an alternative paradigm for prophage induction[J]. Applied and Environmental Microbiology, 2009, 75: 7142-7152 DOI:10.1128/AEM.00950-09 (  0) 0) |
| [69] |
Feiner R, Argov T, Rabinovich L, et al. A new perspective on lysogeny: Prophages as active regulatory switches of bacteria[J]. Nature Reviews Microbiology, 2015, 13: 641-650 DOI:10.1038/nrmicro3527 (  0) 0) |
| [70] |
Paul J H. Prophages in marine bacteria: Dangerous molecular time bombs or the key to survival in the seas?[J]. Isme Journal, 2008, 2(6): 579-589 DOI:10.1038/ismej.2008.35 (  0) 0) |
| [71] |
Sun M, Ye M, Jiao W, et al. Changes in tetracycline partitioning and bacteria/phage-comediated ARGs in microplastic-contaminated greenhouse soil facilitated by sophorolipid[J]. Journal Hazardous. Materials, 2018, 345: 131-139 DOI:10.1016/j.jhazmat.2017.11.036 (  0) 0) |
| [72] |
Quirós P, Muniesa M. Contribution of cropland to the spread of Shiga toxin phages and the emergence of new Shiga toxin-producing strains[J]. Scientific Reports, 2017, 7(1): 7796 DOI:10.1038/s41598-017-08169-6 (  0) 0) |
| [73] |
Yu P F, Mathieu J, Lu G W, et al. Control of antibiotic-resistant bacteria in activated sludge using polyvalent phages in conjunction with a production host[J]. Environmental Science and Technology Letters, 2017, 4: 137-142 DOI:10.1021/acs.estlett.7b00045 (  0) 0) |
| [74] |
Yu P, Mathieu J, Yang Y, et al. Suppression of enteric bacteria by bacteriophages: Importance of phage polyvalence in the presence of soil bacteria[J]. Environmental Science and Technology, 2017, 51(9): 5270-5278 DOI:10.1021/acs.est.7b00529 (  0) 0) |
| [75] |
Shousha A, Awaiwanont N, Sofka D, et al. Bacteriophages isolated from chicken meat and the horizontal transfer of antimicrobial resistance genes[J]. Applied and Environmental Microbiology, 2015, 81(14): 4600-4606 DOI:10.1128/AEM.00872-15 (  0) 0) |
| [76] |
Ziebell K, Johnson R P, Kropinski A M, et al. Gene cluster conferring streptomycin, sulfonamide, and tetracycline resistance in Escherichia coli O157:H7 phage types 23, 45, and 67[J]. Applied and Environmental Microbiology, 2011, 77: 1900-1903 DOI:10.1128/AEM.01934-10 (  0) 0) |
| [77] |
Köhler B, Karch H, Schmidt H. Antibacterials that are used as growth promoters in animal husbandry can affect the release of Shiga-toxin-2-converting bacteriophages and Shiga toxin 2 from Escherichia coli strains[J]. Microbiology, 2000, 146(Pt 5): 1085-1090 (  0) 0) |
| [78] |
Mueller-Doblies D, Speed K, Davies R H. A retrospective analysis of Salmonella serovars isolated from pigs in Great Britain between 1994 and 2010[J]. Preventive Veterinary Medicine, 2013, 110: 447-455 DOI:10.1016/j.prevetmed.2013.02.023 (  0) 0) |
| [79] |
Schmieger H, Schicklmaier P. Transduction of multiple drug resistance of Salmonella enterica serovar typhimurium DT104[J]. Fems Microbiology Letters, 2010, 170(1): 251-256 (  0) 0) |
| [80] |
Bearson B L, Allen H K, Brunelle B W, et al. The agricultural antibiotic carbadox induces phage-mediated gene transfer in Salmonella[J]. Frontiers in Microbiology, 2014, 5: 52 (  0) 0) |
| [81] |
Zhang Y, Lejeune J T. Transduction of blaCMY-2, tet(A), and tet(B) from Salmonella enterica subspecies enterica serovar Heidelberg to S. Typhimurium[J]. Microbiology, 2008, 129: 418-425 (  0) 0) |
| [82] |
Reanney D C, Marsh S C N. The ecology of phages attacking Bacillus stearothermophilis in soil[J]. Soil Biology and Biochemistry, 1973, 5(4): 399-406 DOI:10.1016/0038-0717(73)90066-7 (  0) 0) |
| [83] |
Tan J S H, Reanney D C. Interactions between bacteriophages and bacteria in soil[J]. Soil Biology and Biochemistry, 1976, 8: 145-150 DOI:10.1016/0038-0717(76)90080-8 (  0) 0) |
| [84] |
Moce-Llivina L, Muniesa M, Pimenta-Vale H, et al. Survival of bacterial indicator species and bacteriophages after thermal treatment of sludge and sewage[J]. Applied and Environmental Microbiology, 2003, 69: 1452-1456 DOI:10.1128/AEM.69.3.1452-1456.2003 (  0) 0) |
| [85] |
Sykes I K, Lanning S, Williams S T. The effect of pH on soil actinophage[J]. Journal of General Microbiology, 1981, 122: 271-280 (  0) 0) |
| [86] |
Sykes I K, Williams S T. Interactions of actinophage and clays[J]. Journal of General Microbiology, 1978, 108: 97-102 DOI:10.1099/00221287-108-1-97 (  0) 0) |
| [87] |
Straub T M, Pepper I L, Gerba C P. Persistence of viruses in desert soils amended with anaerobically digested sewage sludge[J]. Applied and Environmental Microbiology, 1992, 58: 636-641 DOI:10.1128/AEM.58.2.636-641.1992 (  0) 0) |
| [88] |
Babich H, Stotzky G. Reductions in inactivation rates of bacteriophage by clay minerals in lake water[J]. Water Research, 1980, 14: 185-187 DOI:10.1016/0043-1354(80)90236-5 (  0) 0) |
| [89] |
Roper M M, Marshall K C J. Effect of clay particle size on clay-Escherichia coli-bacteriophage interactions[J]. Journal of General Microbiology, 1978, 106: 187-189 DOI:10.1099/00221287-106-1-187 (  0) 0) |
| [90] |
Delisle A L, Levin R E. Characteristics of three phages infectious for psychrophilic fishery isolates of Pseudomonas putrefaciens[J]. Antonie van Leeuwenhoek, 1972, 38: 1-8 DOI:10.1007/BF02328071 (  0) 0) |
| [91] |
Archibald A R, Coapes H E. Bacteriophage SP50 as a marker for cell wall growth in Bacillus sublitis[J]. Journal of Bacteriology, 1976, 125: 1195-1206 (  0) 0) |
| [92] |
Wellington E M H, Williams S T. Host ranges of phages isolated to Streptomycetes and other genera[J]. Zentralbl. bakteriol.abt, 1981, 11: 7-16 (  0) 0) |
| [93] |
Williamson K E, Radosevich M, Wommack K E. Abundance and diversity of viruses in six Delaware soils[J]. Applied and Environmental Microbiology, 2005, 71: 3119-3125 DOI:10.1128/AEM.71.6.3119-3125.2005 (  0) 0) |
| [94] |
Kimura M, Jia Z J, Nakayama N, et al. Ecology of viruses in soils: Past, present and future perspectives[J]. Soil Science and Plant Nutrition, 2008, 54(1): 1-32 (  0) 0) |
| [95] |
Babich H, Stotzky G. Differential toxicities of mercury to bacteria and bacteriophages in sea and in lake water[J]. Canadian Journal of Microbiology, 1979, 25: 1252-1257 DOI:10.1139/m79-197 (  0) 0) |
| [96] |
Zachary A. An ecological study of bacteriophages of Vibrio natriegens[J]. Canadian Journal of Microbiology, 1978, 24: 321-324 DOI:10.1139/m78-053 (  0) 0) |
2. Soil Ecology Lab, College of Resources and Environmental Sciences, Nanjing Agricultural University, Nanjing 210095, China
 2020, Vol. 52
2020, Vol. 52


