2. 重庆文理学院微生物生态研究所,重庆永川 402160;
3. 重庆文理学院环境材料与修复技术重庆市重点实验室,重庆永川 402160;
4. 重庆文理学院材料与化学学院,重庆永川 402160;
5. 重庆文理学院水生动物疫病防控研究所,重庆永川 402160
城市绿地是城市生态系统生物多样性的重要载体[1],包含了众多类型[2],具有较强的空间异质性。城市绿地生物多样性特征的变化规律深刻影响着城市区域物种迁移、生物群落演替、能量流动等生态过程,很大程度上决定了城市的生态服务功能,是城市生态系统研究的重要课题[1, 3]。土壤生物在城市绿地生物多样性维持、城市绿地生态系统功能中发挥着重要的作用[3]。然而,有关研究还比较薄弱,需要进一步深入研究。
土壤线虫数量巨大、群落结构复杂、个体食性广泛、生活史类型差异明显,是土壤食物网中的重要营养层级,在氮矿化、重金属转移、养分循环、物质能量流动等众多生态过程中发挥着重要作用[4];同时,土壤线虫本身对栖息环境的变化具有较强的敏感性,其类群的区系特征和空间分布格局特征可以反映出生态系统的结构和功能,能够定性评价土壤的健康状况[5]。因此,调查土壤线虫群落特征,分析线虫物种对城市绿地生态状况的指示意义对城市绿地生物多样性维护和管理至关重要。
本研究以土壤线虫为研究对象,调查不同城市绿地类型中土壤线虫多样性特征,分析不同绿地类型中土壤线虫群落的生物多样性和功能多样性特征,探讨土壤线虫对城市绿地生境的指示意义,以期为城市绿地生物多样性保护提供相关理论依据。
1 材料与方法 1.1 样地概况与样品采集研究区域位于重庆市永川区城区内,105°38′ ~ 106°05′E、28°56′ ~ 29°34′N。属亚热带季风性湿润气候,平均气温17.7 ℃,极端最高气温42.1 ℃,极端最低气温-2.9 ℃。年平均降雨量1 015.0 mm,平均日照1 218.7 h,年平均无霜期317 d。
依据中华人民共和国住房城乡建设部于2018年6月1日实施的《城市绿地分类标准》,将研究区域划分为道路绿地、居住绿地、公园绿地和风景名胜区绿地。根据现场调研实际情况,在每种绿地类型中随机选择3个重复样地,样地尽量保持植被、人为干扰程度和坡度一致。道路绿地:紫色土,以金叶女贞(Ligustrum vicaryi)、海桐(Pittosporum tobira)为主要优势种植物,平均盖度约95%。居住绿地:紫色土,以金叶女贞(Ligustrum vicaryi)、海桐(Pittosporum tobira)、小叶榕(Ficus microcarpa (L.) f.)为主要优势种植物。公园绿地:紫色土,以桂花(Osmanthus fragrans (Thunb.) Lour.)、香樟(Cinnamomum camphora (L.) Presl.)、杜鹃(Rhododendron simsii Planch.)为主要优势种植物。风景名胜区绿地:黄壤,以慈竹(Bambusa emeiensis)和茶树(Camellia sinensis (L.) O. Ktze.)为主要优势种植物。样地土壤理化性质见表 1。
|
|
表 1 四种不同绿地类型中土壤的理化性质 Table 1 Soil physicochemical properties under different green land types |
土壤采样于2017年12月和2018年3月进行。在每个样地内,利用五点取样法,除去地上凋落物,采集0 ~ 15 cm土层的土壤,将5份土壤均匀混合后,按照质量平均分配为两份,其中,一份土壤用于土壤理化性质分析,另一份用于土壤线虫分离。土壤装入自封袋,低温运输,4 ℃冰箱保存。
1.2 土壤线虫分离鉴定用烧杯量取50 ml土壤,用于线虫群落多样性分析。利用改进的贝曼漏斗分离法分离48 h。当一份样品分离出的线虫数量少于或等于150条时,鉴定所有线虫的种类,当数量多于150条时,鉴定前150条,然后统计所有线虫数量,按比例划分剩余土壤线虫种类。土壤线虫鉴定分类至属单元[6-7]。土壤线虫功能类群划分为食细菌类线虫、食真菌类线虫、植食类线虫、捕食类线虫和杂食类线虫[8]。土壤线虫生活史对策按照c-p类群划分[9]。
1.3 数据分析 1.3.1 线虫群落生物多样性分析利用α多样性测度城市绿地中线虫生物多样性水平,指标包括:Margalef丰富度指数(margalef richness, SR):SR=
利用β多样性测度线虫种类对环境异质性的反应,根据Sorensen指数:β=
利用线虫功能多样性指标测度城市绿地土壤健康状况以及土壤食物网特征,指标包括:自由生活类线虫成熟度指数(the free living nematode maturity index):MI =∑v(i)f(i),其中,v(i)为第i种线虫分类单元的cp值,f(i)为第i种线虫分类单元在样品中出现的频率[9];富集指数(the enrichment index):EI = 100×(e/(e+b));结构指数(the structure index):SI=100×(s/(s+b)),详细计算过程见文献[20]。线虫通路指数(the nematode channel ratio):NCR=B / (B+F),B和F分别为食细菌类线虫和食真菌类线虫数量,NCR的数量介于0 ~ 1,当NCR为0时,分解过程为真菌分解,当NCR为1时,分解过程为细菌分解[10]。
1.3.3 线虫物种指示值分析采用主成分分析(principal component analysis, PCA)法,对4种类型绿地中的线虫群落进行排序。为了数据的科学比较,线虫群落数据在分析前均转化为相对丰富度(相对丰富度=P/N,其中:P为群落中某种类群的个体数量,N为群落总量)。通过Canoco 5软件进行统计分析。根据巴特莱特球性检验法(bartlett test of sphericity)进行主成分分析适用性检验(P < 0.05)[11]。
根据指示值法计算不同线虫物种的指示作用,以物种对生境的特异性(specificity)和适宜性(fidelity)为基础,利用改进的R语言统计软件中labdsv软件包计算各物种的IndVal值,将IndVal值大于0.5的类群确定为某一生境类型的特征指示类群(characteristic groups)[12]。利用重复测量方差分析判断绿地类型、取样时间以及两者的相互作用对线虫多样性指数的影响。分析过程在SPSS19.0和Excel中运行。
2 结果与分析 2.1 土壤线虫生物多样性特征通过城市绿地土壤线虫调查共发现46个属(表 2)。道路绿地优势类群主要有Ba2类群中的Anaplectus和Ba3类群中的Prismatolaimus;居住绿地优势类群主要有Fu2类群中的Aphelenchus和Fu4类群中的Dorylaimoides;公园绿地优势类群主要有Ba3类群中的Prismatolaimus和Rhabdolaimus;风景名胜区绿地优势类群占比没有超过10%(表 2)。
|
|
表 2 不同城市绿地中线虫群落组成 Table 2 Community composition of nematode under different green land types |
利用重复测量方差分析判断绿地类型、取样时间以及两者的相互作用对线虫生物多样性指数的影响,结果表明:绿地类型对线虫群落的H、SR和D指数具有显著性影响(P < 0.05);取样时间对H和SR没有显著性影响(P > 0.05);绿地类型和取样时间的相互作用对生物多样性指数没有显著性影响(表 3)。
|
|
表 3 绿地类型和取样时间对线虫群落多样性影响 Table 3 Effects of green land types and sampling time on nematode community diversity |
进一步对线虫生物多样性分析发现:风景名胜区绿地的H指数最高,其次是公园绿地,居住区绿地最低;SR在风景名胜区绿地中最高,道路绿地最低;D在风景名胜区绿地中最高,居住绿地最低(图 1),线虫生物多样性指数结果表示两次采样的平均值。

|
(图中小写字母不同表示差异显著(P < 0.05),下图同) 图 1 城市绿地类型对线虫生物多样性的影响 Fig. 1 Effects of green land types on nematode biodiversity |
利用Sorensen相似系数对不同城市绿地类型线虫群落差异性进行分析。结果表明:风景名胜区绿地与其他类型绿地相似性较低;道路、公园以及居住绿地之间的相似性较高(表 4)。
|
|
表 4 不同城市绿地类型线虫群落的Sorensen相似系数 Table 4 Sorensen similarity coefficients of nematode communities under different green land types |
利用重复测量方差分析绿地类型、取样时间以及两者的相互作用对线虫功能多样性指数影响,结果表明:绿地类型对MI、NCR、EI和SI指数具有显著性影响(P < 0.05);取样时间对线虫功能多样性指数没有显著性影响(P > 0.05);绿地类型和取样时间的相互作用仅对SI有显著性影响(P < 0.05)(表 3)。
进一步对功能多样性分析发现:NCR指数在道路绿地中最高,道路、居住区和公园绿地中的MI指数均低于风景名胜区绿地(图 2),线虫功能多样性指数结果表示两次采样的平均值。根据富集指数(EI)和结构指数(SI)的含义,图 3代表了不同绿地类型土壤食物网状态,风景名胜区出现在象限B中,其他绿地类型土壤食物网指数值出现在象限A。

|
图 2 城市绿地类型对NCR和MI指数的影响 Fig. 2 Effects of green land types on indices of NCR and MI |
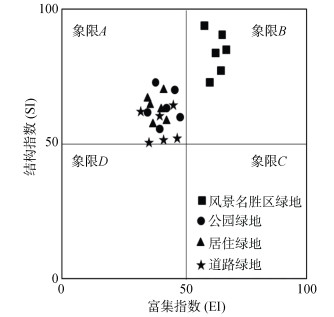
|
(图中富集指数(EI)和结构指数(SI)决定土壤食物网状态,象限A ~象限D参照Ferris等[20]研究) 图 3 土壤线虫加权功能区系分析图 Fig. 3 Nematode weighted faunal analysis |
主成分分析(PCA)表明:不同城市绿地类型线虫空间分布差异明显。第一排序轴解释物种数据36%的变异,第二排序轴解释了27%的变异。道路绿地与Rotylenchus、Tylenchorhynchus和Cylindrolaimus等物种密切相关;公园绿地与Cephalobus密切相关;居住绿地与Coomansinema物种密切相关;分析表明,风景名胜区绿地中包含着众多类群,生境环境与这些物种的分布密切相关(图 4)。在这之后,我们利用指示值法计算出不同城市绿地类型中的线虫指示种,根据IndVal > 0.5的统计意义,结果发现:Aphelenchoides、Cylindrolaimus和Epidorylaimus是道路绿地的指示生物;Bastiania是公园绿地的指示生物;Leptonchus、Monhystera和Clarkus是风景名胜区绿地的指示生物(表 5)。

|
(前4个排序轴的特征值分别为0.36 (F=6.956, P=0.022)、0.27、0.22和0.08。Axo: Axonchium; Hel: Helicotylenchus; Hir: Hirschmanniella; Rot: Rotylenchus: Tyl: Tylenchorhynchus; Tyle: Tylenchus; Cri: Criconemoides; Xip: Xiphinema; Lon: Longidorus; Aph: Aphelenchoides; Aphs: Aphelenchus; Dits: Ditylenchus; Dos: Dorylaimoides; Fis: Filenchus; Lep: Leptonchus; Acr: Acrobeles; Acri: Acrobeloides; Ala: Alaimus; Ana: Anaplectus; Bas: Bastiania; Cae: Caenorhabditis; Cep: Cephalobus; Chi: Chiloplacus; Chid: Chiloplectus; Cyl: Cylindrolaimus; Dip: Diploscapter; Mes: Mesorhabditis; Mon: Monhystera; Ple: Plectus; Pri: Prismatolaimus; Pro: Protorhabditis; Rha: Rhabdolaimus; Ter: Teratocephalus; Tyls: Tylocephalus; Apo: Aporcelaimus; Cla: Clarkus; Diss: Discolaimus; Dis: Discolaimium; Eud: Eudorylaimus; Nyg: Nygolaimus; Tra: Tripyla; Lab: Labronema; Enc: Enchodelus; Enc: Enchodorus; Epi: Epidorylaimus; All: Allodorylaimus; Meso: Mesodorylaimus; Coo: Coomansinema; GGS:道路绿地;RGS:居住绿地;PGS:公园绿地;SGS:风景名胜区绿地) 图 4 不同城市绿地类型样地内线虫组成结构PCA排序图 Fig. 4 Correlation biplot based on PCA of nematode community abundance under different green land types |
|
|
表 5 不同城市绿地类型线虫指示值分析 Table 5 IndVal analysis of nematode under different green land types |
2018年6月1日颁布的《城市绿地分类标准》,意在通过对城市绿地类型的划分提高城市绿地景观结构的多样化,加强对城市生态系统生物多样性的管理[13-14]。本文研究发现不同绿地类型中,土壤线虫群落组成差异明显,这与我国青岛、长春等地的相关研究结果类似[5, 15-16]。
城市道路和居住绿地中的土壤线虫生物多样性较低,且两者线虫群落的相似度较高,道路绿地和居住区绿地中的植物主要以人工种植为主,植被多以金叶女贞、海桐、小叶榕、山茶为主,在研究区域的样地内,生境中植被种类相似,以往研究表明,地下土壤生物对生境条件改变的响应主要通过植被群落起作用[17-18],城市绿化建设过程中,道路绿地和居住区绿地内相似的植物栽培模式有可能导致这两个样地内土壤线虫群落相似度较高。另外,城市道路绿地、居住区绿地以及公园绿地中的土壤受人为踩踏严重,土壤层次模糊,侵入物质复杂,土壤质地表现为沙化和黏化,土层薄,保水能力弱[19],较低的土壤含水量以及土壤营养物质,将导致土壤线虫多样性水平下降[20]。不同营养类群的线虫对土壤含水量的响应过程不同[21],最近的一些研究试图利用先进的手段研究真实自然状况下土壤线虫数量及其在生态过程中发挥的作用,虽然,Nielsen和Ball[21]认为在土壤营养流失过程中,土壤充水孔隙率的提高并不能提高土壤线虫的数量,但在水分缺乏的生境中,土壤含水量上升将导致土壤微生物生物量的增加,从而间接导致增加线虫群落生物多样性水平。
MI指数反映了土壤生态系统的稳定性[9]。MI在风景名胜区绿地中最高,表明该样地内的土壤食物网较为稳定[9],道路绿地MI最低,主要是由于受到强烈的人为干扰后,导致一些c-p值较高的K生活史对策类群数量减少,土壤线虫加权功能区系结果表明,道路绿地中土壤食物网系统极不稳定。在干扰程度较轻的森林生态系统中,土壤线虫结构较火烧、施肥干扰后的稳定[22],本研究中,风景名胜区绿地生态系统类型为森林生态系统,除了对外旅游开放的区域外,其他区域受人为干扰程度较轻,土壤中的有机质、总氮、有效磷、速效钾高于其他绿地,长期稳定的物质循环和能量流动将为土壤生物提供相对充足的营养物质,促进细菌、真菌等微生物的生长,从而进一步增加土壤线虫中高营养级类群的存活率,使土壤食物网达到稳定状态。相关研究也证实了在城市化过程中,随着人类干扰活动的加剧,绿地土壤处于不稳定状态[23]。本研究的结果MI值低于吕莹[5]在大连绿地中的结果,风景名胜区绿地中的土壤是黄壤,和其他绿地类型略有差异,一些特定类型的土壤线虫对土壤质地和生境的机制条件有特殊的要求[8],土壤质地的不同可能是进一步导致这些差异的原因。
NCR值在道路绿地最高,表明样地内生态系统能量流动主要以细菌通道途径为主[10]。公园绿地和风景名胜区绿地的NCR在0.5左右,这表明样地内的真菌和细菌分解途径共同完成着营养循环和能量流动[20]。线虫功能多样性分析表明,风景名胜区绿地的土壤状况最佳,其他3类绿地土壤状况需要改善,这一结果与相关研究结果类似[5, 15]。加权功能区系分析图(EI、SI)进一步证实:风景名胜区中土壤食物网的干扰强度处于中等以下,土壤食物网处于较成熟状态,其他3类绿地均处于强烈的干扰状态,土壤食物网不稳定[20]。城市化进程中人为干扰导致的土壤食物网变化模式与草地、农田的变化相反[20],在后者的生境中,随着牛羊的粪便以及人工合成肥料的添加,使土壤食物网处于富营养状态,并表现出逐步稳定的趋势,而城市土壤绿地中,人为的干扰使道路、公园和居住区绿地处于营养匮乏的不稳定状态,土壤健康质量下降。风景名胜区绿地与其他3类绿地土壤线虫群落结构的差异表明,城市景观中,景观异质性与土地利用方式的差异都将是影响生物多样性的环境因素,相关研究已经在农田等生态系统中证实[13]。
生物的指示作用在评估环境变化对生态系统影响时意义重大[24-25]。生物指示物指包含了与周围环境(或部分环境)质量有关信息的某个生物,或生物的某个组成部分,或一个生物群落[26]。目前,国际上以线虫作为生物指示物评价土壤环境质量的研究内容非常广泛,学者们大多利用群落生物多样性特征的变化反映生境条件的改变,比如物种多样性、营养类群多样性,以及功能多样性等[23, 27]。然而,针对特定线虫类群对环境指示的研究还很薄弱。Malherbe和Marais[28]研究了土壤线虫对土地利用梯度的指示作用,其中,Helicotylenchus以及Cephalobus等类群反映了土壤由自然状态向耕作转变过程中的变化,Park[29]发现,Rhabditis、Cephalobus和Helicotylenchus明显地反映了城市化进程的差异。我们的研究确定了线虫属类群对不同绿地类型的指示值,进一步明确了土壤线虫在环境变化过程中的指示意义。
4 结论本研究选取了4种绿地类型作为研究对象,调查研究了线虫生物多样性以及功能多样性特征。不同城市绿地对线虫群落产生了明显的影响,改变了土壤食物网结构和功能,研究结果进一步明确了线虫类群对城市生态系统绿地生境的指示意义。由于城市绿地受到人为干扰的强烈影响,物种相对匮乏,对线虫指示物的研究,需要进一步开展长期观测,并利用鱼类、藻类等综合的指示作用反映城市生态环境的变化。同时,景观生态学范畴的城市绿地景观格局与土地利用差异对土壤生物多样性影响的研究也将是城市生物多样性保护措施制定的理论依据。
| [1] |
Savard J P L, Clergeau P, Mennechez G. Biodiversity concepts and urban ecosystems[J]. Landscape & Urban Planning, 2000, 48(3): 131-142 (  0) 0) |
| [2] |
徐波, 郭竹梅, 贾俊. 《城市绿地分类标准》修订中的基本思考[J]. 中国园林, 2017, 33(6): 64-66 (  0) 0) |
| [3] |
Bardgett R D, Wardle D A. Aboveground-belowground linkages: Biotic interactions, ecosystem processes, and lobal change[M].
Oxford Universty Press, Oxford, 2010
(  0) 0) |
| [4] |
吴纪华.中国淡水和土壤线虫的研究[D].中国科学院水生生物研究所, 1999.
(  0) 0) |
| [5] |
吕莹, 线虫群落对大连滨海石油与土壤重金属污染及绿地生态系统恢复的指示作用研究[D].辽宁师范大学, 2012. http://cdmd.cnki.com.cn/Article/CDMD-10165-1013159423.htm
(  0) 0) |
| [6] |
Goodey T, Goodey J B, Jenkins W R. Soil and freshwater nematodes[J]. Soil Science, 1964, 97(4): 291 (  0) 0) |
| [7] |
Loof P A A, Jairajpuri M S, Ahmad W. Freeliving, predaceous and plant parasitic nematodes[J]. Fundamental & Applied Nematology, 1992, 3: 286-287 (  0) 0) |
| [8] |
Yeates G W, Bongers T, De Goede R G, et al. Feeding habits in soil nematode families and genera-An outline for soil ecologists[J]. Journal of Nematology, 1993, 25(3): 315-331 (  0) 0) |
| [9] |
Bongers T. The maturity index: An ecological measure of environmental disturbance based on nematode species composition[J]. Oecologia, 1990, 83(1): 14-19 (  0) 0) |
| [10] |
Yeates G W. Nematodes as soil indicators:Functional and biodiversity aspects[J]. Biology & Fertility of Soils, 2003, 37(4): 199-210 (  0) 0) |
| [11] |
Hu J, Wu J H, Ma M J, et al. Nematode communities response to long-term grazing disturbance on Tibetan plateau[J]. European Journal of Soil Biology, 2015, 69: 24-32 (  0) 0) |
| [12] |
孙志强, 张星耀, 朱彦鹏, 等. 应用物种指示值法解析昆嵛山植物群落类型和植物多样性[J]. 生态学报, 2011, 31(11): 3120-3132 (  0) 0) |
| [13] |
Reynolds C, Fletcher R J, Carneiro C M, et al. Inconsistent effects of landscape heterogeneity and land-use on animal diversity in an agricultural mosaic: A multi-scale and multi-taxon investigation[J]. Landscape Ecology, 2018, 33(2): 241-255 (  0) 0) |
| [14] |
Katayama N, Amano T, Naoe S, et al. Landscape heterogeneity-biodiversity relationship: Effect of range size[J]. Plos One, 2014, 9(3): e93359 (  0) 0) |
| [15] |
吴东辉, 张柏, 陈鹏. 长春市不同土地利用生境的土壤线虫群落结构特征[J]. 应用生态学报, 2006, 17(3): 450-456 (  0) 0) |
| [16] |
Pavaozuckerman M A, Coleman D C. Urbanization alters the functional composition, but not taxonomic diversity, of the soil nematode community[J]. Applied Soil Ecology, 2007, 35(2): 329-339 (  0) 0) |
| [17] |
Liu J, Feng C, Wang D L, et al. Impacts of grazing by different large herbivores in grassland depend on plant species diversity[J]. Journal of Applied Ecology, 2015, 52(4): 1053-1062 (  0) 0) |
| [18] |
Hu J, Chen G R, Hassan W M, et al. Fertilization influences the nematode community through changing the plant community in the Tibetan Plateau[J]. European Journal of Soil Biology, 2017, 78: 7-16 (  0) 0) |
| [19] |
郭建平.长沙市河西绿地土壤特征与建设研究[D].长沙: 湖南师范大学, 2007. http://cdmd.cnki.com.cn/article/cdmd-10542-2007174567.htm
(  0) 0) |
| [20] |
Ferris H, Bongers T, Rgmde G. A framework for soil food web diagnostics: Extension of the nematode faunal analysis concept[J]. Applied Soil Ecology, 2001, 18(1): 13-29 (  0) 0) |
| [21] |
Nielsen U N, Ball B A. Impacts of altered precipitation regimes on soil communities and biogeochemistry in arid and semi-arid ecosystems[J]. Global Change Biology, 2015, 21(4): 1407-1421 (  0) 0) |
| [22] |
Forge T, Simard S. Structure of nematode communities in forest soils of southern British Columbia: Relationships to nitrogen mineralization and effects of clearcut harvesting and fertilization[J]. Biology & Fertility of Soils, 2001, 34(3): 170-178 (  0) 0) |
| [23] |
Pereira T J, Castañeda N E N, Cares J E, et al. Nematode communities as indicators of the status of a soil ecosystem influenced by mining practices in Brazil[J]. Nematology, 2016, 18(3): 265-276 (  0) 0) |
| [24] |
Stone D, Ritz K, Griffiths B G, et al. Selection of biological indicators appropriate for European soil monitoring[J]. Applied Soil Ecology, 2016, 97: 12-22 (  0) 0) |
| [25] |
Grzelak K, Gluchowska M, Gregorczyk K, et al. Nematode biomass and morphometric attributes as biological indicators of local environmental conditions in Arctic fjords[J]. Ecological Indicators, 2016, 69: 368-380 (  0) 0) |
| [26] |
Siddig A A H, Ellison A M, Ochs A, et al. How do ecologists select and use indicator species to monitor ecological change? Insights from 14 years of publication in Ecological Indicators[J]. Ecological Indicators, 2016, 60: 223-230 (  0) 0) |
| [27] |
Zhao J, Shao Y H, Wang X L, et al. Sentinel soil invertebrate taxa as bioindicators for forest management practices[J]. Ecological Indicators, 2013, 24(1): 236-239 (  0) 0) |
| [28] |
Malherbe S, Marais D. Nematode community profiling as a soil biology monitoring tool in support of sustainable tomato production: A case study from South Africa[J]. Applied Soil Ecology, 2015, 93: 19-27 (  0) 0) |
| [29] |
Park S. Exploring urban soil ecology: Influence of the length of urbanization period on soil chemical properties and nematode community[R]. Ohio Agricultural Research & Development Center, 2008.
(  0) 0) |
2. Institute of Microbiology, Chongqing University of Arts and Sciences, Yongchuan, Chongqing 402160, China;
3. Chongqing Key Laboratory of Environmental Materials and Remediation Technologies, Chongqing University of Arts and Sciences, Yongchuan, Chongqing 402160, China;
4. College of Materials and Chemical Engineering, Chongqing University of Arts and Sciences, Yongchuan, Chongqing 402160, China;
5. Institute of Aquatic Animal Disease Prevention and Control, Chongqing University of Arts and Sciences, Yongchuan, Chongqing 402160, China
 2020, Vol. 52
2020, Vol. 52


