随着工业的发展,工业“三废”的排放、矿渣的不恰当处理、农用物资的滥用、城市生活废物特别是电子垃圾的增加,加速了Cd在土壤中的积累[1],导致我国农田土壤Cd问题日趋严重[2]。Cd具有较大的生物毒性并且迁移活跃,是土壤优先控制元素之一[3]。截至2014年,全国7%耕地土壤Cd超标[4],Cd污染土壤面积高达13 330 hm2[5],对人民健康和粮食安全造成较大威胁。
影响土壤中Cd2+稳定性的因子主要包括有机质、碳酸钙和铁锰氧化物含量,温度,时间等[6-7]。土壤环境的变化如理化性质和调理剂的施入会对进入土壤中Cd的吸附和解吸动态平衡产生影响,进而改变土壤中Cd的环境风险。通常有机质含量较高的土壤对Cd的吸附能力较强,质地细和碳酸盐含量高的土壤易积累Cd[8],砂土及排水良好的土壤中不易积累Cd[9]。
生物质炭作为重金属污染土壤绿色调理剂[10-13],由于其具有较多的含氧官能团、丰富的孔隙结构以及较大的比表面积等特点[14],可以增强土壤氧化还原特性,增加土壤有机质含量[15],改善生物学活性。同时,其松散的结构可以作为某些功能微生物如枯草芽孢杆菌的载体,通过物理、化学和生物学作用共同达到降低土壤Cd活性和毒性的目的[16-17]。
鉴于此,通过研究不同吸附条件(浓度、有机质、pH、质地)和枯草芽孢杆菌-生物质炭复合体施加后土壤对Cd2+的吸附与解吸作用动态规律,以明确土壤条件对Cd固定能力的影响及其稳定性[18],探索施加枯草芽孢杆菌-生物质炭复合体对土壤吸附Cd的增强效应,为Cd污染土壤的修复提供技术支持。
1 材料与方法 1.1 供试材料供试土壤分别取自沧州某设施蔬菜大棚和保定市郊区,土壤质地分别为壤土和砂质壤土,以研究不同质地土壤对Cd2+的吸附差异。采样深度为0 ~ 20 cm表土层土壤,去除残叶等生物残体,自然风干后过20目筛备用。土壤的基本性质见表 1。
|
|
表 1 供试土壤的理化性质 Table 1 Physicochemical properties of tested soil |
供试菌株为枯草芽孢杆菌(Bacillus subtilis),枯草芽孢杆菌培养基:蛋白胨10 g/L,牛肉浸膏5 g/L,NaCl 5 g/L,调pH至7.5。培养基于121 ℃、0.15 MPa条件下灭菌20 min后用于细菌培养。由菌种保存斜面挑取菌落接种于培养基中,30 ℃、180 r/min振荡培养,培养20 h左右直到细胞生长到指数后期收获菌悬液。以无菌水调节悬液浓度为5×108 cells/ml。
在前期研究的基础上,将75 ml枯草芽孢杆菌液与30 g生物质炭于250 ml三角瓶中混合,30 ℃、180 r/min振荡复合48 h,使枯草芽孢杆菌吸附挂膜于生物质炭表面,制成枯草芽孢杆菌-生物质炭复合体。
1.2 研究方法1) 土壤中枯草芽孢杆菌-生物质炭复合体的施加。添加量分别为0 (对照,CK)、10、20、30、50 ml/kg。施加枯草芽孢杆菌-生物质炭复合体后的土壤保持田间最大持水量的60%,平衡30 d后采集土壤进行测定。
2) 有机质的去除。分别取风干、过20目筛后的土壤,加入30%的H2O2溶液,充分搅动土壤,使有机质分解,待样品中不再有气泡生成时,再加入少量H2O2溶液,重复进行3次,经风干过20目筛后贮藏备用。
3) 批次吸附试验。初始溶液pH范围为3 ~ 8,Cd溶液浓度为11.2 ~ 281.0 mg/L。为确定某环境参数对Cd2+吸附作用的影响,保持其他参数不变、以该参数为唯一变量进行吸附试验。取土壤样品1.50 g置于离心管中并加入30 ml Cd溶液,调节pH,然后将样品在25 ℃恒温振荡器中振荡180 min,然后将悬浮液5 000 r/min离心10 min,收集上清液,通过原子吸收光谱仪测定上清液Cd2+浓度。由溶液中Cd2+浓度的降低计算复合体的吸附量。离心管中剩余残渣待自然风干后,放入自封袋留存。以上试验重复3次。
4) 解吸试验。将上述吸附试验离心后的土样,以0.01 mol/L NaNO3溶液做解吸剂,按1︰20土水比,经充分混匀后,在25 ℃下振荡2 h,离心,测定上清液Cd2+浓度。土壤中Cd2+解吸率为土壤中Cd2+解吸量和吸附量比值的百分数。以上试验均重复3次。
1.3 数据处理为了确定土壤对Cd2+的吸附等温特征,选择Langmuir和Freundlich等温线模型进行非线性拟合。等温吸附模型及参数如下:
| ${C_e}/{q_e} = {C_e}/{q_m} + 1/(b \times {q_m})$ | (1) |
| ${\rm{In}} qe = {\rm{In}}K + \left( {1/n} \right) \times {\rm{In}} Ce$ | (2) |
式中:qe(mg/g)和Ce(mg/L)分别为Cd2+吸附量和溶液中的Cd2+浓度;qm(mg/ml)为最大吸附容量;b为与结合位点的亲和力相关的Langmuir常数;K为吸附容量常数,1/n为Freundlich经验参数,与吸附强度有关。
应用Microsoft Office Excel 2010和SPSS 20进行数据统计分析,采用SigmaPlot 12.5作图。
2 结果与讨论 2.1 壤土对Cd的等温吸附特征壤土对不同平衡溶液中Cd2+的吸附量如图 1所示,土壤对于Cd2+的吸附量随初始Cd2+浓度的增大而增大,Cd2+浓度由11.2 mg/L增至281.0 mg/L时,Cd2+吸附量由0.22 mg/g增至4.25 mg/g。在试验浓度范围内,壤土对Cd2+吸附量未达到100%,主要是由于土壤对于Cd的吸附位点远高于试验中所设的离子浓度[19]。本试验所用的农田壤土对Cd的吸附能力高于一般的林地和草地土壤,以Cd2+浓度为100 mg/L时,3种土壤对Cd2+的吸附量分别为1.84、0.884和0.5 mg/g[20]。Cd2+浓度由11.2 mg/L增至281.0 mg/L时,土壤对于Cd2+的解吸率缓慢增加,但是最大解吸率仍小于2%,表明壤土能保留大部分外源Cd2+,这部分不能解吸的Cd2+代表壤土对Cd(Ⅱ)有很强的亲和力和固定能力。由表 2可知Langmuir和Freundlich模型可以很好地拟合壤土对溶液Cd(Ⅱ)的等温吸附过程,土壤获得的最大理论吸收容量为18.0 mg/g。但是Freundlich等温模型(R2 = 0.991)比Langmuir等温模型(R2 = 0.976)更适于描述该吸附过程,证实了该土壤对Cd2+的吸附发生在非均匀的表面而不是均匀的单层吸附表面,也表明土壤介质的异质性和复杂性会影响重金属的吸附过程[21-22]。

|
图 1 不同初始Cd2+浓度对壤土吸附和解吸Cd2+的影响 Fig. 1 Effects of different initial Cd2+ concentrations on adsorption and desorption of loam for Cd2+ |
|
|
表 2 壤土Cd2+吸附模型拟合参数 Table 2 Fitting parameters of Cd2+ adsorption model of loam |
pH可以影响土壤表面的官能团和表面电荷的解离以及Cd2+在溶液中的形态,进而影响土壤对平衡溶液中Cd2+的吸附量[18]。因此,溶液体系的pH是控制金属离子吸附行为的主要参数之一。对供试的土样(壤土)在不同pH的溶液条件下对Cd2+吸附能力进行评估,结果如图 2所示。随着pH由3增大至6,土壤对平衡溶液中Cd2+的吸附量呈现上升趋势,由1.03 mg/g增至1.09 mg/g。在pH = 6 ~ 7时,吸附曲线的倾斜程度变小,曲线逐渐变得缓和,在pH = 7时,土壤对溶液中的Cd2+吸附量达到最大值,为1.10 mg/g;在pH = 8时,土壤对溶液中的Cd2+吸附量维持在1.10 mg/g。溶液体系pH在酸性时对土壤的吸附Cd2+能力影响较大。有研究表明在酸性条件下,土壤的表面性质是制约Cd2+吸附的主要因素[23-25]。其中阳离子交换是主要吸附机制,且溶液中存在较多的H+,H+与重金属Cd2+竞争土壤的吸附位点,导致吸附量较低,而随着溶液pH的增加,土壤颗粒表面发生去质子化,负电荷数量增加,使得土壤对Cd2+的吸附量增加[26],而且在较高pH时,Cd2+可能会与溶液中多余的OH产生Cd的氢氧化物沉淀。土壤表面性质以外的因素(水解、沉淀等)对吸附的影响逐渐加强,不同土壤对Cd2+的吸附差异逐渐减少[25]。王海燕等[27]用数学方法推导得出土壤Cd吸附量与土壤pH呈正比;王金贵[28]研究表明pH升高有利于增强土壤有机质-金属络合物的稳定性,进而加强土壤对Cd2+的吸附力。
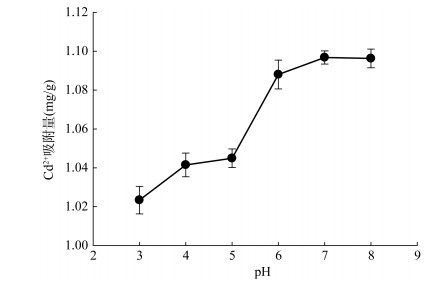
|
图 2 pH对土壤吸附Cd2+的影响 Fig. 2 Effect of pH on Cd2+ adsorption by loam |
由图 3可见,有机质会影响土壤对Cd2+的吸附能力,在较低浓度Cd溶液中(11.2 ~ 89.9 mg/L),未去除有机质的土壤和去除有机质的土壤对Cd2+的吸附量基本一致,并且均随着初始浓度的增加呈现上升趋势;当Cd溶液初始浓度较大时(89.9 ~ 281 mg/L),去除有机质的土壤对Cd2+的吸附量显著低于未去除有机质的土壤,并且二者均随着溶液浓度的增加而上升,当溶液Cd浓度为281 mg/L时,去除有机质后土壤对Cd2+的吸附量(3.50 mg/g)比原土壤吸附量(4.25 mg/g)降低了17.6%,表明有机质对土壤吸附并固定溶液中Cd2+的能力具有一定的促进作用。这也与宋鑫莱等[29]的研究结果相同,土壤有机质的去除会降低其对重金属的络合能力和吸附能力,增大重金属的生物可利用性。这可能是因为去除有机质后会降低土壤表面负电荷数目从而降低土壤对于溶液中Cd2+的吸附能力[6]。因为有机质的去除减少了土壤表面含氧官能团数目,减少了阳离子的吸附点位, 降低了土壤阳离子交换量,从而降低了土壤对于平衡溶液中Cd2+的吸附能力[20]。另一方面可能是由于有机质表面羧基、酚羟基等多种官能团是络合吸附金属离子的主要胶体物质,有机质去除导致土壤中络合吸附金属离子的主要胶体物质减少,进而降低了对Cd2+的吸附能力[30]。朱宁[31]研究发现有机质对土壤吸附Cd的贡献能力较大,在不同大小的土壤微团聚体中有机质吸附Cd的贡献能力为12% ~ 26%,本研究结果与此一致。
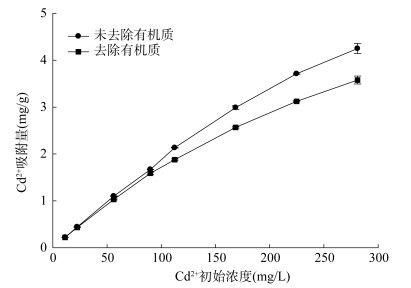
|
图 3 有机质对土壤Cd2+吸附的影响 Fig. 3 Effect of organic matter on Cd2+ adsorption by loam |
分别对壤土和砂质壤土进行Cd2+的等温吸附试验,结果如图 4所示,二者对Cd2+的吸附量均随着Cd2+浓度的增加而增加。在Cd2+平衡溶液浓度为11.2 ~ 56.2 mg/L时,两种质地的土壤对于Cd2+的吸附量无明显差异。当Cd2+初始浓度大于56.2 mg/L时,砂质壤土对Cd2+的吸附能力显著低于壤土,且随着Cd2+初始浓度的增大两种质地的土壤对Cd2+的吸附量差值也逐渐增大。当Cd2+浓度为281 mg/L时,砂质壤土对Cd2+的吸附量(2.53 mg/g)相比壤土(4.25 mg/g)降低了40.5%。由表 1可知砂质壤土的有机质含量(7.4 g/kg)显著低于壤土(20.9 g/kg),说明有机质的差异可能是砂质壤土和壤土对Cd2+吸附能力不同的主要原因。房莉等[31]研究表明,农田、草地和林地对Cd2+的吸附性能差异和土壤中有机质的含量有关,土壤有机质含量越大, 其含有的羟基和羧基也多, 吸附作用也越大。咸翼松[32]研究青紫泥和黄斑田对Cd2+的吸附量差异与其有机质的含量有关;另外有研究表明不同土壤质地的组成成分能够影响土壤颗粒的吸持性能[33],黏粒含量的增加能提高Cd的吸附量[25, 34],土壤pH的升高也能够增强土壤表面的电负性进而增强对Cd2+的吸附能力[35],土壤中氮磷含量的增加可以降低土壤中Cd水溶性和可交换态的含量[36]。

|
图 4 不同土壤质地对Cd2+的等温吸附曲线 Fig. 4 Cd2+ isothermal adsorption curves of loam and sandy loam |
图 5为供试土样(壤土)添加枯草芽孢杆菌-生物质炭复合体后对Cd2+的吸附量和解吸率曲线(初始Cd2+浓度为225 mg/L),由图 5可知,土壤中添加枯草芽孢杆菌-生物质炭复合体后,土壤对Cd2+的吸附量均显著高于对照组(P < 0.05)。但Cd2+的吸附量并不一直随枯草芽孢杆菌-生物质炭复合体的施加量的增加而增加。在添加枯草芽孢杆菌-生物质炭量为20 ml/kg组,土壤对溶液中Cd2+的吸附量达到最大值,为3.44 mg/g,较对照处理高11.7%。同时,添加枯草芽孢杆菌-生物质炭复合体,土壤吸附Cd2+后对Cd2+的解吸能力(0.42% ~ 0.48%)均低于对照组(0.55%),随着添加量的增加土壤表面Cd2+的解吸率缓慢增加,在复合体添加量为10 ml/kg时有最小解吸率为0.42%。综合吸附量和解吸率可知,土壤中最佳的枯草芽孢杆菌-生物质炭复合体添加剂量为10 ~ 30 ml/kg,出现这种现象的原因可能是添加枯草芽孢杆菌-生物质炭复合体后,生物质炭的存在会增加土壤的空隙度,增加土壤的含水率和阳离子交换量[37],进而增加对Cd2+的吸附能力[38]。Beesley等[39]将生物质炭施入土壤后,土壤沥出液中Cd2+的浓度显著降低;Lu等[40]将稻草秸秆生物质炭施入到土壤中,酸提取态的Cd含量降低了11%。另外枯草芽孢杆菌可以钝化土壤中的Cd2+,李晓晴[41]研究表明用枯草芽孢杆菌菌液处理土壤(棕壤、潮土、褐土)后可以显著降低土壤中有效态Cd含量;纪宏伟等[42]研究表明枯草芽孢杆菌可降低潮褐土有效态Cd含量的5.07% ~ 42.63%,促进土壤中的Cd由可交换的形态向其他形态转化。枯草芽孢杆菌能够增加土壤微生物群落的丰度和多样性,进而促进土壤中微生物对重金属的吸附作用[43-44],并且生物质炭和枯草芽孢杆菌均对Cd2+具有吸附特性[45-46],进而使土壤对于Cd2+的吸附解吸能力发生改变。本文结果与以上研究一致,表明枯草芽孢杆菌联合生物质炭能够增加土壤对Cd2+的吸附能力,降低Cd的生物毒性。

|
图 5 枯草芽孢杆菌-生物质炭复合体对土壤Cd2+吸附与解吸的影响 Fig. 5 Cd2+ adsorption and desorption by soil added with different amounts of Bacillus subtilis-biochar immobilized complex |
土壤对Cd2+的吸附量随着溶液Cd浓度、pH的增大而增大。有机质的去除会降低土壤对Cd2+的吸附能力,壤土对Cd2+的吸附能力高于砂土。施加枯草芽孢杆菌-生物质炭复合体能够提升土壤对Cd2+的吸附能力,并且在施加量为20 mg/L对Cd2+的吸附量达到最大值(3.44 mg/g),且比对照组高出11.7%。同时,Freundlich模型(R2=0.997)表明土壤对Cd2+吸附发生在非均质表面。施加枯草芽孢杆菌-生物质炭复合体会降低土壤对Cd2+的解吸率。因此,枯草芽孢杆菌-生物质炭复合体对加强重金属在土壤中的固定稳定化提供了可能。
| [1] |
沈倩, 党秀丽. 土壤重金属镉污染及其修复技术研究进展[J]. 安徽农业科学, 2015, 43(15): 92-94 DOI:10.3969/j.issn.0517-6611.2015.15.036 (  0) 0) |
| [2] |
苗亚琼, 林清. 广西土壤重金属镉污染及对人体健康的危害[J]. 环境与可持续发展, 2016, 41(5): 171-173 DOI:10.3969/j.issn.1673-288X.2016.05.046 (  0) 0) |
| [3] |
和君强, 贺前锋, 刘代欢, 等. 土壤镉食品卫生安全阈值影响因素及预测模型——以长沙某地水稻土为例[J]. 土壤学报, 2017, 54(5): 1181-1194 (  0) 0) |
| [4] |
环境保护部, 国土资源部. 全国土壤污染状况调查公报[J]. 环境教育, 2014(6): 8-10 (  0) 0) |
| [5] |
宁校平, 陈文清. 土壤镉污染修复技术发展现状[J]. 四川化工, 2015, 18(6): 18-21 DOI:10.3969/j.issn.1672-4887.2015.06.006 (  0) 0) |
| [6] |
焦文涛, 蒋新, 余贵芬, 等. 土壤有机质对镉在土壤中吸附-解吸行为的影响[J]. 环境化学, 2005, 24(5): 545-549 DOI:10.3321/j.issn:0254-6108.2005.05.012 (  0) 0) |
| [7] |
陈同斌, 陈志军. 水溶性有机质对土壤中镉吸附行为的影响[J]. 应用生态学报, 2002, 13(2): 183-186 DOI:10.3321/j.issn:1001-9332.2002.02.014 (  0) 0) |
| [8] |
Whalley C, Grant A. Assessment of the phase selectivity of the European Community Bureau of Reference (BCR) sequential extraction procedure for metals in sediment[J]. Analytica Chimica Acta, 1994, 291(3): 287-295 DOI:10.1016/0003-2670(94)80024-3 (  0) 0) |
| [9] |
李宇庆, 陈玲, 仇雁翎, 等. 上海化学工业区土壤重金属元素形态分析[J]. 生态环境, 2004, 13(2): 154-155 DOI:10.3969/j.issn.1674-5906.2004.02.002 (  0) 0) |
| [10] |
吕豪豪, 刘玉学, 杨生茂. 生物质炭化技术及其在农林废弃物资源化利用中的应用[J]. 浙江农业科学, 2015, 56(1): 19-22 (  0) 0) |
| [11] |
杨兰, 李冰, 王昌全, 等. 改性生物炭材料对稻田原状和外源镉污染土钝化效应[J]. 环境科学, 2016, 37(9): 3562-3574 (  0) 0) |
| [12] |
杨晓庆, 侯仔尧, 常梦婷, 等. 生物炭对镉污染土壤的修复研究[J]. 江苏农业科学, 2015, 43(6): 335-337 (  0) 0) |
| [13] |
郭文娟, 梁学峰, 林大松, 等. 土壤重金属钝化修复剂生物炭对镉的吸附特性研究[J]. 环境科学, 2013, 34(9): 3716-3721 (  0) 0) |
| [14] |
李力, 刘娅, 陆宇超, 等. 生物炭的环境效应及其应用的研究进展[J]. 环境化学, 2011, 30(8): 1411-1421 (  0) 0) |
| [15] |
沈盟, 蒋芳玲, 王珊, 等. 生物质炭施用量对土壤性状和番茄产质量的影响[J]. 土壤, 2017, 49(3): 534-542 (  0) 0) |
| [16] |
Bai J, Yang X, Du R, et al. Biosorption mechanisms involved in immobilization of soil Pb by Bacillus subtilis DBM in a multi-metal-contaminated soil[J]. Journal of Environmental Sciences, 2014, 26(10): 2056-2064 DOI:10.1016/j.jes.2014.07.015 (  0) 0) |
| [17] |
Wang T, Sun H. Biosorption of heavy metals from aqueous solution by UV-mutant Bacillus subtilis[J]. Environmental Science and Pollution Research, 2013, 20(10): 7450-7463 DOI:10.1007/s11356-013-1767-x (  0) 0) |
| [18] |
倪吾钟, 龙新宪, 杨肖娥. 菜园土壤镉吸附-解吸特性的研究[J]. 广东微量元素科学, 2000, 7(10): 11-15 DOI:10.3969/j.issn.1006-446X.2000.10.003 (  0) 0) |
| [19] |
Tavlieva M P, Genieva S D, Georgieva V G, et al. Thermodynamics and kinetics of the removal of manganese(Ⅱ) ions from aqueous solutions by white rice husk ash[J]. Journal of Molecular Liquids, 2015, 211: 938-947 DOI:10.1016/j.molliq.2015.08.015 (  0) 0) |
| [20] |
房莉, 余健, 张彩峰, 等. 不同土地利用方式土壤对铜、镉离子的吸附解吸特征[J]. 中国生态农业学报, 2013, 21(10): 1257-1263 (  0) 0) |
| [21] |
Idrees M, Batool S, Ullah H, et al. Adsorption and thermodynamic mechanisms of manganese removal from aqueous media by biowaste-derived biochars[J]. Journal of Molecular Liquids, 2018, 266: 373-380 DOI:10.1016/j.molliq.2018.06.049 (  0) 0) |
| [22] |
荆延德, 赵石萍, 何振立. 土壤中汞的吸附-解吸行为研究进展[J]. 土壤通报, 2010, 41(5): 1270-1274 (  0) 0) |
| [23] |
Zhu Z, Gao C, Wu Y, et al. Removal of heavy metals from aqueous solution by lipopeptides and lipopeptides modified Na-montmorillonite[J]. Bioresour Technol, 2013, 147: 378-386 DOI:10.1016/j.biortech.2013.08.049 (  0) 0) |
| [24] |
宗良纲, 徐晓炎. 土壤中镉的吸附解吸研究进展[J]. 生态环境, 2003, 12(3): 331-335 DOI:10.3969/j.issn.1674-5906.2003.03.019 (  0) 0) |
| [25] |
王果. Cu、Cd在2种土壤上的吸附特征[J]. 福建农业大学学报, 1995, 24(4): 436-441 (  0) 0) |
| [26] |
廖敏, 黄昌勇, 谢正苗. pH对镉在土水系统中的迁移和形态的影响[J]. 环境科学学报, 1999, 19(1): 83-88 (  0) 0) |
| [27] |
王海燕, 吴晓芙, 胡曰利. 土壤镉活度模型与控制相研究[J]. 中南林学院学报, 2000, 20(2): 1-6 DOI:10.3969/j.issn.1673-923X.2000.02.013 (  0) 0) |
| [28] |
王金贵.我国典型农田土壤中重金属镉的吸附-解吸特征研究[D].杨陵: 西北农林科技大学, 2012.
(  0) 0) |
| [29] |
宋鑫莱, 王耀晶, 张琢, 等. 有机质的去除对磷酸盐稳定土壤铅的影响[J]. 农业环境科学学报, 2015, 34(8): 1522-1527 (  0) 0) |
| [30] |
宋波, 曾炜铨. 土壤有机质对镉污染土壤修复的影响[J]. 土壤通报, 2015, 46(4): 1018-1024 (  0) 0) |
| [31] |
朱宁.棕壤各粒级微团聚体及组成成分对Cu2+、Cd2+吸附特性和吸附机制影响的研究[D].沈阳: 沈阳农业大学, 2005.
(  0) 0) |
| [32] |
咸翼松.施用泥炭对土壤镉形态及其植物有效性的影响[D].杭州: 浙江大学, 2008.
(  0) 0) |
| [33] |
张枝枝, 张福平, 燕玉超, 等. 渭河两岸缓冲带的土壤有机质含量分布特征及其影响因子[J]. 土壤, 2017, 49(2): 393-399 (  0) 0) |
| [34] |
Hooda P S, Alloway B J. Cadmium and lead sorption behaviour of selected English and Indian soils[J]. Geoderma, 1998, 84(s 1-3): 121-134 (  0) 0) |
| [35] |
张玉芬, 刘景辉, 杨彦明, 等. 通辽地区4种典型土壤对铅、汞、镉和砷的吸附解吸特征[J]. 中国农业大学学报, 2015, 20(5): 111-118 (  0) 0) |
| [36] |
Tu C, Zheng C R, Chen H M. Effect of applying chemical fertilizers on forms of lead and cadmium in red soil[J]. Chemosphere, 2000, 41(1/2): 133-138 (  0) 0) |
| [37] |
李博, 卢瑛, 熊正琴. 施用生物质炭对集约化菜地土壤肥力质量的影响[J]. 土壤学报, 2018, 55(6): 1345-1357 (  0) 0) |
| [38] |
尚艺婕, 王海波, 史静. 生物质炭对土壤团聚体微域环境及重金属污染的作用研究[J]. 中国农学通报, 2015, 31(7): 223-228 (  0) 0) |
| [39] |
Beesley L, Marmiroli M. The immobilisation and retention of soluble arsenic, cadmium and zinc by biochar[J]. Environmental Pollution, 2011, 159(2): 474-480 (  0) 0) |
| [40] |
Lu K, Yang X, Gielen G, et al. Effect of bamboo and rice straw biochars on the mobility and redistribution of heavy metals (Cd, Cu, Pb and Zn) in contaminated soil[J]. Journal of Environmental Management, 2017, 186(Pt 2): 285-292 (  0) 0) |
| [41] |
李晓晴.枯草芽孢杆菌对花生镉积累的影响机制研究[D].济南: 山东师范大学, 2013.
(  0) 0) |
| [42] |
纪宏伟, 王小敏, 庞宏伟, 等. 枯草芽孢杆菌与巨大芽孢杆菌对土壤有效态Cd的影响研究[J]. 水土保持学报, 2015, 29(3): 325-329 (  0) 0) |
| [43] |
Liu W, Zuo Q, Zhao C, et al. Effects of Bacillus subtilis and nanohydroxyapatite on the metal accumulation and microbial diversity of rapeseed (Brassica campestris L.) for the remediation of cadmium-contaminated soil[J]. Environmental Science and Pollution Research, 2018, 25(25): 25217-25226 DOI:10.1007/s11356-018-2616-8 (  0) 0) |
| [44] |
Wang T, Sun H, Jiang C, et al. Immobilization of Cd in soil and changes of soil microbial community by bioaugmentation of UV-mutated Bacillus subtilis 38 assisted by biostimulation[J]. European Journal of Soil Biology, 2014, 65: 62-69 DOI:10.1016/j.ejsobi.2014.10.001 (  0) 0) |
| [45] |
Li H, Dong X, Da Silva E B, et al. Mechanisms of metal sorption by biochars: Biochar characteristics and modifications[J]. Chemosphere, 2017, 178: 466-478 DOI:10.1016/j.chemosphere.2017.03.072 (  0) 0) |
| [46] |
徐立芹.枯草芽孢杆菌对Cu2+和Cd2+吸附特性及机理的研究[D].沈阳: 东北大学, 2009.
(  0) 0) |
 2020, Vol. 52
2020, Vol. 52


