2. 中国科学院大学,北京 100049;
3. 杭锦后旗农牧业技术推广中心,内蒙古陕坝 015400
盐渍土在我国分布十分广泛,总面积约为3.6×107 hm2,占全国可利用土地面积的4.88%[1]。内蒙古河套灌区是我国三大灌区之一,灌溉面积为5 743 km2 (约为5.7×105 hm2)[2],是我国重要的粮食生产区,该灌区位于黄河流域上游,是我国受盐渍化影响的典型区之一,全区受盐渍化影响面积达3.9×105 hm2,占土地总面积的近69%[3]。由于大水漫灌、排水不畅等原因,导致原生与次生盐渍化并存[4],河套灌区盐渍化面积逐年扩大,大面积的耕地不得不弃耕成为盐荒地,严重制约着该地区农业的发展[5]。
河套灌区作为我国重要粮食产区必然离不开化肥的支撑,而氮肥是农业生产中必不可少的化肥,其施用不当不仅没有效果还会造成环境污染[6]。在氮肥与土壤氮素研究方面,氮肥施入土壤后氮素的去向问题越来越受到人们的重视[7]。近年来,许多学者在内蒙古自治区开展了相关研究,戴庆林等[8]通过调查研究发现20世纪50年代中期内蒙古农田土壤氮肥利用率平均为52.6%,到了90年代中期下降到27.5%,1999年时仅为21.6%;曾文治等[9]通过田间试验,分析了土壤盐分与施氮量的交互作用,结果表明随着土壤盐分的升高,葵花氮肥利用率降低,当盐分大于10 g/kg时氮肥利用率只有10%;张君等[10]的研究表明施氮量为193 ~ 291 kg/hm2时玉米氮肥利用率为21% ~ 26%。由此可知,河套地区氮肥利用效率低下,这不仅是资源的严重浪费,而且会造成农业面源污染。冯兆忠等[11]研究发现,在当前的灌溉与种植制度下,河套灌区每年可损失约2.6×107 kg N,相当于当年施氮量的20.3%。郭嘉等[12]和于瑞宏等[13]研究表明河套灌区农业退水引入的大量氮素是乌梁素海水体富营养化的重要原因。目前,为了提高氮肥利用效率,减少农业面源污染,国内外学者提出了一系列的解决措施。郭宇等[14]通过改进施肥技术,采用穴施的方式来提高向日葵产量和氮肥利用效率,赵春晓等[15]利用添加生物质炭等改良剂有效提高氮肥利用率,刘德平等[16]通过合理配施磷肥的方式,在保证作物产量前提下,适量减少氮、磷肥料的用量,提高肥料利用率,减少农业面源污染。
前人对河套地区氮肥利用效率及其带来的农业面源污染问题已经开展相关研究,并提出了一些解决方法,而对肥料氮素在土壤中转化的过程研究相对较少。众所周知,肥料氮素在土壤中的转化过程主要有水解过程、硝化及反硝化过程,又夹杂着土壤有机氮的矿化,这导致土壤氮素转化过程并不是单一的过程,而是一个多过程交织的综合过程,使得土壤氮素转化的研究工作十分复杂。张金波和宋长春[17]研究发现,最适宜微生物活动的土壤含水量介于土壤最大持水量的60%
~ 80%,温度介于0 ~ 35 ℃,Cassman和Munns[18]研究表明:土壤水分和温度对氮矿化的影响存在交互作用。事实上,温度与水分对所有土壤内部发生的转化反应都存在影响,周旋等[19]研究表明随着土壤温度升高,尿素水解与硝化作用增强;随着土壤含水量降低,尿素水解与硝化作用也随之减弱,李世清和李生秀[20]研究发现尿素水解速率在土壤质量含水量在20% ~ 30%时基本稳定,当含水率降至15%时水解速率较20% ~ 30%时下降32.5%,表明土壤含水率降低会导致尿素水解速率下降;张树兰等[21]的研究表明不同类型的土壤在各种含水率条件下硝化作用差异明显,但是当土壤含水率为田间持水量的60%时,不同土壤的最大硝化速率与硝化量均最高,同时,温度对土壤硝化作用的影响也十分巨大,土壤硝化作用在30 ℃时硝化率最高。
综上所述,前人的研究多集中在温度、水分等环境条件对土壤氮素转化的影响,但是针对盐渍化条件下土壤氮素转化的研究并不充分。为深入探究河套灌区化学氮肥施入盐渍化土壤后的转化过程,本文选取河套地区农业种植常用的基肥磷酸二铵和追肥尿素作为供试肥料,通过室内通气恒温培养的方法,研究不同土壤盐分梯度对施入化学氮肥水解和硝化过程的影响,以期为河套灌区精量施肥、减少氮素养分淋失以及其潜在的面源污染风险提供基础理论支持。
1 材料与方法 1.1 研究区概况供试土壤采自内蒙古自治区巴彦淖尔市杭锦后旗三道桥镇(40°49′42.7′′N,106°54′28.5′′E),试验区位于河套平原,地貌主要由冲击平原、洪积平原和河漫滩3种地形构成;地势西南高,东北低,海拔1 032 ~ 1 050 m;该地区属温带大陆性气候:干燥、日照时间长、昼夜温差大,年平均气温7.9 ℃,夏季日平均气温22.3 ℃;年均降雨量136.5 mm,无霜期152 d左右,年均日照3 200 h。表层土壤(0 ~ 20 cm)质地为粉砂壤土,深层土壤多为黏壤土;灌区采用一年一熟制,常年种植食葵;试验区每年春秋两季采用大水漫灌压盐,受灌水影响地下水埋深波动较大,地下水介于0.35 ~ 2.21 m,全年平均地下水埋深90.2 cm,5月初和10月初地下水埋深最深,5月中下旬和10月下旬灌水后最浅;地下水矿化度平均为3.25 g/L,属微咸水。
1.2 样品采集根据前一年作物长势、产量与实测土壤电导率值(EC5︰1,水︰土= 5︰1)选取盐分梯度差异明显的3处采样点取土,分别记做低盐(L)、中盐(M)和高盐(H)3个供试组,试验用土取自前期确定的3处采样点处的表层土壤(0 ~ 20 cm),取土后风干、研磨并过2 mm筛备用;土壤样品基础养分指标如表 1所示。
|
|
表 1 土壤样品基础养分指标 Table 1 Information of basic nutrients of tested soils |
本研究采用室内通气恒温培养的方法,研究两种肥料(尿素,磷酸二铵)施入不同盐分土壤氮素转化的规律。试验为3(盐分)× 3(氮肥含对照)完全随机试验设计,试验设置3个盐分梯度:低盐(L,1.46 dS/m)、中盐(M,2.19 dS/m)和高盐(H,3.43 dS/m),选取两种肥料:尿素(以CN表示)和磷酸二铵(以NP表示),同时以不施肥(以CK表示)为对照;共9个处理:分别记为L-CN、M-CN、H-CN、L-NP、M-NP、H-NP、L-CK、M-CK、H-CK;氮肥用量为0.1 g/kg纯氮,以水溶液的形式添加,每个处理设置3个重复。
各处理取相当于干土质量100 g的风干土装填入350 ml的圆柱形玻璃瓶,由于当地蒸发强烈,为防止培养期间土壤水分过低影响试验,故将处理含水量设置稍高,调整土壤质量含水率至30%(相当于最大土壤持水量的75%左右),瓶口上部用保鲜膜封口,并在保鲜膜上均匀扎20个小孔通气,后放入28 ℃恒温培养箱(天津泰斯特SPX-250BIII)遮光培养,培养期间定期补水(2 ~ 3 d)保持各处理水分含量相对稳定,由于取样属于破坏性取样,因此根据采样次数设置平行试验,7(采样次数)×9(处理数)× 3(重复数)=189,共189瓶,分别于培养开始第1、3、7、14、21、28、35天取土样测定硝态氮和铵态氮含量,各处理加水至质量含水率30%放置两小时水肥均匀后,采样作为各盐分梯度的初始铵态氮、硝态氮和无机氮含量。
1.4 测定方法与计算土壤EC和pH测定采用电位法测定(水︰土,5︰1;Five Easy Plus Conductivity/pH,梅特勒-托利多);土壤铵态氮(NH4+-N)含量测定采用2 mol/L KCl浸提-靛酚兰比色法[22];土壤硝态氮(NO3--N)含量测定采用双波长紫外分光光度计法[23];土壤有机质测定采用重铬酸钾容量法-外加热法[22];土壤全氮含量测定采用半微量开氏法;土壤有效磷的测定采用0.5 mol/L NaHCO3法。
土壤无机氮含量(mg/kg)=NH4+-Nti+NO3--Nti
水解速率(mg/(kg·d))=(trtNH4+-Nti+1–trtNH4+-Nti)/ (ti+1–ti)
硝化速率(mg/(kg·d))=(trtNO3--Nt i+1–trtNO3--Nti)/ (ti+1–ti)
净水解速率(mg/(kg·d))=[trt (NH4+-Nti+1–NH4+-Nti)–CK(NH4+-Nti+1–NH4+-Nti)]/(ti+1–ti)
净水解量(mg/kg)= trt (NH4+-Nti+1-NH4+-Nti)–CK (NH4+-Nti+1–NH4+-Nti)
净硝化速率(mg/(kg·d))=[trt (NO3--Nti+1–NO3--Nti)–CK(NO3--Nti+1–NO3--Nti)]/(ti+1–ti)
净硝化量(mg/kg)= trt (NO3--Nti+1–NO3--Nti)–CK (NO3--Nti+1–NO3--Nti)
无机氮转化量(mg/kg)=净硝化量(mg/kg)+净水解量(mg/kg)
式中:NH4+-N表示土壤铵态氮含量,NO3--N表示土壤硝态氮含量;trt表示土壤盐分、施肥处理,CK表示不施肥对照;ti+1表示后一次取样,ti表示前一次取样。
1.5 数据处理采用Microsoft Excel 2016和SAS 9.4进行数据计算与统计分析,处理间显著性差异采用Duncan新复极差检验法(α= 0.05,0.01),SigmaPlot 12.5软件绘图。
2 结果与分析 2.1 土壤盐分对氮肥水解过程的影响各处理肥料水解速率和净水解速率结果列于表 2,由表 2可知,各土壤盐分梯度下,尿素与二铵的表观水解速率与净水解速率均于培养第1天达到峰值,并且在达到峰值后随即快速下降,此时肥料净水解速率在数值上即为净水解量。对比不同盐分梯度下两种肥料第1天的水解速率发现:尿素处理的表观水解速率在不同盐分梯度下差异不明显,均在60 mg/(kg·d)左右,但不同土壤盐分梯度下的净水解速率差距较大,分别为81.08 mg/(kg·d)(L-CN)、73.39 mg(kg·d)(M- CN)、59.13 mg/(kg·d)(H-CN),当土壤盐分从中盐上升到高盐时,净水解速率降低了24%;磷酸二铵处理的表观水解速率和净水解速率随着土壤盐分升高,总体都呈现出增大的趋势,其中M-NP的净水解速率为91.12 mg/(kg·d),高于H-NP的87.32 mg/(kg·d),二者远高于L-NP的68.22 mg/(kg·d)。
|
|
表 2 不同盐分处理肥料水解速率(mg/(kg·d)) Table 2 Hydrolysis rates of fertilizers under different soil salinities |
以上结果表明:随着土壤盐分升高,尿素净水解速率降低,且盐分越高降低效果越明显,而土壤盐分升高对磷酸二铵处理净水解速率的影响表现为先促进后抑制,但高盐处理水解速率仍高于低盐处理。土壤盐分相同时,低盐处理下尿素水解作用要强于磷酸二铵,而中盐、高盐处理下磷酸二铵则要强于尿素。
2.2 土壤盐分对氮素硝化过程的影响硝化速率的大小可以直观反映土壤硝化作用的强度,表 3中列出了各处理的表观硝化速率与净硝化速率。由表 3可知,低盐、中盐处理中尿素与磷酸二铵的净硝化速率在培养第7天时均达到峰值,分别为12.54 mg/(kg·d) (L-CN)、11.52 mg/(kg·d)(M-CN)、17.27mg/(kg·d) (L-NP)、17.82 mg/(kg·d)(M-NP),培养第14天时分别为2.24 mg/(kg·d)(L-CN)、3.27 mg/ (kg·d)(M-CN)、3.46 mg/(kg·d)(L-NP)、1.40 mg/(kg·d) (M-NP),相较培养第7天分别降低了82%、72%、80%、92%,这表明培养进行到14 d时硝化反应基本完成;而高盐处理前3 d净硝化速率非常低,有些甚至出现了负值,表明此时反硝化作用占据主导地位,土壤硝化反应非常微弱,然而此时表观硝化速率依旧为正值,原因可能是土壤中原有易矿化氮矿化产生的铵态氮被硝化导致了表观上土壤硝态氮的增加。在培养3 d后,高盐处理净硝化速率明显提高,在培养第7天时尿素和二铵的净硝化速率分别为7.27 mg/(kg·d)和9.40 mg/(kg·d),在培养第14天时尿素与二铵的净硝化速率分别为8.16 mg/(kg·d)和8.83 mg/(kg·d),依旧维持较高水平,培养第21天时高盐处理的净硝化速率大大降低,尿素处理硝化速率降至0.33 mg/(kg·d),而磷酸二铵处理则降至1.38 mg/(kg·d),此时土壤硝化反应基本完成。
|
|
表 3 不同盐分处理土壤硝化速率(mg/(kg·d)) Table 3 Nitrification rates under different soil salinities |
对比相同盐分梯度下的土壤净硝化速率发现:低盐、中盐处理中,尿素处理的硝化作用在培养第1天就已经开始,而磷酸二铵处理在培养第1天净硝化速率为负值,此时硝化作用仍未开始,上述现象表明在土壤盐分较低的情况下,尿素的硝化作用总是先于磷酸二铵发生,但尿素净硝化速率的峰值均低于磷酸二铵处理,而高盐处理中尿素与磷酸二铵的硝化作用几乎同时发生,净硝化速率峰值尿素依旧低于磷酸二铵处理,以上结果表明:在等氮条件下,尿素比二铵更易被硝化,而二铵在土壤中的硝化作用要强于尿素。
2.3 不同盐分梯度下土壤氮素含量变化规律本次试验旨在研究氮肥施入后,土壤盐分对肥料氮素转化的影响,土壤无机氮素含量的动态变化能够反映肥料在土壤中转化轨迹。图 1、图 2、图 3分别为培养期间各盐分梯度下不同施肥处理土壤铵态氮、硝态氮、无机氮含量的变化。由图 1可知,尿素和磷酸二铵施入土壤后迅速转化成为铵态氮,各盐分处理土壤铵态氮含量均于第1天出现峰值,分别为85.2 mg/kg(L-CN)、75.5 mg/kg(M-CN)、74.9 mg/kg(H- CN)、72.3 mg/kg(L-NP)、93.2 mg/kg(M-NP)、103.1 mg/kg (H-NP)。低盐与中盐处理中,尿素与磷酸二铵处理土壤铵态氮达到峰值后迅速下降,其中尿素处理第3天基本降至最低与对照处理无显著差异,磷酸二铵处理第3天时土壤铵态氮含量降至峰值的50%左右;高盐处理两种肥料峰值也出现在第1天,但达到峰值后铵态氮降低速率缓慢,培养第3天两种肥料处理的土壤铵态氮含量在70 mg/kg以上仍处于较高水平,到培养第7天时,所有处理土壤铵态氮含量基本降至最低与对照处理土壤铵态氮含量相近。总体而言,低盐处理与中盐处理的变化趋势较为一致,高盐处理土壤铵态氮在土壤中维持较高含量时间相较低盐、中盐处理更长,但也在培养7 d后降至最低;低盐处理中尿素处理的土壤铵态氮含量峰值高于磷酸二铵处理,中盐与高盐处理的磷酸二铵峰值均高于尿素;在3种盐分梯度下磷酸二铵水解产生的铵态氮与尿素相比在土壤中存在的时间更长,更具持续性。
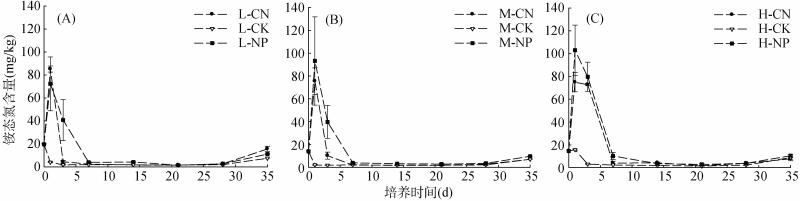
|
图 1 培养期间土壤铵态氮含量变化 Fig. 1 Changes in soil ammonium nitrogen contents during incubation |
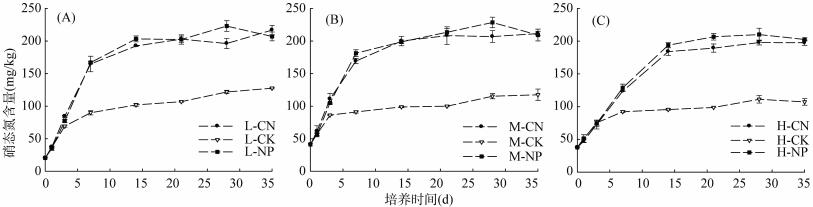
|
图 2 培养期间土壤硝态氮含量变化 Fig. 2 Changes in soil nitrate nitrogen contents during incubation |
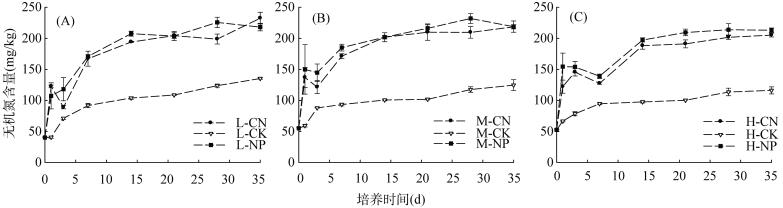
|
图 3 培养期间土壤无机氮含量变化 Fig. 3 Changes in soil inorganic nitrogen contents during incubation |
如图 2所示,施肥处理土壤硝态氮含量在各个土壤盐分梯度下的变化规律一致:土壤硝态氮含量随着培养时间增加而增加,增速随时间降低,7 d内土壤硝态氮含量基本呈线性增长,14 d以后略有增加但基本保持稳定;上文对硝化速率的分析结果显示:低盐、中盐处理在14 d内硝化作用基本完成,而高盐处理21 d时硝化作用基本完成,这一结果与图 2曲线变化规律相一致。考察图 2散点间直线斜率可以发现低、中盐处理斜率明显要大于高盐处理,这直观地反映出盐分升高降低土壤硝化速率。各个盐分梯度下磷酸二铵的曲线多处于尿素处理的上方,说明了尿素的硝化作用要弱于磷酸二铵,这与上文计算所得结果相一致。
施肥处理土壤无机氮含量在各土壤盐分梯度下总体呈现出随着培养时间增加而增加的趋势,但如图 3所示,添加肥料后各盐分梯度处理土壤无机氮含量变化曲线均出现了不同程度的向内凹陷,导致曲线不单调增加,低盐和中盐处理曲线内陷均出现在第3天,高盐处理出现在第7天。尿素与磷酸二铵处理都出现了这种现象,且同一土壤盐分梯度下出现的时间一致,但各土壤盐分不施肥处理的土壤无机氮含量随时间增加而单调增加并未出现这种现象,这说明出现这种现象的原因是施肥。对比土壤铵态氮含量变化(图 1),可以发现,无机氮曲线内陷的时间与土壤铵态氮快速下降的时间一致,比较施肥组与对照组土壤硝态氮含量变化(图 2),不难发现无机氮曲线内陷出现的时间与施肥组和对照组土壤硝态氮含量曲线开始分离的时间也一致。
肥料类型与土壤盐分对氮素含量影响的方差分析结果列于表 4、表 5,结果表明:肥料种类对土壤硝态氮、铵态氮含量的变化并无显著差异(P > 0.05),而土壤无机氮含量的变化上,磷酸二铵显著高于尿素,差异达了极显著水平(P < 0.01),这可能是由于磷酸二铵中含有磷酸根,带入土壤的磷元素促进了氮素的矿化,从而增加了无机氮的积累,Reed等人[26]的研究亦表明磷添加会提高土壤无机氮浓度。土壤盐分对土壤铵态氮含量变化影响比较复杂:高盐处理显著高于中盐处理(P < 0.05),低盐处理介于二者之间差异并不显著;土壤硝态氮含量变化受土壤盐分影响结果则有所不同,中盐处理高于高盐处理且差异极为显著,同时又显著高于低盐处理,而低盐处理与高盐处理差异并不显著;无机氮含量的变化结果较为一致,中盐处理显著高于低盐、高盐处理。
|
|
表 4 肥料种类对不同氮素形态影响的显著性检验 Table 4 Significance tests of effects of fertilizers on different forms of soil nitrogen |
|
|
表 5 土壤盐分对氮素形态影响的显著性检验 Table 5 Significance tests of effects of soil salinities on different forms of soil nitrogen |
本试验研究结果表明,土壤盐分含量对两种肥料的转化规律影响存在一致性,尿素与磷酸二铵两种肥料施入土壤后,土壤铵态氮含量均于第1天达到峰值,随后开始下降,这可能是因为本试验将肥料以水溶液的形式加入到培养体系中,不存在土壤湿润肥料颗粒使其有效成分溶解再进入土壤的过程,因此本试验水解速率较高。低盐、中盐处理净水解速率从培养试验的第3天开始都为负值,表明此时土壤铵态氮量开始减少,此时的净水解速率实际表征的是土壤铵态氮的消耗速率,而在高盐条件下,两种氮肥水解产生的铵态氮在培养第3天后才开始大量转化,相较于低盐、中盐处理推迟了2 d,这说明较高的土壤盐分会抑制铵态氮的转化,导致铵态氮在土壤中滞留一段时间。通过对不同肥料净水解速率的研究,我们发现土壤盐分升高会明显抑制尿素水解,Awad等[27]通过室内试验证明当盐分从40 meq/L升高到200 meq/L时尿素水解速率呈现下降趋势,本试验结果与此一致。土壤盐分越低尿素水解产生的铵态氮越多、转化得越快,这说明土壤盐分对尿素的水解作用和水解产物的转化都存在抑制作用;而土壤盐分升高对磷酸二铵的水解表现为先促进后抑制的规律,中盐水解速率最高、转化最快,低盐处理转化量较高盐处理低,但消耗速率高于高盐处理。李寿田等[28]通过培养试验研究了氯化钾和磷酸二氢钙添加对氯化铵氮转化的影响,发现添加氯化钾会增加土壤铵态氮含量并抑制硝化作用,而氯化钾既是钾肥也是盐,其添加会使得土壤盐分升高,本试验结果与此也一致;本次试验中各土壤盐分条件下磷酸二铵处理铵态氮含量普遍高于尿素,这可能是加入的磷酸根会延缓土壤铵态氮转化所致。低盐处理磷酸二铵水解产生的铵态氮较中、高盐处理低的原因,可能是低盐土有机质丰富、吸附能力强[29],磷酸二铵通过水溶液加入土体后铵根离子随水下渗时被土壤吸附。
3.2 土壤盐分对硝化作用的影响研究表明:硝化作用分两个阶段完成,即铵态氮氧化为亚硝态氮的氨氧化过程和亚硝态氮氧化为硝态氮的亚硝酸盐氧化过程[30]。本试验中高盐处理净硝化速率升高出现时间相较低盐、中盐处理推迟,综合图 1、图 2和表 2各盐分处理肥料水解速率,可以推测产生这种延迟现象的原因可能是,高盐处理土壤铵态氮在第3天时只有少部分发生转化,大量铵态氮滞留在土壤中,土壤无机氮主要以铵态氮为主,此时硝化反应的第一步氨氧化反应只有部分进行,而氨氧化反应是硝化反应的限速步骤,氨氧化反应不充分使得亚硝酸盐氧化反应由于缺乏底物无法进行,造成了净硝化速率一直保持很低的水平,培养第7天时土壤铵态氮基本与对照无异,此时氨氧化反应基本完成,亚硝酸盐氧化反应得以进行,此时净硝化速率升高,这解释了图 3中土壤无机氮回落出现的原因,即氮肥添加引入的土壤铵态氮的氨氧化消耗速率高于亚硝酸盐氧化速率,导致土壤铵态氮损失大于硝态氮的增加,张国桢等[31]的研究也印证了这一观点。Fernando等[32]培养试验的结果显示:在盐渍土中施入铵态氮肥后,土壤铵态氮含量在施入后随即快速下降,同时亚硝态氮含量激增,土壤硝态氮在培养7 d后才开始增加,本次试验高盐处理的结果与此一致。较高的土壤盐分会抑制氨氧化反应,造成不同盐分梯度处理的亚硝酸盐氧化反应的起始时间并不一致,故同一时段各盐分梯度下净硝化速率大小不能完全反映各处理对硝化作用的影响,且高盐处理净硝化速率峰值出现较低盐与中盐处理亦迟,由于本次试验采样间隔不均,前7 d采样相对密集,导致高盐处理净硝化速率峰值数值上较低盐、中盐处理偏低,故直接比较亦不科学。通过考察肥料净硝化量可知,低盐、中盐和高盐处理尿素净硝化积累量分别为:86.21、93.61、85.78 mg/kg,其中中盐处理土壤净硝化量最大,低盐、高盐处理净硝化量基本相等;磷酸二铵在低盐、中盐和高盐处理下的净硝化积累量分别为95.17、113.37、107.83 mg/kg,中盐处理的净硝化量依然最大,但磷酸二铵在高盐处理下净硝化量高于低盐处理,这表明土壤盐分升高,尿素和磷酸二铵处理的硝化过程均表现出先促进后抑制的作用。有学者试验结果表明硝化作用对土壤盐分含量十分敏感,随着土壤含盐量的增加,硝化作用受到抑制[33]。然而有研究表明:低盐分能刺激氮的硝化和矿化作用[34],Sudarno等[35]采用固定床反应器动态研究了盐分等条件对硝化作用的影响,结果表明:盐分变化对氨氧化速率影响表现为:盐分小于35 g/kg时氨氧化速率基本稳定,当盐分大于35 g/kg时,氨氧化速率直线下降;亚硝酸盐氧化速率随盐分升高先增加后降低,35 g/kg时最大,即硝化速率随盐分升高先上升后下降。Nejidat[36]通过添加氯化钠研究盐分对不同土壤硝化过程的影响,试验研究了12种不同环境下的土壤,结果表明:盐胁迫对不同土壤硝化作用的影响并不一致,这是由于不同环境下的硝化细菌种群不同,盐胁迫的耐受性也不尽相同。这说明土壤盐分对氮素转化的影响不能一概而论,需要根据当前区域的微生物群落进行具体分析。本次试验结果表明土壤盐分一定程度上可促进河套地区农田土壤的硝化作用,并不完全表现出抑制作用。
3.3 氮肥种类对氮素转化的影响氮肥种类对其氮素转化过程亦存在重要影响,本次试验统计分析结果表明:在等氮输入条件下,磷酸二铵施入土壤转化形成的铵态氮、硝态氮和无机氮含量均高于尿素处理,这主要是因为磷酸二铵中含有磷元素,额外加入的磷元素会促进氮素的转化。前人通过田间试验研究了氮磷相互作用的影响,结果表明施用磷肥可以提高氮肥利用率,促进氮的转化[37]。李金燕[38]通过培养试验研究了含水率与磷肥施用量对尿素氮转化的影响,结果表明,含水率相同的条件下,铵态氮含量随施磷量的增加而增加,本次试验结果与此相一致;硝态氮浓度变化则与磷添加无关。而Mori等[39]的研究结果表明,磷添加不仅能够缓解土壤磷短缺,而且加速异养微生物活动消耗土壤氧气形成厌氧环境,导致反硝化作用增强,反硝化作用的增强会消耗土壤硝态氮导致其含量降低。本试验结果与此并不一致,这可能是因为本试验中土壤盐分抑制了反硝化细菌活性使得硝态氮含量降低不明显。磷酸二铵常被作为基肥使用,人们对其氮素转化过程关注较少,对其盐胁迫下氮素转化的关注更少,本次试验结果表明等氮条件下其转化产生的各形态氮素量高于尿素,说明其施用不当产生的环境污染可能比尿素还严重,这需要引起更多的重视。
4 结论河套灌区土壤盐度对肥料氮素转化有很大影响:①土壤盐分升高明显抑制尿素水解,却促进磷酸二铵的水解,高土壤盐分会抑制铵态氮的转化,使其在土壤中短暂滞留;②土壤盐分升高对尿素与磷酸二铵硝化作用的影响均表现为先促进后抑制,最大硝化量均出现在中盐处理(2.19 dS/m);③在等氮输入条件下,磷酸二铵施用后转化产生的无机氮总体高于尿素处理;④各处理无机氮含量变化曲线均出现短期下降并不单调上升,其原因是土壤铵态氮的消耗速率高于硝化作用产生硝态氮的速率。
| [1] |
杨劲松. 中国盐渍土研究的发展历程与展望[J]. 土壤学报, 2008, 45(5): 837-845 (  0) 0) |
| [2] |
王文达, 兰敬芳. 内蒙古河套灌区耕地与盐荒地盐分变化规律研究[J]. 现代农业科技, 2017(3): 156-158 (  0) 0) |
| [3] |
黄权中, 徐旭, 吕玲娇, 等. 基于遥感反演河套灌区土壤盐分分布及对作物生长的影响[J]. 农业工程学报, 2018, 34(1): 102-109 (  0) 0) |
| [4] |
杨劲松, 姚荣江, 王相平, 等. 河套平原盐碱地生态治理和生态产业发展模式[J]. 生态学报, 2016, 36(22): 7059-7063 (  0) 0) |
| [5] |
景宇鹏, 段玉, 妥德宝, 等. 河套平原弃耕地土壤盐碱化特征[J]. 土壤学报, 2016, 53(6): 1410-1420 (  0) 0) |
| [6] |
朱兆良. 稻田土壤中氮素的转化与氮肥的合理施用[J]. 化学通报, 1994(9): 15-17, 22 (  0) 0) |
| [7] |
朱兆良. 我国土壤供氮和化肥氮去向研究的进展[J]. 土壤, 1985, 17(1): 2-9 (  0) 0) |
| [8] |
戴庆林, 郑海春, 王芬棠, 等. 内蒙古地区化肥施用与肥分利用现状[J]. 内蒙古农业科技, 2000, 28(3): 3-6 (  0) 0) |
| [9] |
曾文治, 徐驰, 黄介生, 等. 土壤盐分与施氮量交互作用对葵花生长的影响[J]. 农业工程学报, 2014, 30(3): 86-94 (  0) 0) |
| [10] |
张君, 赵沛义, 潘志华, 等. 基于产量及环境友好的玉米氮肥投入阈值确定[J]. 农业工程学报, 2016, 32(12): 136-143 (  0) 0) |
| [11] |
冯兆忠, 王效科, 冯宗炜, 等. 河套灌区秋浇对不同类型农田土壤氮素淋失的影响[J]. 生态学报, 2003, 23(10): 2027-2032 (  0) 0) |
| [12] |
郭嘉, 韦玮, 于一雷, 等. 乌梁素海湿地富营养化研究进展[J]. 生态学杂志, 2015, 34(11): 3244-3252 (  0) 0) |
| [13] |
于瑞宏, 刘廷玺, 许有鹏, 等. 人类活动对乌梁素海湿地环境演变的影响分析[J]. 湖泊科学, 2007, 19(4): 465-472 (  0) 0) |
| [14] |
郭宇, 李仙岳, 丁宗江, 等. 不同施氮方式对向日葵氮肥利用效率的影响[J]. 灌溉排水学报, 2018, 37(7): 20-27 (  0) 0) |
| [15] |
赵春晓, 郑海春, 郜翻身, 等. 不同处理对河套灌区玉米土壤硝态氮和铵态氮动态及氮肥利用率的影响[J]. 中国土壤与肥料, 2017(6): 99-104 (  0) 0) |
| [16] |
刘德平, 杨树青, 史海滨, 等. 氮磷配施条件下作物产量及水肥利用效率[J]. 生态学杂志, 2014, 33(4): 902-909 (  0) 0) |
| [17] |
张金波, 宋长春. 土壤氮素转化研究进展[J]. 吉林农业科学, 2004, 29(1): 38-43, 46 (  0) 0) |
| [18] |
Cassman K G, Munns D N. Nitrogen mineralization as affected by soil moisture, temperature, and depth[J]. Soil Science Society of America Journal, 1980, 44(6): 1233-1237 DOI:10.2136/sssaj1980.03615995004400060020x (  0) 0) |
| [19] |
周旋, 吴良欢, 戴锋. 土壤温度和含水量互作对抑制剂抑制氮素转化效果的影响[J]. 农业工程学报, 2017, 33(20): 106-115 (  0) 0) |
| [20] |
李世清, 李生秀. 影响土壤尿素水解速率的一些因子[J]. 植物营养与肥料学报, 1999, 5(2): 156 (  0) 0) |
| [21] |
张树兰, 杨学云, 吕殿青, 等. 温度、水分及不同氮源对土壤硝化作用的影响[J]. 生态学报, 2002, 22(12): 2147-2153 (  0) 0) |
| [22] |
鲍士旦. 土壤农化分析[M].
中国农业出版社, 北京, 2000
(  0) 0) |
| [23] |
中华人民共和国国家质量监督检验检疫总局, 中国国家标准化管理委员会.土壤硝态氮的测定紫外分光光度法: GB/T 32737—2016[S].北京: 中国标准出版社, 2017.
(  0) 0) |
| [24] |
Zhang M Y, Wang W J, Wang D J, et al. Short-term responses of soil nitrogen mineralization, nitrification and denitrification to prescribed burning in a suburban forest ecosystem of subtropical Australia[J]. Science of The Total Environment, 2018, 642: 879-886 DOI:10.1016/j.scitotenv.2018.06.144 (  0) 0) |
| [25] |
石博文, 赖欣, 李洁, 等. 尿素与有机肥配施对棕红壤氮素转化的影响[J]. 核农学报, 2017, 31(5): 938-945 (  0) 0) |
| [26] |
Reed S C, Seastedt T R, Mann C M, et al. Phosphorus fertilization stimulates nitrogen fixation and increases inorganic nitrogen concentrations in a restored prairie[J]. Applied Soil Ecology, 2007, 36(2): 238-242 (  0) 0) |
| [27] |
Awad Elkarim A H, Elmahi Y G. Effect of soil salinity and sodicity on urea hydrolysis in three soil orders[J]. University of Kharotum Journal of Agricultural Sciences, 1995 (  0) 0) |
| [28] |
李寿田, 周健民, 王火焰, 等. 磷酸二氢钙和氯化钾对氯化铵处理黄泥土水溶性铵态氮和硝态氮的影响[J]. 土壤, 2012, 44(6): 941-946 (  0) 0) |
| [29] |
任子航, 马秀兰, 王而力, 等. 不同腐殖质组分有机矿质复合体对铵态氮的富集特征[J]. 生态与农村环境学报, 2015, 31(1): 106-111 (  0) 0) |
| [30] |
贺纪正, 张丽梅. 土壤氮素转化的关键微生物过程及机制[J]. 微生物学通报, 2013, 40(1): 98-108 (  0) 0) |
| [31] |
张国桢, 李世清. 三种氨态氮肥在石灰性土壤中硝化作用的模拟研究[J]. 干旱地区农业研究, 2007, 25(6): 177-182, 211 (  0) 0) |
| [32] |
López-Valdez F, Fernández-Luque o F, Luna-Guido M L, et al. Microorganisms in sewage sludge added to an extreme alkaline saline soil affect carbon and nitrogen dynamics[J]. Applied Soil Ecology, 2010, 45(3): 225-231 DOI:10.1016/j.apsoil.2010.04.009 (  0) 0) |
| [33] |
徐万里, 刘骅, 张云舒. 新疆盐渍化土壤氮素矿化和硝化作用特征[J]. 西北农林科技大学学报(自然科学版), 2007, 35(11): 141-145 (  0) 0) |
| [34] |
李建兵, 黄冠华. 盐分对粉壤土氮转化的影响[J]. 环境科学研究, 2008, 21(5): 98-103 (  0) 0) |
| [35] |
Sudarno U, Winter J, Gallert C. Effect of varying salinity, temperature, ammonia and nitrous acid concentrations on nitrification of saline wastewater in fixed-bed reactors[J]. Bioresource Technology, 2011, 102(10): 5665-5673 DOI:10.1016/j.biortech.2011.02.078 (  0) 0) |
| [36] |
Nejidat A. Nitrification and occurrence of salt-tolerant nitrifying bacteria in the Negev desert soils[J]. FEMS Microbiology Ecology, 2005, 52(1): 21-29 (  0) 0) |
| [37] |
邢丹, 李淑文, 夏博, 等. 磷肥施用对冬小麦产量及土壤氮素利用的影响[J]. 应用生态学报, 2015, 26(2): 437-442 (  0) 0) |
| [38] |
李金燕.磷影响尿素氮转化的生物化学过程研究[D].长春: 吉林农业大学, 2008.
(  0) 0) |
| [39] |
Mori T, Ohta S, Ishizuka S, et al. Effects of phosphorus addition with and without ammonium, nitrate, or glucose on N2O and NO emissions from soil sampled under Acacia mangium plantation and incubated at 100% of the water-filled pore space[J]. Biology and Fertility of Soils, 2013, 49(1): 13-21 DOI:10.1007/s00374-012-0690-5 (  0) 0) |
2. University of Chinese Academy of Sciences, Beijing 100049, China;
3. Inner Mongolia Hangjinhouqi Centre of Agricultural Technology Extension, Shanba, Inner Mongolia 015400, China
 2020, Vol. 52
2020, Vol. 52


