2. 中国科学院土壤环境与污染修复重点实验室(南京土壤研究所),南京 210008;
3. 安徽农业大学资源与环境学院,合肥 230036;
4. 安徽外国语学院国际旅游学院,合肥 231201
土壤作为生态环境的重要组成部分,是人类赖以生存的主要资源之一,也是生物地球化学循环的物质储存库。土壤有机质是土壤中各种含碳有机化合物的总称,它与矿物质一起构成土壤的固相部分。土壤有机质是衡量土壤肥力的重要指标,对作物生长、土壤中的物质循环和代谢具有十分重要的作用[1]。土壤微生物是土壤具有生命力的重要部分,土壤中细菌最多,放线菌其次,真菌再次之,藻类、原生动物和微型动物等由多到少依次排列。它们在土壤形成和发育过程中起重要作用,同时,它们也是使土壤有机污染物降解的动力[2-3]。因此,土壤微生物群体是评价土壤质量和健康状况的重要指标之一。近些年,随着我国产业结构的调整及城市化进程的加快,全国大中城市都实施了“退二进三”、“退城进园”的政策,大批涉及化工、冶金、石油、交通运输、轻工等行业的污染企业先后搬迁或关闭。2014年,《全国土壤污染状况调查公报》显示,我国总体的土壤环境质量不容乐观,土壤污染总的点位超标率为16.1%,重污染企业用地的点位超标率为36.3%。据不完全统计,目前国内约有几十万个污染场地。政府或业主对这些土壤进行再利用时,必须进行前期的修复[4]。基于H2O2或芬顿(Fenton)试剂的化学氧化技术被广泛地应用于场地有机污染土壤的修复。芬顿试剂法主要是由亚铁离子(Fe2+)和H2O2发生反应迅速生成羟基自由基(·OH)来实现有机污染物的降解[5]:H2O2+ Fe2+ → ·OH + OH- + Fe3+,·OH具有较高的氧化还原电势(E0= 2.8 V)[6],它不仅能够有效无选择性地快速降解土壤中的各种有机污染物,而且还能实现污染物的矿化[6-10]。宋刚练等[11]成功地将芬顿氧化法应用于上海某工业场地的苯并[a]蒽和苯并[b]荧蒽修复中。裴晓哲和刘守清[12]研究了芬顿氧化法对敌百虫污染土壤的修复效果,发现芬顿氧化法能够快速高效地降解土壤中的污染物。Ojinnaka等[13]考察了pH对芬顿试剂氧化降解污染土壤中轻质原油效率的影响,发现在酸性条件下芬顿试剂能够高效降解土壤中的原油。
但以Fe2+/H2O2构成的均相芬顿体系在实际的修复过程中存在一些问题,比如此反应需要在强酸的条件下发挥作用(通常pH < 3.0)、反应速度不容易控制、自由基利用效率低等[14-16]。为了克服这些问题,柠檬酸通常作为Fe2+的络合剂来控制Fe2+的反应速率,从而大大提高自由基的利用率和污染物的修复效率[17]。另外,有研究表明,土壤中的一些矿物如铁锰氧化物、钒矿物等也能催化分解H2O2产生自由基来降解污染物从而达到修复的目的[18-19]。因此,在实际场地的修复过程中,有一些企业尝试在土壤中直接添加H2O2,利用土壤本身的矿物活化分解H2O2产生自由基来降解污染物。Lu等[20]研究了近中性pH条件下类芬顿试剂对石油污染土壤中碳氢化合物的降解效果,发现当H2O2与Fe2+摩尔比为200∶1且pH为7.0时达到最佳去除效果。Xu等[21]探究了不同改性芬顿试剂对土壤中原油选择性降解的影响,发现分批次加入低浓度的H2O2对土壤中总石油烃降解效果最佳。江闯等[22]研究了类芬顿氧化法修复总石油烃类污染土壤的效果,发现此修复方法可行且高效。本课题前期研究也发现,五氧化二钒能够高效活化H2O2产生·OH降解邻苯二甲酸二乙酯[23]。
H2O2用于有机污染土壤修复时,H2O2的引入势必对土壤基本性质、微生物特征等产生影响,最终影响土壤的生态功能[24]。但目前关于这方面的研究较少,亟需系统评价H2O2对土壤生态功能等方面指标如土壤有机质、铵态氮、硝态氮和微生物的影响。为此,本文将系统研究H2O2、类芬顿体系如V2O3/H2O2和柠檬酸铁/H2O2对土壤有机质、铵态氮、硝态氮及微生物等指标的影响,以为评价基于H2O2化学氧化修复污染土壤的生态安全提供支撑。
1 材料与方法 1.1 供试土壤供试土壤为采自江苏省张家港市的某渗育型水稻土,采集深度为0 ~ 20 cm,经室内自然风干、研磨过10目筛备用。土壤中有机质含量为37.2 g/kg,pH为6.4,钒基底值为84.4 mg/kg,电导率为307.85 μs/cm,阳离子交换量为15.1 cmol/kg,Fe2O3含量为8.23 g/kg,Al2O3含量为1.03 g/kg。
1.2 药品与试剂过氧化氢(H2O2),购自国药集团化学试剂有限公司,质量分数30%;三氧化二钒(V2O3,99%),购自Stream Chemicals, INC;氯化钾、柠檬酸、七水合硫酸亚铁、硫酸钛为分析纯,购自南京化学试剂有限公司。
1.3 仪器与设备称量天平:Sartorius(BAS124S),赛多利斯科学仪器有限公司;离心机:TG16-WS,上海卢湘仪离心机仪器有限公司;紫外可见分光光度计:UV2700,日本岛津;超纯水仪:Ultrapure(type1)water,德国密理博;冻干机:ALPHA 1-2 LD plus,德国格马;pH计:Thermo scientific,赛默飞世尔科技有限公司;恒温震荡箱:IS-RDV1,上海珂淮仪器有限公司。
1.4 试验方法 1.4.1 不同处理H2O2投加试验H2O2的用量采用场地土壤修复的常用剂量200 mmol/L,通过分批投加的方式,投加4次,每次50.0 mmol/L,待上一批次H2O2消耗完毕后,继续添加50 mmol/L。试验中液土比为2∶1(V/m),设置3种处理方式:①单独投加H2O2体系:称取10 g土置于100 ml敞口三角瓶内,H2O2的投加浓度为50 mmol/L,分4次投加,每次投加0.2 ml 5.0 mol/L的H2O2母液,最终反应体系为20 ml土壤悬液;②V2O3/ H2O2体系:称取10 g土置于100 ml敞口三角瓶内,H2O2的投加方式和量同处理①,V2O3粉末投加量为0.001 g;③柠檬酸铁/H2O2体系:称取10 g土置于100 ml敞口三角瓶内,H2O2的投加方式和量同处理①,用柠檬酸和硫酸亚铁按照1∶1(n/n)比例配制柠檬酸铁溶液,再以柠檬酸铁溶液与H2O2比例1∶100 (V/V)投加。试验同时设置单独10 g土+ 20 ml超纯水的处理作为对照体系。
每个处理设置8组样品,每组样品3个平行,采用破坏性取样方式,分别于反应后1、3、5、7、10、14、21、28 d混匀后吸取5 ml上层液过0.45 μm水系针式滤器,将滤液保存于4℃冰箱备测。测定滤液中H2O2浓度和溶解性有机碳(DOC)含量,根据土壤中实际测得的H2O2浓度来确定添加H2O2的时间。当H2O2完全分解,再继续添加浓度为50 mmol/L的H2O2于剩余样品中,以此类推。并将剩余的水土混合样品分别全部转移到50 ml康宁管后进离心机(TG16-WS,上海),以4 500 r/min速度离心10 min后倒掉上清液,置于-70℃冰箱冷冻后进冻干机中冷冻干燥48 h后常温保存备用。
1.4.2 土壤铵态氮和硝态氮的提取将经过冷冻干燥处理的土壤样品置于研钵中研磨过筛后,按照固液比1∶4(m/V)的比例,称取2.0 g土置于15 ml康宁管,投加8 ml浓度为2 mol/L的KCl溶液后置于条件为25℃、200 r/min的恒温振荡箱中提取1 h,再以4 500 r/min的速度离心8 min后,取5 ml上清液至离心管中待测。
1.4.3 土壤微生物的提取本试验使用的是MP FastDNA提取试剂盒法来提取经冷冻干燥处理后保存备用土壤中的DNA。具体实验步骤如下:称取已冷冻干燥过的0.5 g土壤到2.0 ml的裂解介质管中,在FastPrep核酸提取仪中混匀;将裂解介质管离心,提取上清液转移到离心管中,在上清液中加入蛋白质沉淀剂(PPS)试剂,手动混匀;再次离心后,提取上清液转移到离心管中,在上清液中加入结合基质悬浮液;将离心管上下倒置2 min后静置,使DNA附着于结合基质悬浮液并等待二氧化硅基质沉淀;弃上清液,重悬结合基质中的剩余液体。将混合物转移到旋转过滤器(置于接管中)中,多次离心,倒空接管中的液体;添加盐/乙醇洗涤液(SEW-M)到旋转过滤器混匀再次离心,倒空接管,重复操作一次;离心旋转过滤器,清干剩余的SEW-M,移动旋转过滤器到干净的离心管中,室温风干5 min;加入DNA洗脱液(DES)轻轻混匀后,放置在水浴锅中水浴5 min后离心过滤;将提取好的DNA放置在冰上,使用超微量分光光度计测定DNA的浓度和纯度。针对DNA含量较低的或是杂质较多的,采用PCR扩增并经过纯化以后,再进行高通量测序,PCR扩增的条件如下:95℃预变性5 min;95 ℃变性45 s,55 ℃变性50 s,72 ℃变性45 s,30个循环;72 ℃延伸10 min,4 ℃结束。
1.4.4 土壤理化性质的测定土壤悬液DOC测定:将过0.45 μm滤器的滤液经过不同稀释倍数稀释定容至20 ml,使用Jena Muiti 3100总有机碳/总氮分析仪测定。
土壤有机质测定:将经过冷冻干燥处理的土壤样品称取5.0 g置于研钵中,研磨过筛后取3.0 g用塑封袋分装每一个土壤样品,使用电位滴定仪测定。
土壤铵态氮和硝态氮测定:根据土壤铵态氮和硝态氮提取方法提取出的5 ml上清液样品,使用流动分析仪Skalar(4)和流动分析仪Skalar(2)进行测定。
1.4.5 H2O2浓度测定H2O2浓度用硫酸钛显色后用紫外可见分光光度计(岛津UV2700,日本)测定[25],并根据文献和试验需要,优化了试验条件和相关参数:首先配制0.4 mol/L的硫酸溶液,然后称取一定质量的硫酸钛(Ti2(SO4)3)溶于0.4 mol/L H2SO4溶液中,配成硫酸钛浓度为75 mmol/L的显色反应液。再投加一定体积的反应滤液至显色体系中,显色体系为10 ml,显色5 min,使用紫外分光光度计在410 nm条件下比色测定。
1.4.6 土壤微生物测序经扩增和纯化后的土壤微生物样品,采用Miseq高通量测序平台测序。
1.5 数据处理文中数据处理与统计分析分别使用Origin 8.5和SPSS19.0软件,土壤微生物数据采集用Mothur软件。
2 结果与讨论 2.1 不同处理H2O2浓度变化已有的研究表明,逐步投加较低浓度的H2O2到土壤中对土著菌的影响较小,可以进一步提升微生物降解土壤污染物的能力。因而本试验参考选取了逐步投加H2O2的方式。不同处理H2O2分解动力学结果如图 1所示,可见,单独投加H2O2和V2O3/H2O2两个处理下,H2O2缓慢逐渐分解,到反应5 d时基本分解完全;此时继续投加H2O2,反应7 d时H2O2浓度变化不明显,而反应至10 d时H2O2已经被分解完全;继续第3次投加H2O2,反应至14 d时H2O2被分解完全后;接着第4次投加H2O2,反应21 d时H2O2被分解完全。而柠檬酸铁/H2O2体系中,H2O2从一开始投加后,3 d内被迅速分解,在后续的投加过程中均未检测到H2O2的残留,这主要是由于柠檬酸铁催化分解H2O2的活性较高,H2O2一经加入立刻被分解。
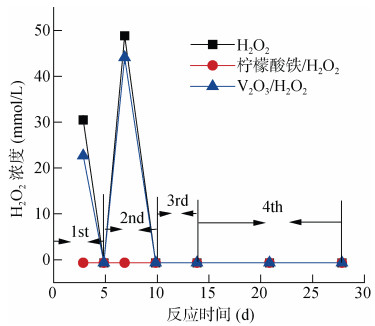
|
(图中1st、2nd、3rd、4st分别表示H2O2第一、二、三、四次投加) 图 1 不同处理H2O2的分解情况 Fig. 1 H2O2 decomposition under different treatments |
H2O2进入土壤后很快被分解,主要原因有两个方面:①土壤组分消耗H2O2,土壤中有机质含量较高,H2O2投入以后,土壤有机质的氧化会迅速地消耗H2O2,同时土壤中铁锰等矿物也会催化分解H2O2产生羟基;②催化剂如柠檬酸铁、V2O3等也能快速地催化分解H2O2。以上结果表明,在实际利用H2O2修复有机污染土壤时,土壤组分也会消耗H2O2从而影响氧化剂的利用和修复效率。
2.2 不同处理土壤DOC浓度变化土壤有机质含量不仅是土壤肥力的重要指标,也是评价有机污染物生物有效性的重要因子,因为有机污染物大多以有机质结合态的形式存在。通常在单独H2O2/土壤体系中,H2O2也能被快速分解,说明有机质能够消耗H2O2,因此对反应过程中的土壤有机质进行检测十分必要。图 2显示,在逐步芬顿氧化以后,添加了H2O2的3个处理样品悬液DOC含量是空白对照的10倍左右。单独H2O2处理和V2O3/H2O2处理变化趋势基本一致,反应5 d时DOC含量达到最大,随后迅速下降,反应7 d时达到1 100 mg/L,但相比于对照,DOC含量仍然很高,且在10 d时出现缓慢回升的现象,原因可能是10 d时H2O2被土壤中的有机质或V2O3消耗完全,固定在土壤中的有机碳溶解到水中;反应14、21、28 d时DOC含量继续下降,并在反应28 d时达到基本稳定的状态,主要原因是随着H2O2的持续加入,溶解态的有机碳被进一步矿化成二氧化碳,从而导致DOC含量的下降。但柠檬酸铁/H2O2处理在反应的前7 d内DOC含量远低于其他H2O2处理,最大值仅为2 000 mg/L,随着反应的进行DOC含量逐渐降低,7 d后基本稳定在600 mg/L,这主要是因为柠檬酸铁与H2O2反应活性较高,竞争性抑制了土壤有机质与H2O2或羟基的反应,从而降低了土壤中有机碳的释放速度,导致水溶液中DOC含量较为稳定。而对照中DOC含量始终很低,表明添加H2O2会对土壤中固定的有机碳产生影响。
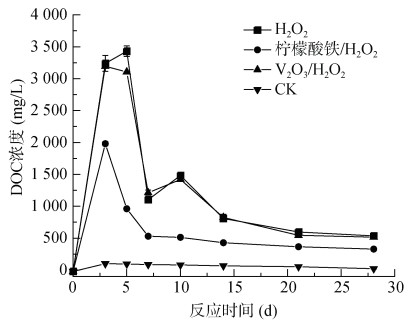
|
图 2 不同处理DOC含量随时间的变化 Fig. 2 DOC concentrations changing with time under different treatments |
以上结果表明,土壤有机质在添加H2O2后会随之分解。图 3显示了不同处理有机质含量的动态变化,可见,单独投加H2O2和V2O3/H2O2处理随着时间的延长,有机质含量呈现逐渐下降的趋势,反应前5 d下降趋势不明显,但至7 d时有机质含量从37.2 g/kg迅速下降到了22.3 g/kg,这是因为随着H2O2在土壤中投加量的增加,对土壤中有机碳的消耗也增多,因此测得的有机质含量下降较多;而柠檬酸铁/H2O2处理在反应的前5 d相比其他两个处理,有机质含量为其一半,这主要原因是柠檬酸铁与H2O2反应活性较高,在一开始就将土壤中固定的有机碳激活释放出来,而至7 d时已基本保持稳定,这也表明反应7 d后3个处理土壤内部易分解的有机碳已全部释放。而通过对照有机质含量数据可看出,土壤中原始有机质含量大约为37 g/kg,投加H2O2处理均降低了有机质的含量。众所周知,有机质具有很多优点,它能够提高土壤温度、增强保水保肥性和缓冲性,同时为植物提供大量的有效养分,还可与进入土壤中的化学农药结合,降低或延缓重金属的污染,对农药等有机污染物具有固定作用,有利于全球碳平衡[2]。但H2O2的加入,会降低有机质的含量,从而阻碍土壤微生物和动物的活性。因此,在修复土壤的同时,还要种植绿肥、秸秆还田,促进土壤中有机质含量的提高,以降低H2O2投入土壤后造成的影响。
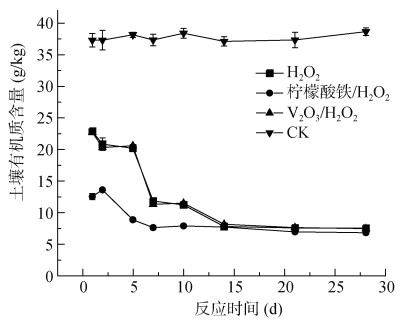
|
图 3 不同处理土壤有机质含量随时间的变化 Fig. 3 SOM concentrations chaning with time under different treatments |
氮是作物生长需求量和增产贡献最大的营养元素,土壤中的氮素大多以有机结合形态而存在,无机形态的氮一般只占全氮的1% ~ 5%。作物可直接吸收利用的矿质态氮主要是铵态氮(NH4+-N)和硝态氮(NO3--N)。北方土壤以硝态氮为主,南方水田以铵态氮为主。硝态氮促进植物吸收阳离子,有利于有机阴离子合成;而铵态氮则促进吸收阴离子,消耗有机酸。一般而言,同时施用铵态氮和硝态氮肥能提高作物的长势和产量。本试验测得的不同处理土壤铵态氮和硝态氮结果如图 4所示,可见,随着反应的进行,投加H2O2的3个处理土壤铵态氮含量具有明显上升的趋势,尤其是单独投加H2O2处理,土壤中铵态氮的含量在反应1 d时就显著高于其他处理;而对照中铵态氮的含量很低,且变化趋势不明显。这说明添加H2O2能够有效增加土壤中铵态氮的含量;对于硝态氮,无论是投加H2O2处理还是对照,土壤硝态氮含量均在反应5 d时达到最大值6 mg/L,且变化趋势一致。造成铵态氮上升和硝态氮变化不明显的原因可能是H2O2的添加影响了氮转化的微生物活性,深层次的原因有待进一步阐明。

|
图 4 不同处理下土壤铵态氮和硝态氮含量的变化 Fig. 4 Concentrations of soil ammonia nitrogen and nitrate nitrogen changing with time under different treatments |
本研究利用高通量测序方法,使用mothur软件经前期预处理共获得1 006 090条细菌序列,各样品中所得序列数在12 293 ~ 30 021条,进一步处理前,对每个样品中序列数进行标准化处理,使得每个样品的最终序列数统一为12 000条。经测定发现,这些细菌分属于22个门,其中主要门类包括Firmicutes(厚壁菌门)、Proteobacteria(变形菌门)、Bacteroidetes(拟杆菌门)、Actinobacteria(放线菌门)、Acidobacteria(酸杆菌门)、Chloroflexi(绿弯菌门)、Verrucomicrobia(疣微菌门)(图 5)。反应28 d时数据显示,H2O2处理明显减少了微生物的多样性,原因可能是H2O2杀死了土壤中部分微生物。
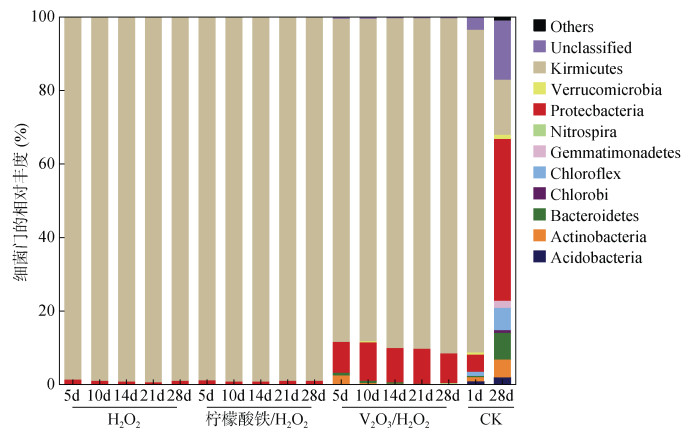
|
(图例中“Others”代表相对丰度 < 0.2%的门) 图 5 在门的分类水平上的细菌相对丰度 Fig. 5 Bacterial relative abundance at phylum level |
从图 5中还可以看出,单独投加H2O2处理与柠檬酸铁/H2O2处理在不同时间的物种丰度上没有明显差异,均以厚壁菌门为主。厚壁菌门是原核生物界中一类细胞壁厚度为10 ~ 50 nm的细菌高级分类单元,包括一大类细菌,多数为革兰氏阳性。很多厚壁菌可以产生芽孢,它可以抵抗脱水和极端环境。在不同时间点的样品中厚壁菌门的相对丰度均在98% 以上,另外还有一小部分的变形菌门占比1% 左右,土壤群落物种结构较为单一。V2O3/H2O2处理也是以厚壁菌门为主,且随着培养时间的延长,厚壁菌门的相对丰度从87.67% 上升到了91.1%,但是相对于前两个处理,该处理条件下微生物的丰度较高,变形菌门的相对丰度均在8% 以上。对照处理在反应1 d时的微生物丰度相比于其他处理较大,但各菌门所占比例远不及厚壁菌门,而28 d时微生物的丰度显著提高,且各菌门所占比例也大幅度提升,其中拟杆菌门占比从0.12% 提高到6.96%、变形菌门从4.94% 提高到42.32%。因此,在土壤中添加H2O2会降低微生物的多样性。
2.6 不同处理土壤微生物群落结构差异性运用SPSS软件采用Tukey test方法对每一个细菌门下各处理间的差异性进行分析发现,单独投加H2O2处理与柠檬酸铁/H2O2处理的厚壁菌门同V2O3/ H2O2处理和对照具有显著性差异。
在门的分类水平上,细菌群落结构如图 6所示,可见,H2O2处理土壤与原土壤中微生物群落较为类似;对照土壤则随培养时间延长发生了很大变化;投加H2O2的3个处理和对照反应样品的群落结构具有较高的相似度,且柠檬酸铁/H2O2处理各反应时间样品之间的相似度更高。

|
图 6 在门的分类水平上的群落结构分布图 Fig. 6 Community structure distribution at phylum level |
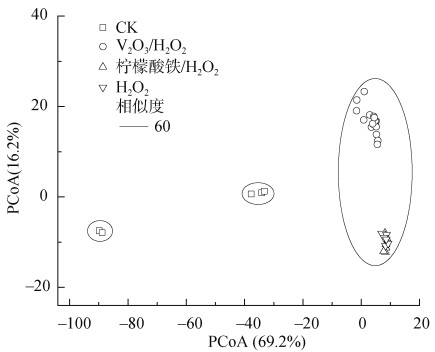
在属的分类水平上,总共有363个被检出,结果如下图 7示。总体而言,群落结构变化PCoA图和cluster聚类分析表明,H2O2处理与对照的细菌群落结构在属的分类水平上表现出明显不同。3种H2O2处理具有较高的相似度,尤其是单独H2O2处理和柠檬酸铁/H2O2处理的相似度极高。
|
图 7 在属的分类水平上的群落结构分布图 Fig. 7 Community structure distribution at genera level |
表 1数据显示,因H2O2处理而发生改变的细菌属有以下两种情况:①因H2O2处理而丰度有明显增加的属主要有厚壁菌门中的芽孢杆菌属(Bacillus)、乳球菌属(Lactococcus)、大洋芽孢杆菌(Oceanobacillus)、土芽孢杆菌属(Geobacillus)、链球菌属(Streptococcus)等,变形菌门中的假单胞杆菌属(Pseudomonas),在V2O3/H2O2处理中的不动杆菌属(Acinetobacter);②因H2O2处理而丰度有所减少的属主要有厚壁菌门中梭状芽孢杆菌(Clostridium-sensu stricto)、变形菌门中的鞘氨醇单胞菌属(Sphingomonas)以及未分类的一些菌属等。综上结果可以看出,Fenton试剂对土壤微生物的群落结构和多样性产生了很大的影响。通过对比试验中3个不同处理发现,单独投加H2O2处理和柠檬酸铁/H2O2处理微生物的丰度较低,而V2O3/H2O2处理对土壤微生物的影响相对较小。总体而言,在门的分类水平上,3个H2O2处理微生物群落结构与处理前的土壤微生物群落较为类似。反映群落结构变化的PCoA图和cluster聚类分析显示3个H2O2处理与对照的细菌群落结构在属的分类水平上明显不同,但3个H2O2处理之间具有较高的相似度,尤其是单独H2O2处理和柠檬酸铁/H2O2处理。
|
|
表 1 H2O2处理细菌丰度增加和降低的菌属 Table 1 The species of bacterial genus abundance increased and decreased by hydrogen peroxide |
投加Fenton试剂进入土壤后,H2O2在土壤中会快速分解,使土壤有机质含量显著下降,土壤铵态氮含量显著升高,但土壤硝态氮含量变化不明显。另外,Fenton试剂也会对土壤微生物的群落结构和多样性产生很大影响。通过对比试验可以发现,单独投加H2O2和柠檬酸铁/H2O2处理微生物的丰度较低,而V2O3/H2O2处理对土壤微生物的影响相对较小。在门的分类水平上,3个H2O2处理对微生物群落结构影响较小,但对细菌群落结构在属的分类水平上影响较大。以上研究为H2O2和芬顿试剂修复场地土壤的生态安全评价提供了数据支撑。
| [1] |
杨帆, 徐洋, 崔勇, 等. 近30年中国农田耕层土壤有机质含量变化[J]. 土壤学报, 2017, 54(5): 1047-1056 (  0) 0) |
| [2] |
陈怀满. 环境土壤学(3版)[M].
科学出版社, 北京, 2018
(  0) 0) |
| [3] |
蔡冰杰, 范文卿, 王慧, 等. 不同有机物料对微域内土壤原生动物和线虫的影响[J]. 土壤学报, 2017, 54(3): 713-721 (  0) 0) |
| [4] |
朱长银, 方国东, 司友斌, 等. 洗脱-过硫酸钠氧化联合去除土壤中PCBs的研究[J]. 土壤, 2015, 47(6): 1125-1131 (  0) 0) |
| [5] |
Cheng M, Zeng G M, Huang D L, et al. Hydroxyl radicals based advanced oxidation processes (AOPs) for remediation of soils contaminated with organic compounds: A review[J]. Chemical Engineering Journal, 2016, 284: 582-598 (  0) 0) |
| [6] |
Legrini O, Oliveros E, Braun A M. Photochemical processes for water treatment[J]. Chemical Reviews, 1993, 93(2): 671-698 DOI:10.1021/cr00018a003 (  0) 0) |
| [7] |
Haag W R, Yao C C D. Rate constants for reaction of hydroxyl radicals with several drinking water contaminants[J]. Environmental Science & Technology, 1992, 26(5): 1005-1013 (  0) 0) |
| [8] |
谢银德, 陈锋, 何建军, 等. Photo-Fenton反应研究进展[J]. 感光科学与光化学, 2000, 18(4): 357-365 (  0) 0) |
| [9] |
Malato S, Blanco J, Vidal A, et al. Applied studies in solar photocatalytic detoxification: An overview[J]. Solar Energy, 2003, 75(4): 329-336 DOI:10.1016/j.solener.2003.07.017 (  0) 0) |
| [10] |
Zhou Y, Wang X L, Zhu C Y, et al. New insight into the mechanism of peroxymonosulfate activation by sulfur- containing minerals: Role of sulfur conversion in sulfate radical generation[J]. Water Research, 2018, 142: 208-216 DOI:10.1016/j.watres.2018.06.002 (  0) 0) |
| [11] |
宋刚练, 江建斌, 祝可成. 芬顿氧化法修复上海某工业场地的技术应用[J]. 地质灾害与环境保护, 2017, 28(2): 106-110 (  0) 0) |
| [12] |
裴晓哲, 刘守清. 芬顿氧化法修复敌百虫污染土壤的研究[J]. 苏州科技学院学报(自然科学版), 2014, 31(3): 29-32, 42 (  0) 0) |
| [13] |
Ojinnaka C, Osuji L, Achugasim O. Remediation of hydrocarbons in crude oil-contaminated soils using Fenton's reagent[J]. Environmental Monitoring and Assessment, 2012, 184(11): 6527-6540 DOI:10.1007/s10661-011-2438-3 (  0) 0) |
| [14] |
Zhang X, Gu X G, Lu S G, et al. Degradation of trichloroethylene in aqueous solution by calcium peroxide activated with ferrous ion[J]. Journal of Hazardous Materials, 2015, 284: 253-260 DOI:10.1016/j.jhazmat.2014.11.030 (  0) 0) |
| [15] |
Zhang X, Gu X G, Lu S G, et al. Application of calcium peroxide activated with Fe(II)-EDDS complex in trichloroethylene degradation[J]. Chemosphere, 2016, 160: 1-6 (  0) 0) |
| [16] |
吴文慧, 朱长银, 施维林, 等. 微纳铁活化过硫酸钠降解污染土壤中DDTs的效果研究[J]. 土壤, 2017, 49(3): 460-466 (  0) 0) |
| [17] |
Silva M R A, Trovó A G, Nogueira R F P. Degradation of the herbicide tebuthiuron using solar photo-Fenton process and ferric citrate complex at circumneutral pH[J]. Journal of Photochemistry and Photobiology A: Chemistry, 2007, 191(2-3): 187-192 (  0) 0) |
| [18] |
Fang G D, Deng Y M, Huang M, et al. A mechanistic understanding of hydrogen peroxide decomposition by vanadium minerals for diethyl phthalate degradation[J]. Environmental Science & Technology, 2018, 52(4): 2178-2185 (  0) 0) |
| [19] |
Pham A L T, Doyle F M, Sedlak D L. Kinetics and efficiency of H2O2 activation by iron-containing minerals and aquifer materials[J]. Water Research, 2012, 46(19): 6454-6462 (  0) 0) |
| [20] |
Lu M, Zhang Z Z, Qiao W, et al. Removal of residual contaminants in petroleum-contaminated soil by Fenton-like oxidation[J]. Journal of Hazardous Materials, 2010, 179(1-3): 604-611 (  0) 0) |
| [21] |
Xu J L, Deng X, Cui Y W, et al. Impact of chemical oxidation on indigenous bacteria and mobilization of nutrients and subsequent bioremediation of crude oil-contaminated soil[J]. Journal of Hazardous Materials, 2016, 320: 160-168 (  0) 0) |
| [22] |
江闯, 赵宁华, 魏宏斌, 等. 类芬顿氧化法处理TPH污染土壤的试验研究[J]. 中国给水排水, 2018, 34(3): 97-99 (  0) 0) |
| [23] |
邓亚梅, 王荣富, 方国东, 等. 五氧化二钒类Fenton降解邻苯二甲酸二乙酯的机制研究[J]. 生态毒理学报, 2017, 12(3): 717-725 (  0) 0) |
| [24] |
Floris B, Sabuzi F, Coletti A, et al. Sustainable vanadium-catalyzed oxidation of organic substrates with H2O2[J]. Catalysis Today, 2017, 285: 49-56 (  0) 0) |
| [25] |
刘小为, 陈忠林, 沈吉敏, 等. 硫酸钛光度法测定O3/H2O2体系中低浓度H2O2[J]. 中国给水排水, 2010, 26(16): 126-129 (  0) 0) |
2. Key Laboratory of Soil Environment and Pollution Remediation, Institute of Soil Science, Chinese Academy of Sciences, Nanjing 210008;
3. School of Resources and Environment, Anhui Agricultural University, Hefei, Anhui 230036;
4. School of International Tourism, Anhui International Studies University, Hefei 231201, China
 2020, Vol. 52
2020, Vol. 52


