2. 中国科学院土壤环境与污染修复重点实验室(南京土壤研究所),南京 210008;
3. 中国科学院大学,北京 100049
随着人类社会的迅速发展以及资源的大量消耗,发展与利用海洋资源已经成为众多国家重要的发展方向。海岛作为海洋的重要组成部分,资源巨大,其可持续发展关系到海洋的生态平衡、海洋经济发展以及国家安全。因此,海岛资源合理的开发利用与海岛的可持续发展已引起国内外学者的高度关注[1-2]。中国热带珊瑚岛礁是由珊瑚砂堆积形成,具有高盐、强碱、贫瘠等独特的生态环境,不利于植物的生长与定居,而植被是海岛的3个基本组成要素之一[3],岛礁快速土壤化改造是构建岛礁稳定植被的关键。近年来,我国学者对南海诸岛植物和植被的研究较多[4-6],为热带岛礁植被重建与可持续发展提供了重要的理论支持。植物残体、植物根系以及微生物都能分泌出小分子有机酸[7-8],其在原生矿物与次生矿物的溶蚀风化过程中有着较强的促进作用[9],其中有机酸中的二元和三元羧酸对金属离子具有很强的络合能力,能加快矿物溶蚀以及促进碳酸盐岩溶蚀风化成土[10-11],而矿物风化是土壤形成的前提与基础。小分子有机酸对矿物风化速率与程度的影响近年来研究较多[12-13],土壤中的有机酸菌群[14]可以通过分泌有机酸(草酸、乳酸、柠檬酸和琥珀酸)促进方解石的风化溶解,其中草酸、乳酸和琥珀酸能使方解石颗粒失重,而柠檬酸能导致方解石发生重结晶行为[15-18],同时,矿物溶解过程中释放的元素也为微生物的生长与繁殖提供了能量。此外矿物所处环境对其风化具有较强的影响,环境中pH越小,矿物风化作用越强[13];小分子有机酸也可导致硅酸盐矿物和磷酸盐矿物的溶蚀过程以及改变矿物晶型[11]。然而目前对于小分子有机酸溶蚀风化珊瑚砂的相关研究及机理探讨均未见报道。
因此,本文以土壤中广泛存在的柠檬酸作为小分子有机酸代表物,开展了柠檬酸对珊瑚砂的溶蚀研究,分析了不同浓度和不同pH柠檬酸溶液对珊瑚砂的溶蚀过程,结合柠檬酸的解离与柠檬酸钙沉积理论,研究柠檬酸与珊瑚砂的反应过程及机理,以期为岛礁的建设提供基础资料。
1 材料与方法 1.1 试验材料珊瑚砂样品:试验所采用的珊瑚砂采自中国南方某岛屿,将珊瑚砂用自来水和去离子水反复浸泡清洗,直到浸泡液的电导低于30 µS/cm,烘干后过筛取1 ~ 2 mm的珊瑚砂备用。
1.2 试验试剂HCl、NaOH、柠檬酸均为分析纯试剂,其中柠檬酸与HCl购自南京化学股份有限责任公司,NaOH购自上海沃凯生物技术公司。
1.3 试验仪器上海傲谱AP1302型火焰光度计;美国珀金埃尔默Optima 8000型电感耦合等离子原子发射光谱仪;日本理学isss-120644型X射线衍射仪(XRD);德国蔡司MERLIM型扫描电子显微镜(SEM);北京赛多利斯BSA124S型分析天平;美国奥利龙Star A211型台式数显酸度计;北京菜伯泰科UV8100B型分光光度计;太仓华美QHZ-12B型组合式全温度恒温振荡培养箱;美国尼高利Nicolet 8700型红外光谱仪。
1.4 试验方法 1.4.1 珊瑚砂物相分析运用X射线衍射仪、红外光谱、电镜分析仪对洗净后的珊瑚砂以及溶蚀后固体进行分析。X射线衍射光谱使用Cu靶,电压40 kV,电流20 mA,扫描速度2o/min,扫描步长0.02o,扫描范围2o ~ 60o。XRD数据使用软件MDI Jade6.5处理。SEM图像通过高分辨率热场发射扫描电镜MERLIN SE2得到。红外光谱扫描范围650 ~ 4 000 cm–1,KBr压片,分辨率4 cm-1,扫描次数32,红外光谱数据使用软件OMNIC 9.2进行处理。
1.4.2 不同浓度柠檬酸对珊瑚砂溶蚀动态过程准确称取烘干后的珊瑚砂5.00 g于250 ml锥形瓶中,分别与1、10、100 mmol/L的柠檬酸溶液100 ml混合后,加盖硅胶塞防止空气中的CO2进入。置于30 ℃,185 r/min的摇床中振荡。分别于1、2、4、8、12、18、24、36、48、72、96、120 h时将锥形瓶取出,用隔膜真空泵(50 µm滤膜)快速过滤固液分离,测定液体部分的pH和Ca2+、Mg2+及柠檬酸浓度,并运用XRD和红外光谱仪分析固体部分组成,SEM观察其表面形貌。
1.4.3 不同pH对柠檬酸溶蚀珊瑚砂的影响准确称取备用的珊瑚砂5.00 g于250 ml的锥形瓶中,分别与不同初始pH(1、3、5、7、9、11、13)、浓度为10 mmol/L的100 ml柠檬酸溶液(用1 mol/L NaOH和HCl调节)混合,加盖硅胶塞后于30 ℃,185 r/min摇床中振荡48 h,快速过滤固液分离,测定液体部分pH和Ca2+、Mg2+及柠檬酸浓度。
选取初始pH为1、7、13的柠檬酸溶液进行动态试验,分别在1、2、4、8、12、18、24、36、48 h将锥形瓶取出,快速过滤固液分离,测定液体部分的pH和Ca2+、Mg2+及柠檬酸浓度,固体部分采用XRD对其晶体晶型进行半定量分析。
溶液中Ca2+、Mg2+浓度用火焰光度计及ICP- OES进行测定,pH采用Star A211 pH计测定。柠檬酸浓度使用Fe3+络合分光光度法进行测定[19]。
上述系列试验均设置3次重复。
2 结果 2.1 珊瑚砂组分分析用X射线衍射仪对珊瑚砂进行物相分析,衍射谱图如图 1所示,其特征谱线为3.408 5(111)、3.285 1 (021)、2.995 7(104)、2.708 9(012)、2.491 2(102)、2.379 1(112)、1.980 5(211)、1.884 9(202)、1.817 9 (132)、1.745 9(113)。采用Jade 6.5分析软件将衍射图谱与PDF卡片库对比,发现该图谱与文石(卡片71-1663)匹配,特征峰2.995 7(104)经过筛选比对确定其为镁方解石的特征峰,此外少量的杂峰显示珊瑚砂中还含有少量的方解石。运用Jade中PIR对样品进行半定量分析得出珊瑚砂中各组分的含量分别为文石(570 g/kg)、镁方解石(380 g/kg)、方解石(50 g/kg)。在珊瑚砂的SEM图(图 1B)中可以明显地观察到其表面粗糙多孔,内部分布着大量条状文石晶须。
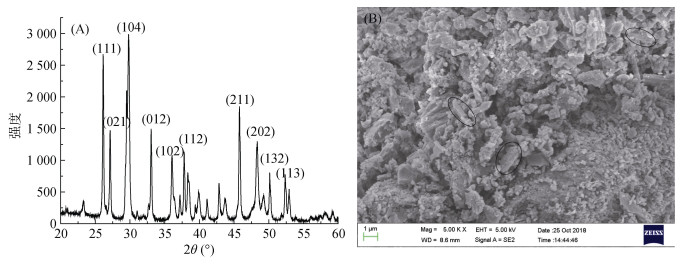
|
(A.珊瑚砂的XRD谱图;B.珊瑚砂的SEM图片(图中圈画标识为文石晶须)) 图 1 珊瑚砂的X射线衍射谱图及SEM图片 Fig. 1 X-ray diffractogram and SEM photograph of coral sand |
图 2A、2B为不同浓度柠檬酸溶液中Ca2+、Mg2+浓度随时间的变化曲线。由图可知,当柠檬酸浓度为100 mmol/L时,在1 h时溶液中Ca2+浓度最高,随后迅速降低,在4 h时Ca2+浓度达到平衡,其浓度为3.82 mmol/L。在此处理中,起始时Ca2+迅速大量地溶出,溶液中柠檬酸浓度较高,导致柠檬酸钙的结晶速率较快,在1 h、2 h时分离的样品溶液中,大量的Ca2+仍与柠檬酸及柠檬酸根在样品管壁上络合形成柠檬酸钙结晶物,导致测量时溶液中Ca2+浓度降低。当柠檬酸浓度为10 mmol/L时,在0 ~ 4 h内,随着时间的增加Ca2+浓度迅速升高,随后逐渐降低,在36 h时Ca2+浓度达到平衡,其浓度为2.45 mmol/L。当柠檬酸浓度为1 mmol/L时,Ca2+浓度在1 h时达到最高,随后缓慢降低,在48 h时Ca2+浓度达到平衡,其浓度为1.07 mmol/L。当柠檬酸浓度为100 mmol/L时,Mg2+浓度在2 h内迅速升高,随后缓慢上升,在120 h时浓度为12.84 mmol/L。当柠檬酸浓度为10、1 mmol/L时,Mg2+浓度在1 h内迅速升高,随后缓慢上升,在120 h时浓度分别为1.61 mmol/L和0.40 mmol/L。图 2C与2D为柠檬酸浓度与pH随时间的变化曲线。1、10、100 mmol/L的柠檬酸溶液,初始的pH分别为3.15、2.41、1.57,在反应开始阶段pH迅速上升,随着反应的进行上升趋势逐渐平缓,随后反应逐渐趋于平衡,反应结束后柠檬酸溶液pH分别为8.26、8.33、8.74。在100、10 mmol/L柠檬酸溶液中,柠檬酸浓度在反应初始阶段迅速减小随后趋于平衡;在1 mmol/L柠檬酸中,柠檬酸浓度随时间的增加略有降低。
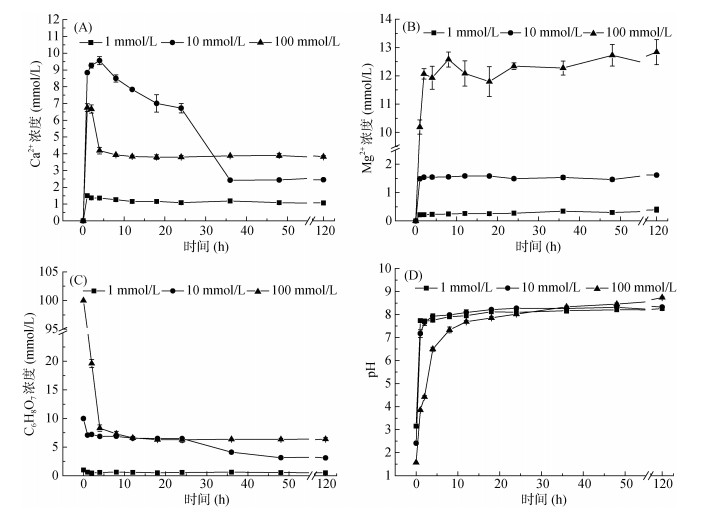
|
(A. Ca2+浓度变化;B. Mg2+浓度变化;C.柠檬酸浓度变化;D. pH变化) 图 2 珊瑚砂反应动力学 Fig. 2 Reaction kinetics of coral sand |
图 3表示不同初始pH的10 mmol/L柠檬酸溶液与珊瑚砂混合振荡48 h后溶液中Ca2+、Mg2+的浓度。随着pH的升高,溶液中Ca2+、Mg2+的浓度逐渐降低,且溶液中Ca2+浓度是Mg2+浓度的13倍~ 14倍。当1≤pH < 7时,pH对Ca2+、Mg2+溶出影响较大,溶液pH决定着Ca2+、Mg2+溶出量大小;当7≤pH≤11时,pH对溶液中Ca2+、Mg2+溶出影响较小;在pH为13时溶液中Ca2+、Mg2+浓度低至0.99 mmol/L和0.013 mmol/L。
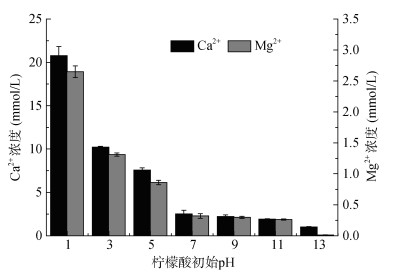
|
图 3 不同pH柠檬酸48 h时Ca2+、Mg2+浓度 Fig. 3 Concentrations of Ca2+ and Mg2+ of citric acid with different pH values at 48 h |
表 1为48 h时不同初始pH柠檬酸溶液中pH与柠檬酸浓度值。当初始pH < 7,反应48 h后溶液pH范围为8 ~ 9;当初始pH为7、9、11时,反应48 h后溶液的平衡pH为10左右;当初始pH为13时,反应48 h后平衡时pH为11.87。当初始pH为3、5、7、9、11时,溶液中柠檬酸浓度均为7 mmol/L左右;当初始pH为1时,柠檬酸浓度为2.15 mmol/L;当初始pH为13时,柠檬酸浓度为9.08 mmol/L。
|
|
表 1 48 h时柠檬酸pH与柠檬酸浓度 Table 1 pH and concentration of citric acid at 48 h |
图 4为柠檬酸(10 mmol/L,初始pH = 1、7、13)溶液中Ca2+、Mg2+浓度,柠檬酸浓度及pH随时间的变化曲线图。当柠檬酸初始pH为1时,Ca2+浓度在1 h内迅速升高,在1 ~ 18 h内缓慢上升,随后缓慢降低,在36 h时反应达到平衡;Mg2+浓度在1 h内迅速升高,随后缓慢上升,在12 h时达到平衡;柠檬酸浓度在1 h内迅速降低随后缓慢降低,在24 h时达到平衡;pH在1 h内迅速升高,随后缓慢上升,在12 h时达到平衡。当柠檬酸初始pH为7时,Ca2+浓度缓慢上升,在12 h时达到平衡;Mg2+浓度1 h内迅速升高,随后缓慢上升;柠檬酸浓度在1 h内迅速降低,随后缓慢降低,在24 h达到平衡;pH在1 h内迅速升高,随后逐渐趋于平衡。当柠檬酸初始浓pH为13时,Ca2+浓度缓慢上升,在24 h时达到平衡,其溶出量低,溶出速率缓慢;而溶液中Mg2+浓度接近零;柠檬酸浓度在1 h内略有降低,随后缓慢降低,在24 h时达到平衡;pH在1 h内降低至11.57,在1 ~ 12 h时缓慢上升,在12 h达到平衡。
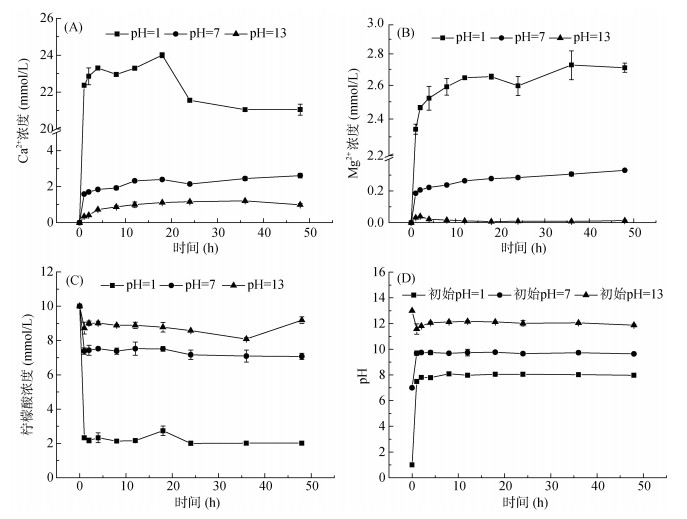
|
(A. Ca2+浓度变化;B. Mg2+浓度变化;C.柠檬酸浓度变化;D. pH变化) 图 4 不同pH下10 mmol/L柠檬酸溶液中不同离子及pH随时间的变化 Fig. 4 Changes of different ions and pH with time in 10 mmol/L citric acid solution of different pH values |
图 5分别为1、10、100 mmol/L的柠檬酸与珊瑚砂振荡反应120 h后固相,100 mmol/L的柠檬酸与珊瑚砂反应1 h固液分离后液相部分静置一段时间后结晶析出固体产物,以及珊瑚原砂的XRD谱图。分别运用Jade 6.5对其物相组成及含量进行分析,结果如表 2所示,当柠檬酸浓度为100 mmol/L时,有大量四水合柠檬酸钙沉淀的产生,随着柠檬酸浓度的增大,镁方解石/方解石的相对含量逐渐减小。
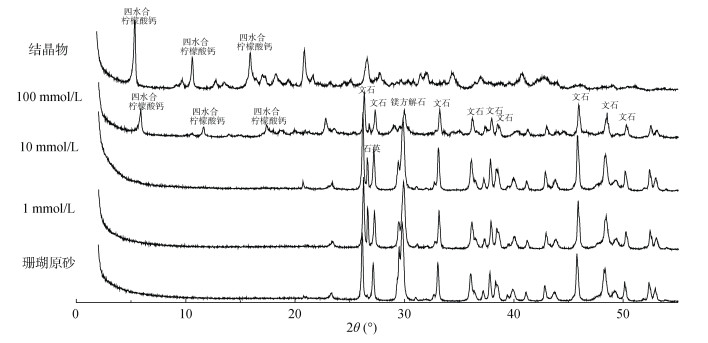
|
图 5 柠檬酸与珊瑚砂反应120 h后固体部分XRD谱图 Fig. 5 XRD of solids after citric acid reacted with coral sand for 120 h |
|
|
表 2 柠檬酸(100 mmol/L)与珊瑚砂反应120 h后固相部分组成 Table 2 Solid phase fractionation after citric acid (100 mmol/L) reacted with coral sand for 120 h |
图 6为100 mmol/L柠檬酸与珊瑚砂反应1 h后液相静置一段时间后固体的红外光谱图,在4 000 ~ 2 000 cm–1只有一个峰,说明此化合物只含有一个羟基。在指纹区,1 614.6、1 539.3、1 076.4、886.7 cm–1等均为四水合柠檬酸钙的特征峰。因此,此结晶物为四水合柠檬酸钙[20]。图 7分别为珊瑚砂与100 mmol/L柠檬酸与珊瑚砂反应1、8、120 h时固相部分的XRD谱图,分别运用Jade 6.5对其物相组成及含量进行分析。结果如表 3所示,在1 h时,镁方解石含量显著降低;在8 h时文石含量显著降低,并伴有少量的柠檬酸钙沉淀的生成;在120 h时,镁方解石与文石的含量都有所降低,并生成大量的柠檬酸钙沉淀。
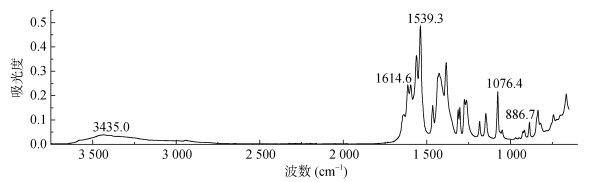
|
图 6 结晶固体物红外光谱图 Fig. 6 FTIR spectrum of crystalline solids |
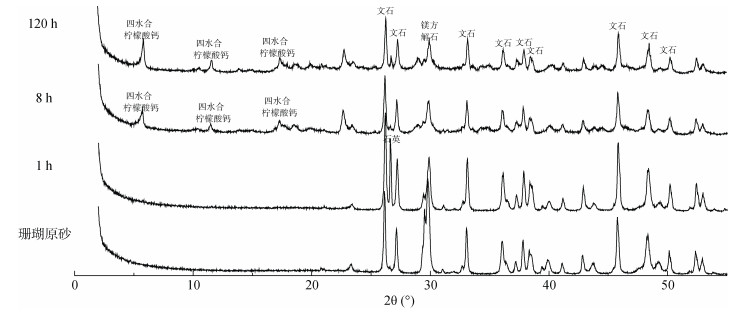
|
图 7 柠檬酸(100 mmol/L)与珊瑚砂反应不同时间固体部分XRD谱图 Fig. 7 XRD of solid fractions after citric acid (100 mmol/L) reacted with coral sand for different time |
|
|
表 3 柠檬酸(100 mmol/L)与珊瑚砂反应不同时间后固相部分组成 Table 3 Solid phase fractions affer citric acid (100 mmol/L) reacted with coral sand for different time |
图 8中A、B、C分别为1、10、100 mmol/L的柠檬酸与珊瑚砂振荡反应120 h后剩余固相部分放大5 000倍的SEM图片,图A和B中由于柠檬酸钙含量较低,因此很难明显地观察到柠檬酸钙晶体的存在;在图C中,可以观察到在珊瑚砂表面覆盖着大量的鳞片状柠檬酸钙晶体。图D是柠檬酸与珊瑚砂反应1 h液相部分静置一段时间后结晶析出产物,该结晶固体为规则、平整的条状柠檬酸钙晶体。
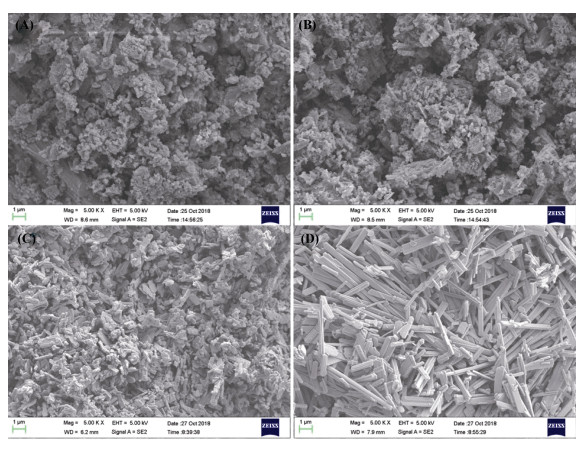
|
(A. 1 mmol/L柠檬酸;B. 10 mmol/L柠檬酸;C.100 mmol/L柠檬酸;D.100 mmol/L柠檬酸与珊瑚砂反应1 h液相部分静置一段时间后结晶析出固体) 图 8 不同浓度柠檬酸与珊瑚砂反应120 h后固相部分的SEM图片 Fig. 8 SEM photograph of solid phase fractions after citric acid reacted with coral sand for 120 h |
柠檬酸(H3AOH)是一种三元弱酸,其在水中的电离方程式如式(1) ~ (4)所示:
| $ {{\rm{H}}_{\rm{3}}}{\rm{AOH}} \leftrightarrow {{\rm{H}}_{\rm{2}}}{\rm{AO}}{{\rm{H}}^{\rm{-}}}{\rm{ + }}{{\rm{H}}^{\rm{ + }}} $ | (1) |
| $ {{\rm{H}}_{\rm{2}}}{\rm{AO}}{{\rm{H}}^{\rm{-}}} \leftrightarrow {\rm{HAO}}{{\rm{H}}^{{\rm{2-}}}}{\rm{ + }}{{\rm{H}}^{\rm{ + }}} $ | (2) |
| $ {\rm{HAO}}{{\rm{H}}^{{\rm{2-}}}} \leftrightarrow {\rm{AO}}{{\rm{H}}^{{\rm{3-}}}}{\rm{ + }}{{\rm{H}}^{\rm{ + }}} $ | (3) |
| $ {\rm{AO}}{{\rm{H}}^{{\rm{3-}}}} \leftrightarrow {\rm{A}}{{\rm{O}}^{{\rm{4-}}}}{\rm{ + }}{{\rm{H}}^{\rm{ + }}} $ | (4) |
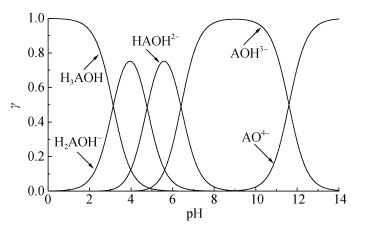
其中,A为C6H4O6,柠檬酸的形态分布取决于其解离常数(Ka)和pH。在25 ℃下,pKa1、pKa2、pKa3、pKa4的值分别为3.13、4.76、6.40和11.60[21]。由柠檬酸的pKa值计算得出柠檬酸形态分布随pH的变化关系如图 9所示。当pH为1 ~ 3时,主要以柠檬酸(H3AOH)和柠檬酸二氢根(H2AOH–)的状态存在;随着pH逐渐升高,溶液中柠檬酸一氢根(HAOH2–)以及柠檬酸根离子(AOH3–)含量增加;当pH为6 ~ 9时柠檬酸主要以AOH3–和HAOH2–的形式存在[16]。本研究中柠檬酸与珊瑚砂反应在短时间内溶液pH均达到6以上,最终平衡在8左右,此时溶液中柠檬酸主要以AOH3–的形式存在。
|
图 9 25 ℃时不同pH下柠檬酸形态的摩尔分数 Fig. 9 Mole fractions of citric acid at different pH values at 25 ℃ |
由于珊瑚砂中主要物质为文石和镁方解石,其化学成份均为CaCO3和CaMgCO3,因此其与柠檬酸的一部分反应可以用方程(5) ~ (10)来表示[16-18, 22-23]。
| $ {\rm{2}}{{\rm{H}}^{\rm{ + }}}{\rm{ + CaC}}{{\rm{O}}_{\rm{3}}} \leftrightarrow {\rm{C}}{{\rm{a}}^{{\rm{2 + }}}}{\rm{ + }}{{\rm{H}}_{\rm{2}}}{\rm{O + C}}{{\rm{O}}_{\rm{2}}} $ | (5) |
| $ \begin{array}{*{20}{l}} {{\rm{2}}{{\rm{H}}^{\rm{ + }}}{\rm{ + C}}{{\rm{a}}_{({\rm{1 - }}x)}}{\rm{M}}{{\rm{g}}_{(x)}}{\rm{C}}{{\rm{O}}_{\rm{3}}}({\rm{1 - }}x){\rm{C}}{{\rm{a}}^{{\rm{2 + }}}}{\rm{ + }}(x){\rm{M}}{{\rm{g}}^{{\rm{2 + }}}}{\rm{ + }}}\\ {{{\rm{H}}_{\rm{2}}}{\rm{O + C}}{{\rm{O}}_{\rm{2}}}} \end{array} $ | (6) |
| $ \begin{array}{*{20}{l}} {{{\rm{H}}_{\rm{2}}}{\rm{AO}}{{\rm{H}}^{\rm{ - }}}{\rm{ + C}}{{\rm{a}}^{{\rm{2 + }}}} \leftrightarrow {\rm{Ca}}{{\rm{H}}_{\rm{2}}}{\rm{AO}}{{\rm{H}}^{\rm{ + }}}} \end{array} $ | (7) |
| $ \begin{array}{l} \begin{array}{*{20}{l}} {{\rm{3C}}{{\rm{a}}^{{\rm{2 + }}}}{\rm{ + 2(Ca}}{{\rm{H}}_{\rm{2}}}{\rm{AO}}{{\rm{H}}^{\rm{ + }}}{{\rm{)}}_{\left( {{\rm{aq}}} \right)}} \leftrightarrow } \end{array}\\ \begin{array}{*{20}{l}} {{\rm{C}}{{\rm{a}}_{\rm{3}}}{{\left( {{\rm{AOH}}} \right)}_{\rm{2}}}{{\rm{ }}_{\left( {\rm{s}} \right)}}{\rm{ + 4}}{{\rm{H}}^{\rm{ + }}}} \end{array} \end{array} $ | (8) |
| $ \begin{array}{*{20}{l}} {{\rm{C}}{{\rm{a}}^{{\rm{2 + }}}}{\rm{ + AO}}{{\rm{H}}^{{\rm{3-}}}} \leftrightarrow {\rm{CaAO}}{{\rm{H}}^{\rm{-}}}} \end{array} $ | (9) |
| $ \begin{array}{l} \begin{array}{*{20}{l}} {{\rm{C}}{{\rm{a}}_{{\rm{(1-}}x{\rm{)}}}}{\rm{M}}{{\rm{g}}_{{\rm{(}}x{\rm{)}}}}{\rm{C}}{{\rm{O}}_{\rm{3}}}{\rm{ + }}{{\rm{H}}_{\rm{2}}}{\rm{O}} \leftrightarrow {\rm{(1-}}x{\rm{)C}}{{\rm{a}}^{{\rm{2 + }}}}{\rm{ + }}} \end{array}\\ \begin{array}{*{20}{l}} {{\rm{(}}x{\rm{)M}}{{\rm{g}}^{{\rm{2 + }}}}{\rm{ + HC}}{{\rm{O}}^{{\rm{3-}}}}{\rm{ + O}}{{\rm{H}}^{\rm{-}}}} \end{array} \end{array} $ | (10) |
在柠檬酸与珊瑚砂的反应中,3种不同浓度的柠檬酸溶液中短时间内都有大量的Ca2+、Mg2+溶出,此时柠檬酸电离产生大量的H+参与了方程(5)、(6)的反应。随着反应的进行,pH升高,此时溶液中柠檬酸主要以H2AOH–和HAOH2–的形态存在,在此过程中主要发生方程(7)、(8)的反应,Ca2+浓度逐渐降低,大量的Ca2+与柠檬酸根离子沉淀形成四水合柠檬酸钙。随着柠檬酸浓度的升高,平衡时Ca2+、Mg2+溶出浓度越高,达到平衡时间越短。在100 mmol/L柠檬酸与珊瑚砂反应的试验中,通过对1、8、120 h时固相部分XRD的分析发现,在1 h时固相部分镁方解石含量显著降低,文石含量显著升高,在此过程中珊瑚砂中的镁方解石首先发生溶解反应。在8 h时,文石含量大幅降低,方解石含量显著升高,在此阶段珊瑚砂中的文石首先发生溶解反应。在120 h时反应处于平衡状态,此时固相部分中含有大量的柠檬酸钙沉淀,且方解石/文石、方解石/镁方解石的比值显著增高。当柠檬酸浓度为1 mmol/L和10 mmol/L时,反应过程中优先溶出的Mg2+将会抑制方解石的溶解[24],这导致反应平衡后镁方解石与文石的相对含量都有所降低,方解石的相对含量升高。因此柠檬酸优先溶解珊瑚砂中的镁方解石和文石。
在不同初始pH柠檬酸溶液中,Ca2+、Mg2+的浓度随着pH的增大逐渐减小,且初始pH < 7时,Ca2+、Mg2+的浓度变化较大,其原因为在初始pH < 7时主要发生方程(5)、(6)、(7)、(8)的反应,此时Ca2+的溶出主要受H+浓度的影响。当柠檬酸初始pH为7 ~ 11时,溶液中柠檬酸主要以AOH3–形式存在,其与Ca2+发生方程(9)的反应形成六配位八面体结构的络合物[25],且具有较强的稳定性[26],从而促进了珊瑚砂中Ca2+、Mg2+的解离(方程10),提高了珊瑚砂中Ca2+、Mg2+浸出率[27-28],此时溶液中AOH3-的含量决定着其提高珊瑚砂浸出Ca2+、Mg2+的程度,因此在pH为7 ~ 11时溶液中Ca2+、Mg2+浓度随pH的升高无明显差异。在AOH3-络合Ca2+,促进Ca2+、Mg2+解离过程中同时会产生大量的HCO– 3与CO2– 3,形成较为稳定的碳酸盐缓冲体系,导致反应结束后溶液中pH均在10左右。当柠檬酸初始pH为13时,溶液中柠檬酸主要以AO4–的形式存在,此过程中Ca2+溶出量较低,Mg2+浓度基本为零,溶液中的Mg2+被迅速地沉淀形成Mg(OH)2沉淀。柠檬酸浓度和pH小幅降低。通过对初始pH为1、7、13反应中Ca2+、Mg2+、柠檬酸浓度及pH的动态监测得出Ca2+、Mg2+的溶出发生在反应初期,随后部分Ca2+通过结晶生成沉淀,形成新的物相,溶出速率随时间逐渐减小。
风化作用作为土壤形成的前提与条件,在矿物演变为土壤的过程中有着不可取代的作用。由于珊瑚砂为碳酸盐矿物,导致其遇酸易溶蚀风化。因此,植物残体、植物根系及微生物分泌的小分子有机酸(如:草酸、乙酸、柠檬酸、苹果酸等)在珊瑚砂风化成土的过程中起到非常重要的作用。本试验发现在有柠檬酸存在的条件下,柠檬酸首先与珊瑚砂发生酸碱反应,珊瑚砂中的Ca2+、Mg2+溶解流失,而其中的难溶物、酸不溶物、迁移能力较弱的物质及杂质在此过程中由于重力的作用沉积下来,堆积形成风化残积土。此过程速度较快且常伴随着巨大的体积缩小,其反应速率受小分子有机酸浓度的影响,小分子有机酸的浓度越高,可电离的H+越多,pH越低,对珊瑚砂溶蚀作用越强,速率越快,溶蚀过程中体积的缩小随着珊瑚砂中杂质含量的增加而减小。此外柠檬酸对Ca2+的络合能力较强,在珊瑚砂溶蚀的过程中Ca2+与柠檬酸络合形成柠檬酸钙沉淀,提高了珊瑚砂中有机碳的含量,为微生物的生长繁殖提供了更多的碳源,进一步加快珊瑚砂的风化成土速率。
4 结论1) 不同浓度柠檬酸与珊瑚砂的溶蚀反应过程中,反应初始阶段主要发生Ca2+、Mg2+酸碱溶出反应,此后主要发生Ca2+、Mg2+与AOH3–的络合反应和Ca2+沉淀结晶反应。
2) 柠檬酸溶液的初始pH对柠檬酸溶蚀珊瑚砂影响较大,随着pH的升高,Ca2+、Mg2+的溶出量逐渐减小。当pH < 7时Ca2+、Mg2+主要由H+与珊瑚砂酸碱反应溶出,当7≤pH≤11时主要由柠檬酸根与Ca2+、Mg2+络合促进其溶出。
3) 随着柠檬酸浓度的增加,生成的柠檬酸钙沉淀的晶体晶型越规则。当柠檬酸浓度达到100 mmol/L时已经可以观察到规则的鳞片状柠檬酸钙化合物;当100 mmol/L的柠檬酸与珊瑚砂反应1 h后固液分离后,液体部分重结晶生成到规则、表面平整的条状柠檬酸钙化合物。
4) 在柠檬酸溶蚀珊瑚砂反应中,首先溶解镁方解石,其次为文石,最后为方解石,这导致固相部分方解石相对含量升高。
| [1] |
杨红, 苏婷, 戴小杰. 上海市无居民岛土地资源开发适宜性研究[J]. 上海海洋大学学报, 2012, 21(1): 92-96 (  0) 0) |
| [2] |
黎树式, 黄鹄, 戴志军, 等. 广西海岛岸线资源空间分布特征及其利用模式研究[J]. 海洋科学进展, 2016, 34(3): 437-448 DOI:10.3969/j.issn.1671-6647.2016.03.014 (  0) 0) |
| [3] |
林忆雪, 刘慧, 贺鹏程, 等. 三种适生植物对热带珊瑚岛胁迫生境的生理生化响应[J]. 热带亚热带植物学报, 2017, 25(6): 562-568 (  0) 0) |
| [4] |
曹策, 简曙光, 任海, 等. 热带海滨植物水芫花(Pemphis acidula)的生理生态学特性[J]. 生态环境学报, 2017, 26(12): 2064-2070 (  0) 0) |
| [5] |
任海, 简曙光, 张倩媚, 等. 中国南海诸岛的植物和植被现状[J]. 生态环境学报, 2017, 26(10): 1639-1648 (  0) 0) |
| [6] |
罗琦, 刘慧, 吴桂林, 等. 基于功能性状评价5种植物对热带珊瑚岛环境的适应性[J]. 生态学报, 2018, 38(4): 1256-1263 (  0) 0) |
| [7] |
Strobel B W. Influence of vegetation on low-molecular- weight carboxylic acids in soil solution—A review[J]. Geoderma, 2001, 99(3-4): 169-198 DOI:10.1016/S0016-7061(00)00102-6 (  0) 0) |
| [8] |
Jones D L, Dennis P G, Owen A G, et al. Organic acid behavior in soils-misconceptions and knowledge gaps[J]. Plant and Soil, 2003, 248(1/2): 31-41 DOI:10.1023/A:1022304332313 (  0) 0) |
| [9] |
Lundström U, Öhman L O. Dissolution of feldspars in the presence of natural, organic solutes[J]. Journal of Soil Science, 1990, 41(3): 359-369 (  0) 0) |
| [10] |
Wei W, Zhang X, Cui J, et al. Interaction between low molecular weight organic acids and hydroxyapatite with different degrees of crystallinity[J]. Colloids and Surfaces A: Physicochemical and Engineering Aspects, 2011, 392(1): 67-75 (  0) 0) |
| [11] |
Lazo D E, Dyer L G, Alorro R D. Silicate, phosphate and carbonate mineral dissolution behaviour in the presence of organic acids: A review[J]. Minerals Engineering, 2017, 100: 115-123 DOI:10.1016/j.mineng.2016.10.013 (  0) 0) |
| [12] |
杨金玲, 张甘霖. 土壤风化速率研究及其应用[J]. 土壤, 2010, 42(6): 882-888 (  0) 0) |
| [13] |
庄翔宇, 杨金玲, 张甘霖, 等. 亚热带花岗岩地区土壤矿物风化过程中盐基离子的释放特征[J]. 土壤, 2016, 48(2): 374-380 (  0) 0) |
| [14] |
毛欣欣, 何琳燕, 王琪, 等. 具矿物风化效应伯克霍尔德氏菌的筛选与生物学特性研究[J]. 土壤, 2017, 49(1): 77-82 DOI:10.3969/j.issn.1673-3908.2017.01.015 (  0) 0) |
| [15] |
王建萍, 李琼芳, 董发勤, 等. 3种常见细菌胞外特征有机酸对方解石的溶蚀研究[J]. 岩石矿物学杂志, 2015, 34(3): 387-392 (  0) 0) |
| [16] |
Al-Khaldi M H, Nasr-El-din H A, Mehta S, et al. Reaction of citric acid with calcite[J]. Chemical Engineering Science, 2007, 62(21): 5880-5896 DOI:10.1016/j.ces.2007.06.021 (  0) 0) |
| [17] |
Alkhaldi M H, Nasreldin H A, Sarma H K. Kinetics of the reaction of citric acid with calcite[J]. Spe Journal, 2010, 15(3): 704-713 (  0) 0) |
| [18] |
Alkhaldi M H, Sarma H K, Nasreldin H A. Diffusivity of citric acid during its reaction with calcite[J]. Journal of Canadian Petroleum Technology, 2010, 49(8): 43-52 DOI:10.2118/139570-PA (  0) 0) |
| [19] |
朱军利. 分光光度法定量测定柠檬酸及其盐的含量[J]. 分析试验室, 2012, 31(2): 115-117 DOI:10.3969/j.issn.1000-0720.2012.02.029 (  0) 0) |
| [20] |
陈连蔚, 陆杰. 柠檬酸氢钙水合物的制备与表征[J]. 应用化工, 2015, 44(2): 199-202, 205 (  0) 0) |
| [21] |
Levien B J. A physicochemical study of aqueous citric acid solutions[J]. The Journal of Physical Chemistry, 1955, 59(7): 640-644 DOI:10.1021/j150529a016 (  0) 0) |
| [22] |
Davies C W, Hoyle B E. The interaction of calcium ions with some phosphate and citrate buffers[J]. Journal of the Chemical Society (Resumed), 1953, 4134 DOI:10.1039/jr9530004134 (  0) 0) |
| [23] |
Plummer L N, MacKenzie F T. Predicting mineral solubility from rate data; application to the dissolution of magnesian calcites[J]. American Journal of Science, 1974, 274(1): 61-83 (  0) 0) |
| [24] |
Arvidson R S, Collier M, Davis K J, et al. Magnesium inhibition of calcite dissolution kinetics[J]. Geochimica et Cosmochimica Acta, 2006, 70(3): 583-594 DOI:10.1016/j.gca.2005.10.005 (  0) 0) |
| [25] |
何春芳, 叶近婷, 高阳, 等. 三聚磷酸钠与柠檬酸钠钙螯合机理和螯合能力的对比分析[J]. 分子科学学报(中英文版), 2015, 31(3): 198-202 (  0) 0) |
| [26] |
陈先勇, 唐琴, 胡卫兵, 等. 孪生球状碳酸钙的直接混合沉淀法制备及表征[J]. 高等学校化学学报, 2010, 31(10): 1940-1944 (  0) 0) |
| [27] |
谷晋川, 刘亚川. 柠檬酸助浸效果研究[J]. 矿冶工程, 2001, 21(4): 49-51 DOI:10.3969/j.issn.0253-6099.2001.04.016 (  0) 0) |
| [28] |
Yörükoğlu A, Obut A, Girgin İ. Effect of thiourea on sulphuric acid leaching of bastnaesite[J]. Hydrome tallurgy, 2003, 68(1/2/3): 195-202 (  0) 0) |
2. Key Laboratory of Soil Environment and Pollution Remediation, Institute of Soil Science, Chinese Academy of Sciences, Nanjing 210008, China;
3. University of Chinese Academy of Sciences, Beijing 100049, China
 2020, Vol. 52
2020, Vol. 52


