2. 中国科学院南京土壤研究所,南京 210008;
3. 浙江省嘉兴生态环境监测中心,浙江嘉兴 314000
氮是影响水稻产量最重要的营养元素之一,也是所有营养元素当中最活跃的。土壤中氮素转化主要包括有机态氮的矿化和矿质态氮的生物固定,铵的黏土矿物固定–释放、铵的吸附和解吸,氮硝化–反硝化,以及氨的挥发等[1-3]。氮素转化过程与水稻氮素吸收效率紧密相关。大量研究表明,不同基因型水稻的氮素吸收效率间存在明显差异[4-5]。氮素吸收效率高的水稻品种在生长期内从土壤中吸收更多氮素营养[6]。籼粳杂交稻是籼稻和粳稻杂交而成的水稻品种,植株高大、穗大粒多、分蘖势强、茎秆粗壮抗倒、根系发达,它互补了籼稻前期生长快、后期谷草比低和粳稻前期生产慢、后期谷草比高的特点,氮素吸收能力明显增强[7-8]。
有关水稻氮素吸收效率差异的相关机理机制研究,一些研究者从水稻植株自身出发,发现根表面积大、总根长长、根系活力强的水稻品种的氮素吸收能力强[4, 9],水稻植株体内以及根系氮素代谢酶(如谷氨酰胺合成酶(GS)和依赖于NADH的谷氨酸合酶(NADH-GOGAT))活性强与水稻氮素吸收能力强紧密相关[10-11];一些研究者则将水稻根系特性与土壤氮素转化过程相结合,证明水稻氮素吸收能力与根际土壤硝化作用紧密相关。氮素吸收能力强的水稻品种根系通气组织发达,向根际土壤泌氧较多,使根际土壤中的硝化作用强度增大,硝态氮含量升高[12-13]。而硝态氮的存在有利于直接促进水稻对铵态氮的吸收,而提高氮素吸收效率[14],或是促进水稻侧根发育和伸长,间接增加氮素吸收效率[15]。另外,有研究者发现不同水稻品种种植其土壤氮矿化能力存在较大差异。植株生物量或根系生物量大、通气组织发达的水稻品种有利于土壤氮素矿化[16-17]。籼粳杂交稻氮素吸收能力强是否与其土壤氮素矿化能力强紧密相关?
本研究以籼粳杂交水稻为材料,以常规粳稻为对照,通过盆栽、根袋培养以及营养液培养试验在中氮和低氮水平下研究不同水稻品种根系生物学特性和根际土壤理化性状,并从根系角度出发探讨水稻氮素吸收能力与根际土壤硝化强度和土壤氮素矿化能力间的相互关系,为提高水稻氮素吸收效率提供理论依据。
1 材料与方法 1.1 试验材料在浙江省嘉兴市农业科学院培养室开展盆栽和根袋试验。嘉兴位于杭嘉湖平原(30°50′N,120°43′E)、太湖流域内。盆栽和根袋试验用土采集于嘉兴农科院试验基地稻田耕表(0 ~ 20 cm),土壤类型为青紫泥水稻土,其理化性质为:有机碳29.3 g/kg,全氮1.85 g/kg,碱解氮147 mg/kg,有效磷9.87mg/kg,速效钾97.5 mg/kg,pH 6.43(土水比为1:2.5)。土壤自然风干后,敲碎并去除其中根系、碎石等杂物,研磨过3 mm筛,待用。
以籼粳杂交水稻甬优12(YY-12)、嘉优中科6号(JY-6)和常规粳稻秀水134(XS-134)为研究材料。YY-12由宁波市农科院选育,JY-6和XS-134由嘉兴市农科院选育。
1.2 试验设计盆栽试验:将处理好的土壤装盆,每盆5 kg。装盆前土壤与0.8 g过磷酸钙(P2O5,36 kg/hm2)和0.4 g氯化钾(K2O,90 kg/hm2)充分混均,装盆后灌水。根袋试验:将一定量土壤预先装入500目根袋(12 cm × 18 cm),再将根袋垂直置入培养箱中,每个培养箱置4个根袋,装土20 kg,完毕后灌水。
氮肥设置两个水平:①不施氮(L-N),②常规施氮(M-N)。盆栽试验在2017年开展,水稻秧苗于当年5月13日在田间苗床中培养,6月27日移栽至盆中。每盆移栽1穴,每穴2株。试验期间表面水层深度保持在5 cm左右。M-N处理苗肥和分蘖肥均施尿素0.40 g/盆。待水稻生长至分蘖盛期时采集地上部和根系样品用于干物质累积和氮含量测定分析。根袋试验在2018开展,水稻秧苗于当年5月14日在田间苗床培养,6月28日移栽至培养箱根袋中。每根袋移栽1穴,每穴2株。土壤表面水层深度保持在5 cm左右。M-N处理苗肥和分蘖肥均施尿素1.88 g/盆。待水稻生长至分蘖盛期时采集根际土壤样品测定分析矿质氮(NH4+-N和NO3--N)含量、根际土壤硝化强度和氨氧化细菌(AOB)数量。
营养液培养试验于2018年6月底在培养室中开展。营养液采用国际水稻研究所(IRRI)的常规营养液配方。先将3个品种水稻种子(YY12、JY6和XS134)在30% H2O2溶液中消毒30 min,然后用去离子水反复冲洗,挑选大小一致的稻种放入育苗筐,在30℃恒温培养箱中培养。当水稻幼苗培养至2叶1心时,供1/2全营养液(NH4+-N和NO3--N等体积混合),培养至3叶1心时移苗至中转箱中,每个中转箱移栽24穴,各品种为8穴。氮水平设中氮(2.86 mmol/L)和低氮(0.1 mmol/L),氮营养中NH4+-N((NH4)2SO4提供)和NO3--N(Ca(NO3)2提供)各占一半。各处理重复3次。营养液pH保持在5.50 ± 0.05,每隔3 ~ 4 d更换一次营养液。培养至分蘖盛期时测定分析水稻根孔隙度(POR)和根系径向泌氧量(ROL)。
1.3 样品测定方法1) 水稻植株氮含量测定:水稻植株样品烘干磨碎后,用浓H2SO-H2O2消解,凯氏定氮法测定。
2) POR测定:参照并改进Kludze等[18]方法。50 ml比重瓶装满去离子水称重;将反复冲洗擦干后水稻根系剪成0.5 ~ 1 cm长度,混匀,称取0.6 ~ 1.0 g新鲜根系放入装有一定量水的比重瓶中,加满水称重;将已装入根的比重瓶抽真空2 h,取出根系研磨成糊状,之后重新放入比重瓶称重。POR(%) = [mr'-mr)/(m +mp-mr)]×100,式中:POR为根孔隙度(%),mr'为研磨后的根和装满水的比重瓶的总质量(g),mr为未经研磨的根和装满水的比重瓶的总质量(g),m为根质量(g),mp为充满水的比重瓶质量(g)。
3) ROL测定:采用柠檬酸钛比色法[13]。将40 ml 10%水稻营养液加入50 ml试管,充氮气30 min赶走溶液中多余氧气;用石蜡膜缠绕冲洗干净的水稻根基部,并迅速置于试管中,在试管内溶液上层加入2 cm石蜡油防止氧气进入;用注射器将5 ml柠檬酸钛溶液加入试管中,对照试管未加水稻植株;6 h后轻摇试管,用注射器吸取试管中的柠檬酸钠溶液在527 nm下用分光光度计比色。ROL (O2, μmol/h)计算公式为:ROL=1000 × V× (C0 - C)/T,式中:V为最初加入到每一试管中的柠檬酸钛体积(L),C0为6 h后对照处理(不加水稻植株)中柠檬酸钛浓度(Ti3+, mmol /L),C为6 h后添加水稻植株处理中柠檬酸钛浓度(mmol Ti3+/L),T为反应时间(h)。
4) 根际土壤NH4+-N和NO3--N含量测定:将根际土壤用2 mol/L KCl溶液(液土体积质量比10:1)振荡浸提30 min后,过滤,滤液中NH4+-N采用靛酚蓝比色法测定,NO3--N氮用紫外分光光度法测定。
5) 根际土壤短期硝化强度(常用于表征土壤硝化特征)测定:参考李奕林和王兴祥[13]的方法,称取5 g鲜土样3份,分别置于100 ml三角瓶中,加2.5 ml NaClO3 (75 mmol/L)测定,其中两份在25℃下培养24 h,另一份置于-20℃冰箱中24 h作对照;培养结束后每份加入5 ml去离子水、10 ml 2 mol/L KCl,完全摇匀后立即过滤;吸取5 ml滤液放入试管中,加3 ml NH4Cl缓冲溶液(0.19 mol/L,pH 8.5)、2 ml磺胺试剂,摇匀后室温下放置15 min,520 nm波长下比色。硝化强度按下列公式计算:NO2--N (mg/(kg·h))=[(Ct-Ck)×12.5]/(5×θ×24),式中:Ct为滤液NO– 2-N浓度,Ck为对照滤液NO2--N浓度,12.5为所加入试剂体积,5为土样质量,θ表示每克湿土的干重,24为培养时间。硝化强度用单位时间内产生的NO2--N量表示。
6) 根际土壤氨氧化细菌计数:采用MPN法,其中液体培养基包含:(NH4)2SO4 0.5 g/L、NaCl 0.3 g/L、FeSO4·7H2O 0.03 g/L、K2HPO4 1 g/L、MgSO4·7H2O 0.3 g/L和CaCO3 7.5 g/L,pH 7.8,25℃恒温培养14 d,具体方法见《农业微生物学实验技术》[19]。
1.4 计算和统计方法氮素吸收效率(mg/mg)=地上部氮累积量/土壤供氮量
氮素生理利用效率(mg/mg)=地上部干物质累积量/地上部氮累积量
试验数据采用SAS和SPSS分析软件进行处理和统计分析,采用Sigmaplot软件制图。
2 结果与分析 2.1 水稻干物质累积和氮素吸收利用YY-12和JY-6在M-N和L-N处理下地上部和根系干物质累积均显著高于XS-134,其中,M-N处理下比XS-134分别高51.8%和53.2%;L-N处理下分别高77.4%和78.9%。与M-N处理相比,在L-N处理下YY-12和JY-6地上部干物质累积分别下降22.1%和22.5%,XS-134下降33.5%;YY-12和JY-6根系干物质累积分别显著增加20.2%和20.4%,XS-134无明显变化。
YY-12和JY-6在M-N和L-N处理下地上部氮素累积和氮素吸收效率均显著高于XS-134,而3个水稻品种的氮素生理利用效率无明显差异。与M-N处理相比,在L-N处理下YY-12和JY-6地上部氮累积量分别下降39.1%和39.1%,XS-134下降46.3%;YY-12和JY-6氮素吸收效率分别显著增加11.5%和11.6%,而XS-134氮素吸收效率无明显差异。3个水稻品种在L-N处理下的氮素生理利用效率均明显高于M-N处理,三者增加比例基本一致,分别为27.4%、24.1%和28.8%。
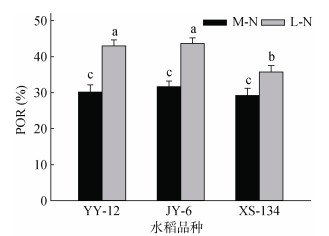
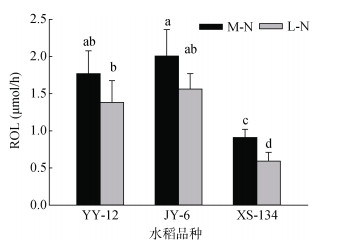
2.2 水稻根孔隙度(POR)和根系径向泌氧量(ROL)M-N处理下YY-12和JY-6的POR大于XS-134,但不明显;L-N处理下明显大于XS-134。与M-N处理相比,L-N处理使不同水稻品种的POR显著增加,其中YY-12和JY-6分别增加42.4%和37.7%,而XS-134增加22.1%(图 1)。YY-12和JY-6在两种供氮水平下ROL均显著高于XS-134。与M-N处理相比,YY-12和JY-6在L-N处理下ROL呈下降趋势,但不显著,但XS-134显著降低28.1%(图 2)。
|
(柱图上方不同小写字母代表处理间差异达显著水平(P≤0.05),下同) 图 1 不同水稻品种POR Fig. 1 POR of different rice varieties |
|
图 2 不同水稻品种ROL Fig. 2 Root radial oxygen losses (ROLs) of different rice varieties |
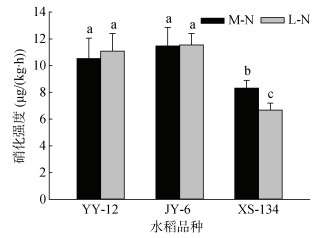
由图 3可见,YY-12和JY-6在两种供氮水平下根际土壤硝化强度均明显高于XS-134。其中,M-N处理下分别高26.5%和37.9%,L-N处理下分别高58.0%和64.8%。与M-N处理相比,L-N处理使XS-134根际土壤硝化强度降低19.7%,但对YY-12和JY-6影响不明显。
|
图 3 不同水稻品种根际土壤硝化强度 Fig. 3 Nitrification activities in rhizosphere soils of different rice varieties |
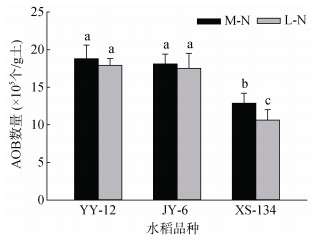
在两种供氮水平下,YY-12和JY6根际土壤中AOB数量均显著高于XS-134。其中,M-N处理下比XS-134分别高46.0%和40.6%;L-N处理下分别高68.7%和64.9%。XS-134根际土壤AOB数量在L-N处理下比M-N处理下降低17.5%,而YY-12和JY-6无明显变化(图 4)。
|
图 4 不同水稻品种根际土壤AOB数量 Fig. 4 Numbers of ammonia oxidizing bacteria (AOB) in rhizosphere soils of different rice varieties |
由表 2可见,YY-12和JY-6在两种供氮水平下根际土壤NH4+-N含量均高于XS-134,但不明显。YY-12和JY-6在M-N处理下根际土壤NH4+-N含量分别比XS-134高5.73%和7.21%,在L-N处理下分别高4.86%和8.22%。与M-N处理相比,L-N处理使水稻根际土壤NH4+-N含量明显降低,YY-12、JY-6和XS-134下降比例分别为16.8%、15.3%和16.1%。
|
|
表 1 不同水稻品种干物质累积和氮吸收利用效率 Table 1 Biomass and nitrogen use efficiency of different rice varieties |
|
|
表 2 不同水稻品种根际土壤中矿质氮含量 Table 2 Mineral N concentrations in rhizosphere soils of different rice varieties |
两种供氮水平下YY-12和JY-6根际土壤NO3--N含量均显著高于XS-134。其中,YY-12和JY-6在M-N处理下比XS-134分别高31.9%和23.8%,在L-N处理下分别高29.2%和22.4%。L-N处理下YY-12、JY-6和XS-134根际土壤NO3--N含量分别比M-N处理降低6.15%、6.88%和15.1%(表 2)。
YY-12和JY-6在两种供氮水平下根际土壤矿质氮含量(NH4+-N + NO3--N)均高于XS-134。其中,YY-12和JY-6在M-N处理下分别比XS-134高10.6%和10.6%,在L-N处理下分别高13.8%和14.4%。与M-N处理相比,L-N处理使YY-12、JY-6和XS-134根际土壤矿质氮含量分别降低12.6%、12.0%和15.8%(表 2)。
3 讨论 3.1 根际土壤硝化作用与水稻氮素吸收之间的关系水稻以有氧呼吸为主,通过叶片吸收空气中的O2以及光合作用制造的O2,经由叶鞘和茎秆的通气组织输送至根系,供根系呼吸,同时有大约30% ~ 40%的O2扩散至根际土壤中,形成一个微域的“氧化圈”[20-21]。进入根际土壤的O2不仅可以缓解一些还原性物质(如Fe2+、Mn2+和H2S)对根系的毒害作用,同时也能促进硝化作用等好氧过程发生[18, 21]。不同水稻品种间根孔隙度(POR)存在较大差异,使根际土壤含氧状况差异较大[17]。本研究中籼粳杂交稻在中氮水平下POR稍大于常规粳稻(图 1),但其根系径向泌氧量(ROL)却明显增大(图 2),这与籼粳杂交稻明显大的根系生物量(表 1)紧密相关。研究表明水稻根系泌氧能力强能够使根际土壤中氨氧化菌(AOB)数量增加,硝化作用增强[17, 22]。本研究中籼粳杂交稻根际土壤的硝化强度明显比常规粳稻强(图 3),同时AOB数量也明显较多(图 4),表明籼粳杂交稻根际土壤中的O2浓度要高于常规粳稻。这与实测的籼粳杂交稻ROL高(图 2)相吻合。大量研究表明水稻根际土壤硝化作用与氮素吸收能力紧密相关。根际土壤硝化作用强水稻氮素吸收能力就强,硝化作用弱水稻氮素吸收能力就相对较差[12-13, 23-24]。与NH4+-N单独存在相比,NO3--N存在时更有利于水稻植株生长、产量形成以及氮素吸收利用[14, 25-27]。这可能是通过某种NO3--N专一性的诱导方式作用于水稻NH4+-N的同化过程,促进NH4+-N吸收[28];也可能是NO3--N存在促进水稻侧根的发育生长[15]。可见水稻根际土壤中由硝化作用形成的NO3--N对水稻植株氮素吸收至关重要[26, 29]。在本研究中,籼粳杂交稻根际土壤的NO3--N含量明显高于常规粳稻(表 2),这是硝化作用增强(图 3)的结果。因此,籼粳杂交稻根系干物质累积量大,通气组织发达,根系泌氧量大,使根际土壤硝化强度增大是其氮素吸收能力强的主要原因之一。
3.2 根际土壤氮素矿化与水稻氮素吸收之间的关系土壤有效态氮库(包括NH4+-N和NO3--N)占比不到土壤全氮含量的2%。主要通过土壤氮矿化而来。因此,土壤矿化氮为植株提供所需氮源[17]。不同水稻品种利用土壤氮素的能力存在差异[5, 16]。Kundu和Ladha[30]研究发现水稻植株生物量越大对土壤氮矿化的影响就越大。Ghosh和Kashyap[17]发现水稻根系生物量大、根系通气组织发达的水稻品种,其土壤中矿物质氮含量更高,矿化速率更快。原因可能是根系通气组织发达的水稻品种,根际土壤O2含量高,从而导致与土壤氮矿化相关的微生物数量增大、活性增强[31-33]。在本研究中,籼粳杂交稻根际土壤矿质氮含量显著高于常规水稻品种(表 2),为其提供了更多可利用的氮源。这很可能是由于籼粳杂交稻根系生物量大(表 1),POR大(图 1),根系通气组织发达,泌氧能力强,从而使其具有更强的土壤氮素矿化能力。相关性分析表明,水稻根际土壤矿质氮含量与水稻植株氮素吸收效率呈极显著正相关(r=0.535,P < 0.01)。由此可见,根际土壤氮素矿化能力强可能也是籼粳杂交稻氮素吸收能力强的原因之一。
3.3 低氮促进氮素吸收能力强水稻品种的氮素吸收研究表明低氮能够诱导水稻根长和根表面积增加[10, 34],这可能与水稻植株地上部生长素向根系极性运输减少紧密相关[35]。本研究中,低氮不同程度地增加了水稻根系干物质累积,但籼粳杂交稻在低氮下根系干物质累积增加比例明显大于常规粳稻(表 1),这表明籼粳杂交稻对低氮胁迫的响应更积极。Saengwilai等[36]发现低氮下玉米根皮层通气组织明显比氮充足时发达,这在很大程度上降低了根系代谢耗能,增加了根长和根体积,从而促进根系对土壤氮的吸收。宋娜娜[37]比较了低氮下水稻根系形态特性,发现低氮处理促进了水稻根系通气组织面积增加和外皮层厚壁细胞加厚,减小了皮层活细胞比例。但不同水稻品种对低氮影响存在较大差异。Abiko和Obara[34]发现低氮下水稻根系通气组织明显增加,并认为这可能是水稻通过增加根系通气组织来减少根系吸收或是活化土壤氮素,又或是两者。本研究再次证明低氮能够增加水稻根系通气组织面积(POR增大)(图 1)。但不同水稻品种POR对低氮响应存在差异,籼粳杂交稻POR发育对低氮响应比常规粳稻更积极,POR增加比例更大(图 1)。这很可能是其在低氮下ROL下降比例小于常规粳稻的原因所在。另外,这很可能也是籼粳杂交稻在低氮下根际土壤硝化强度与中氮水平相比无明显差异,而常规粳稻却明显下降的主要原因。
4 结论籼粳杂交稻氮素吸收能力强与其根系生物量大、通气组织发达、泌氧能力强所导致的根际土壤硝化作用强和氮素矿化能力强紧密相关。另外,籼粳杂交稻根系生物量形成和通气组织发育对低氮响应更积极也是促使其在低氮水平下氮素吸收效率高的主要原因。
| [1] |
朱兆良. 土壤中氮素的转化[J]. 土壤学报, 1963, 11(3): 328-338 (  0) 0) |
| [2] |
袁磊, 李文周, 陈文伟, 等. 戴云山自然保护区森林土壤氮转化特点研究[J]. 土壤, 2017, 49(2): 240-247 (  0) 0) |
| [3] |
张文学, 杨成春, 王少先, 等. 脲酶抑制剂与硝化抑制剂对稻田土壤氮素转化的影响[J]. 中国水稻科学, 2017, 31(4): 417-424 (  0) 0) |
| [4] |
Ju C X, Buresh R J, Wang Z Q, et al. Root and shoot traits for rice varieties with higher grain yield and higher nitrogen use efficiency at lower nitrogen rates application[J]. Field Crops Research, 2015, 175: 47-55 DOI:10.1016/j.fcr.2015.02.007 (  0) 0) |
| [5] |
陈贵, 施卫明, 赵国华, 等. 太湖地区主栽高产水稻品种对土壤和肥料氮的利用特性研究[J]. 土壤, 2016, 48(2): 241-247 (  0) 0) |
| [6] |
Chen G, Chen Y, Zhao G H, et al. Do high nitrogen use efficiency rice cultivars reduce nitrogen losses from paddy fields?[J]. Agriculture, Ecosystems & Environment, 2015, 209: 26-33 (  0) 0) |
| [7] |
王林友, 王建军, 张礼霞, 等. 杂交稻浙优18特征特性及栽培技术[J]. 浙江农业科学, 2013, 1(4): 364-366 DOI:10.3969/j.issn.0528-9017.2013.04.002 (  0) 0) |
| [8] |
林建荣, 宋昕蔚, 吴明国, 等. 籼粳超级杂交稻育种技术创新与品种培育[J]. 中国农业科学, 2016, 49(2): 207-18 DOI:10.3864/j.issn.0578-1752.2016.02.002 (  0) 0) |
| [9] |
Fan J B, Zhang Y L, Turner D, et al. Root physiological and morphological characteristics of two rice cultivars with different nitrogen-use efficiency[J]. Pedosphere, 2010, 20(4): 446-455 DOI:10.1016/S1002-0160(10)60034-3 (  0) 0) |
| [10] |
Shi W M, Xu W F, Li S M, et al. Responses of two rice cultivars differing in seedling-stage nitrogen use efficiency to growth under low-nitrogen conditions[J]. Plant and Soil, 2009, 326(1/2): 291-302 (  0) 0) |
| [11] |
Andrews M, Lea P J, Raven J A, et al. Can genetic manipulation of plant nitrogen assimilation enzymes result in increased crop yield and greater N-use efficiency? An assessment[J]. Annals of Applied Biology, 2004, 145(1): 25-40 DOI:10.1111/j.1744-7348.2004.tb00356.x (  0) 0) |
| [12] |
LI Y L, FAN X R, SHEN Q R. The relationship between rhizosphere nitrification and nitrogen-use efficiency in rice plants[J]. Plant, Cell & Environment, 2008, 31(1): 73-85 (  0) 0) |
| [13] |
李奕林, 王兴祥. 红壤区不同肥力水稻土根际硝化作用特征[J]. 土壤学报, 2012, 49(5): 962-970 (  0) 0) |
| [14] |
Duan Y H, Zhang Y L, Ye L T, et al. Responses of rice cultivars with different nitrogen use efficiency to partial nitrate nutrition[J]. Annals of Botany, 2007, 99(6): 1153-1160 DOI:10.1093/aob/mcm051 (  0) 0) |
| [15] |
Kant S, Bi Y M, Rothstein S J. Understanding plant response to nitrogen limitation for the improvement of crop nitrogen use efficiency[J]. Journal of Experimental Botany, 2011, 62(4): 1499-1509 (  0) 0) |
| [16] |
de Datta S K, Broadbent F E. Methodology for evaluating nitrogen utilization efficiency by rice genotypes[J]. Agronomy Journal, 1988, 80(5): 793-798 DOI:10.2134/agronj1988.00021962008000050020x (  0) 0) |
| [17] |
Ghosh P, Kashyap A K. Effect of rice cultivars on rate of N-mineralization, nitrification and nitrifier population size in an irrigated rice ecosystem[J]. Applied Soil Ecology, 2003, 24(1): 27-41 DOI:10.1016/S0929-1393(03)00068-4 (  0) 0) |
| [18] |
Kludze H K, DeLaune R D, Patrick W H Jr. Aerenchyma formation and methane and oxygen exchange in rice[J]. Soil Science Society of America Journal, 1993, 57(2): 386-391 DOI:10.2136/sssaj1993.03615995005700020017x (  0) 0) |
| [19] |
李阜棣. 农业微生物学实验技术[M].
中国农业出版社, 北京, 1996
(  0) 0) |
| [20] |
Armstrong W. Aeration in higher plants[M].
Amsterdam: Elsevier, Advances in Botanical Research., 1980: 225-332
(  0) 0) |
| [21] |
Li Y L, Zhang Y L, Hu J, et al. Contribution of nitrification happened in rhizospheric soil growing with different rice cultivars to N nutrition[J]. Biology and Fertility of Soils, 2007, 43(4): 417-425 DOI:10.1007/s00374-006-0119-0 (  0) 0) |
| [22] |
Kirk G J D, Kronzucker H J. The potential for nitrification and nitrate uptake in the rhizosphere of wetland plants: A modelling study[J]. Annals of Botany, 2005, 96(4): 639-646 DOI:10.1093/aob/mci216 (  0) 0) |
| [23] |
李奕林, 张亚丽, 张耀鸿, 等. 施N对不同水稻品种N肥利用率及根际硝化作用和硝化微生物的影响[J]. 生态学报, 2007, 27(6): 2507-2515 DOI:10.3321/j.issn:1000-0933.2007.06.045 (  0) 0) |
| [24] |
李奕林, 王兴祥, 张桃林. 红壤区不同产量籼稻品种苗期根表和根际土壤硝化特征[J]. 生态学报, 2009, 29(7): 3704-3712 DOI:10.3321/j.issn:1000-0933.2009.07.031 (  0) 0) |
| [25] |
Raman D R, Spanswick R M, Walker L P. The kinetics of nitrate uptake from flowing solutions by rice: Influence of pretreatment and light[J]. Bioresource Technology, 1995, 53(2): 125-132 DOI:10.1016/0960-8524(95)98138-E (  0) 0) |
| [26] |
Kronzucker H J, Siddiqi M Y, Glass A D M, et al. Nitrate-ammonium synergism in rice. A subcellular flux analysis[J]. Plant Physiology, 1999, 119(3): 1041-1046 (  0) 0) |
| [27] |
Koutroubas S D, Ntanos D A. Genotypic differences for grain yield and nitrogen utilization in Indica and Japonica rice under Mediterranean conditions[J]. Field Crops Research, 2003, 83(3): 251-260 DOI:10.1016/S0378-4290(03)00067-4 (  0) 0) |
| [28] |
Britto D T, Kronzucker H J. Bioengineering nitrogen acquisition in rice: can novel initiatives in rice genomics and physiology contribute to global food security?[J]. BioEssays, 2004, 26(6): 683-692 DOI:10.1002/bies.20040 (  0) 0) |
| [29] |
Kronzucker H J, Glass A D M, Siddiqi M Y, et al. Comparative kinetic analysis of ammonium and nitrate acquisition by tropical lowland rice: Implications for rice cultivation and yield potential[J]. New Phytologist, 2000, 145(3): 471-476 DOI:10.1046/j.1469-8137.2000.00606.x (  0) 0) |
| [30] |
Kundu D K, Ladha J K. Effect of growing rice on nitrogen mineralization in flooded soil[J]. Soil Science Society of America Journal, 1997, 61(3): 839-845 DOI:10.2136/sssaj1997.03615995006100030018x (  0) 0) |
| [31] |
Kitayama K, Aiba S I, Majalap-Lee N, et al. Soil nitrogen mineralization rates of rainforests in a matrix of elevations and geological substrates on Mount Kinabalu, Borneo[J]. Ecological Research, 1998, 13(3): 301-312 DOI:10.1046/j.1440-1703.1998.00264.x (  0) 0) |
| [32] |
曹小闯, 李晓艳, 朱练峰, 等. 水分管理调控水稻氮素利用研究进展[J]. 生态学报, 2016, 36(13): 3882-3890 (  0) 0) |
| [33] |
唐美玲, 魏亮, 祝贞科, 等. 稻田土壤有机碳矿化及其激发效应对磷添加的响应[J]. 应用生态学报, 2018, 29(3): 857-864 (  0) 0) |
| [34] |
Abiko T, Obara M. Enhancement of porosity and aerenchyma formation in nitrogen-deficient rice roots[J]. Plant Science, 2014, 215/216: 76-83 DOI:10.1016/j.plantsci.2013.10.016 (  0) 0) |
| [35] |
孙虎威, 王文亮, 刘尚俊, 等. 低氮胁迫下水稻根系的发生及生长素的响应[J]. 土壤学报, 2014, 51(5): 1096-0102 (  0) 0) |
| [36] |
Saengwilai P, Nord EA, Chimungu J G, et al. Root cortical aerenchyma enhances nitrogen acquisition from low-nirogen soils in Maize[J]. Plant Physiology, 2014, 166: 726-735 DOI:10.1104/pp.114.241711 (  0) 0) |
| [37] |
宋娜娜.水稻根系特性对根系碳氮成本影响及其与氮素吸收利用的关系研究[D].武汉: 华中农业大学, 2017.
(  0) 0) |
2. Institute of Soil Science, Chinese Academy of Sciences, Nanjing 210008, China;
3. Jiaxing Ecology and Environment Bureau, Jiaxing, Zhejiang 314000, China
 2020, Vol. 52
2020, Vol. 52


