2. 中国科学院大学, 北京 100049
碳氮代谢是植物最基本的代谢过程[1]。氮代谢需要依赖碳代谢为其提供碳源和能量,碳代谢也需要氮代谢为其提供酶和光合色素。碳代谢和氮代谢需要共同的还原力、ATP和碳骨架[2],因此,两个代谢之间存在着竞争关系。碳氮代谢的平衡对植物碳氮营养的分配起着至关重要的影响[3-4]。氮素主要通过NH4+-N和NO3--N两种形式进入植株体内[5-6],已有研究表明,植物优先利用NH4+,但是,一旦植物吸收了过多的NH4+,就会对植物的生长发育产生铵毒害[7]。Harada等[8]研究发现:植物吸收过量NH4+后将在植物体内造成游离铵的过量累积,从而引起植物的生长受到抑制。在高等植物中,谷氨酰胺合成酶(GS)则是NH4+同化途径中的限速酶,对植物的生长发育和产量有直接的影响[9]。在拟南芥中研究发现,拟南芥atgs1;2缺陷突变体,植株的子叶氮转化再利用步骤受到抑制,从而导致子叶中游离氮积累,缺陷突变体长势受到阻碍[10]。
蔗糖不仅仅是光合作用的主要产物之一,还可以作为信号分子参与植物的生长发育过程[11],如作为信号分子调节拟南芥花青素的积累[12];此外,蔗糖还可以提高植物的抗氧化能力[13]。另外糖也能参与到植物氮同化酶的调节,可以促进离体植物叶片中硝酸还原酶(NR)在转录水平上的表达[14];外源蔗糖还可以显著升高烟草叶片中谷氨酰胺合成酶(GS)的活性[15]。除此之外,蔗糖还可以缓解植株在高盐胁迫下植株的生命活动。现在已经有报道,外源添加蔗糖可以增强小麦幼苗抗盐性[16];外源添加蔗糖可以对盐胁迫下荞麦幼苗根系的生长有缓解作用[17]。
本试验以拟南芥的谷氨酰胺合成酶相关基因的T-DNA突变体和野生型为材料。在高NH4+胁迫下,通过外源添加蔗糖对谷氨酰胺合成酶的T-DNA缺陷体和野生型的碳氮代谢相关基因、酶活性进行研究,探索高NH4+胁迫下,如何维持拟南芥的碳氮代谢平衡、为减轻NH4+胁迫对作物的毒害作用提供参考依据。
1 材料与方法 1.1 材料野生型拟南芥(Arabidopsis thaliana Columbia)为本实验室保存(下文简称Col-0)。GS家族T-DNA插入突变体购自ABRC(www.arabidopsis.org),CS721512 (下文简称gs1.1)和Salk-003343C(下文简称gs1.2)。
2Mix rTaq、RNAiso Plus和PrimeScript TMII RT试剂盒以及TaKaRa Ex Taq购自宝生物工程(大连)有限公司。引物由生工生物工程(上海)有限公司合成。其他生化试剂均为国产分析纯试剂。
1.2 培养方法 1.2.1 培养基培养培养方法参考文献[18],光照培养箱的温度为(23 ± 1) ℃,光周期为16 h光照、8 h黑暗,光照强度为100 μmol/(m2·s)。营养液成分根据Yuan等[19]修改得:2 mmol/L NH4NO3,1 mmol/L KH2PO4,1 mmol/L MgSO4,250 μmol/L K2SO4,250 μmol/L CaCl2,100 μmol/L Na-Fe-EDTA,50 μmol/L KCl,50 μmol/L H3BO3,5 μmol/L MnSO4,1 μmol/L ZnSO4,1 μmol/L CuSO4,1 μmol/L Na2MoO4,1 mmol/L MES-KOH(2-码啉已磺酸),1% (w/V) 蔗糖,0.8% (w/V) 琼脂,pH 5.7。纯合体拟南芥种子先用10% 的次氯酸钠(V/V)和0.1% (w/V) SDS消毒5 min,然后用灭菌水清洗干净(5次),置4 ℃低温避光保存48 h,然后播种于培养基(10 cm × 10 cm),密封好。将培养皿直立地置于光照培养箱中,让根沿琼脂表面向下生长。
1.2.2 高NH4+胁迫下外源添加蔗糖培养在培养基生长7 d后,挑选长势一致的植株幼苗移植到泥炭土: 蛭石: 石英砂=3:3:1的土培培养基中接着生长,土培培养基在用于生长前用清水漂洗,尽可能地除去里面所含有的营养物质。土培培养时所用光照强度同前文培养基生长,培养液配方也参照前文培养基配方,但是不含有蔗糖和琼脂,每周每组浇灌1 L培养液。等苗龄21 d后,分为3组,将培养液配方中NH4NO3更换为NH4Cl,其余成分与之前培养液一致,具体处理方法如表 1。
|
|
表 1 试验设计 Table 1 Experiment design |
gs1.1和gs1.2的基因名称及引物序列见表 2。
|
|
表 2 拟南芥T-DNA突变体株系及引物序列 Table 2 Arabidopsis thaliana T-DNA mutant and primer sequences |
采用蔗糖法[20-21]提取拟南芥基因组DNA,随后进行PCR反应,PCR所用引物序列如表 2。
反应体系如下:模板DNA 1 μl,正向引物(10 μmol/L)0.4 μl,反向引物(10 μmol/L)0.4 μl,2 ×Mix rTaq10 μl,双蒸水8.2 μl,总体积20 μl,混匀后进行PCR反应。PCR反应条件为:94 ℃预变性3 min;94 ℃变性30 s,60 ℃退火45 s,72 ℃延伸90 s,30次循环;最后72 ℃延伸10 min。PCR产物利用1.0% 琼脂糖凝胶电泳检测,所用的电泳缓冲溶液为1×TBE,电泳电压为120 V。
利用TaKaRa的RNAiso Plus试剂提取拟南芥野生型与待检测T-DNA插入株系叶片的RNA。用NanoDrop 2000超微量分光光度计测定RNA的浓度。利用Prime-Script TMII RT试剂盒进行cDNA合成。利用At5g37600基因的特异引物At5g37600-F(5′-CATCAACCTTAACCTCTCAGACTCCA-3’)和At5g37600-R(5′-GGTTTGGCCCATCAGAATCG-3′)进行RT-PCR检测At5g37600的表达;利用At1g66200基因的特异引物At1g66200-F(5′-CATCAACCTTAACCTCTCAGACTCCA-3′)和At1g66200-R(5′-GGTTTGGCCCATCAGAATCG-3′)进行RT-PCR检测At1g66200的表达。ACTIN1基因作为内参,ACTIN1引物序列为ACTIN1-F:5’-ACACCAGACATAGTAGCAGAAATCAAG-3’,ACTIN1-R:5’-GAGCCTTACAACGCTACTCTGTCTGTC-3’。PCR扩增条件:94 ℃ 3 min;94 ℃ 3 min,58 ℃ 30 s,72 ℃ 1 min,25个循环;最后72 ℃延伸5 min。扩增产物用1.0% 琼脂糖凝胶电泳进行分析。
1.3.2 外源蔗糖对高NH4+胁迫下植株生理生化的影响将外源添加蔗糖处理4周的拟南芥植株收样,并测定其鲜重。参照文献[22-23]测定叶绿素含量;采用蒽酮比色法测定可溶性糖含量;采用考马斯亮蓝G-250染色法测定可溶性蛋白含量;采用靛酚蓝比色法测定游离NH4+含量。每个处理重复3次,计算平均值。
1.3.3 外源蔗糖对高NH4+胁迫下拟南芥植株的GS和GDH酶的影响称取0.2 g鲜样叶片,放入预冷的研钵中,加入1.5 ml预冷的提取缓冲液,添加少量石英砂在冰上研磨,匀浆收集至2.0 ml离心管中,4 ℃,16 000 g离心20 min。将上清液转移到新的离心管中用于测定相关酶活性。提取缓冲液成分:50 mmol/L Tris-HCl(pH 7.5),10 mmol/L MgCl2,1 mmol/L EDTA,1 mmol/L EGTA,1 mmol/L苯甲脒,1 mmol/L ε-氨基乙酸和10 μmol/L亮抑酶肽。采用Migge等[24]方法测定谷氨酰胺合成酶(GS)和谷氨酸脱氢酶(GDH)酶活性
1.3.4 外源蔗糖对高NH4+胁迫下拟南芥植株矿质元素的影响用天平称量拟南芥地上部鲜重;参照文献[23],采用凯氏定氮法测定全氮;采用H2SO4-H2O2-钒钼黄比色法测定全磷含量;采用H2SO4-H2O2火焰原子吸收分光光度法测定全钾含量。采用干灰化-稀HCl溶解-火焰原子吸收分光光度法,测定钙、镁、铁含量。
1.3.5 数据分析采用Microsoft Excel 2010软件和SPSS13.0软件进行试验数据的统计和相关性分析,采用Duncan’s检验法进行显著性差异分析。
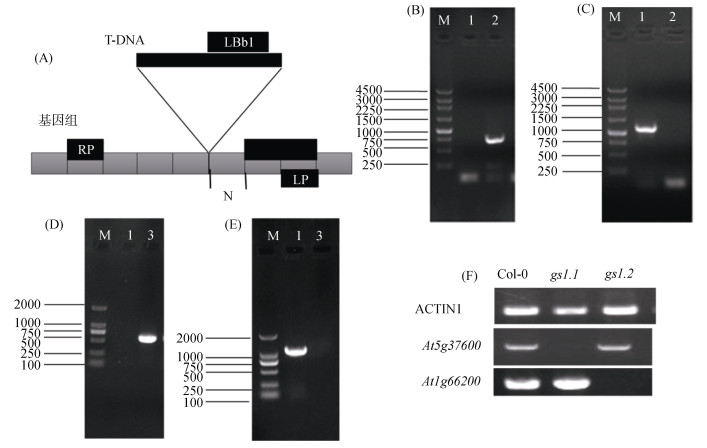
2 结果与分析 2.1 gs1.1和gs1.2插入纯合体的鉴定对拟南芥gs1.1和gs1.2株系鉴定结果如图 1B、1D,结果显示该gs1.1和gs1.2突变体有非常清晰的插入特异性扩增条带,产物大约为700 bp。然后,对两个株系DNA样品利用T-DNA插入两端的LP和RP引物进行了PCR扩增,其结果如图 1C、1E,野生型样品有预测的1 057 bp和1 105 bp大小的特异PCR产物,而gs1.1和gs1.2株系样品并没有扩增条带,说明gs1.1和gs1.2为纯合的T-DNA插入。对其进行RT-PCR发现,在gs1.1株系中,几乎检测不到At5g37600,表明gs1.1株系在T-DNA插入的作用下,At5g37600基因完全被敲除。在gs1.2株系中,几乎检测不到At1g66200,表明gs1.2株系在T-DNA插入的作用下,At1g66200基因完全被敲除。
|
(A:T-DNA突变体插入片段PCR鉴定模式图;B:Col-0和gs1.1的LBb1和LP引物扩增结果;C:Col-0和gs1.1的RP和LP引物扩增结果(M为Takara 250 bp DNA Marker,1为Col-0,2是gs1.1);D:Col-0和gs1.2的LBb1和LP引物扩增结果;E:Col-0和gs1.2的RP和LP引物扩增结果(M为Takara DL2000 DNA Marker,1为Col-0,3是gs1.2);F:Col-0、gs1.1和gs1.2株系在At5g37600和At1g66200的表达结果(ACTIN1为内参)) 图 1 gs1.1和gs1.2纯合体鉴定 Fig. 1 Identification of homozygous gs1.1 and gs1.2 mutants |
从表 3可以看出,CK处理,Col-0和gs1.1、gs1.2 3个株系的鲜重并没有显著差异。T1处理下,和CK相比较,3个株系的鲜重都略有增加,分别增加了2.3%、2.3% 和3.5%,并未达到显著差异;T2处理下,3个拟南芥植株的鲜重出现降低,和CK相比分别降低了14.6%、24.0% 和23.0%,其中Col-0的降低幅度最小,远低于gs1.1和gs1.2;T3处理下,3个株系植株的鲜重和T2处理相比,有所增加,其增加的幅度依次为6.7%、10.9% 和10.5%,其中,gs1.1和gs1.2的增加幅度要大于Col-0;T3处理下和CK相比,3个株系的鲜重分别降低了6.8%、13.7% 和11.9%,其中,Col-0降低的幅度最小;表明蔗糖可以缓解高NH4+胁迫对拟南芥生长的抑制,但是缓解作用有限,并不能完全缓解高NH4+胁迫作用,其中外源添加蔗糖对gs1.1和gs1.2的效果更为明显。
|
|
表 3 外源蔗糖对高NH4+胁迫下拟南芥鲜重影响(g/株) Table 3 Effects of exogenous sucrose on fresh weights of Arabidopsis thaliana under high NH4+ stress |
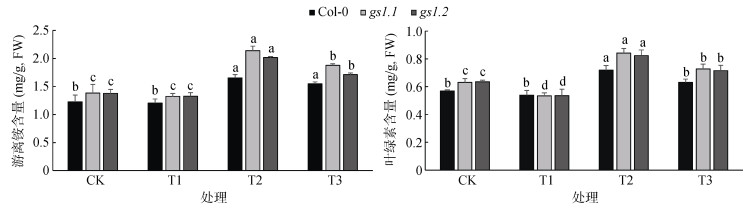
从图 2中可以看出,和CK相比,T1处理下,Col-0、gs1.1和gs1.2植株体内的游离NH4+含量分别降低了1.7%、4.4% 和3.7%;T2处理下,和CK相比,3个株系的游离NH4+含量分别增加了35.0%、54.3% 和46.4%,其中,gs1.1的游离NH4+含量增加最为明显,其次为gs1.2,Col-0的增加最少;和T2相比,T3处理下,游离NH4+含量分别降低了6.5%、12.2% 和15.1%。外源添加蔗糖可以在一定程度上减少植物体内游离NH4+含量,对高NH4+处理下植株更为明显,相较而言,外源添加蔗糖对高NH4+胁迫下的gs1.1和gs1.2的缓解能力更强。
|
(图中小写字母不同表示不同处理下同一株系间差异达P < 0.05显著水平,下图同) 图 2 外源蔗糖对高NH4+胁迫下拟南芥植株的游离NH4+和叶绿素含量的影响 Fig. 2 Effects of exogenous sucrose on contents of free ammonium and chlorophyll of Arabidopsis thaliana under high NH4+ stress |
叶绿素含量也是反映植物体中N含量的一个重要因素,从图 2可以看出,和CK相比,T1处理植物体内的叶绿素含量分别降低了5.2%、15.3% 和15.7%,其中,gs1.1和gs1.2的叶绿素含量变化更为显著,降低幅度大于Col-0;T2处理下,植株体内的叶绿素含量分别增加了26.3%、33.4% 和29.6%,其中gs1.1的叶绿素增加最为显著。T3处理下,和T2相比,3个株系植株体内叶绿素含量分别减少了9.5%、13.6% 和13.1%,其中,gs1.1和gs1.2变化幅度高于gs1.1和gs1.2。可以看出,外源添加蔗糖,可以在一定程度上缓解高NH4+对拟南芥植株的胁迫,其中,对gs1.1和gs1.2的影响更为明显。
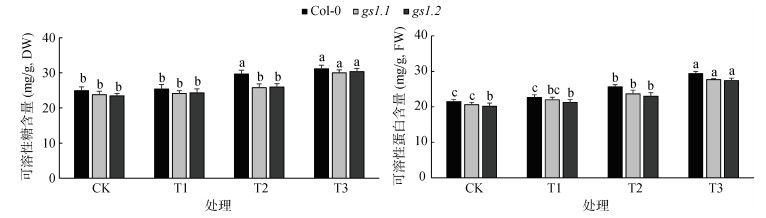
2.4 外源蔗糖对高NH4+胁迫下拟南芥植株可溶性糖和可溶性蛋白含量的影响植物中碳水化合物是重要的渗透调节物质,由图 3可知,T1处理下,与CK相比,3个株系可溶性糖含量分别增加了1.6%、1.3% 和3.1%,在CK处理和T1处理下,3个株系之间无显著性差异;T2处理下,和CK相比,3个株系可溶性糖含量分别增加18.9%、8.4% 和10.6%,其中Col-0的增加幅度明显高于gs1.1和gs1.2,Col-0和gs1.1、gs1.2之间达到显著性差异;和T2处理相比,T3处理下,Col-0、gs1.1和gs1.2的可溶性糖含量分别增加5.0%、16.4% 和17.1%,gs1.1和gs1.2的增幅更为显著,Col-0和gs1.1和gs1.2间没有达到显著性差异。
|
图 3 外源蔗糖对高NH4+胁迫下拟南芥植株的可溶性糖和可溶性蛋白含量的影响 Fig. 3 Effects of exogenous sucrose on contents of soluble sugar and protein of Arabidopsis under high NH4+ stress |
和CK相比,T1处理下,Col-0、gs1.1和gs1.2的可溶性蛋白含量均增加,分别增加5.5%、6.5% 和5.5%,在CK处理和T1处理下,3个株系之间并无显著性差异;T2处理下,和CK相比,3个株系的可溶性蛋白含量分别增加了19.3%、14.7% 和14.1%,Col-0和gs1.1、gs1.2之间并没有达到显著性差异。和T2处理相比,T3处理下,Col-0、gs1.1和gs1.2的可溶性蛋白含量分别增加14.7%、16.9% 和19.3%,gs1.1和gs1.2的增幅更为明显,Col-0和gs1.1、gs1.2都未达到显著性差异。
高NH4+胁迫下,拟南芥植株的可溶性糖和可溶性蛋白含量增加,添加外源蔗糖在一定程度上增加了植株体内可溶性糖和可溶性蛋白含量,从而增加植株碳水化合物的含量,维持细胞内渗透压的平衡,提高植物的抗逆性,同时为氮代谢提供碳源,维持碳氮代谢。
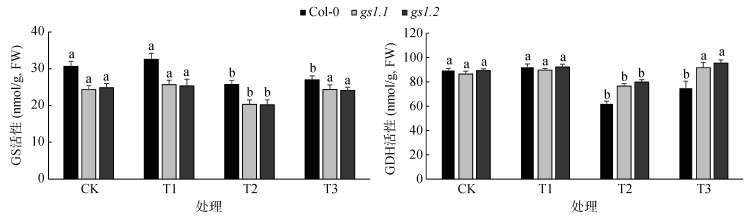
2.5 外源蔗糖对高NH4+胁迫下拟南芥植株GS和GDH活性的影响GS、GDH是氮代谢中的关键酶,GS是无机氮转化为有机氮的关键酶,GDH是连接碳、氮代谢的关键点。从图 4可知,T1处理下,和CK相比,植株叶片中GS的活性增加,Col-0、gs1.1和gs1.2分别增加了6.1%、5.2和1.9%,Col-0和gs1.1、gs1.2的GS酶活性存在显著性差异;T2处理和CK相比,3个株系GS活性分别降低了15.9%、16.5% 和18.89%,说明高NH4+胁迫降低了GS的活性,3个株系的降低幅度差异并不大;T3处理下,和T2处理相比,3个株系的GS酶活出现不同程度的增加,分别提高了4.7%、19.7% 和19.5%,添加外源蔗糖对gs1.1和gs1.2的GS酶活提高更显著。添加外源蔗糖可以提高植株中GS的活性,促进植物中无机氮转化为有机氮的过程。
|
图 4 外源蔗糖对高NH4+胁迫下拟南芥植株的GS和GDH酶活的影响 Fig. 4 Effects of exogenous sucrose on activities of GS and GDH of Arabidopsis under high NH4+ stress |
与CK相比,T1处理中,Col-0、gs1.1和gs1.2的GDH酶活分别增加了2.9%、3.6% 和3.2%,3个株系之间并没有显著差异;T2处理下和CK相比,3个株系分别降低了30.6%、11.5% 和10.6%,其中,Col-0的降低幅度最为显著,3个株系之间差异显著;T3处理下提高了植物的GDH活性,和T2处理相比,Col-0、gs1.1和gs1.2分别增加了20.8%、19.7% 和19.5%,表明外源添加蔗糖在一定程度上可以提高植物中GDH酶活。
2.6 外源添加蔗糖对高NH4+胁迫下植株矿质元素含量的影响表 4是外源添加蔗糖后,植物体内矿质元素的含量。从表 4中可知,3个株系中的N、P、K、Ca的含量都呈现出T3>T2>T1>CK的趋势。与CK相比,T1处理下,拟南芥中的N含量增加,3个株系分别增加了5.5%、8.8% 和15.2%;T2处理下,3个株系的N含量分别增加了32.2%、36.3% 和36.9%,与T2相比,T3处理下,N含量显著增加了26.7%、28.6% 和27.5%。植株体内P含量,在T1处理下比CK增加了4.4%、5.0% 和3.6%;T2处理下增加了42.8%、30.4% 和39.6%;和T2处理相比,T3处理下分别增加了24.3%、36.3% 和32.8%。植株体内的K含量,与CK相比,T1处理下Col-0、gs1.1和gs1.2分别增加了6.6%、5.4% 和5.3%;T2处理下K含量增加16.9%、14.3% 和8.1%;和T2处理相比,T3处理下分别增加了7.1%、10.8% 和7.8%。植物中Ca含量,变化幅度和其他元素相比较低,与CK相比,T1处理下3个株系增加了0.06%、2.7% 和1.2%;T2处理和CK相比提高了1.2%、3.5% 和3.1%;T3处理和T2相比,增加了0.3%、2.4% 和3.4%。高NH4+胁迫下,植株的N、P、K、Ca含量都表现出不同程度的增加,外源添加蔗糖后,N、P、K、Ca的含量继续不同幅度提高。
|
|
表 4 外源添加蔗糖对高NH4+胁迫下拟南芥植株矿质元素含量的影响(mg/g,FW) Table 4 Effects of exogenous sucrose on mineral element contents of Arabidopsis under high NH4+ stress |
3个株系植株Mg含量都呈现出T1>CK>T3>T2的趋势,与CK相比,T1处理分别增加了2.9%、6.0% 和4.1%,T2处理下降低了28.7%、12.8% 和20.8%;T3处理和T2相比,分别提高了10.8%、4.1% 和7.8%,高NH4+胁迫下植株中Mg含量减少,外源添加蔗糖在一定程度上提高了植株的Mg含量。3个株系植株Fe含量呈现出T2>T3>CK>T1的趋势,和CK相比,T1处理下植株的Fe含量分别降低7.0%、9.5% 和9.5%,T2处理下分别增加38.1%、63.1% 和57.9%;T3处理下和T2相比减少了27.5.%、29.0% 和26.6%。高NH4+胁迫下植株的Fe含量增加,外源添加蔗糖在一定程度上减少植株的Fe含量。
3 讨论氮是植物生长发育所必需的营养元素[25-26],而NH4+是植物重要的氮素之一,但是高NH4+胁迫对植物的生长发育会有严重的抑制,而且和植株体内的碳、氮代谢之间存在着复杂的联系[27]。一般来说,高NH4+毒害产生的首要原因,是植物体内积累了较多的自由NH4+,远远超出了植物自身同化量[28]。有研究认为GS是NH4+高效利用植物的绿色组织中NH4+解毒和代谢中的一个关键因子[29]。因此,缺乏AtGS1;1或者AtGS1;2基因,植株的铵同化能力受到部分抑制。而植物的鲜重可直观地反映植株生长状况[24, 30],叶绿素含量也是反映植株体内含N量的一个重要因素。李保海和施卫明[31]在研究中发现,拟南芥叶绿素含量随着外界NH4+的增加而增加,其中对NH4+敏感的株系含量增加更明显。Raab和Terry[32]报道高NH4+能抑制甜菜叶面积的生长,增加叶绿素含量,但是单位面积的光合速率不变。罗金葵等[33]也报道,随着NH4+浓度的增加,小白菜植株叶绿素含量升高,叶面积减少,但是光合速率并不受影响。因此初步猜测高NH4+下植株叶绿素含量增加是因为植物为了保持光合速率的不变,在叶面积减少的情况下,增加叶绿素含量用来维持光合速率。本文试验结果也与之符合,高NH4+胁迫下拟南芥植株的鲜重减少,体内游离NH4+积累量增多,叶绿素含量增加,gs1.1、gs1.2和Col-0相比,受到高NH4+毒害更为严重,可能是因为gs1.1和gs1.2缺陷突变体缺乏AtGS1;1和AtGS1;2基因,植株本身的同化能力就受到一定程度的抑制,因此体内游离NH4+不能及时同化,导致积累过多,从而对植株生长产生毒害。
本试验中,高NH4+胁迫下外源添加蔗糖可以在一定程度上缓解高NH4+对植物的毒害[31, 33-34]。CK和T1处理相比,植株的鲜重、游离NH4+含量等数值差异并不显著,基本排除了外源添加蔗糖缓解高NH4+胁迫是因为蔗糖提供营养的可能性。植株在逆境条件下会通过渗透调节来适应环境,而可溶性糖和可溶性蛋白一般会作为植株体内重要的渗透调节物质,充当衡量植物抗逆性的指标。闫素芳等[16]报道,外源蔗糖可以通过提高小麦的可溶性糖含量来提高小麦幼苗的耐盐性;常丽丽等[35]报道外源蔗糖可以缓解高NO-3胁迫对叶用莴苣生长的抑制,提高叶用莴苣的可溶性糖含量,降低NH4+含量。本文研究结果表明,在高NH4+处理下,拟南芥的可溶性糖和可溶性蛋白含量都出现增加,猜测是因为植物为了通过渗透调节缓解高NH4+胁迫,高NH4+条件下外源添加蔗糖,可以增加拟南芥植株的可溶性糖和可溶性蛋白含量,进一步帮助植株提高渗透调节缓解高NH4+胁迫,说明外源添加蔗糖可以增加植株体内的碳水化合物含量,从而维持细胞的渗透压平衡,提高植株的抗逆性;另外,外源添加蔗糖还可为氮代谢提供碳源,维持植株体内的碳、氮平衡。
GS酶是植株体内NH4+同化过程中的一个关键酶[36],在高等植物中,95% 的NH4+是通过GS/ GOGAT循环同化的。NH4+对植物GS基因表达的调节会因为植物种类、NH4+浓度及器官的不同而不同。有研究表明,外源的NH4+可以提高水稻的GS活性[37],而在菜豆植物体及根瘤的GS活性则会随着外界NH4+浓度的增加而降低[38]。本试验中,GS酶活性随着外界NH4+的增加而降低,抑制了NH4+同化过程,外源添加蔗糖可以提高GS酶活性,在一定程度上缓解了NH4+胁迫对氮代谢的抑制。GDH是连接碳、氮代谢的关键酶,现在认为GDH在解除氨毒过程中起主要作用[39]。在本研究结果中,gs1.1和gs1.2在高NH4+胁迫下GDH酶活性高于Col-0,可能是因为gs1.1和gs1.2在高NH4+处理下受到的抑制更大,此时GDH酶活性提高可以在一定程度上缓解NH4+毒害。外源添加蔗糖可以增加植株体内的GDH酶活性,猜测外源蔗糖通过提高植株的GDH酶活性,来缓解高NH4+毒害,减少游离NH4+含量,从而提高植株对N的利用率。
NH4+的吸收会影响到其他阳离子的吸收,因此,高NH4+胁迫对植物的毒害症状还有可能和植物体内的矿质元素旳不足相关。有研究表明,供应NH4+-N会显著改善缺铁植物的铁营养[40]。氮素形态、供应量及时间影响作物对土壤中钾的固定与释放,以及对钾的吸收、转运、循环和重新利用[41]。Zacheo等[42]研究认为,NH4+能够促进向日葵根际的Ca2+的移动,当然也可能与阴离子的吸收有关;与NO3--N的处理相比,NH4+-N培养的植株中的P含量较高,NH4+可能促进植物P元素的吸收[43]。陈沂岭等[44]研究发现NH4+增加了水稻地上部P和Fe含量。本研究结果表明,高NH4+处理下,添加外源蔗糖后,拟南芥植株的N、P、K、Ca、Mg含量都增加,其中N、P、K含量增加比较显著,N含量增加,表明植株利用N的能力增强,加快植株对N的吸收利用,一定程度上缓解了高NH4+毒害。但外源添加蔗糖不能提高植株中Fe的含量。已有文献报道[35],高NH4+胁迫会降低植株的含K量,本文中随着NH4+浓度的增加,含K量也随之增加,猜测可能是因为本文测定的是植株鲜重的含K量,高NH4+降低了植株的含水量,因此植株鲜重的含K量增加。高NH4+胁迫显著抑制了拟南芥的生长,影响了矿质元素在植株中的含量,外源添加蔗糖可缓解高NH4+胁迫对拟南芥生长的抑制作用,并提高了各矿质元素的含量,说明外源添加蔗糖可通过影响矿质元素的吸收积累,维持离子之间的平衡,减轻高NH4+胁迫对拟南芥的毒害作用。
综上所述,NH4+胁迫显著抑制了拟南芥植株的生长,外源添加蔗糖可以缓解高NH4+胁迫的抑制,这可能是由于外源蔗糖可以提高植株体内碳水化合物的含量,维持细胞内渗透压平衡,从而提高植株的抗逆性;另外,外源蔗糖处理提高了GS和GDH的酶活性,加速氨同化作用,减少植株体内游离NH4+含量;外源添加蔗糖处理还可以通过对矿质元素的吸收积累,减轻高NH4+胁迫对拟南芥的毒害作用。
| [1] |
宋建民, 田纪春. 植物光合碳和氮代谢之间的关系及其调节[J]. 植物生理学通讯, 1998, 34(3): 230-238 (  0) 0) |
| [2] |
隋方功, 吕银燕, 稻永醇二. 氮素营养对甜椒果实生长发育的影响[J]. 植物营养与肥料学报, 2004, 10(5): 499-503 (  0) 0) |
| [3] |
崔秀敏, 王秀峰. 基质供水状况对番茄穴盘苗碳氮代谢及生长发育的影响[J]. 园艺学报, 2004, 31(4): 477-481 (  0) 0) |
| [4] |
隋方功, 吕银燕, 王运华, 等. 不同施氮量对甜椒碳、氮营养分配的影响[J]. 园艺学报, 2004, 31(4): 472-476 (  0) 0) |
| [5] |
李宝珍, 范晓荣, 徐国华. 植物吸收利用铵态氮和硝态氮的分子调控[J]. 植物生理学通讯, 2009(1): 80-88 (  0) 0) |
| [6] |
陈琪, 刘之广, 张民, 等. 包膜磷酸二铵配施黄腐酸提高小麦产量及土壤养分供应强度[J]. 土壤学报, 2018, 55(6): 1472-1484 (  0) 0) |
| [7] |
Serna M D, Borras R, Legaz F, et al. The influence of nitrogen concentration and ammonium/nitrate ratio on N-uptake, mineral composition and yield of citrus[J]. Plant and Soil, 1992, 147(1): 13-23 DOI:10.1007/BF00009366 (  0) 0) |
| [8] |
Harada T, Takaki H, Yamada Y. Effect of nitrogen sources on the chemical components in young plants[J]. Soil Science and Plant Nutrition, 1968, 14(2): 47-55 DOI:10.1080/00380768.1968.10432008 (  0) 0) |
| [9] |
Kusano M, Tabuchi M, Fukushima A, et al. Metabolomics data reveal a crucial role of cytosolic glutamine synthetase 1;1 in coordinating metabolic balance in rice[J]. The Plant Journal, 2011, 66(3): 456-466 DOI:10.1111/j.1365-313X.2011.04506.x (  0) 0) |
| [10] |
Guan M, Møller I S, Schjoerring J K. Two cytosolic glutamine synthetase isoforms play specific roles for seed germination and seed yield structure in Arabidopsis[J]. Journal of Experimental Botany, 2015, 66(1): 203-212 DOI:10.1093/jxb/eru411 (  0) 0) |
| [11] |
Ho S L, Chao Y C, Tong W F, et al. Sugar coordinately and differentially regulates growthand stress-related gene expression via a complex signal transduction network and multiple control mechanisms[J]. Plant Physiology, 2001, 125(2): 877-890 DOI:10.1104/pp.125.2.877 (  0) 0) |
| [12] |
杨少华, 王丽, 穆春, 等. 蔗糖调节拟南芥花青素的生物合成[J]. 中国生物化学与分子生物学报, 2011, 27(4): 364-369 (  0) 0) |
| [13] |
Cao Y Y, Yang M T, Chen S Y, et al. Exogenous sucrose influences antioxidant enzyme activities and reduces lipid peroxidation in water-stressed cucumber leaves[J]. Biologia Plantarum, 2015, 59(1): 147-153 DOI:10.1007/s10535-014-0469-7 (  0) 0) |
| [14] |
Vincentz M, Moureaux T, Leydecker M T, et al. Regulation of nitrate and nitrite reductase expression in Nicotiana plumbaginifolia leaves by nitrogen and carbon metabolites[J]. The Plant Journal, 1993, 3(2): 315-324 DOI:10.1111/j.1365-313X.1993.tb00183.x (  0) 0) |
| [15] |
Morcuende R, Krapp A, Hurry V, et al. Sucrose-feeding leads to increased rates of nitrate assimilation, increased rates of α-oxoglutarate synthesis, and increased synthesis of a wide spectrum of amino acids in tobacco leaves[J]. Planta, 1998, 206(3): 394-409 DOI:10.1007/s004250050415 (  0) 0) |
| [16] |
闫素芳, 于洋, 葛青, 等. 外源蔗糖对小麦幼苗耐盐性的影响[J]. 中国生态农业学报, 2012, 20(2): 225-230 (  0) 0) |
| [17] |
刘丽萍, 臧小云, 袁巧云, 等. 外源蔗糖对盐胁迫荞麦幼苗根系生长的缓解效应[J]. 植物生理学通讯, 2006(5): 847-850 (  0) 0) |
| [18] |
刘峰, 施卫明. 拟南芥室内水培方法的改进[J]. 土壤, 2006, 38(1): 102-105 (  0) 0) |
| [19] |
Yuan L X, Loqué D, Ye F H, et al. Nitrogen-dependent posttranscriptional regulation of the ammonium transporter AtAMT1;1[J]. Plant Physiology, 2007, 143(2): 732-744 DOI:10.1104/pp.106.093237 (  0) 0) |
| [20] |
Takakura K I, Nishio T. Safer DNA extraction from plant tissues using sucrose buffer and glass fiber filter[J]. Journal of Plant Research, 2012, 125(6): 805-807 DOI:10.1007/s10265-012-0502-x (  0) 0) |
| [21] |
Smith D S, Maxwell P W, de Boer S H. Comparison of several methods for the extraction of DNA from potatoes and potato-derived products[J]. Journal of Agricultural and Food Chemistry, 2005, 53(26): 9848-9859 DOI:10.1021/jf051201v (  0) 0) |
| [22] |
李合生. 植物生理生化实验原理与技术[M].
高等教育出版社, 北京, 2010
(  0) 0) |
| [23] |
鲁如坤. 土壤农业化学分析方法[M].
中国农业科技出版社, 北京, 2000
(  0) 0) |
| [24] |
Migge A, Carrayol E, Kunz C, et al. The expression of the tobacco genes encoding plastidic glutamine synthetase or ferredoxin-dependent glutamate synthase does not depend on the rate of nitrate reduction, and is unaffected by suppression of photorespiration[J]. Journal of Experimental Botany, 1997, 48(6): 1175-1184 DOI:10.1093/jxb/48.6.1175 (  0) 0) |
| [25] |
程谊, 张金波, 蔡祖聪. 气候-土壤-作物之间氮形态契合在氮肥管理中的关键作用[J]. 土壤学报, 2019, 56(3): 507-515 (  0) 0) |
| [26] |
孙海军, 闵炬, 施卫明, 等. 硝化抑制剂影响小麦产量、N2O与NH3排放的研究[J]. 土壤, 2017, 49(5): 876-881 (  0) 0) |
| [27] |
Guo S, Bruck H, Sattelmacher B. Effects of supplied nitrogen form on growth and water uptake of Frenchbean (Phaselous vulgaris.L) plants[J]. Plant and soil, 2002, 219: 267-275 (  0) 0) |
| [28] |
李春顺. 高铵胁迫对小麦幼苗生长的影响及其生理基础[D]. 南京: 南京农业大学, 2013.
(  0) 0) |
| [29] |
Cruz C, Bio A F M, Domínguez-Valdivia M D, et al. How does glutamine synthetase activity determine plant tolerance to ammonium?[J]. Planta, 2006, 223(5): 1068-1080 DOI:10.1007/s00425-005-0155-2 (  0) 0) |
| [30] |
Ni L Y. Growth of potamogeton maackianus under low-light stress in eutrophic water[J]. Journal of Freshwater Ecology, 2001, 16(2): 249-256 DOI:10.1080/02705060.2001.9663809 (  0) 0) |
| [31] |
李保海, 施卫明. 拟南芥幼苗对高NH4+响应的特征及不同生态型间的差异[J]. 土壤学报, 2007, 44(3): 508-515 (  0) 0) |
| [32] |
Raab T K, Terry N. Nitrogen source regulation of growth and photosynthesis in Beta vulgaris L[J]. Plant Physiology, 1994, 105(4): 1159-1166 DOI:10.1104/pp.105.4.1159 (  0) 0) |
| [33] |
罗金葵, 陈巍, 张攀伟, 等. 增铵对小白菜生长和叶绿素含量的影响[J]. 土壤学报, 2005, 42(4): 614-618 (  0) 0) |
| [34] |
匡艺, 李廷轩, 余海英. 氮素对不同氮效率小黑麦基因型叶片保护酶活性和膜脂过氧化的影响[J]. 草业学报, 2011, 20(6): 93-100 (  0) 0) |
| [35] |
常丽丽, 廖宗文, 陈日远, 等. 外源蔗糖对NO-3胁迫下叶用莴苣碳氮代谢的影响[J]. 北方园艺, 2016(1): 10-15 (  0) 0) |
| [36] |
Miflin B J, Lea P J. Ammonia assimilation[M]//Amino Acids and Derivatives. Amsterdam: Elsevier, 1980: 169-202.
(  0) 0) |
| [37] |
Hayakawa T, Kamachi K, Oikawa M, et al. Response of glutamine synthetase and glutamate synthase isoforms to nitrogen sources in rice cell cultures[J]. Plant and Cell Physiology, 1990, 31(8): 1071-1077 (  0) 0) |
| [38] |
Chen W J. Expression of glutamine synthetase genes from Phaseolus oulgaris L. in transgenic plants[D]. PhD Thesis of Imperial College of Science and Technology, University of London, 1990.
(  0) 0) |
| [39] |
Melo-Oliveira R, Oliveira I C, Coruzzi G M. Arabidopsis mutant analysis and gene regulation define a nonredundant role for glutamate dehydrogenase in nitrogen assimilation[J]. Proceedings of the National Academy of Sciences of the United States of America, 1996, 93(10): 4718-4723 DOI:10.1073/pnas.93.10.4718 (  0) 0) |
| [40] |
邹春琴, 范晓云, 石荣丽. 铵态氮和硝态氮对旱稻、水稻生长及铁营养状况的影响[J]. 中国农业大学学报, 2007, 12(4): 45-49 (  0) 0) |
| [41] |
Zhang F S, Niu J F, Zhang W F, et al. Potassium nutrition of crops under varied regimes of nitrogen supply[J]. Plant and Soil, 2010, 335(1/2): 21-34 DOI:10.1007/s11104-010-0323-4 (  0) 0) |
| [42] |
Zaccheo P, Crippa L, di Muzio Pasta V. Ammonium nutrition as a strategy for cadmium mobilisation in the rhizosphere of sunflower[J]. Plant and Soil, 2007, 301(1/2): 325 (  0) 0) |
| [43] |
Schittenhelm S, Menge-Hartmann U. Yield formation and plant metabolism of spring barley in response to locally injected ammonium[J]. Journal of Agronomy and Crop Science, 2006, 192(6): 434-444 (  0) 0) |
| [44] |
陈沂岭, 赵学强, 张玲玉, 等. 铵硝营养对水稻氮效率和矿质养分吸收的影响[J]. 土壤, 2019, 51(2): 243-250 (  0) 0) |
2. University of Chinese Academy of Sciences, Beijing 100049, China
 2021, Vol. 53
2021, Vol. 53


