二月兰(Orychophragmus violaceus)是十字花科植物,具有观赏和绿化的价值,是北方地区不可多得的早春观花、冬季观绿的地被植物。它还是一种实用性冬绿肥[1],盛花期含有丰富的氮、磷、钾等矿质元素,翻压可以提高土壤有机碳含量,促进土壤微生物的活性,有利于保持土壤肥力[2-3],还能提高主作物的产量和品质[4]。绿肥生物量是发挥其地面覆盖、土壤残留氮素截获、土壤固碳和养分循环等农田生态服务功能的重要基础。研究表明施用氮肥可以显著提高二月兰的鲜草产量、养分累积量和籽粒产量[5-6]。但现在大部分氮的施入是通过施加化肥,对土壤、作物和环境都会带来一系列的危害[7]。有研究表明通过接种植物促生菌(PGPB)可以提高植株生物量[8-10]和养分含量[11],并对土壤有一定的改良作用[12]。植物促生菌是在一定条件下有利于植物生长的自由生活在土壤、根际、根表、叶际的细菌[13]。它们的促生机制包括固氮、解磷、产生植物激素等[14-15]。
土壤供氮能力是绿肥作物生长的重要限制因子,特别对于非豆科绿肥作物,其生长所需氮素主要来源于土壤残留无机氮和土壤矿化氮,因此提高土壤氮水平很重要。土壤中有一些固氮微生物可以通过生命活动,将空气中游离态的氮素直接转变为含氮化合物,除供自身生长发育外,部分以无机状态或简单的有机氮化物分泌于体外,供植物吸收利用[16]。由于植物能够调控土壤周围有益微生物的数量和活性[17],植物根际土壤中微生物具有更多功能多样性,因此,可从根际土壤中分离和选育功能各异的有益微生物[18-19],比较不同功能微生物或者混合培养物对植物生长的促进效应。
目前植物促生菌接种绿肥作物的报道较少,不同功能微生物的复合接种更少,而且除生物量外,绿肥养分含量及对土壤性质的影响很少被关注。因此,本文尝试从根际土壤中分离筛选高效固氮菌,结合实验室保存的产吲哚乙酸(IAA)菌株,在温室盆栽条件下研究单一和复合接种植物促生菌对绿肥作物——二月兰的促生效果,以及对其养分含量和土壤性质改良方面的影响,以为绿肥作物二月兰专用菌剂的生产和应用提供理论基础。
1 材料与方法 1.1 供试材料 1.1.1 土壤样品来源及前期处理采自山东泰安综合试验站(117°0′27″ E,35°59′55″ N)种植花生的0 ~ 20 cm土样,土壤类型为棕壤褐土。挑除新鲜土样中的根系、蚯蚓、小石块等,土壤经风干、粉碎、过2 mm筛,备用。土壤有机质、NH4+-N、NO3--N、全氮含量和pH分别为25.77 g/kg、1.84 mg/kg、5.84 mg/kg、1.4 g/kg和7.19。
1.1.2 培养基LB培养基:蛋白胨10 g,酵母提取物5 g,氯化钠10 g,pH 7.0 ~ 7.2。Ashby无氮培养基:葡萄糖10 g,KH2PO4 0.2 g,MgSO4·7H2O 0.2 g,NaCl 0.2 g,CaCO3 5 g,CaSO4·2H2O 0.1 g,pH 6.8 ~ 7.0。无机盐培养基:(NH4)2SO4 2 g,NaH2PO4 0.5 g,K2HPO4 0.5 g,MgSO4·7H2O 0.2 g,CaCl2·2H2O 0.1 g,pH 7.0 ~ 7.2。各培养基配置时均用蒸馏水定容至1 000 ml,121℃灭菌20 min,固体培养基在此配方基础上加18 g琼脂。
1.1.3 供试菌株为比较筛选菌株的固氮能力和产IAA能力,选择本实验室已筛选获得的成团泛菌CDL29[20](Pantoea agglomerans)、附着剑菌R[21](Ensifer adhaerens)以及购自中国农业微生物菌种保藏管理中心的固氮微生物圆褐固氮菌YH[22](Azotobacter chroococcum,菌株编号为ACCC10006)、巴西固氮螺菌B[23](Azospirillam brasilense,菌株编号为ACCC10104)进行对比。
1.2 固氮菌的筛选及功能测定称取10 g土样,将其置于装有适量玻璃珠和90 ml无菌水的250 ml三角瓶中,30℃、180 r/min振荡20 min,静置10 min,得到土壤悬浮液。采用梯度稀释法稀释至10-6后,吸取0.1 ml涂布在Ashby固体培养基上,平板置于30℃恒温箱中倒置培养24 h后,将不同类型典型单个菌落挑出,经平板多次纯化后,4℃保存在Ashby固体培养基斜面待用。
固氮酶活性的测定:采用乙炔还原法[24]。将筛选的固氮菌及对比菌株分别接入LB液体培养基中,培养24 h后用离心法收集菌细胞;再用无氮液体培养基重悬菌体,制成108 CFU/ml的固氮菌悬液,作为待接种菌液;接种制好的固氮菌悬液于装有2 ml无氮液体培养基的青霉素小瓶中,30℃培养24 h;用密封性好的注射器先从培养有菌的青霉素小瓶抽取1 ml空气,再注入1 ml乙炔,用胶布密封针眼;继续培养24 h,取100 μl气样在气相色谱仪上测定乙烯峰值。
采用Agilent 7890A气相色谱仪进行测定,其工作条件设置为:前进样口温度200℃,前检测器(FID)温度250℃,分离比5∶1,载体流速1 ml/min,氢气流速30 ml/min,空气流速300 ml/min,尾吹气(氮气)流速26 ml/min;柱温为梯度升温:32 ℃保持1 min,32 ~ 70℃升温速度为30 ℃/min,70℃保持5 min,70 ~ 160 ℃升温速度为10 ℃/min,160 ℃保持15 min。乙炔还原活性计算公式为:乙炔还原活性ARA(C2H4,nmol/(h·ml))=(实际C2H4 ×峰面积标注气含量×青霉素瓶容积)/(标准气峰面积×进样量×培养时间×样品量)。
产IAA功能测定:将分离纯化后的细菌及对比菌株,接种于含有L-色氨酸(100 mg/L)的LB液体培养基中,180 r/min、30℃条件下摇床培养1 d。吸取2 ml菌液于离心管,10 000 r/min离心10 min,取1.5 ml上清液并加入等体积Salkowski比色液(50 ml 35% HClO4 + 1 ml 0.5 mol/L FeCl3)于5 ml离心管中,避光静置30 min,测定其OD530值。对照标准曲线计算单位体积发酵液中IAA的含量。标准曲线的绘制采用分析纯的IAA梯度稀释制备。
1.4 N3菌株的生理生化及16S rDNA序列分析 1.4.1 形态及生理生化特征测定接种固氮菌N3于Ashby固体培养基平板上,观察菌落、菌体形态[25]。参考《常见细菌系统鉴定手册》和《微生物学实验》测定相关生理生化特征[26]。
1.4.2 16S rDNA测序与系统学分析常规方法培养菌株,SDS-CTAB法提取细菌基因组总DNA,作为扩增模板,采用16S rDNA通用引物27f(5'- AGAGTTTGATCCTGGCTCAG-3')和1492r(5'-TACGGTTACCTTGTTACGACTT-3')进行16S rDNA的PCR扩增,扩增片段长度为1.5 kb。PCR反应条件:94℃预变性5 min,进入热循环,94 ℃变性30 s,52℃退火30 s,72℃延伸10 min,共30个循环。DNA测序由南京思普金生物科技有限公司完成,再将所得序列在NCBI进行比对,使用MEGA 5.1软件以NJ法建立系统发育树。
1.5 二月兰温室促生试验 1.5.1 试验设计将筛选出的固氮能力强的菌株N3和产IAA能力强的菌株CDL29分别接种于LB液体培养基,30℃、180 r/min摇床培养24 h后,在无菌条件下将菌液倒入已灭菌的离心管中,8 000 r/min离心5 min,去掉上清液,再用无菌水重悬菌体,制成菌悬液。
取山东泰安种植花生的土壤3 kg装盆,每盆种植15颗二月兰,二月兰种子首先用3% 双氧水进行表面消毒20 min,再用无菌水冲洗。菌液接种量按108 CFU/g土接入,复合处理中两株菌比例为1∶1,对照为接种等量无菌水,每个处理设4个重复,控制含水量至田间最大持水量的80%。种植4个月后,每盆采集长势一致的二月兰3株测定生物量、养分含量和根系形态及活力指标,同时采集土壤样品,测定土壤养分含量、微生物生物量碳和氮(MBC、MBN)含量及固氮酶活性。
1.5.2 指标测定植株根系指标测定:根系扫描仪(LA1600+scanner,Canada)扫描二月兰根系形态,获取根系图像(Winrhizo2003b,Canada)进行相关根系指标分析。二月兰根系活力测定采用TTC法。
植株养分含量测定:H2SO4-H2O2消煮法,植株氮含量采用凯氏定氮法,磷含量采用钼蓝比色法,钾含量采用火焰光度计法。
土壤理化和生物学性质测定:pH采用无CO2水浸提pH计法(土水质量比1∶2.5)测定;有机质含量采用重铬酸钾容量法测定;全氮含量采用半微量开氏法测定;全磷含量采用HClO4-H2SO4法测定;有效磷含量采用0.5 mol/L NaHCO3法测定;速效钾含量采用NH4OAc浸提,火焰光度计法测定。土壤NH4+-N、NO3--N采用2 mol/L KCl溶液浸提,流动分析仪(SEAL Auto Analyzer3,德国) 测定;土壤MBC、MBN采用氯仿熏蒸-硫酸钾浸提法,K2CrO7外加热法测定MBC含量,半微量凯氏定氮法测定MBN含量。
土壤固氮酶活性测定。采用乙炔还原法取盆栽土样15 g于100 ml血清瓶中,加入0.1 mol/L葡萄糖液2 ml,摇匀,塞上异丁基胶塞,加铝盖密封。用注射器从瓶中抽出5 ml空气再注入等体积乙炔气体,密封针眼,28℃培养2 d。培养结束后,取500 μl气样在气相色谱仪上测定乙烯峰值(测定仪器和参数设置与菌株固氮酶活性测定一致)。乙炔还原活性计算公式为:
乙炔还原活性ARA(C2H4,μmol/(h·g))=
式中:k为乙烯峰高/乙炔峰高;T为绝对温度;x为测定时的气温;y为测定时的大气压;760为标准大气压(汞柱);z为注入乙炔的量(ml);22.4为1 g分子气体在绝对温度和标准大气压下的体积;m为测定样品的干重(g),t为注入乙炔后的反应时间(h)。
1.6 数据处理利用Microsoft Excel 2007软件处理数据,并运用SPSS 20.0对数据进行单因素方差分析,对其显著性差异(P < 0.05)用LSD和Duncan’s检验法进行多重比较。
2 结果与分析 2.1 固氮菌的筛选及功能测定本研究从供试土壤中分离得到3株具有固氮能力的菌株,分别命名为N1、N2、N3。对菌株固氮酶活性和产IAA能力进行测定,结果如图 1所示,菌株N3固氮能力最强,固氮酶活性达C2H4 28.33 nmol/ (h·ml),与其他菌株间差异达到显著水平。菌株成团泛菌(CDL29)产IAA能力最强,培养24 h时IAA产生量达15.76 mg/l。

|
(图中不同小写字母表示不同菌株固氮酶活性或产IAA能力差异显著(P < 0.05)) 图 1 菌株的固氮酶活性和产IAA能力比较 Fig. 1 Comparison of nitrogenase activities and IAA production capacities of different strains |
筛选出的固氮菌株N3,如图 2所示,在无氮培养基上形成的菌落较小,为白色隆起,边缘整齐,表面光滑湿润,不透明,不规则杆状排列。该菌生理生化特性是:革兰氏阳性,兼性好氧,化能异氧,接触酶阳性,VP试验阴性,淀粉水解阳性,明胶水解阳性,硝酸盐还原阴性。
|
图 2 菌株N3的菌落形态特征 Fig. 2 Colony morphology of strain N3 |
经16S r DNA序列分析和NCBI数据库在线比对,结果显示,N3与Bacillus megaterium的同源性达100%,序列登入号为MK391574。用MEGA 5.1软件以NJ法建立系统发育树(图 3),N3与Bacillus megaterium (MF187637.1)同源性最高,结合形态以及生理生化特征鉴定菌株N3为巨大芽孢杆菌属(Bacillus megaterium)。

|
(标尺代表每100个核苷酸中有5个核苷酸替代) 图 3 基于菌株N3和相关菌株的16S r DNA序列采用邻接法建立的系统发育树 Fig. 3 Phylogenetic established by neighbor-joining method, based on 16S rDNA sequences of N3 and related strains |
由表 1可知,与CK相比,各接种植物促生菌处理二月兰地上部和地下部鲜重、株高和茎粗都增加,表明接种植物促生菌能促进二月兰的生长。接种菌株N3处理二月兰地上部和地下部鲜重、株高和茎粗显著增加且数值最大,说明接种固氮菌株N3处理对二月兰的促生效果好于接种产IAA菌株CDL29处理和复合菌株接种处理。
|
|
表 1 不同处理对二月兰生长发育的影响 Table 1 Root growth and development of Orychophragmus violaceus under different treatments |
二月兰接种植物促生菌后,根系生长发育指标:根系总长、表面积、体积以及根尖数都有显著性提高,特别是N3处理,接种固氮菌株N3后二月兰根系总长、表面积、体积、根尖数较CK分别提高1.27倍、1.28倍、1.48倍、1.11倍(表 1)。
此外,接种植物促生菌能显著提高二月兰根系活力,其中以接种固氮菌株N3处理最高,达0.16 mg/(g·h),但接种菌株CDL29处理和复合接种N3+CDL29处理间没有显著差异(图 4)。

|
(图中不同小写字母表示处理间差异在P < 0.05水平显著,下同) 图 4 不同处理对二月兰根系活力的影响 Fig. 4 Root activities of Orychophragmus violaceus under different treatments |
由表 2可知,与CK相比,各接种植物促生菌处理二月兰植株地上和地下部氮、磷、钾养分含量有所增加,表明接种植物促生菌对二月兰植株的养分含量有一定的积累作用。单一接种固氮菌株N3处理能显著提高二月兰地上部氮、磷和地下部氮、钾的含量,相比CK,增幅分别为33.03%、55.56% 和29.87%、51.11%。单一接种产IAA菌株CDL29处理以及复合接种处理也有促进二月兰养分含量的趋势,但并不显著。
|
|
表 2 不同处理对二月兰植株养分含量的影响 Table 2 Nutrient contents in Orychophragmus violaceus under different treatments |
由表 3可知,接种植物促生菌对土壤pH影响不大,但能够提高土壤有机质、全氮、全磷和速效养分含量。单一接种固氮菌株N3处理能显著提高土壤全氮、NH4+-N和NO– 3-N含量,较CK分别提高了0.21倍、1.21倍和1.01倍。
|
|
表 3 接种植物促生菌对土壤理化性质的影响 Table 3 Effects of inoculation with plant probiotics on soil physical and chemical properties |
接种植物促生菌均有效提高土壤MBC和MBN含量,单一接种固氮菌株N3处理提升效果最佳,土壤MBC和MBN含量达272.93 μg/g和91.55 μg/g(图 5),复合菌株接种处理土壤MBC和MBN提升效果不如单一接种处理。

|
图 5 不同处理对土壤MBC和MBN含量的影响 Fig. 5 Soil MBC and MBN contents under different treatments |
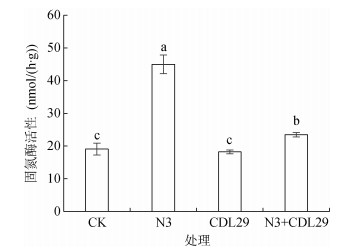
由图 6可知,与CK相比,单一接种产IAA菌株CDL29处理并不影响土壤固氮酶活性,而单一接种固氮菌株N3处理能够显著提高土壤固氮酶活性,达C2H4 44.97 nmol/(g·h),与CK相比提升了1.35倍。
|
图 6 不同处理对土壤固氮酶活性影响 Fig. 6 Soil nitrogenase activities under different treatments |
接种植物促生菌对二月兰有一定的促生作用,且不同植物促生菌对二月兰的促生效果不同,接种固氮菌株N3对二月兰的促生效果好于产IAA菌株CDL29和复合菌株接种处理,较不接菌处理二月兰地上部鲜重、株高和植株地上部氮、磷、钾养分含量分别显著提高了227.66%、56.12%、33.03%、55.56% 和31.94%。这与本实验室徐文思等[27]筛选获得的产IAA菌株JX15和姜瑛等[28]筛选的固氮解磷菌株JX14接种花生盆栽试验结果“产IAA菌和固氮菌对花生具有很好的促生作用,能够显著促进花生生物量和株高的增加,且两者对花生的促生效果不同”一致。由于土壤供氮是绿肥作物生长的重要限制因子,特别对于非豆科植物二月兰,接种固氮菌株对土壤固氮微生物发挥重要的作用[29]。
接种植物促生菌对二月兰根系生长发育有较好的促生作用,根系总长、表面积、体积以及根尖数和根系活力都显著增加,且二月兰植株地上和地下部氮、磷、钾含量都有增加的趋势。李冰等[30]研究表明,小麦幼苗接种植物根际促生菌后,对小麦根的总长度、总表面积、根尖数有明显促生作用,且这些指标与小麦根干重、株高和茎干重显著相关。郑文波等[31]研究表明,接种产IAA、解磷菌株ZH5能提高花生根系的根长、根表面积、根体积和根尖数,说明菌株ZH5对花生根系生长发育有较好的促进作用,进而提高花生植株全磷养分含量。根的生长情况和活力水平直接影响地上部的生长和营养状况及产量水平。接种植物促生菌处理二月兰根系具有更多的分支并且更长更粗,增加了对养分的接触面。此外,根系活力的增加促进了二月兰对土壤中营养元素的吸收,进而提高了其地上部鲜重、株高以及氮、磷、钾养分含量。
土壤微生物作为土壤生态系统的重要组成部分,其量的变化是评价土壤肥力高低的重要依据[32]。土壤固氮酶活性在一定程度上能够反映土壤固氮微生物固氮酶作用能力及强弱。接种固氮菌株N3,能提高土壤脲酶活性,并且可以提高细菌总代谢活性[33],通过固氮作用,将空气中游离态的氮素直接转变为含氮化合物[34],能显著提高土壤全氮、NH4+-N和NO3--N含量。王慧桥等[35]研究表明,不同自生固氮菌均能提高玉米土壤有效氮含量,活化的养分更有利于二月兰的生长和吸收利用。本试验表明,接种植物促生菌对土壤pH影响不大,但能够提高土壤有机质、全磷、有效磷和速效钾含量。接种植物促生菌均有效提高土壤MBC和MBN的含量,接种固氮菌株N3处理提升效果最佳,这与固氮菌株N3分离筛选于本试验所用土壤,属于土著微生物,相比产IAA菌株CDL29具有更好的适应性,更有利于功能的发挥有关。复合接种相比单一接种可能存在资源的竞争,从而提升效果不如单一接种处理。接种固氮菌株N3后,土壤固氮酶活性最高,这与固氮菌株N3有较强的固氮酶活性直接相关,同时土著固氮菌株N3的强适应能力及定殖能力也是原因之一。
4 结论本试验筛选出了1株固氮能力较强的菌株N3,固氮酶活性达C2H4 28.33 nmol/(h·ml),通过细菌形态和生理生化特征以及16S rDNA基因序列分析,鉴定为巨大芽孢杆菌属(Bacillus megaterium)。将该菌接种于二月兰能有效促进其生物量的增加、根系发育,提高二月兰氮、磷、钾养分的积累,同时有效提高土壤速效养分、有机质、MBC和MBN含量及固氮酶活性。接种产IAA菌CDL29同样能够促进二月兰生长,但在二月兰养分积累和土壤性质改良效果上不如接种固氮菌N3。复合接种两株菌效果低于单一菌株处理,可见菌株之间的竞争可能会影响效果的发挥。
| [1] |
陈兵, 任全进. 二月兰的特征特性及其应用价值[J]. 现代农业科技, 2015(9): 169 (  0) 0) |
| [2] |
刘佳, 张杰, 徐昌旭, 等. 二月兰不同翻压量对土壤肥力的影响[J]. 干旱地区农业研究, 2014, 32(1): 123-127 (  0) 0) |
| [3] |
赵秋, 高贤彪, 宁晓光, 等. 华北地区春玉米-冬绿肥轮作对碳、氮蓄积和土壤养分以及微生物的影响[J]. 植物营养与肥料学报, 2013, 19(4): 1005-1011 (  0) 0) |
| [4] |
Gao J S, Xu M G, Dong C H, et al. Effects of long-term rice-rice-green manure cropping rotation on rice yield and soil fertility[J]. Acta Agronomica Sinica, 2013, 39(2): 343 DOI:10.3724/SP.J.1006.2013.00343 (  0) 0) |
| [5] |
刘佳, 张杰, 徐昌旭, 等. 氮肥用量对诸葛菜产量及氮素吸收利用的影响[J]. 中国油料作物学报, 2013, 35(2): 185-189 (  0) 0) |
| [6] |
白金顺, 曹卫东, 曾闹华, 等. 不同供氮量对二月兰产量、土壤无机氮残留及氮平衡的影响[J]. 应用生态学报, 2018, 29(10): 3206-3212 (  0) 0) |
| [7] |
陆宇燕, 李丕鹏. 氮肥污染的危害[J]. 沈阳师范大学学报(自然科学版), 2014, 32(1): 1-5 (  0) 0) |
| [8] |
Liu J L, Tang L, Gao H, et al. Enhancement of alfalfa yield and quality by plant growth-promoting rhizobacteria under saline-alkali conditions[J]. Journal of the Science of Food and Agriculture, 2019, 99(1): 281-289 DOI:10.1002/jsfa.9185 (  0) 0) |
| [9] |
Mareque C, Taule C, Beracochea M, et al. Isolation, characterization and plant growth promotion effects of putative bacterial endophytes associated with sweet sorghum (Sorghum bicolor (L) Moench)[J]. Annals of Microbiology, 2015, 65(2): 1057-1067 DOI:10.1007/s13213-014-0951-7 (  0) 0) |
| [10] |
Viruel E, Erazzú L E, Martínez Calsina L, et al. Inoculation of maize with phosphate solubilizing bacteria: Effect on plant growth and yield[J]. Journal of Soil Science and Plant Nutrition, 2014 (  0) 0) |
| [11] |
马骢毓, 张英, 孙广正, 等. 披碱草根际促生菌筛选及其接种剂的促生作用[J]. 植物营养与肥料学报, 2016, 22(4): 1039-1048 (  0) 0) |
| [12] |
Galaviz C, Lopez B R, De-Bashan L E, et al. Root growth improvement of mesquite seedlings and bacterial rhizosphere and soil community changes are induced by inoculation with plant growth-promoting bacteria and promote restoration of eroded desert soil[J]. Land Degradation & Development, 2018, 29(5): 1453-1466 (  0) 0) |
| [13] |
Lugtenberg B, Kamilova F. Plant-growth-promoting rhizobacteria[J]. Annual Review of Microbiology, 2009, 63: 541-556 DOI:10.1146/annurev.micro.62.081307.162918 (  0) 0) |
| [14] |
李琬, 刘淼, 张必弦, 等. 植物根际促生菌的研究进展及其应用现状[J]. 中国农学通报, 2014, 30(24): 1-5 (  0) 0) |
| [15] |
黄晓东, 季尚宁, Bernard Glick, 等. 植物促生菌及其促生机理[J]. 现代化农业, 2002(6): 7 (  0) 0) |
| [16] |
张武, 杨琳, 王紫娟. 生物固氮的研究进展及发展趋势[J]. 云南农业大学学报(自然科学), 2015, 30(5): 810-821 (  0) 0) |
| [17] |
Zhang X X, Zhang R J, Gao J S, et al. Thirty-one years of rice-rice-green manure rotations shape the rhizosphere microbial community and enrich beneficial bacteria[J]. Soil Biology and Biochemistry, 2017, 104: 208-217 DOI:10.1016/j.soilbio.2016.10.023 (  0) 0) |
| [18] |
康林玉, 刘周斌, 欧立军, 等. 土壤微生物促进作物生长发育研究进展[J]. 湖南农业科学, 2017(3): 113-116 (  0) 0) |
| [19] |
秦宝军. 高效固氮菌选育与土壤培肥研究[D]. 杨陵: 西北农林科技大学, 2010.
(  0) 0) |
| [20] |
徐莉, 常大丽, 张旭辉, 等. 一种多重重金属耐性产吲哚乙酸的菌株及其应用: CN109136147A[P]. 2019-01-04.
(  0) 0) |
| [21] |
陈雄, 韦祎旸, 李辉信, 等. 附着剑菌对三氯联苯的吸附及降解机制研究[J]. 中国环境科学, 2015, 35(5): 1423-1428 (  0) 0) |
| [22] |
王秀呈, 曹艳花, 唐雪, 等. 水稻内生固氮菌Herbaspirillum seropedicae DX35的筛选及其促生特性[J]. 微生物学报, 2014, 54(3): 292-298 (  0) 0) |
| [23] |
阎大来, 何路红, 李季伦. 固氮螺菌与植物的相互关系研究进展[J]. 微生物学通报, 1995, 22(3): 176-179 (  0) 0) |
| [24] |
Das S, De T K. Microbial assay of N2 fixation rate, a simple alternate for acetylene reduction assay[J]. MethodsX, 2018, 5: 909-914 DOI:10.1016/j.mex.2017.11.010 (  0) 0) |
| [25] |
东秀珠, 蔡妙英. 常见细菌系统鉴定手册[M].
科学出版社, 北京, 2001
(  0) 0) |
| [26] |
廖延雄. 《伯杰氏鉴定细菌学手册》与《伯杰: 氏分类细菌学手册》[J]. 微生物学通报, 1992, 19(4): 249 (  0) 0) |
| [27] |
徐文思, 姜瑛, 李引, 等. 一株植物促生菌的筛选、鉴定及其对花生的促生效应研究[J]. 土壤, 2014, 46(1): 119-125 (  0) 0) |
| [28] |
姜瑛, 吴越, 王国文, 等. 一株固氮解磷菌的筛选鉴定及其对花生的促生作用研究[J]. 土壤, 2015, 47(4): 698-703 (  0) 0) |
| [29] |
刘璐, 何寻阳, 杜虎, 等. 喀斯特土壤固氮微生物群落与植被、土壤的关系[J]. 生态学报, 2017, 37(12): 4037-4044 (  0) 0) |
| [30] |
李冰, 龚文秀, 李清, 等. 植物根际促生菌株对小麦根系发育的影响[J]. 安徽农业大学学报, 2015, 42(2): 276-282 (  0) 0) |
| [31] |
郑文波, 申飞, 闫小梅, 等. 红壤中产吲哚乙酸并具解磷作用的促生菌筛选鉴定及促生效果研究[J]. 土壤, 2015, 47(2): 361-368 (  0) 0) |
| [32] |
王艳霞, 冯宏, 李华兴, 等. 生物复混肥对土壤微生物的影响研究[J]. 植物营养与肥料学报, 2008, 14(6): 1206-1211 (  0) 0) |
| [33] |
陈胜男, 谷洁, 付青霞, 等. 接种自生固氮菌对玉米根际土壤酶活性和细菌群落功能多样性的影响[J]. 植物营养与肥料学报, 2012, 18(2): 444-450 (  0) 0) |
| [34] |
Mus F, Alleman A B, Pence N, et al. Exploring the alternatives of biological nitrogen fixation[J]. Metallomics, 2018, 10(4): 523-538 DOI:10.1039/C8MT00038G (  0) 0) |
| [35] |
王慧桥, 陈为峰, 宋付朋, 等. 不同自生固氮菌对盐碱地玉米生长与土壤养分特性的影响[J]. 土壤通报, 2018, 49(6): 1341-1347 (  0) 0) |
 2021, Vol. 53
2021, Vol. 53


