2. 中国科学院大学, 北京 100049;
3. 南京林业大学林学院, 南京 210037
生物质炭拥有诸多有益于生态环境的功能,例如增加土壤肥力,提高酸性土壤pH[1],激发土壤微生物活性[2]以及钝化有害污染物[3]等,生物质炭在土壤中的长期固碳功能是其中最重要的功能[4]。与制炭生物质材料相比,由于生物质炭中的碳元素有着高度芳香化的特征[5],生物质炭在土壤中极为稳定,它的固碳时间可达数百年至数千年之久[6-9]。因此,生物质炭施入土壤被普遍认为可以将大气中的碳有效地固存在土壤之中,同时降低大气中CO2的浓度达到减缓气候变化的目的[4]。虽然近年来有关不同生物质炭中的碳在土壤中稳定性的研究,特别是大量有关制炭条件及制炭原材料种类对生物质炭–碳稳定性影响的报道[8, 10-11],使人们对生物质炭自身固碳能力的认识大幅提高。但是,生物质炭在不同性质土壤中对土壤原有机碳周转速率的影响(激发效应)还不清楚。
生物质炭的添加对土壤质地[12]、土壤性质[1]以及土壤微生物群落[6, 13]等产生巨大的影响,进而影响土壤原有机碳的矿化速率[10, 14]。现有研究表明,生物质炭的添加对土壤原有机碳有正激发效应、负激发效应以及无激发效应,不同研究有着不同的结论。例如,Luo等[15]研究表明,C4植物大角委陵菜制成的生物质炭在黏性壤土中会加速土壤原有机碳的矿化,引起正激发效应;而Kuzyakov等[6]利用14C放射性同位素标记的黑麦草生物质炭研究其在淋溶土中的稳定性,发现生物质炭不会引发激发效应;另Lu等[16]研究发现生物质炭在砂壤土中会引发负激发效应。有关生物质炭在土壤中激发效应的结论存在巨大差异的原因,其一是研究所使用的生物质炭不同。例如,Luo等[15]分别将700℃及350 ℃条件下制成的大角委陵菜生物质炭加入同种土壤中进行为期87 d的室内培养,结果表明,700℃条件下制成的生物质炭引发的正激发效应比350℃条件下制成的小;另有研究表明,草本生物质炭激发效应强度大于木本生物质炭[17]。除生物质炭不同外,土壤性质的不同是导致生物质炭在土壤中的激发效应结论不一致的另一个重要原因。有研究认为,由于生物质炭具有表面积大、多孔性以及吸附性强的特点,可以大量吸附土壤中的有机质等营养物质[18],土壤微生物的活性降低,因此产生负激发效应[17]。但这显然无法解释同种生物质炭在不同土壤中产生的激发效应不同的现象。由于生物质炭含有少部分易分解态碳,生物质炭添加到土壤中后可导致土壤中的微生物量和代谢活性增加[19]。土壤黏粒可以吸附和包裹土壤原有机碳[20],对土壤原有机碳进行保护,因而阻止微生物对土壤原有机碳进行分解利用,使土壤原有机碳免受生物质炭添加的影响[9, 21]。故土壤自身黏粒含量很可能是导致生物质炭在不同土壤中激发效应不同的原因。因此,本研究假设生物质炭引发的土壤碳激发效应与土壤自身的黏粒含量有关,黏粒含量越高,正激发效应量越低。
现有的有关生物质炭引发的激发效应的研究大多基于单一种类的土壤,且由于试验条件(水分、温度、生物质炭添加比例)、培养时间、试验方法(同位素标记和非标记)等差异,研究之间可比性较低。相同试验条件下,同种生物质炭在多种土壤类型中的激发效应量,以及激发效应量与土壤性质之间的关系还鲜有研究报道。大量研究中,利用生物质炭添加处理与空白处理差减的方法以及利用C3、C4不同碳源13C自然丰度差异进行示踪的方法均难以准确地将土壤原有机质的降解量与生物质炭的降解量区分开来[6, 22-23],导致生物质炭在土壤中碳激发效应的测定存在偏差。因此,本研究利用人工13C稳定性同位素标记技术,将人工标记的高13C丰度小麦秸秆制作成生物质炭,研究其在4种不同类型土壤中的激发效应,同时以13C标记的小麦秸秆作为对照,以验证本研究的假设,即小麦秸秆生物质炭引发的土壤碳激发效应与土壤自身的黏粒含量有关,黏粒含量越高,正激发效应量越低。
1 材料与方法 1.1 13C标记生物质炭的制备本试验采用13C稳定性同位素标记的小麦秸秆作为原料来制备生物质炭。13C标记小麦秸秆是利用田间原位标记生长箱[24],在密闭的条件下,对小麦植株进行13CO2饲喂而获得。具体为:在田间条件下,将处于拔节期的小麦盆栽置于体积为710 L的生长箱内生长,箱内温度由自动制冷循环系统控制并保持在与外界温度±2 ℃的范围内,箱中的CO2浓度通过二氧化碳分析仪(Li-Cor 6252, Li-Cor Incorporated, Lincoln, Nebraska, USA)进行实时监测,输入箱内的13CO2气体是将稀盐酸与Ba13CO3固体(> 99 atom% 13C)进行化学反应而制得;整个标记过程持续4 h,开箱后,小麦自然生长6 d,将其收获;收获后的小麦秸秆在105℃杀青2 h,80 ℃条件下烘干至恒重。
将烘干的小麦秸秆切割成2 ~ 3 cm的小段放入炭化炉反应箱中。箱内温度以3.8℃/min的速度升至400℃之后,维持温度2.5 h,随后自然冷却。为保证生物质炭在无氧的条件下裂解,反应箱在加热前预先通入3倍箱子体积的氮气(N2)以驱赶空气,在之后的加热以及冷却过程中均持续以0.5 L/min的速度通入N2。所得生物质炭用粉碎机粉碎并过100目筛,备用。
1.2 供试材料理化性质本试验从北到南依次采集了我国4种不同类型的水稻土,分别为我国辽宁省的黑土发育的水稻土(黑土水稻土),江苏省的下位砂姜土发育的水稻土(下位砂姜土水稻土),江西省的红壤发育的水稻土(红壤水稻土)以及长期定位不施肥的红壤发育的水稻土(低肥力红壤水稻土)。黑土水稻土采自沈阳市,地理坐标为123°19'01'' E, 41°53'09'' N;下位砂姜土水稻土采自江都市,地理坐标为119°42'00'' E, 32°35'05'' N;红壤水稻土采自鹰潭市,地理坐标为116°55'45'' E, 28°12'07'' N,低肥力红壤水稻土于长期定位试验田中不施肥处理小区中采集,采集地距离红壤水稻土采集地约450 m。4种土壤均采于0~15 cm耕作层。土壤样品自然风干后,挑出残留植物、石子等,过2 mm土筛,混匀,用于理化性质的分析以及矿化培养试验。
土壤酸碱度(pH)以及电导率(EC)采用水土质量比2.5∶1,运用pH计(Mettler-Toledo)和数显电导率仪(雷磁DDS-11A)分别测得;土壤全磷(TP)、全钾(TK)分别采用浓H2SO4-HClO3消煮–钼锑抗比色法以及HF-HClO3消煮–火焰光度法测得;土壤粒径组成(体积分数)采用激光粒度分析仪(LS13320)测定。生物质炭pH以及EC采用水生物质炭质量比5∶1测得;灰分含量运用马弗炉在525 ℃下将样品灰化至灰白色称重测定。土壤、生物质炭以及秸秆的全碳、全氮用碳氮元素分析仪(SerCon Ltd, Crewe, UK)测得,13C丰度(δ13C)运用元素分析仪和同位素质谱联用仪(Thermo Fisher Scientific Inc., Waltham, MA, USA)测定。具体测定结果见表 1。
|
|
表 1 供试材料理化性质 Table 1 Physiochemical properties of tested soils, 13C-labelled biochar and 13C-labelled wheat straw |
每种土壤类型下设置3个处理,分别是:生物质炭处理,添加0.19 g碳当量的生物质炭于30 g干重的土壤中;秸秆处理,添加0.19 g碳当量的秸秆于30 g干重土壤中;空白土壤处理(CK),30 g干重土壤。每个处理设置3个重复。生物质炭–碳的添加量是假设在碳含量为18 g/kg的土壤中,生物质炭降解5%的情况下,保证混合释放的CO2的13C含量达到1.2% 而计算得到的。此生物质炭的添加量相当于小麦秸秆生物质炭连续5年还田的剂量(当季收获的小麦秸秆全部制成生物质炭后还田)。单个样品混合均匀后置于250 ml的小口玻璃瓶中,加纯水至最大持水量的60%,于21℃±1 ℃恒温房保持瓶口敞开培养368 d。培养过程中,每周用称重法维持水分含量,定期采集培养瓶中的气体测定CO2浓度,采气次数前期较频繁,后期减少次数,培养期间一共采气21次。
采气前将瓶口用橡胶塞塞住,通过抽气泵将瓶内气体置换为普通空气,后用注射器采30 ml的气体作为0时刻的气体样品,继续培养;约4 h以后,采集第二针气体,气体样品中的CO2浓度采用气象色谱仪测定(Agilent 7890, Santa Clara, CA, USA)。其中,培养1、4、10、18 d以及368 d的气体样品用来分析13C丰度,所用仪器为气相色谱质谱联用仪(Thermo Finnigan, Bremen, Germany)。
1.4 参数计算1) CO2-C释放速率。向土壤中加入生物质炭或秸秆后,混合土壤的CO2-C释放速率(Sm, mg/(kg·d))计算公式如下[16]:
| $ S_{\mathrm{m}}=\left(\left(C_{2}-C_{1}\right) \times M_{\mathrm{c}} \times V \times 10^{3} \times 24\right) /\left(m \times \mathrm{MV}_{\mathrm{corr}} \times t\right) $ | (1) |
式中:C1、C2分别代表采气时0时刻以及4 h后时刻培养瓶中的CO2浓度;Mc为碳元素的分子质量(12 g/mol);V代表瓶子上部的空间体积(m3);m代表土壤干重(kg);MVcorr是根据温度矫正后的气体摩尔体积(0.0242 m3/mol)。
2) 生物质炭及秸秆的CO2-C释放速率。在添加生物质炭的处理中,生物质炭CO2-C释放速率根据质量守恒原理,由以下公式算得[16]:
| $ \delta_{\text {total }}=f_{\mathrm{SOM}} \times \delta_{\mathrm{SOM}}+f_{\text {biochar }} \times \delta_{\text {biochar }} $ | (2) |
式中:δtotal、δSOM、δbiochar分别代表混合土壤释放的CO2-C、土壤原有机质以及生物质炭中的δ13C值;fSOM及fbiochar分别代表混合土壤释放的CO2-C中来自土壤以及生物质炭的比例。又因为fSOM+ fbiochar =1,且δtotal、δSOM以及δbiochar均已测得,因此便能联立方程解得fSOM以及fbiochar。同理算得小麦秸秆碳的CO2-C释放速率。
3) CO2-C累积释放量。CO2-C累积释放量(Lcum,mg/kg)通过以下公式算得:
| $ L_{\mathrm{cum}}=\sum\limits_{i=1}^{n}\left[\left(R_{i}+R_{i+1}\right) / 2 \times\left(t_{i+1}-t_{i}\right)\right] $ | (3) |
式中:R代表CO2–C释放速率(mg/(kg·d));i代表采样批次;n代表采样次数;t代表采样时间,即培养天数(d)。
4) 激发效应量计算。每千克土壤的碳激发效应量(PE,mg/kg)计算公式为:
| $ \mathrm{PE}=\mathrm{PE}_{\mathrm{N} 1}-\mathrm{PE}_{\mathrm{N} 2} $ | (4) |
式中:PEN1代表添加生物质炭或秸秆的处理中每千克土壤原有机碳的CO2-C释放量(mg/kg),PEN2代表相应的土壤CK处理中的CO2-C释放量(mg/kg)。
5) 碳净损失量。等碳量的生物质炭及秸秆分别加入土壤培养368 d之后,每千克土壤的碳净损失量(Z,mg/kg)计算公式为:
| $ Z=Z_{1}+Z_{2} $ | (5) |
式中:Z1为每千克土壤中的生物质炭-碳或秸秆-碳的降解量(mg/kg);Z2为相对应的碳激发效应量(mg/kg)。负激发效应为负值,正激发效应为正值。
1.5 数据分析数据运用SPSS 13.0软件包进行分析。不同土壤之间的性质、不同处理之间各碳源CO2-C释放速率以及累积CO2-C释放量的差异,采用one-way ANOVA和LSD多重比较进行分析;生物质炭-碳和秸秆-碳的降解量及相应的激发效应量分别与土壤性质之间的相关性运用Pearson相关分析法进行分析;差异显著性性水平为P < 0.05。
2 结果与分析 2.1 不同类型土壤的性质及生物质炭标记效果4种不同类型土壤的理化性质存在显著的差异(表 1)。红壤水稻土的全碳(26.0 g/kg)、全氮(2.7 g/kg)、全磷(2.91 g/kg)、全钾(34.9 g/kg)含量均显著高于其他3种土壤,其他3种土壤的大小顺序依次是黑土水稻土 > 下位砂姜土水稻土 > 低肥力红壤水稻土。但红壤水稻土的pH最低,为4.77,其次是低肥力红壤水稻土4.99,pH最高的土壤为下位砂姜土水稻土6.80。低肥力红壤水稻土黏粒含量最高,其他大小顺序依次是:黑土水稻土 > 红壤水稻土 > 下位砂姜土水稻土。
拔节期的小麦植株利用田间原位生长箱进行13C稳定性同位素标记后,δ13C从自然丰度-27‰增至651‰(表 1)。13C标记小麦秸秆制作成为生物质炭后,生物质炭δ13C丰度没有显著变化,为657‰。
2.2 土壤CO2-C释放速率及碳累积释放量各处理的CO2-C释放速率随着时间的延长而逐步降低(图 1),生物质炭处理的土壤CO2–C释放速率远小于秸秆处理。培养368 d后,生物质炭处理中累积释放的碳量在黑土水稻土以及下位砂姜土水稻土中均小于相应的CK处理,而在红壤以及低肥力红壤水稻土中均略大于CK处理。相同处理下,不同土壤的碳累积释放量大小顺序均为:红壤水稻土 > 黑土水稻土 > 下位砂姜土水稻土 > 低肥力红壤水稻土(图 1)。

|
(图A中嵌入的小图为培养72 ~ 368 d土壤总碳释放速率动态变化) 图 1 生物质炭及秸秆分别添加到不同土壤中后总碳释放速率动态变化(A)以及逐步累积的总碳释放量(B) Fig. 1 Dynamics of CO2-C emission (A) and cumulative CO2-C emission (B) from different soils added with biochar or straw |
各个处理中,土壤原有机碳的降解速率随着培养时间的延长而逐渐降低(图 2)。同种土壤中,添加秸秆处理土壤原有机碳的降解速率普遍高于CK处理以及生物质炭处理,生物质炭处理与CK处理差异较小。
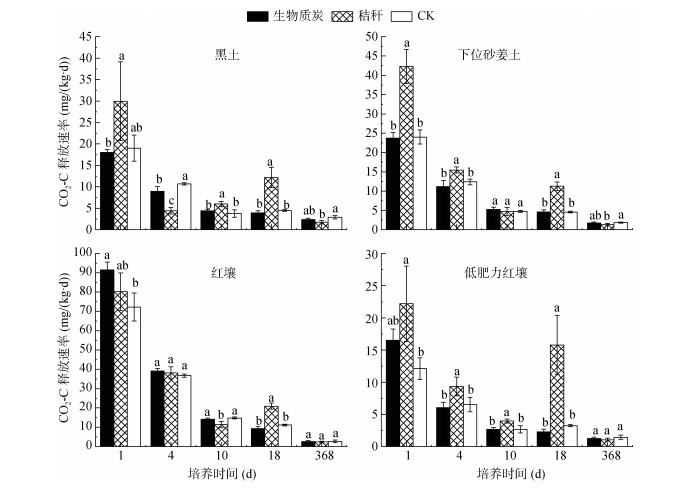
|
(图中不同小写字母代表同一培养时间不同处理之间差异达显著水平(P < 0.05,n=3)) 图 2 生物质炭及秸秆分别添加到不同土壤中后土壤原有机碳分解速率动态变化 Fig. 2 Dynamics of CO2-C emission from native organic carbon in different soils added with biochar and straw |
生物质炭及秸秆添加在不同土壤中培养368 d后,生物质炭在黑土水稻土以及下位砂姜土水稻土中分别引发了显著的负激发效应(图 3),激发效应量分别为–284 mg/kg和–157 mg/kg(表 2);在红壤水稻土以及低肥力红壤水稻土中均引发了正激发效应,但二者差异未达显著水平,激发效应量分别为33.3 mg/kg和58.0 mg/kg;秸秆在4种土壤中均引发了正激发效应,激发效应量的大小顺序为:低肥力红壤水稻土 > 红壤水稻土 > 黑土水稻土 > 下位砂姜土水稻土(表 2)。
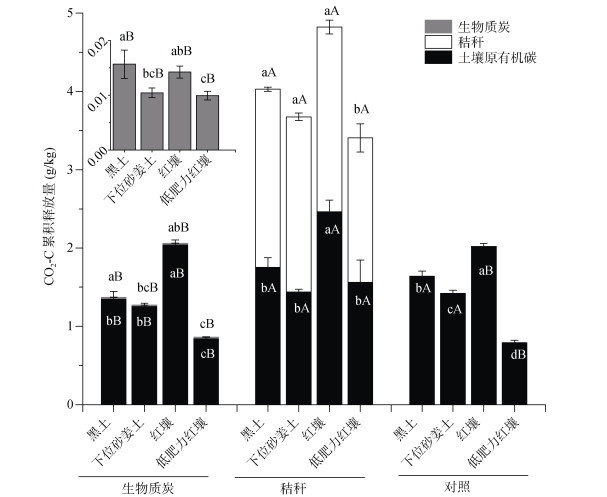
|
(图中嵌入图为生物质炭处理中生物质炭-碳累积释放量的放大;不同小写字母代表同一添加处理不同土壤之间的差异达显著水平(P < 0.05,n= 3);不同大写字母代表同一土壤类型不同添加处理之间的差异达显著水平(P < 0.05,n= 3)) 图 3 生物质炭与秸秆分别添加到不同类型土壤中后各碳源的碳累积释放量 Fig. 3 Cumulative CO2-C emissions from different carbon sources in different soils added with biochar and straw |
|
|
表 2 生物质炭与秸秆分别添加到不同类型土壤中后土壤原有机碳的激发效应量 Table 2 Priming effects induced by biochar and straw amendments in different soils |
生物质炭以及秸秆的碳释放速率随着时间的延长均逐步降低,生物质炭–碳的降解速率远小于秸秆–碳(图 4)。在培养1 d时,添加生物质炭处理中,红壤水稻土中生物质炭的降解速率显著高于其他土壤,为1.41 mg/(kg·d),其次为下位砂姜土水稻土中,低肥力红壤水稻土中最低;同样,添加秸秆处理中,红壤水稻土中秸秆降解速率最快,为234 mg/(kg·d),低肥力红壤水稻土中次之,黑土和下位砂姜土水稻土中秸秆降解速率差别不大。而在培养368 d时,添加生物质炭处理中,低肥力红壤水稻土中生物质炭的降解速率显著高于其他土壤,红壤水稻土中最低;而在添加秸秆处理中,黑土水稻土中秸秆降解速率最高,低肥力红壤水稻土中最低(图 4)。
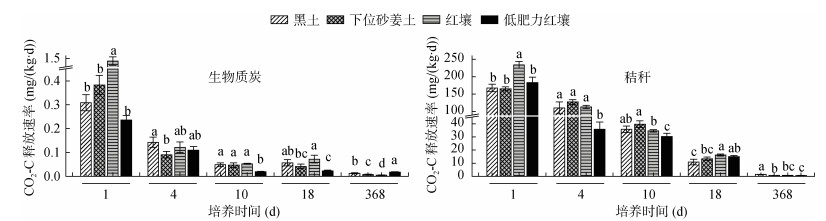
|
(图中不同小写字母代表同一培养时间不同处理之间的差异达显著水平(P < 0.05,n= 3)) 图 4 生物质炭及秸秆分别添加到不同类型土壤中后生物质炭-碳和秸秆-碳的降解速率动态变化 Fig. 4 Dynamics of CO2-C emission from biochar and straw in different soil |
生物质炭在土壤中培养368 d后,其累积的碳降解量远小于秸秆(图 3)。不同土壤中生物质炭–碳降解量显著不同,其大小顺序为:黑土水稻土(15.6 mg/kg) > 红壤水稻土(14.2 mg/kg) > 下位砂姜土水稻土(10.4 mg/kg) > 低肥力红壤水稻土(9.92 mg/kg),分别占生物质炭中碳元素的0.25%、0.23%、0.17% 和0.16%。秸秆–碳的累积降解量在黑土水稻土、下位砂姜土水稻土以及红壤水稻土中没有显著差异,降解量为2.24 ~ 2.36 g/kg,占秸秆中碳元素的比例为35.5% ~ 37.4%;而在低肥力红壤水稻土中秸秆–碳降解量显著低于以上3种土壤,为1.84 g/kg,占秸秆中碳元素的比例为29.2%(图 3)。
2.5 碳净损失量等碳量的生物质炭及秸秆分别添加到土壤中培养368 d后,生物质炭处理每千克土壤的的碳净损失量远小于秸秆处理。生物质炭处理的土壤碳净损失量为黑土水稻土最低,为–268 mg/kg,下位砂姜土次之,低肥力红壤最高,如表 3所示;而秸秆添加处理中,下位砂姜土水稻土最低,为2.26 g/kg,黑土水稻土次之,红壤水稻土最高。
|
|
表 3 等碳量的生物质炭及秸秆添加后土壤的碳净损失量 Table 3 Net carbon losses of biochar-soil and straw-soil mixtures for different soils |
由表 4可知,生物质炭及秸秆碳降解量、土壤碳激发效应量及碳净损失量分别与不同的土壤性质存在相关性。生物质炭在土壤中的碳降解量与土壤中的全钾及全碳含量具有显著的正相关关系,相关系数分别为0.679与0.584。与秸秆中碳降解量最为相关的是土壤的C/N(r=0.863, P < 0.01)。生物质炭的激发效应量与土壤的EC相关性最强(P < 0.01),相关系数r为–0.884,其次为pH(P < 0.01, r= –0.824)。秸秆的激发效应量与土壤的粉粒含量最为相关(r= –0.937, P < 0.01),其次为EC(r= –0.902, P < 0.01)。生物质炭处理碳净损失量与EC和pH呈极显著负相关关系,相关系数分别为–0.880和–0.831,秸秆处理的碳净损失量与土壤pH以及砂粒含量分别呈极显著的负相关关系。
|
|
表 4 生物质炭–碳降解量、秸秆–碳降解量、土壤原有机碳的激发效应量以及碳净损失量分别与土壤性质之间的Pearson相关系数 Table 4 Pearson correlation coefficients of soil properties and biochar-carbon decomposition, straw-carbon decomposition, priming effects and carbon net losses |
目前,生物质炭在土壤中引发激发效应的机理还并不明确。有研究[10, 15]认为,生物质炭在土壤中引发正激发效应的原因可能为,生物质炭中少部分的不稳定碳为土壤中的微生物增加了碳源,使微生物的生长代谢增加,分解土壤原有机质的酶类增加,因此引发了正激发效应。生物质炭引发负激发效应的机理,主要推测为由于生物质炭自身表面积大、多孔性的特性,对土壤原有机碳有吸附和保护作用,避免了微生物对土壤原有机碳的降解,从而出现了负激发效应[16-17]。
生物质炭的激发效应对不同性质的土壤有不同的响应。本研究结果表明,经过为期368 d的室内培养,在黑土水稻土以及下位砂姜土水稻土中生物质炭引发显著的负激发效应,且前者的负激发效应量大于后者,分别为–284 mg/kg和–157 mg/kg;而在红壤水稻土以及低肥力红壤水稻土中引发正激发效应,且后者的正激发效应量大于前者,分别为33.3 mg/kg和58.0 mg/kg(表 2)。说明生物质炭在不同土壤中激发效应方向和程度不同,有研究也证明了这一点。Cross和Sohi[25]将C4植物甘蔗制备的生物质炭分别添加到3种土壤中培养两周后发现,生物质炭在草地土壤中引发了负激发效应,而在耕作以及免耕土壤中均未引发激发效应。以上结果说明土壤自身的性质对生物质炭引发的激发效应有极大的影响。
本试验结果表明,生物质炭的激发效应量与土壤EC和pH有极显著的负相关关系,而与土壤黏粒含量并没有显著的相关性,这证明本研究此前的假设并不成立,即土壤黏粒对土壤原有机质的保护程度不同,并非引起生物质炭在不同土壤中激发效应不同的主要原因。而Ding等[21]通过对27个生物质炭室内培养试验数据进行收集,并利用回归树模型分析后发现,土壤黏粒对生物质炭激发效应的贡献只有4%。本研究结果显示,与生物质炭激发效应量最密切相关的土壤性质是土壤电导率EC(表 4)。土壤电导率反映土壤中的盐离子含量,盐离子含量越高,即EC值越高,生物质炭引发的正激发效应越小,负激发效应越大;反之,则正激发效应越大,负激发效应越小。土壤的盐离子含量通常决定着土壤的酸碱度[26]。本研究的相关性分析结果表明,土壤pH与生物质炭激发效应量也有着极显著的负相关关系,相关程度仅次于EC值。由于擅长分解土壤原有机质等难分解有机碳源的k-型微生物多为真菌[23],而真菌大多在偏酸性(pH约为5 ~ 7)的生存环境中最适宜生长[27-28]。因此推测,盐离子含量丰富的碱性生物质炭(表 1)能够提高强酸性土壤中的低盐基离子含量,导致土壤pH升高[29],使擅长降解土壤原有机碳的真菌的生存环境更为适宜,活性更高,从而促进了土壤原有机质的分解。然而,在盐离子含量较高的土壤中,生物质炭的添加使土壤盐离子含量更高,导致pH进一步增加,恶化了降解土壤原有机碳的真菌适宜生存的偏酸性的土壤环境,使真菌活性降低,土壤原有机碳矿化速率变低。因此,生物质炭的添加改变了土壤中盐离子的含量,影响了土壤的酸碱度,进而微生物的活性受到影响,最终导致了土壤原有机碳降解速率的改变。然而,由于秸秆和秸秆生物质炭两者自身性质的巨大差异,导致与秸秆激发效应量密切相关的土壤特性与生物质炭的不同。主要原因可能是生物质炭中的碳多为芳香化的惰性碳[5],可被微生物利用的碳源例如脂肪族碳、羟基碳等[30]远远少于秸秆[2],秸秆添加后土壤微生物群落的组成结构与生物质炭添加后的截然不同[2, 31]。由于影响不同微生物群落代谢的主要土壤特性不同[13],微生物群落的代谢又与土壤原有机质的降解密切相关[23],故与秸秆和生物质炭激发效应密切相关的土壤特性不同。也正是由于秸秆和生物质炭添加后微生物群落组成和结构不同,导致了二者引发的激发效应量不同(表 2)。有研究[32-33]表明,土壤的粒级组成不同,微生物生物量不同,因此,可以推测秸秆激发效应之所以与土壤粒级含量有关(表 4),可能是因为土壤的机械组成对秸秆添加后土壤微生物的数量和组成有影响,从而影响了激发效应。
本试验运用人工标记13C稳定性同位素的方法,使生物质炭的δ13C值由自然丰度的–27‰标记至657‰,有效地将生物质炭的降解量与土壤原有机质的矿化量区分开来,避免了由于生物质炭矿化量少而导致的混合CO2-C的13C丰度与土壤原有机质的13C丰度差异太小,从而产生的试验系统误差[6, 22-23]。与本研究方法相似,Wu等[34]运用人工13C标记的水稻秸秆,500℃条件下制成δ13C值为570‰的生物质炭,经过为期390 d的培养,生物质炭在土壤中的降解量为0.17% ~ 0.28%,与本试验结果0.16% ~ 0.25% 相似。因此,本研究结果得到的不同土壤中的生物质炭降解量以及土壤原有机碳激发效应结果较为可靠。
3.2 生物质炭在不同土壤中的固碳效果生物质炭与其制炭原材料相比,前者在土壤中自身的稳定性远远大于后者。本试验结果显示,小麦秸秆生物质炭在4种不同的土壤上培养1年后的降解量为0.16% ~ 0.25%,而小麦秸秆则为29% ~ 37%,这证明了生物质炭在土壤中的长期固碳功能。生物质炭在不同土壤中的碳降解速率不同,与下位砂姜土水稻土、红壤水稻土以及低肥力红壤水稻土相比,生物质炭在黑土水稻土中的碳降解速率最高,自身稳定性最差。但生物质炭添加到土壤中后,土壤碳净损失速率才能够真正反映生物质炭在土壤中的固碳效果[17]。碳净损失速率不仅由生物质炭自身的降解速率决定,还受到其对土壤原有机碳矿化速率产生的促进或者抑制作用的影响,即激发效应的影响。正激发效应会增加土壤碳净损失量,相反,负激发效应会减少碳净损失量。Jones等[35]利用14C长期标记的土壤探究生物质炭对土壤呼吸的影响,发现生物质炭会显著抑制土壤原有机碳的分解,而这部分被抑制的有机碳刚好抵消生物质炭自身降解所释放的CO2-C,从而肯定了生物质炭拥有强力的固碳效果。本研究碳净损失量计算结果表明,等碳量生物质炭还田后,生物质炭在黑土水稻土中的碳净损失量最小,固碳效果最好;下位砂姜土水稻土次之,红壤及低肥力红壤水稻土中的碳净损失量最大,固碳效果最差。与生物质炭引发的碳激发效应量相似,生物质炭添加后,混合土壤的碳净损失量与土壤自身的EC与pH均有极显著的负相关关系,这表明碳净损失速率主要由生物质炭引发的碳激发效应量决定,这一点通过比较各土壤中生物质炭–碳降解量与激发效应量也可以被证实。因此,在衡量生物的固碳效果时,应综合考虑生物质炭自身稳定性以及生物质炭对土壤原有机碳周转的影响,只关注生物质炭的降解速率会高估或者低估生物质炭的固碳效果。
有研究[34, 36]表明,生物质炭在土壤中的降解速率随着土壤原有机碳含量的增加而增加,并将其归因于土壤原有机碳与生物质炭之间的共同代谢效应[6],即丰富的土壤原有机碳为微生物提供了可利用的碳源,使得生物质炭可以被微生物一同迅速利用。另有研究[36-37]表明,生物质炭在土壤中的稳定性与土壤的黏粒含量以及土壤氮素含量有关。而本研究的结果则表明,生物质炭降解速率与土壤中的钾含量存在显著的正相关关系(表 4)。由于前人[38]有研究表明,生物质炭加入土壤中,土壤硅酸盐解钾菌的数量会增多,因此可以推测,硅酸盐解钾菌有助于生物质炭的降解,而全钾含量高的土壤硅酸盐解钾菌更活跃,因而土壤钾含量影响生物质炭的降解速率。
综上所述,生物质炭在土壤中引发的碳激发效应对不同性质土壤的响应不同,其与土壤的盐离子含量有密切的负相关关系。本研究的不足之处在于,研究仅利用了一种生物质炭来进行探究,更多种类的生物质炭在土壤中的激发效应及降解情况还需要进一步研究。另外,土壤自身的盐离子含量影响生物质炭在土壤中引发的激发效应,以及土壤钾含量影响生物质炭在土壤中降解速率的机理还有待进一步证实。
4 结论1) 生物质炭在不同土壤中的激发效应方向及程度不同,在黑土水稻土以及下位砂姜土水稻土中引发显著的负激发效应,激发效应量分别为–284 mg/kg和–157 mg/kg;而在红壤水稻土以及低肥力红壤水稻土中引发正激发效应,激发效应量分别为33.3 mg/kg和58.0 mg/kg。生物质炭激发效应量与土壤自身的盐离子含量呈极显著的负相关关系(P < 0.01,r=–0.884),土壤自身盐离子含量越高,生物质炭引发的土壤原有机碳正激发效应越小,负激发效应越大。
2) 生物质炭自身的碳降解量在不同性质土壤中不同,其与土壤自身的全钾含量有显著的正相关关系(P < 0.05,r= 0.679)。等碳量的生物质炭添加到土壤中后,在黑土水稻土中碳净损失量最低,固碳效果最好,下位砂姜土水稻土次之,红壤以及低肥红壤水稻土中碳净损失量最高,固碳效果最差。
3) 在评估生物质炭在土壤中的固碳作用时,除需考虑生物质炭自身的降解速率之外,还应考虑生物质炭在土壤中引发的激发效应。
致谢: 衷心感谢在本研究的试验过程中提供大力支持和帮助的张燕辉、靳海洋、胡天龙等课题组成员。
| [1] |
谢祖彬, 刘琦, 许燕萍, 等. 生物炭研究进展及其研究方向[J]. 土壤, 2011, 43(6): 857-861 (  0) 0) |
| [2] |
Budai A, Rasse D P, Lagomarsino A, et al. Biochar persistence, priming and microbial responses to pyrolysis temperature series[J]. Biology and Fertility of Soils, 2016, 52(6): 749-761 DOI:10.1007/s00374-016-1116-6 (  0) 0) |
| [3] |
El-Naggar A, Shaheen S M, Ok Y S, et al. Biochar affects the Dissolved and colloidal concentrations of Cd, Cu, Ni, and Zn and their phytoavailability and potential mobility in a mining soil under dynamic redox-conditions[J]. Science of the Total Environment, 2018, 624: 1059-1071 DOI:10.1016/j.scitotenv.2017.12.190 (  0) 0) |
| [4] |
Lehmann J. A handful of carbon[J]. Nature, 2007, 447(7141): 143-144 DOI:10.1038/447143a (  0) 0) |
| [5] |
McBeath A V, Smernik R J. Variation in the degree of aromatic condensation of chars[J]. Organic Geochemistry, 2009, 40(12): 1161-1168 DOI:10.1016/j.orggeochem.2009.09.006 (  0) 0) |
| [6] |
Kuzyakov Y, Subbotina I, Chen H Q, et al. Black carbon decomposition and incorporation into soil microbial biomass estimated by 14C labeling[J]. Soil Biology and Biochemistry, 2009, 41(2): 210-219 DOI:10.1016/j.soilbio.2008.10.016 (  0) 0) |
| [7] |
Zimmerman A R. Abiotic and microbial oxidation of laboratory-produced black carbon (biochar)[J]. Environmental Science & Technology, 2010, 44(4): 1295-1301 (  0) 0) |
| [8] |
Singh B P, Cowie A L, Smernik R J. Biochar carbon stability in a clayey soil as a function of feedstock and pyrolysis temperature[J]. Environmental Science & Technology, 2012, 46(21): 11770-11778 (  0) 0) |
| [9] |
Fang Y Y, Singh B, Singh B P. Effect of temperature on biochar priming effects and its stability in soils[J]. Soil Biology and Biochemistry, 2015, 80: 136-145 DOI:10.1016/j.soilbio.2014.10.006 (  0) 0) |
| [10] |
Wang J Y, Xiong Z Q, Kuzyakov Y. Biochar stability in soil: meta-analysis of decomposition and priming effects[J]. GCB Bioenergy, 2016, 8(3): 512-523 DOI:10.1111/gcbb.12266 (  0) 0) |
| [11] |
Leng L J, Huang H J. An overview of the effect of pyrolysis process parameters on biochar stability[J]. Bioresource Technology, 2018, 270: 627-642 DOI:10.1016/j.biortech.2018.09.030 (  0) 0) |
| [12] |
Liu Q, Liu B J, Zhang Y H, et al. Can biochar alleviate soil compaction stress on wheat growth and mitigate soil N2O emissions?[J]. Soil Biology and Biochemistry, 2017, 104: 8-17 DOI:10.1016/j.soilbio.2016.10.006 (  0) 0) |
| [13] |
Steinbeiss S, Gleixner G, Antonietti M. Effect of biochar amendment on soil carbon balance and soil microbial activity[J]. Soil Biology and Biochemistry, 2009, 41(6): 1301-1310 DOI:10.1016/j.soilbio.2009.03.016 (  0) 0) |
| [14] |
Maestrini B, Nannipieri P, Abiven S. A meta-analysis on pyrogenic organic matter induced priming effect[J]. GCB Bioenergy, 2015, 7(4): 577-590 DOI:10.1111/gcbb.12194 (  0) 0) |
| [15] |
Luo Y, Durenkamp M, De Nobili M, et al. Short term soil priming effects and the mineralisation of biochar following its incorporation to soils of different pH[J]. Soil Biology and Biochemistry, 2011, 43(11): 2304-2314 DOI:10.1016/j.soilbio.2011.07.020 (  0) 0) |
| [16] |
Lu W W, Ding W X, Zhang J H, et al. Biochar suppressed the decomposition of organic carbon in a cultivated sandy loam soil: a negative priming effect[J]. Soil Biology and Biochemistry, 2014, 76: 12-21 DOI:10.1016/j.soilbio.2014.04.029 (  0) 0) |
| [17] |
Zimmerman A R, Gao B, Ahn M Y. Positive and negative carbon mineralization priming effects among a variety of biochar-amended soils[J]. Soil Biology and Biochemistry, 2011, 43(6): 1169-1179 DOI:10.1016/j.soilbio.2011.02.005 (  0) 0) |
| [18] |
Kasozi G N, Zimmerman A R, Nkedi-Kizza P, et al. Catechol and humic acid sorption onto a range of laboratory-produced black carbons (biochars)[J]. Environmental Science & Technology, 2010, 44(16): 6189-6195 (  0) 0) |
| [19] |
Lehmann J, Rillig M C, Thies J, et al. Biochar effects on soil biota-A review[J]. Soil Biology and Biochemistry, 2011, 43(9): 1812-1836 DOI:10.1016/j.soilbio.2011.04.022 (  0) 0) |
| [20] |
Wagner S, Cattle S R, Scholten T. Soil-aggregate formation as influenced by clay content and organic-matter amendment[J]. Journal of Plant Nutrition and Soil Science, 2007, 170(1): 173-180 DOI:10.1002/jpln.200521732 (  0) 0) |
| [21] |
Ding F, Zwieten L, Zhang W D, et al. A meta-analysis and critical evaluation of influencing factors on soil carbon priming following biochar amendment[J]. Journal of Soils and Sediments, 2018, 18(4): 1507-1517 DOI:10.1007/s11368-017-1899-6 (  0) 0) |
| [22] |
Brewer C E, Hu Y Y, Schmidt-Rohr K, et al. Extent of pyrolysis impacts on fast pyrolysis biochar properties[J]. Journal of Environmental Quality, 2012, 41(4): 1115-1122 DOI:10.2134/jeq2011.0118 (  0) 0) |
| [23] |
Kuzyakov Y. Priming effects: Interactions between living and dead organic matter[J]. Soil Biology and Biochemistry, 2010, 42(9): 1363-1371 DOI:10.1016/j.soilbio.2010.04.003 (  0) 0) |
| [24] |
Bei Q C, Liu G, Tang H Y, et al. Heterotrophic and phototrophic 15N2 fixation and distribution of fixed 15N in a flooded rice-soil system[J]. Soil Biology and Biochemistry, 2013, 59: 25-31 DOI:10.1016/j.soilbio.2013.01.008 (  0) 0) |
| [25] |
Cross A, Sohi S P. The priming potential of biochar products in relation to labile carbon contents and soil organic matter status[J]. Soil Biology and Biochemistry, 2011, 43(10): 2127-2134 DOI:10.1016/j.soilbio.2011.06.016 (  0) 0) |
| [26] |
黄昌勇. 土壤学[M].
中国农业出版社, 北京, 2000
(  0) 0) |
| [27] |
Yamanaka T. The effect of pH on the growth of saprotrophic and ectomycorrhizal ammonia fungiin vitro[J]. Mycologia, 2003, 95(4): 584-589 DOI:10.1080/15572536.2004.11833062 (  0) 0) |
| [28] |
Smith J L, Doran J W. Measurement and use of pH and electrical conductivity for soil quality analysis[M].
Soil Science Society of America, Madison, WI, USA, 2015: 169-185
(  0) 0) |
| [29] |
Alburquerque J A, Calero J M, Barrón V, et al. Effects of biochars produced from different feedstocks on soil properties and sunflower growth[J]. Journal of Plant Nutrition and Soil Science, 2014, 177(1): 16-25 DOI:10.1002/jpln.201200652 (  0) 0) |
| [30] |
Purakayastha T J, Kumari S, Pathak H. Characterisation, stability, and microbial effects of four biochars produced from crop residues[J]. Geoderma, 2015, 239-240: 293-303 DOI:10.1016/j.geoderma.2014.11.009 (  0) 0) |
| [31] |
陈利军, 孙波, 金辰, 等. 等碳投入的有机肥和生物炭对红壤微生物多样性和土壤呼吸的影响[J]. 土壤, 2015, 47(2): 340-348 (  0) 0) |
| [32] |
王彦武, 罗玲, 张峰, 等. 河西绿洲荒漠过渡带梭梭林土壤保育效应[J]. 土壤学报, 2019, 56(3): 749-762 (  0) 0) |
| [33] |
郝余祥, 程丽娟. 不同粒径土壤团聚体的微生物组成[J]. 土壤学报, 1964, 1(2): 192-195 (  0) 0) |
| [34] |
Wu M X, Han X G, Zhong T, et al. Soil organic carbon content affects the stability of biochar in paddy soil[J]. Agriculture, Ecosystems & Environment, 2016, 223: 59-66 (  0) 0) |
| [35] |
Jones D L, Murphy D V, Khalid M, et al. Short-term biochar-induced increase in soil CO2 release is both biotically and abiotically mediated[J]. Soil Biology and Biochemistry, 2011, 43(8): 1723-1731 DOI:10.1016/j.soilbio.2011.04.018 (  0) 0) |
| [36] |
Bai M, Wilske B, Buegger F, et al. Degradation kinetics of biochar from pyrolysis and hydrothermal carbonization in temperate soils[J]. Plant and Soil, 2013, 372(1/2): 375-387 DOI:10.1007/s11104-013-1745-6 (  0) 0) |
| [37] |
Singh B P, Fang Y Y, Boersma M, et al. In situ persistence and migration of biochar carbon and its impact on native carbon emission in contrasting soils under managed temperate pastures[J]. PLoS One, 2015, 10(10): e0141560 DOI:10.1371/journal.pone.0141560 (  0) 0) |
| [38] |
姜敏, 顾炽明, 李志国, 等. 土壤钾素养分和理化性质对生物炭的响应[J]. 高效施肥, 2016, 10(37): 56-60 (  0) 0) |
2. University of Chinese Academy of Sciences, Beijing 100049, China;
3. College of Forestry, Nanjing Forestry University, Nanjing 210037, China
 2021, Vol. 53
2021, Vol. 53


