2. 南方现代林业协同创新中心, 南京林业大学生物与环境学院, 南京 210037;
3. 中国科学院大学, 北京 100049
花生在红壤旱地适应性强,种植面积占油料作物总种植面积的35% 左右[1]。作为我国最重要的油料作物之一,花生种植效益高,集约化经营普遍,经济效益驱动农民长期连作,最多已连作20 a[2-3]。长期连作会改变土壤理化性质和生物特性,进而影响花生的生长及产量[4]。由于土壤生物的隐蔽性和非生物环境的复杂性[5],花生连作障碍的机制尚未完全揭示,防控措施也有待进一步探索。
轮作换茬可通过改善土壤微生物区系消减土壤病原菌的积累,进而控制土传病害的发生,已在多种作物中被证明是缓解连作障碍的有效方法,但农民的种植习惯不易改变,生产中不易推广[6]。对土壤熏蒸灭菌可以杀灭因长期连作所滋生的土传病原菌从而实现增产,但熏蒸也杀灭了土壤中的有益微生物,部分熏蒸剂还会破坏臭氧层,不仅恶化了土壤生态环境,还不利于农业绿色健康发展[7]。因此亟待探索安全有效的方法,进一步认识该方法下作物产量及根际微生物区系变化情况,进而缓解和防控连作障碍。
我国每年产生的畜禽粪便达31.9亿t,经过发酵腐熟的粪便堆肥中含有丰富的养分元素,既能直接促进作物生长,又能改善土壤理化性质和微生物区系,间接改良作物农艺性状[8]。过去20 a,有机物料用于缓解连作障碍已有大量报道[9-10]。但与单一的有机粪肥相比,功能菌剂联合有机粪肥(生物有机肥)作为一种新型的提高作物产量方法是近年来研究的热点[11]。这是因为生物有机肥中的功能菌一方面可以通过分泌生长激素来调节植物生长发育,另一方面还可以通过产生拮抗物质,如脂肽类,抑制病原微生物的生长与繁殖,提高作物对生物和非生物胁迫的抵抗能力,从而缓解连作障碍[12]。虽然学者对生物有机肥对土壤微生物群落及作物产量的影响开展了一些研究[13],但连续多年持续施用生物有机肥对作物生长、根际微生物区系的影响及其与土壤理化性质的关系还鲜有报道。因此,本文通过高通量测序的方法探究连作制度下持续施用化肥和生物有机肥对花生生长及根际细菌群落的影响,为探索有效稳定的连作障碍缓解措施提供理论依据,为化肥减量增产提供切实行动。
1 材料与方法 1.1 试验材料盆栽试验于中国科学院南京土壤研究所温室大棚中开展,供试土壤采自江西省鹰潭市余江县刘家站红壤旱地(28°13′N,116°55′E),此田块近5 a没有种植过花生。采集表层耕作土(0 ~ 30 cm)带回实验室备用。土壤理化性质:pH 4.79,有机质12.14 g/kg,全氮0.85 g/kg,全磷0.78 g/kg,全钾9.20 g/kg,碱解氮54.51 mg/kg,有效磷16.72 mg/kg,速效钾230.10 mg/kg。新鲜猪粪经堆沤发酵(50 ℃ ± 10 ℃)30 d、自然风干60 d(期间每隔15 d翻压一次)后获得堆肥。试验所用菌株为短小芽孢杆菌(Bacillus pumilus)WXX-2,经被孢霉Mortierella sp. 真菌菌丝体在牛肉膏蛋白胨培养基中诱导强化后,定殖于无菌蘑菇粉中恒温(28 ℃)培养7 d后制得,已保藏于中国微生物菌种保藏管理委员会普通微生物中心,保藏编号为CGMCC No.11540。将WXX-2菌株于马铃薯葡萄糖液体培养基中置于恒温摇床(28 ℃、150 r/min)黑暗培养3 ~ 5 d后,与经过灭菌处理(121 ℃,1 h)的堆肥按1:50比例充分混合制备而成,每克干质量肥料含1×109个WXX-2菌落数,作为生物有机肥备用。生物有机肥理化性质:pH 7.73,有机碳262.03 g/kg,全氮20.85 g/kg,全磷11.21 g/kg,全钾16.11 g/kg。
1.2 试验设计与方法盆栽试验始于2015年。塑料盆规格为内径40 cm,高35 cm,每盆装土5 kg。试验共设3个处理:连作花生施用化肥(CF),每盆化肥用量为尿素0.53 g/kg干土,钙镁磷肥1.33 g/kg干土,氯化钾0.40 g/kg干土;连作花生施用生物有机肥(OF),每盆施用生物有机肥6.00 g/kg干土,再根据生物有机肥养分含量,补加尿素、钙镁磷肥和氯化钾,以保持OF与CF施用等量的氮、磷、钾养分含量;轮作(CK),2015年、2017年、2019年种植花生,2016年、2018年种植玉米,施用与CF等量化肥。每个处理3个重复,每个重复3盆,采用完全随机区组排列。花生品种为赣花5号,玉米品种为长江玉6号,每盆2株,幼苗期适当遮荫,早晚各浇一次水,收获后休闲(9月到翌年3月)。
1.3 样品采集及项目测定 1.3.1 花生农艺性状指标测定2015-2019年每年的8月10日前后收获花生,并晾干、称重获得荚果干重;2016年和2018年的9月20日收获玉米,并晾干、脱粒、称重获得玉米籽粒干重。2019年花生收获后对每株花生根瘤数量计数,测定花生株高、主根长、地上鲜重和根鲜重。每个重复中6株花生农艺指标的均值作为此重复的指标值。
1.3.2 根际土壤采集和处理2019年收获花生时小心拔起花生并抖动去除根部大颗粒土块,然后用无菌毛刷刷取粘附在花生根系上的根际土壤,每个重复中6株花生根际土壤充分混合成为一个混合土样。取土后立即将土样在4 ℃冰盒中带回实验室并分成两份,一份-25 ℃保存,用于土壤DNA提取;另一份风干过筛(0.15 mm),用于土壤理化性质测定。
1.3.3 土壤微生物DNA提取及高通量测序按照试剂盒(Fast DNA SPIN Kit for Soil,MP,美国)要求的步骤提取根际土壤总DNA,使用NanoDrop 2000(Thermo Scientific,美国)测定DNA浓度,并用引物[14]338F: ACTCCTACGGGAGGCAGCA和806R: GGACTACHVGGGTWTCTAAT基于Illumina MiSeq平台对根际土壤细菌进行16S rRNA扩增子测序,测序由上海派森诺生物科技有限公司完成。
1.3.4 土壤理化性质测定采用电极法测定土壤pH;采用重铬酸钾外加热法测定有机质含量;采用凯氏定氮法测定全氮含量;采用钼锑抗比色法测定全磷含量;采用火焰光度法测定全钾含量;采用扩散吸收法测定碱解氮含量;采用钼锑抗比色法测定有效磷含量;采用火焰光度法测定速效钾含量[15]。
1.4 数据处理与统计分析采用Microsoft Excel 2013对每处理3个重复的花生农艺性状指标进行数据处理,采用SPSS进行差异显著性分析(Duncan法)。采用QIIME软件(v.1.7.0)分析原始序列,用FLASH拼接成对的末端序列,通过UPARSE方法将序列在97% 相似性水平下聚类并分配给操作分类单元(OTU),使用16S rRNA Greengene(v.13.8)数据库对各OTU代表序列进行物种注释。基于R(v.3.5.1)使用“vegan”包计算OTU水平上根际细菌群落的多样性、丰富度和均匀度;基于Bray-Curtis距离在OTU水平上对细菌群落进行主坐标分析(PCoA),采用置换多元方差分析(PERMANOVA)比较处理间差异显著性。采用STAMP软件分析根际细菌属水平相对丰度差异(前25个优势属纳入统计分析),t检验(双侧)用于不同处理两两之间相对丰度差异显著性检验。采用Canoco软件(v.5.0)进行冗余分析(基于999次Monte Carlo置换检验)用以评估土壤理化性质与根际优势细菌属的分布关系。
2 结果 2.1 持续施用生物有机肥对花生产量和农艺性状的影响2015-2017年,不同处理下花生产量无显著差异。2018年,CF和OF处理花生产量差异显著,相比于施用化肥(CF),施用生物有机肥(OF)时花生产量增加了18%(表 1)。
|
|
表 1 2015-2018年不同处理下的花生和玉米产量(g/株) Table 1 Peanut and maize yields under different treatments from 2015 to 2018 |
与花生/玉米轮作(CK)相比,花生连作(CF)5 a后株高、地上鲜重、根瘤数及荚果干重显著降低(图 1);连作制度下,与施用化肥(CF)相比,持续施用生物有机肥(OF)显著提高了花生株高、地上鲜重、根鲜重和根瘤数及荚果产量。其中,花生根瘤数量对生物有机肥具有高度敏感性,持续施用生物有机肥后花生根瘤数相比于施用化肥提高了5倍。值得注意的是,相比于施用化肥,连续5 a施用生物有机肥后花生产量提高了27%(图 1)。
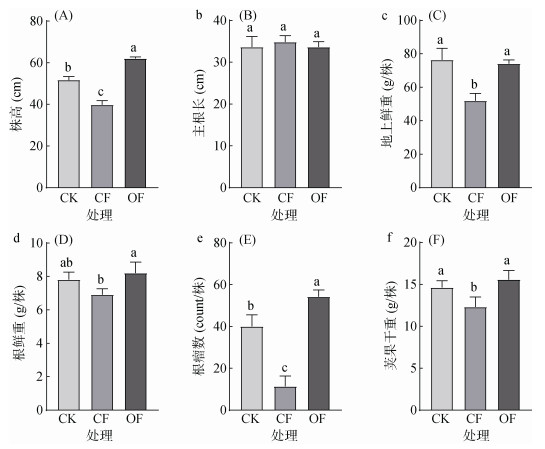
|
(图中小写字母不同表示处理间差异达P < 0.05显著水平) 图 1 成熟期不同处理下的花生农艺性状 Fig. 1 Peanut agronomic traits at maturation stage under different treatments |
主坐标分析(图 2)表明,不同处理下花生根际细菌群落结构差异显著(F(2, 6) = 9.81, P < 0.01)。相比于花生/玉米轮作,花生连作后根际细菌多样性和均匀度显著降低,而连作花生持续施用生物有机肥后,花生根际细菌多样性和丰富度显著升高(表 2)。
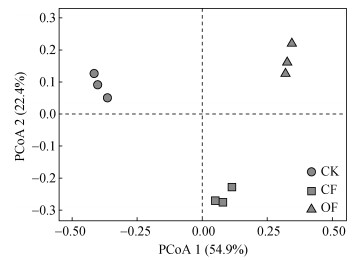
|
图 2 不同处理下花生根际细菌群落结构 Fig. 2 Principle coordinate analysis of peanut rhizosphere bacterial community structures under different treatments |
|
|
表 2 不同处理下花生根际细菌群落的多样性、丰富度和均匀度 Table 2 Shannon diversity, Chao 1 richness and Pielou evenness of bacterial communities in peanut rhizospheres under different treatments |
本研究共获得细菌序列266 013条,聚类后获得2 198个OTU,分布在22个门、46个纲、86个目、153个科、429个属。其中,放线菌门(Actinobacteria)、变形菌门(Proteobacteria)、暂定螺旋体门(Candidatus Saccharibacteria)、绿弯菌门(Chloroflexi)和酸杆菌门(Acidobacteria)为花生根际的优势菌门(相对丰度均大于1%),占获得总细菌序列量的75.2%。对比各处理间细菌门水平相对丰度差异后发现(图 3),相比于轮作(CK),花生连作(CF)后根际放线菌门的相对丰度显著降低(P < 0.01),而绿弯菌门和酸杆菌门的相对丰度显著升高(P < 0.01);相比于CF,连作花生持续施用生物有机肥(OF)后,变形菌门(P < 0.05)、暂定螺旋体门(P < 0.05)及拟杆菌门(Bacteroidetes)(P < 0.01)的相对丰度分别上升了7%,22% 和53%。
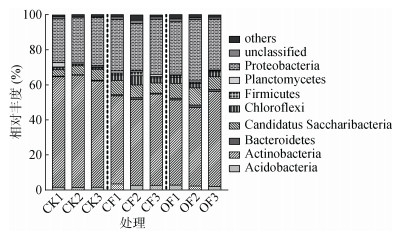
|
图 3 不同处理下花生根际细菌群落组成 Fig. 3 Bacterial community compositions (phylum level) in peanut rhizospheres under different treatments |
属水平上,相比于轮作(CK),Leifsonia,Mycobacterium,Burkholderia,Singulisphaera,Streptomyces,Dyella和Gp3的相对丰度在连作花生施用化肥(CF)处理下显著升高,Devosia,Mesorhizobium,Conexibacter,Catenulispora和Actinospica的相对丰度显著降低;相比于CF,Rhizobium,Marmoricola,Mesorhizobium,Mycobacterium,Kribbella,Devosia和Bradyrhizobium的相对丰度在施用生物有机肥处理(OF)下显著升高,Leifsonia,Actinospica,Burkholderia,Gp3,Catenulispora和Dyella的相对丰度显著降低。其中,α-变形菌门下Rhizobium,Mesorhizobium,Devosia和Bradyrhizobium的相对丰度分别升高了295%、89%、96% 和40%;放线菌门下Marmoricola,Mycobacterium和Kribbella的相对丰度升高了229%、104%、106%,Leifsonia的相对丰度下降了67%;β-变形菌门下Burkholderia的相对丰度下降了47%(图 4)。Bacillus属的相对丰度(< 0.2%)在各处理间无显著差异。
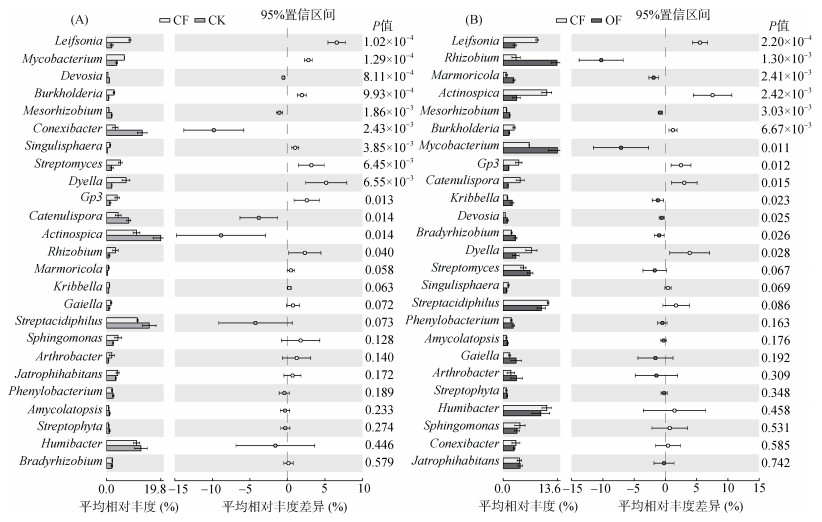
|
(图中误差线为标准差(n = 3),超出置信区间虚线表示两处理间差异达P < 0.05显著水平) 图 4 CF与CK (A)、CF与OF (B) 处理下花生根际优势细菌属平均相对丰度差异 Fig. 4 Differences in relative abundances of dominant bacterial genera in peanut rhizospheres under CF/CK (A) and CF/OF (B) treatments |
为了揭示不同处理下土壤理化性质对根际细菌群落的影响,针对根际细菌群落中相对丰度出现显著差异的细菌属进行冗余分析(图 5)。通过Canoco软件中“前向选择”(Forward selection)去除土壤全氮、全钾和速效钾3个与其他解释变量具有较强相关性的环境因子,以获得更稳定的多元回归模型。结果发现,土壤有机质含量对根际细菌群落的影响最显著,解释了41.4% 的群落变化;其次是土壤pH和有效磷含量,分别解释了16.3%和9.1% 的群落变化,所有理化因子共解释了80.1% 的群落变化。施用化肥后连作花生根际富集了Leifsonia,Burkholderia和酸杆菌Gp3等,而施用生物有机肥后连作花生根际富集了Rhizobium,Kribbella和Bradyrhizobium等。RDA分析的第一轴解释了63.1%,第二轴解释了14.0%,共解释了77.1% 的群落差异。

|
图 5 根际细菌群落(属水平)与土壤理化性质的冗余分析 Fig. 5 Redundancy analysis of soil bacterial community (genus level) in peanut rhizosphere and soil physicochemical properties |
土壤微生物多样性在维持植物健康的过程中扮演着重要的角色[16]。研究表明,作物长期连作后根际土壤细菌多样性降低,病原菌丰度增加,导致土传病害发生[17]。例如,邓晓等[18]在研究健康和发病(枯萎病)香蕉根际细菌群落时发现,健康香蕉根际细菌多样性显著高于发病香蕉根际细菌多样性。因此,提高植物根际细菌多样性可能是缓解作物连作障碍的关键。本研究中,持续施用生物有机肥显著提高了连作花生根际细菌多样性,而施用化肥时连作花生根际细菌多样性处于较低水平。一方面,施用生物有机肥到连作土壤后,活性Bacillus pumilus繁殖代谢过程中会分泌出大量胞外多糖,有效地改善了土壤团粒结构及化学性质,而土壤良好的团粒结构、适宜的酸碱环境及充足的碳源是提高土壤微生物多样性的关键因素[19]。另一方面,施用的生物有机肥持续缓慢地释放有效养分,为植物不断从土体土壤向根际富集稀有微生物种做出了重要的贡献[20],因而根际微生物种类显著增加,细菌多样性显著提高。Fu等[21]发现,连续3 a施用生物有机肥后香蕉根际细菌多样性和丰富度显著升高。可见,生物有机肥对土壤细菌多样性的提高有显著的促进作用。在针对其他经济作物连作障碍的研究中,例如黄瓜[22]和西瓜[23],结果亦表明施用生物有机肥可以提高根际细菌多样性。本研究中根际细菌多样性与荚果产量呈正相关,较高的细菌多样性保持了微生物群落拥有较高的竞争活性,这样的资源竞争状态将会抑制土传病原菌的活性,限制病原菌在根际定殖和入侵根系[24],稳定了根际有益微生物群落,为作物增收稳产提供了防御策略。总的来说,花生根际细菌多样性及丰富度的增加可能是连作制度下施用生物有机肥后花生实现增产的重要原因。
土壤微生物是土壤生态系统的重要组成部分,在土壤养分循环、有机物形成与分解、植物生长发育与健康方面发挥着重要作用[25]。在连作种植体系下,持续施用生物有机肥后α-变形菌门中的根瘤菌Rhizobium,Bradyrhizobium,Mesorhizobium和放线菌门中的Marmoricola,Mycobacterium,Kribbella等在花生根际显著富集。Badawi等[26]通过接种培养实验发现,Bradyrhizobium可以稳定定殖在花生根际,并产生促进花生生长及提高产量的效应。根瘤菌是植物根际促生细菌中的重要一类,能侵染豆科作物并与之进行共生结瘤固氮,将空气中的氮气转化为自身可以利用的化合态氮[27],施用生物有机肥后花生根际土壤中根瘤菌属相对丰度显著升高,说明施用生物有机肥后花生根系的共生固氮能力增强,这与施用生物有机肥下根瘤数量和荚果产量显著增加结果是一致的(图 1 E)。Trivedi等[28]通过随机森林模型和结构方程模型对澳大利亚24个农田样本点的土壤微生物群落分析发现,放线菌门的相对丰度与土壤对病原菌的抑制作用呈显著正相关。Cha等[29]通过高通量测序揭示了放线菌门可能参与了对草莓枯萎病菌的抑制,并通过分离培养鉴定出部分具有直接拮抗效应的放线菌株,这表明本研究中的Marmoricola,Mycobacterium和Kribbella是潜在的病原微生物拮抗菌,其作用有待于进一步分析验证。本研究中,Gp3,Leifsonia和Burkholderia在施用化肥的连作花生根际显著富集。酸杆菌门中的Gp3是一种嗜酸菌[30],本研究中施用化肥的连作花生根际土壤pH为4.80,在各处理中最低,因此其相对丰度较高。王恒波等[31]发现,Leifsonia xyli sub sp.可以引起甘蔗矮化,Leifsonia在花生根际富集可能是导致施用化肥处理花生的株高显著低于其他处理的主要原因。伯克氏菌(Burkholderia)在连作花生根际富集可能与花生根系释放的酚酸可诱导根际伯克氏菌的增殖有关[32];此外,有研究报道伯克氏菌属下的很多菌种对植物生长具有不利影响[33]。Fu等[21]也报道了施用含有Bacillus spp.生物菌剂的生物有机肥后香蕉根际伯克氏菌属相对丰度下降。本研究中生防菌剂Bacillus pumilus在生物有机肥处理下的花生根际的相对丰度极低,这可能与总细菌丰度过高有关,所以高通量测序下检测到Bacillus pumilus的reads数极少;尽管Bacillus pumilus的相对丰度低,但Bacillus pumilus可能通过微生物种间相互作用激发其他有益微生物在根际富集,如根瘤菌[34]。因此,持续施用生物有机肥后根际促生菌的增加可能是花生产量提高的另一重要原因。
有机物料为土壤微生物的生长繁殖提供了物质来源。杨宇虹等[35]通过微平板法研究发现,施用猪粪有机肥促进了以有机酸为碳源的微生物生长。本研究中,连作花生施用生物有机肥后土壤有机质含量和pH显著升高,与之相对应的是根际细菌群落多样性显著升高,这表明根际细菌群落对有机肥响应敏感,细菌多样性极易受到施肥种类的影响,土壤有机质和pH分别解释了41.4% 和16.3% 的群落变化。可见,连作花生长期施用生物有机肥后土壤有机质含量改善,提高了土壤pH,调节了土壤微生态环境,这为花生根际土壤细菌群落结构的改善、多样性的提高以及有益微生物种群的培育创造了条件。有研究针对5种不同有机质含量的农田黑土通过Biolog法比较其土壤微生物的生态特征发现,不同有机质含量介导的不同微生物群落多样性和丰富度及功能微生物与土壤微生物(细菌、真菌和放线菌等)数量、呼吸强度、代谢能力及代谢产物密切相关[36]。因此,本研究中持续施用生物有机肥下不同功能微生物的代谢特征是如何驱动花生生长发育并提高荚果产量有待于进一步研究与验证。
综上所述,持续施用生物有机肥可以改良南方酸性红壤,改善红壤旱地肥力,优化连作制度下花生根际细菌群落结构,促进了花生根部结瘤固氮,以达到缓解连作障碍的目标。这为突破红壤区花生连作障碍防控技术瓶颈提供了有效稳定的措施,同时也为其他作物连作障碍发生机制研究和防治技术研发提供重要参考。
| [1] |
万书波, 王才斌, 卢俊玲, 等. 连作花生的生育特性研究[J]. 山东农业科学, 2007, 39(2): 32-36 DOI:10.3969/j.issn.1001-4942.2007.02.009 (  0) 0) |
| [2] |
汤松, 禹山林, 廖伯寿, 等. 我国花生产业现状、存在问题及发展对策[J]. 花生学报, 2010, 39(3): 35-38 DOI:10.3969/j.issn.1002-4093.2010.03.008 (  0) 0) |
| [3] |
李孝刚, 张桃林, 王兴祥. 花生连作土壤障碍机制研究进展[J]. 土壤, 2015, 47(2): 266-271 (  0) 0) |
| [4] |
王兴祥, 张桃林, 戴传超. 连作花生土壤障碍原因及消除技术研究进展[J]. 土壤, 2010, 42(4): 505-512 (  0) 0) |
| [5] |
张亚楠, 李孝刚, 王兴祥. 茅苍术间作对连作花生土壤线虫群落的影响[J]. 土壤学报, 2016, 53(6): 1497-1505 (  0) 0) |
| [6] |
姚小东, 李孝刚, 丁昌峰, 等. 连作和轮作模式下花生土壤微生物群落不同微域分布特征[J]. 土壤学报, 2019, 56(4): 975-985 (  0) 0) |
| [7] |
Li R, Shen Z Z, Sun L, et al. Novel soil fumigation method for suppressing cucumber Fusarium wilt disease associated with soil microflora alterations[J]. Applied Soil Ecology, 2016, 101: 28-36 DOI:10.1016/j.apsoil.2016.01.004 (  0) 0) |
| [8] |
张国栋, 展星, 李园园, 等. 有机物料发酵流体和堆肥对苹果连作土壤环境及平邑甜茶幼苗生物量的影响[J]. 生态学报, 2015, 35(11): 3663-3673 (  0) 0) |
| [9] |
朱林, 彭宇, 袁飞, 等. 施用稻草等有机物料对黄瓜连作土壤速效养分的影响[J]. 中国农学通报, 2001, 17(2): 30-32, 36 (  0) 0) |
| [10] |
李孝刚, 王兴祥, 戴传超, 等. 不同施肥措施对连作花生土传病害及产量的影响[J]. 土壤通报, 2014, 45(4): 930-933 (  0) 0) |
| [11] |
刘金光, 李孝刚, 王兴祥. 连续施用有机肥对连作花生根际微生物种群和酶活性的影响[J]. 土壤, 2018, 50(2): 305-311 (  0) 0) |
| [12] |
杨珍, 戴传超, 王兴祥, 等. 作物土传真菌病害发生的根际微生物机制研究进展[J]. 土壤学报, 2019, 56(1): 12-22 (  0) 0) |
| [13] |
王文丽, 李娟, 赵旭. 生物有机肥对连作当归根际土壤细菌群落结构和根腐病的影响[J]. 应用生态学报, 2019, 30(8): 2813-2821 (  0) 0) |
| [14] |
Derakhshani H, Tun H M, Khafipour E. An extended single-index multiplexed 16S rRNA sequencing for microbial community analysis on MiSeq illumina platforms[J]. Journal of Basic Microbiology, 2016, 56(3): 321-326 DOI:10.1002/jobm.201500420 (  0) 0) |
| [15] |
鲁如坤. 土壤农业化学分析方法[M].
中国农业科技出版社, 北京, 2000
(  0) 0) |
| [16] |
Garbeva P, van Veen J A, van Elsas J D. Microbial diversity in soil: Selection microbial populations by plant and soil type and implications for disease suppressiveness[J]. Annual Review of Phytopathology, 2004, 42: 243-270 DOI:10.1146/annurev.phyto.42.012604.135455 (  0) 0) |
| [17] |
Li X G, Ding C F, Zhang T L, et al. Fungal pathogen accumulation at the expense of plant-beneficial fungi as a consequence of consecutive peanut monoculturing[J]. Soil Biology and Biochemistry, 2014, 72: 11-18 DOI:10.1016/j.soilbio.2014.01.019 (  0) 0) |
| [18] |
邓晓, 李勤奋, 武春媛, 等. 健康香蕉(Musa paradisiaca)植株与枯萎病患病植株根区土壤细菌多样性的比较研究[J]. 生态环境学报, 2015, 24(3): 402-408 (  0) 0) |
| [19] |
侯晓杰, 汪景宽, 李世朋. 不同施肥处理与地膜覆盖对土壤微生物群落功能多样性的影响[J]. 生态学报, 2007, 27(2): 655-661 DOI:10.3321/j.issn:1000-0933.2007.02.029 (  0) 0) |
| [20] |
魏巍, 许艳丽, 朱琳, 等. 长期施肥对黑土农田土壤微生物群落的影响[J]. 土壤学报, 2013, 50(2): 372-380 (  0) 0) |
| [21] |
Fu L, Penton C R, Ruan Y Z, et al. Inducing the rhizosphere microbiome by biofertilizer application to suppress banana Fusarium wilt disease[J]. Soil Biology and Biochemistry, 2017, 104: 39-48 DOI:10.1016/j.soilbio.2016.10.008 (  0) 0) |
| [22] |
Qiu M H, Zhang R F, Xue C, et al. Application of bio-organic fertilizer can control Fusarium wilt of cucumber plants by regulating microbial community of rhizosphere soil[J]. Biology and Fertility of Soils, 2012, 48(7): 807-816 DOI:10.1007/s00374-012-0675-4 (  0) 0) |
| [23] |
Ling N, Deng K Y, Song Y, et al. Variation of rhizosphere bacterial community in watermelon continuous mono-cropping soil by long-term application of a novel bioorganic fertilizer[J]. Microbiological Research, 2014, 169(7/8): 570-578 (  0) 0) |
| [24] |
van Elsas J D, Chiurazzi M, Mallon C A, et al. Microbial diversity determines the invasion of soil by a bacterial pathogen[J]. PNAS, 2012, 109(4): 1159-1164 DOI:10.1073/pnas.1109326109 (  0) 0) |
| [25] |
Berendsen R L, Pieterse C M J, Bakker P A H M. The rhizosphere microbiome and plant health[J]. Trends in Plant Science, 2012, 17(8): 478-486 DOI:10.1016/j.tplants.2012.04.001 (  0) 0) |
| [26] |
Badawi F S F, Biomy A M M, Desoky A H. Peanut plant growth and yield as influenced by co-inoculation with Bradyrhizobium and some rhizo-microorganisms under sandy loam soil conditions[J]. Annals of Agricultural Sciences, 2011, 56(1): 17-25 DOI:10.1016/j.aoas.2011.05.005 (  0) 0) |
| [27] |
Zhang W, Wang X X, Yang Z, et al. Physiological mechanisms behind endophytic fungus Phomopsis liquidambari-mediated symbiosis enhancement of peanut in a monocropping system[J]. Plant and Soil, 2017, 416(1/2): 325-342 DOI:10.1007/s11104-017-3219-8 (  0) 0) |
| [28] |
Trivedi P, Delgado-Baquerizo M, Trivedi C, et al. Keystone microbial taxa regulate the invasion of a fungal pathogen in agro-ecosystems[J]. Soil Biology and Biochemistry, 2017, 111: 10-14 DOI:10.1016/j.soilbio.2017.03.013 (  0) 0) |
| [29] |
Cha J Y, Han S, Hong H J, et al. Microbial and biochemical basis of a Fusarium wilt-suppressive soil[J]. The ISME Journal, 2016, 10(1): 119-129 DOI:10.1038/ismej.2015.95 (  0) 0) |
| [30] |
Fan F L, Yu B, Wang B R, et al. Microbial mechanisms of the contrast residue decomposition and priming effect in soils with different organic and chemical fertilization histories[J]. Soil Biology and Biochemistry, 2019, 135: 213-221 DOI:10.1016/j.soilbio.2019.05.001 (  0) 0) |
| [31] |
王恒波, 陈平华, 高三基, 等. 甘蔗宿根矮化病菌实时荧光定量PCR检测方法的建立[J]. 植物病理学报, 2015, 45(3): 232-238 (  0) 0) |
| [32] |
Liu J G, Li X G, Jia Z J, et al. Effect of benzoic acid on soil microbial communities associated with soilborne peanut diseases[J]. Applied Soil Ecology, 2017, 110: 34-42 DOI:10.1016/j.apsoil.2016.11.001 (  0) 0) |
| [33] |
Kumar Trivedi M. An effect of biofield treatment on multidrug-resistant Burkholderia cepacia: A multihost pathogen[J]. Journal of Tropical Diseases, 2015, 3(3): 167-171 (  0) 0) |
| [34] |
Dutta S, Mishra A K, Dileep Kumar B S. Induction of systemic resistance against fusarial wilt in pigeon pea through interaction of plant growth promoting rhizobacteria and rhizobia[J]. Soil Biology and Biochemistry, 2008, 40(2): 452-461 DOI:10.1016/j.soilbio.2007.09.009 (  0) 0) |
| [35] |
杨宇虹, 晋艳, 杨丽萍, 等. 有机肥的不同配置对烤烟生长的影响[J]. 中国农学通报, 2007, 23(2): 290-293 DOI:10.3969/j.issn.1000-6850.2007.02.069 (  0) 0) |
| [36] |
焦晓光, 高崇升, 隋跃宇, 等. 不同有机质含量农田土壤微生物生态特征[J]. 中国农业科学, 2011, 44(18): 3759-3767 DOI:10.3864/j.issn.0578-1752.2011.18.007 (  0) 0) |
2. Co-Innovation Center for Sustainable Forestry in Southern China, College of Biology and the Environment, Nanjing Forestry University, Nanjing 210037, China;
3. University of Chinese Academy of Sciences, Beijing 100049, China
 2021, Vol. 53
2021, Vol. 53


