2. 贵州大学林学院, 贵阳 550025
植物健康的生长发育离不开根际微生物菌群的协同作用,而土壤中微生物菌群也依赖植物根系获取营养物质以维持自身的繁殖和生存。根际微生物的多样性及其丰富度与植物健康密切联系,同时根际微生物是衡量土壤肥力的指标之一[1]。植物生长发育与根际区微生物的关系非常密切,根际区是植物根系与土壤养分、能量交换的场所。大量研究表明,根际微生物菌群多样性和丰富度受植物类型、土壤类型、土壤pH等诸多因素影响[2-3]。即使同一植物的不同基因型和相同作物的不同生长时期,其根际微生物的数量、种类和多样性也呈现动态变化趋势,植物的发育阶段在决定菌群结构方面起着关键作用[4-5]。因此,研究根际微生物对植株生长的影响成为科学家研究的新热点。
猕猴桃是猕猴桃科猕猴桃属藤本落叶果树,其果实细嫩多汁、清香鲜美、酸甜宜人,营养极为丰富,素有“果中珍品”的美誉。猕猴桃产业在农业经济发展中具有重要的地位。因美味猕猴桃为种子繁殖,出苗率高,该品种培育的砧木生长旺盛、抗病性强,具有发达的根系,能够有效吸收土壤中的养分,而且与红阳和东红猕猴桃嫁接亲和力好,嫁接树结果早、产量高[6]。因此,生产上将美味猕猴桃种子繁殖的实生苗作为猕猴桃的砧木,目前该砧木在贵州和四川应用较多。而猕猴桃砧木苗质量的好坏直接影响猕猴桃的产量和品质。因此,培育健壮的猕猴桃砧木,是保障猕猴桃产业健康发展的重要保障。
大量研究证明,土壤中的真菌能分泌植物生长调节剂,如促生激素和挥发性有机化合物,能促进植物生长,部分有益微生物能增强植物的抗病性、保水能力和抗旱耐盐等能力[7]。此外,也有研究者对果蔬类根际微生物展开了相关研究,例如仝利红等[8]、王飞等[9]分别研究了草莓和黑果枸杞作物中土壤群落的多样性和数量,发现微生物数量和多样性与植物不同生育期和根际养分密切相关。因此,研究猕猴桃苗不同生长期与根际土壤真菌群落结构及土壤养分之间的关系,对生产中通过改变土壤微生物菌群结构,从而培育健壮的苗木具有重要意义。目前关于猕猴桃苗不同生长时期根际真菌群落结构变化研究较少。
本研究采用Illumina MiSeq高通量测序技术,对猕猴桃苗不同生长期根际土壤中的真菌群落结构进行分析,探讨猕猴桃苗不同生长期与真菌群落组成及土壤养分之间的相互关系,详尽反映猕猴桃苗生长过程中根际环境的变化,为在实践中改良苗圃地微生物种群和土壤养分结构,培育健壮苗木提供一定的指导。
1 材料与方法 1.1 研究区概况研究区位于贵州省水城县米箩镇俄嘎村猕猴桃产学研基地,地理坐标104°58′01.39″ ~ 26°24′57.81″E,26°24′53″ ~ 26°25′05″N,海拔1 000 ~ 1 200 m,年均日照时数1 560 h,年均有效积温4 500 ℃,年均气温17.8 ℃,土壤类型为壤土,年降水量为1 100 ~ 1 350 mm。
1.2 样地设置及土壤采集猕猴桃种子为贵长猕猴桃(Actinidia chinensis cv. Guichang),猕猴桃育苗圃共3个,作为样地生物学重复,育苗圃规格均为长方形(长×宽=1.5 m × 0.8 m),于2019年3月播种,分别于2019年6月(猕猴桃苗株高7 ~ 8 cm,主茎直径0.1 ~ 0.2 cm)、8月(猕猴桃苗株高16 ~ 17 cm,主茎直径0.5 ~ 0.6 cm)和10月(猕猴桃苗株高19 ~ 20 cm,主茎直径0.6 ~ 0.7 cm)采用随机5点混合取样法,分别采集猕猴桃苗生长前期根际土壤(标记mc1、mc2、mc3)、速生期根际土壤(标记mz1、mz2、mz3)、生长后期根际土壤(标记mh1、mh2、mh3)样品,且从播种到最后一次采样结束均未施用任何肥料。根际土壤取样参考杨美玲等[2] “抖落法”。土壤样品采集完后充分混合装入无菌自封袋,并低温带回实验室分别放在4 ℃和-80 ℃冰箱保存,分别用于土壤养分含量测定和高通量测序。
1.3 土壤理化指标取200 g土壤在35 ℃烘箱烘干后用于以下指标分析:土壤理化指标检测参考鲍士旦主编的《土壤农化分析》。土壤pH在采样时,采用便捷式酸度计测定,土壤速效氮(AN)采用碱解扩散法测定,土壤有效磷(AP)采用NaHCO3浸提-钼锑比色法测定,土壤速效钾(AK)采用醋酸铵浸提-火焰原子光度计法测定,土壤有机碳(SOC)采用重铬酸钾分光光度法测定,每个指标设置3个重复,使用SPSS(Version 18.0)分析软件对土壤理化性质进行单因素方差分析。
1.4 土壤真菌分子测序每个样品总DNA基因组采用CTAB法进行提取,用1% 琼脂糖凝胶电泳检测提取的DNA,每个样品3个重复。以稀释后的DNA为模板,使用高保真酶进行PCR扩增,扩增引物序列分别是:ITS1 F(5′-CTTGGTCATTTAGAGGAAGTAA-3′)和ITS2 R(5′-GCTGCGTTCTTCATCGATGC-3′)。PCR扩增反应体系(20 μl):DNA模板3 μl,5×FastPfu Buffer 4 μl,2.5 mmol/L dNTPs 2 μl, Forward Primer(5 μmol/L) 0.8 μl,Reverse Primer (5 μmol/L)) 0.8 μl,FastPfu Polymerase 0.4 μl,BSA 0.2 μl,ddH2O2 8.8 μl。PCR反应条件:97 ℃ 1 min;95 ℃ 10 s,50 ℃ 30 s,72 ℃ 30 s,35个循环;72 ℃ 4 min。PCR产物使用2% 的琼脂糖凝胶电泳检测,使用Thermo Scientific公司提供的胶回收试剂盒进行回收纯化。经检测合格的PCR产物由上海美吉生物医药科技有限公司用于Illumina MiSeq上机测序。
1.5 生物信息及统计分析使用软件FLASH对MiSeq测序得到的双端序列根据PE reads之间的overlap关系,将成对的reads拼接(merge)成一条序列,同时对reads的质量和merge的效果进行质控过滤,根据序列首尾两端的barcode和引物序列区分样品得到有效序列,即为优化数据。采用Usearch软件平台(vsesion 7.0 http://drive5.com/uparse/)对全部有效序列进行聚类,将达到97% 以上的序列聚类为OTUs,使用RDP classifier (version 2.2 http://sourceforge.net/projects/rdp-classifier/)贝叶斯算法对97% 相似水平的OTU代表序列进行分类,并分别在界(kingdom)、门(Phylum)、纲(Class)、目(Order)、科(Family)、属(Genus)、种(Species)统计各样本的群落物种组成,比对真菌ITS Unit数据库(https://unite.ut.ee/)分类注释土壤真菌物种信息。最后利用Mothur软件分析,计算不同随机抽样下的Alpha多样性指数,通过Alpha多样性分析可以得到群落中物种的丰富度、覆盖度和多样性等。用97% 相似性的样本OUT,基于spearman相关系数,采用R语言分析环境因子与样本群落做RDA和Heatmap相关分析并作图。运用SPSS(Version 18.0)软件进行单因素方差(One-way Anova)和邓肯氏新复极差法(Duncan)做差异显著统计比较分析。测序与信息分析由上海美吉生物医药科技有限公司完成。
2 结果与分析 2.1 猕猴桃苗不同生长期根际土壤理化性质由表 1可知,随着猕猴桃苗根系不断生长,土壤pH、速效氮、有效磷出现先升高后降低趋势,速效钾则随着根系生长呈先降低后升高的趋势。方差分析显示,土壤pH、速效氮和有效磷含量表现为速生期与生长前期和生长后期差异显著(P < 0.05);土壤速效钾则表现为生长前期与速生期和生长后期差异显著;土壤有机碳在猕猴桃生长各时期无显著差异。
|
|
表 1 猕猴桃苗不同生长期根际土壤理化性质 Table 1 Rhizosphere soil physiochemical properties in different growth stages of kiwifruit seedlings |
由图 1可知,当序列数在30 000时所有样品Sobs指数曲线趋于平缓,说明所有样品进入平台期,所有土壤样品能够真实反映不同生长时期的真菌群落信息。从表 2可知,猕猴桃苗3个不同生长期的9个土壤样品共获得215 612条有效序列,平均长度为234.62 bp,以97% 相似水平下对序列进行OTUs聚类,共得到1 776个OUTs,各样品测序覆盖率99% 以上(表 2)。方差分析发现,多样性指数(Shannon)表现为猕猴桃生长前期与速生期和生长后期之间有显著差异(P < 0.05),Chao1丰富度指数和覆盖率在各时期无显著差异(表 2)。分析结果表明,猕猴桃苗在不同生长阶段,根际土壤真菌的丰富程度基本趋于一致,但是多样性有差异,随着猕猴桃苗根系生长,多样性在逐渐减少或趋于平缓。
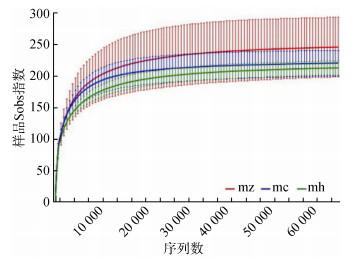
|
图 1 土壤样品稀释曲线图 Fig. 1 Dilution curves for soil samples |
|
|
表 2 样品序列数统计、丰富度及多样性 Table 2 Sequence numbers, richness and diversity indexes of samples |
9个土壤样品共获得1 776个OTUs,分属于10门22纲151科157属。各生长时期门水平上的数量构成均是10个门;在纲水平上数量构成体现为生长初期和速生期一样多,但比生长后期多1个纲;在科和属水平上数量构成均表现为速生期最多,其次是生长初期,数量最少的是生长后期(表 3)。此结果表明,猕猴桃苗生长过程中,土壤中真菌科和属数量出现先升高后降低趋势,在猕猴桃苗速生期真菌OTUs数量高于其他时期,生长后期最少。
|
|
表 3 猕猴桃苗不同生长期土壤真菌门、纲、科、属的数量构成 Table 3 Quantity compositions of soil fungi at phylum, classes, families and genera levels in kiwifruit seedlings at different growth stages |
由表 4可知,在猕猴桃生长初期土壤真菌特有菌属有43个(已分类属有29个,未分类的有14个属,鉴定比例67.44%);速生期特有菌属有59个(已分类属有45个,未分类的有14个属,鉴定比例76.27%);生长后期特有菌属有30个(未分类的有4个属,鉴定比例80%)。此外,猴桃苗各生长时期共有的菌属有170个(未分类的有54属,鉴定比例68.23%),其中被孢霉属Mortierela(15.84%)、枝鼻菌属Cladorrhinum (7.39%)、镰刀菌属Fusarium(7.06%)、球囊菌Plectosphaerella(4.55%)、柱孢属Cylindrocarpon (3.14%) 5个属相对丰度较大,是猕猴桃苗整个生长期共有的核心真菌(表 5)。分析结果表明猕猴桃苗在不同生长期,这些特有和核心菌群与猕猴桃生长发育密切相关。
|
|
表 4 猕猴桃苗不同生长期土壤真菌特有菌属构成 Table 4 Relative abundances of fungal community at phyla level |
|
|
表 5 猕猴桃不同生长期共有菌属组成 Table 5 Common bacterial genuses in different growth stages |
1) 门分类水平。表 6为猕猴桃苗在3个不同生长期根际土壤真菌门分类水平下菌群组成比例及变化规律(相对丰度 < 1% 归为其他)。猕猴桃苗生长期,相对丰度最大是子囊菌门Ascomycota (72.69%),其次为被孢霉门Mortierellomycota (18.80%),罗兹菌门Rozellomycota (6.68%),担子菌门Basidiomycota(4.28%)和球囊菌门Glomeromycota(1.45%)。在门分类水平下,有10.62% ~ 17.13% 的真菌类群依据目前分类学无法划分到任何菌门水平。子囊菌门相对丰度随着猕猴桃根系生长表现先升高后降低趋势,在速生期最高,相对丰度高达72.69%;被孢霉门、罗兹菌门和担子菌门出现先降低后升高,在生长初期相对丰度最高;球囊菌门相对丰度随着猕猴桃根系生长逐渐增加。子囊菌门在各生长期相对丰度差异显著,其他菌门随着猕猴桃根系生长有变化,但差异不显著。
|
|
表 6 门分类水平下的真菌组成 Table 6 Relative abundances of fungal community at phyla level |
分析结果表明,子囊菌门、被孢霉门、罗兹菌门、担子菌门和球囊菌门是猕猴桃苗不同生长期根际土壤微生物组成的核心真菌,其中子囊菌门和被孢霉门占主导地位,根际真菌群落组成变化与不同生长时期密切相关。
2) 科分类水平。表 7为猕猴桃苗在3个不同生长期根际土壤真菌科分类水平下个菌群组成比例及变化规律(相对丰度 < 1% 归为其他)。在猕猴桃苗生长期,根际真菌群落相对丰度较高的是毛球壳科Lasiosphaeriaceae(18.97%),其次为被孢霉科Mortierellaceae(17.32%)、丛赤壳科Nectriaceae(13.20%)、白球菌科Pletctosphaerellaceae(6.42%)。部分菌科在不同生长期出现丰度很低或缺少,例如:粪伞科(Bolbitiaceae)在生长初期出现,在速生期和生长后期相对丰度很低;曲霉科(Aspergillaceae)和圆盘菌科(Orbiliaceae)的真菌群落发速生期出现,在生长初期和生长后期相对丰度很低,将相对丰度低的均归在其他类型。此外有35.52% ~ 26.03% 的真菌类群依据目前分类学研究无法划分到任何菌科水平。
|
|
表 7 科分类水平下的真菌组成 Table 7 Relative abundances of fungal community at family level |
被孢霉科和丛赤壳科相对丰度随着猕猴桃根系生长表现先降低后升高趋势,在生长后期丰度最高;毛球壳科、白球菌科、毛壳菌科出现先升高后降低,在速生期丰度最高;葡萄穗霉科相对丰度随着猕猴桃根系生长表现逐渐降低。在各生长时期,土壤样品间的相对丰度有粪伞科、曲霉科和亚隔孢壳科存在显著差异,其他菌群差异不显著。已有报道,毛壳菌可作为生防菌防控由丝核菌、镰刀菌引起的松苗猝倒病,还可防控由Venturiain aequalis致病菌引起的苹果黑星病[10]。本研究发现毛壳菌在猕猴桃苗速生期最高,因此推测该菌可能在猕猴桃速生期对促进猕猴桃苗健康生长具有积极作用。
分析结果表明,猕猴桃苗在整个生育期的真菌具有相似性,被孢霉科、毛球壳科、丛赤壳科、白球菌科是猕猴桃苗生长期的优势菌科。
3) 属分类水平。表 8为猕猴桃苗在3个不同生长期根际土壤真菌属分类水平下各菌群组成比例及变化规律(相对丰度 < 1% 归为其他)。在猕猴桃苗不同生长期,根际土壤相对丰度最大是被孢霉属Mortierella (18.63%),其次是枝鼻菌属Cladorrhinum (16.65%)、镰刀菌属Fusarium (8.02%)。有42.19% ~ 28.75% 的真菌类群依据目前分类学研究无法划分到任何菌属水平。
|
|
表 8 属分类水平下真菌组成 Table 8 Relative abundances of fungal community at genus level |
被孢霉属和镰刀菌属相对丰度随着猕猴桃根系生长表现先降低后升高,在生长后期最高,枝鼻菌属(Cladorrhinum)相对丰度则表现先升高后降低,速生期达最高。大部分菌属在不同生长期出现丰度较低,例如:枝鼻菌属(Cladorrhinum)、锥盖伞属(Conocybe)和茎点霉属(Phoma)相对丰度在生长前期比速生期和生长后期高;节丛孢属(Arthrobotrys)和青霉属(Penicillium)相对丰度在速生期比生长初期和生长后期高;环腺菌属Periglandula、镰刀菌属Fusicolla和瓶霉菌属(Phialophora)的相对丰度在生长后期比生长初期和速生期高。还有部分菌属是猕猴桃不同生长时期的特有菌属(表 4)。
分析结果表明,在属分类水平上,不同生长时期的土壤真菌群落组成差异主要体现在被孢霉属、枝鼻菌属和镰刀菌属,他们是猕猴桃苗不同生长期土壤微生物组成的核心真菌,且占主导地位,根际菌群组成和比例与不同生长时期密切相关。
2.3 真菌优势群落与土壤特性的关联分析通过RDA分析得知,第一、二轴分别解释了51.53% 和11.74%,累计解释率达到63.27%(图 2),说明第一、二轴能很好地反映出猕猴桃苗生长期优势真菌群落组成与土壤环境因子之间的相关性。其中具有优势的子囊菌门与有效磷、速效氮、pH箭头方向相同,呈正相关,与有机碳、速效钾方向相反,呈负相关;被孢霉门、担子菌门与有机碳、速效钾相同,呈正相关,与有效磷、速效氮、pH呈负相关(图 2)。RDA分析结果表明,土壤中速效养分含量与猕猴桃苗不同生长期真菌变化具有相关性。
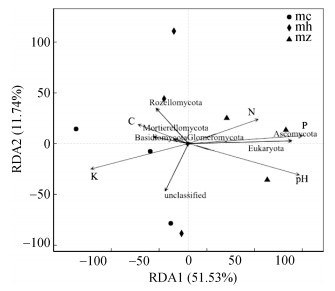
|
图 2 真菌优势类群与土壤环境因子的RDA分析 Fig. 2 Redundancy analysis of fungal dominant groups and soil environmental factors |
进一步通过spearman相关性系数评估土壤中优势真菌与土壤理化性质的相关性,将总丰度前12个物种通过相关性表更详细和直观展示真菌群落与土壤理化性质的关系。从表 9可知,子囊菌门与有效磷含量呈极显著正相关(spearman相关系数r=0.80,P=0.009);与pH呈显著正相关(r = 0.76,P = 0.017),与速效钾呈极显著负相关(r =-0.80,P=0.009);与速效氮呈正相关(r = 0.18,P=0.65),与有机碳负相关(r = -0.25,P=0.52),但相关性不显著。壶菌门与有机碳呈显著负相关(r=-0.72,P=0.029),与其他速效养分相关性不显著。此外,还有大部分菌门与速效养分有相关性,但相关性均不显著,例如被孢霉门与有机碳(r=0.6,P=0.087)和速效钾(r=0.47,P=0.2)呈正相关,与速效氮(r= -0.15,P=0.69)、有效磷(r= -0.35,P=0.35)和pH(r= -0.27,P=0.47)呈负相关。担子菌门、罗兹菌门、球囊菌门等与速效养分无显著相关性(图 2、表 9)。
|
|
表 9 真菌优势类群与土壤环境因子的相关性 Table 9 Correlation of fungal dominant groups and soil environmental factors |
以上分析结果表明,猕猴桃苗不同生长时期,土壤中不同真菌类群与土壤养分含量的相互关系存在差异,其中土壤有效磷和速效钾含量是影响子囊菌门群落组成的主导因子。
3 讨论 3.1 根际土壤养分变化分析由表 2可知,根际速效氮和有效磷在速生期最高,过了速生期又下降;速效钾则随着根系的生长先降低后升高,有机碳几乎不变。出现这种养分变化可能是根际土壤微生物具有对土壤氮、磷循环影响的结果。氮和磷是植物生长两大必需元素,有研究发现微生物通过氮矿化、硝化、反硝化等氮循环过程,在短期会增加土壤有效氮含量[11-12]。例如丛枝菌根真菌能够改变土壤微生物,进而影响土壤氮矿化,增加土壤有效氮库存[13]。此外,土壤中的很多真菌具有分解植物残体和有机质中的磷的作用,通过分泌磷酸酶,将有机磷水解为磷酸根和其他无机磷转化为有效磷,增加土壤磷的供应[14],还有研究认为,丛枝菌根还能为植物贡献高达90% 的磷[15-16]。由此可知,土壤真菌在土壤为植物提供养分过程中起着重要作用。本研究在速生期速效氮和有效磷含量增加,可能是在速生期含有相对丰富的丛枝菌根真菌或其他能快速分解有机质的真菌,这些真菌通过土壤氮循环和土壤磷循环过程,进而改变土壤根际环境,以满足猕猴桃苗速生期营养需求。这一推测与子囊菌和球囊菌(丛枝菌根真菌归属于球囊菌门)在速生期丰度较高相呼应。因此,生产上可通过间接调控土壤微生物的功能达到调控土壤养分的目的。
3.2 根际土壤真菌群落组成及多样性分析用土壤微生物生物量、多样性、微生态平衡等指标来评价土壤的质量和健康程度已被人们认可。Illumina MiSeq高通量测序技术作为新一代测序手段,能够系统全面地测定和分析土壤微生物的群落结构特征,常用Chao1指数和Shannon指数来评价群落丰度和群落多样性,其指数值越高,说明该区域的群落丰度和多样性高,目前已在农业微生物领域得以迅速应用[17]。本研究通过Illumina MiSeq高通量测序研究3个不同生长时期猕猴桃苗根际土壤中真菌群落结构变化,发现子囊菌门随着猕猴桃根系生长表现先升高后降低,在速生期子囊菌门的比例最高达72.69%。这一点与仝利红等[8]监测结果基本一致,仝利红等研究草莓不同生育期根际微生物的动态变化,发现真菌相对丰度最高的是子囊菌门,且优势菌群的丰富度和多样性在花期上升,生长后期又下降,主要菌群相对丰度也随着生育期的变化而变化。与康捷等[18]研究麻山药不同生长时期主要真菌种类和相对丰度比较既有相似部分,也有差异部分,相似部分:镰刀菌属和被孢霉属都是麻山药和猕猴桃苗共有的主要真菌属;差异部分是不同生长时期,主要真菌属其变化趋势存在差异,例如:被孢霉属在麻山药生长过程中相对丰度逐渐增加,而在猕猴桃苗生长过程中被孢霉属在速生期最低,到生长后期又开始增加到生长初期的水平,镰刀菌属在麻山药生长后期相对丰度最低,而在猕猴桃生长后期刚好相反。出现这种异同的可能原因是根际土壤菌群组成和优势菌属具有植物特异性,不同的根际菌群与植物种类、不同发育阶段、土壤理化性质等很多因素有关,但植物的发育阶段在决定菌群结构方面可能起着重要作用,这一结论与赵柏霞等[19]、Schüβler等[20]研究结果一致。
丛枝菌根真菌(AMF)与植物根系可形成菌根共生体,促进植物生长。AMF能够明显促进土壤中速效养分的吸收和利用。2001年,德国科学家把AMF的分类提升至门,并把AMF命名为球囊菌门[20]。我们研究发现,在猕猴桃苗生长过程,球囊菌门相对丰度逐渐增加,这一趋势变化与杨凤铃等[21]研究烟草栽培过程中AMF变化基本一致,但是与烟草根际速效氮、有效磷和pH变化有差异;与巩晓芳等[5]研究当归不同生长时期AMF以及有效磷、速效氮、速效钾等土壤养分的变化趋势也有差异。有资料表明球囊菌的代谢物球囊霉素不仅具有重要的碳汇功能,还具有改善土壤质地和提高土壤全氮和其他养分含量的作用[22]。由此推测,在猕猴桃生长过程中,检测到的球囊菌作为丛枝菌根真菌,可促进猕猴桃根系对养分吸收和利用来帮助猕猴桃苗的生长,球囊菌可能在猕猴桃苗生长过程中具有积极的促进作用。
本研究发现猕猴桃苗不同生长时期,土壤中真菌Shannon指数之间有显著差异,但Chao1丰富度指数无显著差异,根际土壤真菌科、属、总OTUs和特有菌属数量在速生期均最高,生长后期最低(表 2和表 4)。表明猕猴桃苗在速生期根际生理代谢活动最强,根系产生的代谢物可能仅有利于某些特定菌群的生长而成为优势菌群,而这些菌群可能具有竞争优势并大量繁殖,所以出现速生期数量增加,另一些菌群则在竞争中被抑制或降低,与本试验中丰度指数不变、多样性指数有差异相呼应。早在1954年,Martin等[23]研究发现燕麦种子被球毛壳菌侵染后,会使燕麦根际土壤中镰刀菌相对含量降低或受到抑制,而被球毛壳菌数量增加。本研究中被孢霉属相对丰度增加,镰刀菌属相对丰度也随着增加(表 8),这点与Martin等[23]测定结果有差异。出现这种差异的可能原因是被孢霉属和镰刀菌属其包含的种类太多,由于本研究未检测到种,大部分只比对到属,可能存在种与种之间较大的功能差异,所以导致结果差异。例如,Zhang等[24]报道,发现非致病尖刀镰刀菌(Fusarium.oxysporum)在棉花根部产生的烯烃类、烷类、酯类、有机酸等多种挥发性物质,这些挥发性物质具有广谱的抗真菌活性,对很多致病菌如黄曲霉菌(Aspergillus flavus)、灰葡萄孢菌(Botrytis cinerea)、禾谷镰孢菌(Fusarium graminearum)、意大利青霉(Penicillium italicum)、立枯丝核菌(Rhizoctonia solani)等14种真菌具有一定杀菌功能和抗菌活性。另一种尖刀镰刀菌能引起植物苗期猝倒病,由此可知,镰刀菌属不同种之间的功能差异较大。本研究虽然检测到了相对丰度较高的镰刀菌,但只是在属的水平进行比较,本研究中监测的镰刀菌是否存在与Zhang报道尖刀镰刀菌是相同的种,有待考证。此外还有另外一种观点认为,土壤中镰刀菌和丝核菌含量增加是土壤恶化、作物连作障碍的指示真菌[25]。本试验地块由于是第一年培育猕猴桃苗,镰刀菌属在生长后期相对含量较高,是否表明该试验地土壤环境发生恶化,是否与后期连作障碍有关,需在后续试验中继续检测。
本研究还发现,在猕猴桃不同的生长发育期,根际土壤中均出现一些特有属,例如:根生壶菌属(Rhizophydium)、暗球腔菌属(Phaeosphaeria)等44种菌属是生长初期特有菌属;球腔菌属(Mycosphaerella)、枝霉属(Rhinocladiella)等60种是速生期特有菌属;拟青霉属(Paecilomyces)、黑耳属(Exidia)等30种是生长后期特有菌属。这些种属在猕猴桃的生长发育过程中的功能未知。结合猕猴桃苗不同生长期对温度、湿度、土壤养分等环境的要求,以及根系自身的代谢活动强弱,推测这些特定菌属的功能可能存在着一个复杂的调控机制。然而根际土壤真菌群落结构复杂,植物种类、植物生长发育、土壤环境因子都是影响根际真菌群落结构的主要因子[17, 26],这些因子通过什么途径调控植物生长,以及其影响程度等仍然不清楚,后续研究可从这些特有菌群和主要菌群着手,探究猕猴桃苗不同生长时期这些特有菌属在猕猴桃根际中的功能,可通过研发土壤微生物菌剂的措施,改变土壤微生物菌群的结构,使其通过真菌与真菌之间的相互作用,达到抑制有害菌的生长,增加有益菌繁殖,为后续培育健康的猕猴桃苗木提供一定的参考。
3.3 根际真菌群落与土壤养分关系分析土壤酸碱性、速效氮、有效磷、速效钾、有机碳等均属于土壤养分的基本组成成分,可以反映出土壤的肥力状况,它们对土壤中微生物的繁殖、生存和植物的生长具有显著影响。土壤真菌群落与土壤理化因子的相关性表明,猕猴桃苗不同生长时期有效磷和土壤pH与子囊菌显著正相关,速效钾与子囊菌显著负相关,但与其他菌群相关性不显著。说明有效磷、速效钾、pH是影响子囊菌门物种组成和丰度的主要因子,在偏酸性土壤中子囊菌容易富集和繁殖。该研究结果与赵帆等[27]研究草莓根际菌群结构与土壤养分有差异,如在草莓根际土壤中,子囊菌门与速效氮含量呈显著负相关,与速效钾、有效磷及pH呈极显著负相关。有研究指出,速效氮含量增加会抑制真菌、细菌及放线菌的生长,高含量的有效磷可造成土壤养分比例失衡,细菌数目急剧下降,进而影响真菌群落组成[28]。由此可知,土壤中速效养分过高或养分比例不当均会对土壤微生物菌群组成存在不利影响。本研究中有效磷和子囊菌在速生期丰度均较高,可能是土壤中的子囊菌门中包含丰度较高的具有分解植物残体和有机质中的磷的作用的真菌,这些真菌通过分泌磷酸酶,将有机磷水解为磷酸根和其他无机磷转化为有效磷,增加土壤磷的供应,这一推论与本研究中有效磷和子囊菌显著的正相关相呼应。钾是植物生长必需的营养元素,在土壤中可被植物直接吸收和利用,能够影响植物根际群落结构[29]。周玉杰等[29]认为土壤养分含量,尤其是速效钾含量是橡胶林土壤真菌多样性的重要影响因素,表明钾元素与土壤微生物生态特征和土壤理化性质关系密切。综上,通过对猕猴桃根际真菌群落与土壤理化因子的相关分析,结果表明,猕猴桃根际土壤真菌群落结构和组成(尤其时是囊菌门)变化,受土壤pH、有效磷、速效钾的影响尤为显著。
4 结论猕猴桃苗不同生长期(生长前期、速生期、生长后期)土壤性质存在显著差异,各生长时期Shannon指数显著差异。序列分析发现,子囊菌门(丰度72.69%)、被孢霉门(18.80%)、罗兹菌门(6.68%)、担子菌门(4.28%)和球囊菌门(1.45%)是猕猴桃苗不同生长期的优势菌门。结合其他优势菌群在不同生长时期的明显变化,可以看出,猕猴桃苗不同时期根际土壤真菌群落结构和组成以及所占的比例各不相同,与作物生长时期和植物类型有关。根际土壤真菌群落结构和组成(尤其是子囊菌门)变化受土壤pH、有效磷、速效钾的影响尤为显著,优势菌群和特有菌属在猕猴桃生长期发挥特殊作用。该研究反映了猕猴桃苗生长过程中根际环境的变化,为在实践中改良苗圃地微生物种群和土壤养分以及培育健壮苗木提供一定的指导。
| [1] |
杨珍, 戴传超, 王兴祥, 等. 作物土传真菌病害发生的根际微生物机制研究进展[J]. 土壤学报, 2019, 56(1): 12-22 (  0) 0) |
| [2] |
杨美玲, 张霞, 王绍明, 等. 基于高通量测序的裕民红花根际土壤细菌群落特征分析[J]. 微生物学通报, 2018, 45(11): 2429-2438 (  0) 0) |
| [3] |
王兵爽, 李淑君, 张舒桓, 等. 西瓜根系分泌酸性磷酸酶对有机肥营养的响应[J]. 土壤学报, 2019, 56(2): 454-465 (  0) 0) |
| [4] |
Lauber C L, Hamady M, Knight R, et al. Pyrosequencing-based assessment of soil pH as a predictor of soil bacterial community structure at the continental scale[J]. Applied and Environmental Microbiology, 2009, 75(15): 5111-5120 DOI:10.1128/AEM.00335-09 (  0) 0) |
| [5] |
巩晓芳, 祝英, 彭轶楠, 等. 当归不同生长时期根际丛枝真菌分布及土壤养分和酶活性的动态变化[J]. 微生物学通报, 2017, 44(11): 2596-2605 (  0) 0) |
| [6] |
陈锦永, 方金豹, 齐秀娟, 等. 猕猴桃砧木研究进展[J]. 果树学报, 2015, 32(5): 959-968 (  0) 0) |
| [7] |
Bais H P, Weir T L, Perry L G, et al. The role of root exudates in rhizosphere interactions with plants and other organisms[J]. Annual Review of Plant Biology, 2006, 57: 233-266 DOI:10.1146/annurev.arplant.57.032905.105159 (  0) 0) |
| [8] |
仝利红, 高洁, 靳永胜. 草莓不同生育期根际微生物的动态变化[J]. 北京农学院学报, 2019, 34(4): 10-15 (  0) 0) |
| [9] |
王飞, 杨晓东, 李岩. 不同生长季节黑果枸杞的根际细菌群落结构[J]. 微生物学报, 2019, 59(3): 533-545 (  0) 0) |
| [10] |
Cullen D, Andrews J H. Evidence for the role of antibiosis in the antagonism of Chaetomium globosum to the apple scab pathogen, Venturia inaequalis[J]. Canadian Journal of Botany, 1984, 62(9): 1819-1823 DOI:10.1139/b84-246 (  0) 0) |
| [11] |
Nanang Z, 程谊, 张金波. 不同利用方式红壤反硝化势和气态产物排放特征[J]. 土壤, 2020, 52(2): 348-355 (  0) 0) |
| [12] |
Unkovich M, Jamieson N, Monaghan R, et al. Nitrogen mineralisation and plant nitrogen acquisition in a nitrogen-limited calcareous grassland[J]. Environmental and Experimental Botany, 1998, 40(3): 209-219 DOI:10.1016/S0098-8472(98)00038-0 (  0) 0) |
| [13] |
Nuccio E E, Hodge A, Pett-Ridge J, et al. An arbuscular mycorrhizal fungus significantly modifies the soil bacterial community and nitrogen cycling during litter decomposition[J]. Environmental Microbiology, 2013, 15(6): 1870-1881 DOI:10.1111/1462-2920.12081 (  0) 0) |
| [14] |
沈仁芳, 赵学强. 土壤微生物在植物获得养分中的作用[J]. 生态学报, 2015, 35(20): 6584-6591 (  0) 0) |
| [15] |
van der Heijden M G A, Streitwolf-Engel R, Riedl R, et al. The mycorrhizal contribution to plant productivity, plant nutrition and soil structure in experimental grassland[J]. The New Phytologist, 2006, 172(4): 739-752 DOI:10.1111/j.1469-8137.2006.01862.x (  0) 0) |
| [16] |
李婠婠, 滕艳敏, 李季. 不同温室蔬菜种植模式下土壤磷素形态分布与转化[J]. 土壤, 2020, 52(2): 271-278 (  0) 0) |
| [17] |
Konstantinidis K T, Tiedje J M. Genomic insights that advance the species definition for prokaryotes[J]. PNAS, 2005, 102(7): 2567-2572 DOI:10.1073/pnas.0409727102 (  0) 0) |
| [18] |
康捷, 章淑艳, 韩韬, 等. 麻山药不同生长时期根际土壤微生物多样性及群落结构特征[J]. 生物技术通报, 2019, 35(9): 99-106 (  0) 0) |
| [19] |
赵柏霞, 潘凤荣, 韩晓日. 基于高通量测序技术的樱桃根际细菌群落研究[J]. 土壤通报, 2018, 49(3): 596-601 (  0) 0) |
| [20] |
Schüβler A, Schwarzott D, Walker C. A new fungal Phylum, the Glomeromycota: Phylogeny and evolution[J]. Mycological Research, 2001, 105(12): 1413-1421 DOI:10.1017/S0953756201005196 (  0) 0) |
| [21] |
杨凤铃, 赵方贵, 刘洪庆, 等. 不同烟草栽培地区土壤理化性质与AM真菌分布关系[J]. 中国农学通报, 2011, 27(1): 116-120 (  0) 0) |
| [22] |
郭良栋, 田春杰. 菌根真菌的碳氮循环功能研究进展[J]. 微生物学通报, 2013, 40(1): 158-171 (  0) 0) |
| [23] |
Martin T, Moore M B. Isolate of Chaetomium that protect oats from Helm in thosporium victoriae[J]. Phytopathology, 1954, 44(1): 686-689 (  0) 0) |
| [24] |
Zhang Q H, Yang L, Zhang J, et al. Production of anti-fungal volatiles by non-pathogenic Fusarium oxysporum and its efficacy in suppression of Verticillium wilt of cotton[J]. Plant and Soil, 2015, 392(1/2): 101-114 (  0) 0) |
| [25] |
Elad Y, Chet I, Henis Y. Biological control of Rhizoctonia solani in strawberry fields by By harzianum[J]. Plant and Soil, 1981, 60(2): 245-254 DOI:10.1007/BF02374109 (  0) 0) |
| [26] |
Marschner P, Yang C H, Lieberei R, et al. Soil and plant specific effects on bacterial community composition in the rhizosphere[J]. Soil Biology and Biochemistry, 2001, 33(11): 1437-1445 DOI:10.1016/S0038-0717(01)00052-9 (  0) 0) |
| [27] |
赵帆, 赵密珍, 王钰, 等. 基于高通量测序研究草莓根际微生物群落结构和多样性[J]. 土壤, 2019, 51(1): 51-60 (  0) 0) |
| [28] |
黎宁, 李华兴, 朱凤娇, 等. 菜园土壤微生物生态特征与土壤理化性质的关系[J]. 应用生态学报, 2006, 17(2): 285-290 DOI:10.3321/j.issn:1001-9332.2006.02.025 (  0) 0) |
| [29] |
周玉杰, 李建华, 张广宇, 等. 基于高通量测序的橡胶林土壤真菌多样性及群落组成分析[J]. 南方农业学报, 2018, 49(9): 1729-1735 DOI:10.3969/j.issn.2095-1191.2018.09.07 (  0) 0) |
2. College of Forestry, Guizhou University, Guiyang 550025, China
 2021, Vol. 53
2021, Vol. 53


