2. 中国科学院大学, 北京 100049;
3. 江苏开放大学, 南京 210036;
4. 云南省烟草农业科学研究院, 昆明 650021;
5. 红塔烟草(集团)有限责任公司, 云南玉溪 653100
施肥是农业生产主要的措施之一,对土壤质量和可持续利用具有深远影响,长期施肥可改变土壤理化性质和生物活性,影响作物产量[1]。微生物是土壤生物中最重要的组成部分,对环境变化十分敏感,是土壤环境质量的重要指标[2]。近年来,国内外展开了诸多卓有成效的研究,主要集中于不同肥料处理如有机肥、有机无机肥配合施用对土壤肥力以及土壤微生物区系等方面的影响。有研究表明施用化肥可以增加30% ~ 50% 的粮食作物产量[3],但是长期大量和过量施用化肥会引起土壤酸化板结、供肥能力下降等问题[4-5]。与仅使用化肥相比,有机肥料、化肥和有机肥料配合施用有利于土壤团粒结构的形成,增加土壤透气性,增强保水保肥能力,协调水、气、热交换,促进土壤养分转化,从而刺激微生物的生长[6-7]。有机肥施入土壤后,除了引起土壤微环境的变化外,同时又引入了一些外源微生物,打破了土著微生物动态平衡,最终造成整个土壤微生物区系的变化[8]。因此,有机肥、有机肥与化肥的配合施用可以调控土壤微生物区系,是提升土壤质量和微生物多样性的重要途径。
烟草是我国重要的经济作物,我国烟草种植面积和烟叶产量均居世界首位[9]。云南玉溪地处西南边陲,长期种植烟草,大多数烟区植烟历史超过百年,由于长期连作以及化学品(农药、除草剂)的大量投入,部分地区植烟土壤质量下降明显,已成为当地烟叶生产的主要障碍因子,制约烟叶产业的可持续发展。针对不同施肥措施对植烟土壤微生物的影响,有研究表明施用腐熟芝麻饼肥、腐殖酸或氨基酸可以明显增加烟田土壤根际细菌和放线菌的数量,对土壤真菌的数量影响较小[10]。郭红祥等[11]研究发现,施用菜籽饼和花生饼后烟田土壤中细菌、放线菌、好气性纤维分解菌和亚硝化细菌数量上升。张晓海等[12]研究表明,施用菜籽饼不仅增加了烤烟根际土壤的细菌数量,而且显著提高了烟草生育中后期根际解磷细菌和解钾细菌的生物量。施用有机肥可以有效提高土壤中有益微生物的数量,降低或者控制土壤中病原微生物的数量,促进土壤微生物区系逐步向健康的状态转变,例如李想等[13-14]研究发现施用L-25生物有机肥后,烟苗根际土壤中病原菌的数量从107 cfu/g下降至106 cfu/g,烟草根系表面形成“微生物生物防御层”,从而防止或减少病原菌的侵入。上述研究主要集中于施用有机肥对植烟土壤微生物数量的影响,对于土壤微生物多样性及功能变化的研究相对较少;此外,无机肥、有机肥和有机无机肥配合施用对土壤微生物群落结构、多样性及其功能的影响和差异也尚不明确。
目前,对植烟土壤响应施肥处理的研究主要集中在微生物群落组成和多样性,在功能层面上对微生物群落进行描述可以更深入地探讨施肥产生的影响。FAPROTAX是一个进行细菌功能比对的数据库,不仅可对细菌进行具体的功能预测,还能对执行相关功能的菌群进行鉴定分类。FAPROTAX在细菌群落研究中得到了较为广泛的应用[15-16]。因此,本研究以云南玉溪种植烟草的土壤为研究对象,联合使用定量PCR、高通量测序技术和FAPROTAX软件,分析不同肥料处理对盆栽植烟土壤理化性质和微生物群落结构、数量和功能的差异,探究各处理对土壤质量的影响,以期为烟叶种植的合理施肥和烟草生产的可持续发展提供科学依据。
1 材料与方法 1.1 温室盆栽试验概况供试土壤采自云南省玉溪市峨山县岔河乡河外村典型烟田,质地为紫色土,土壤的基本理化性质:pH 6.32,全氮1.87 g/kg,全磷1.22 g/kg,有效磷22.73 mg/kg,速效钾117.96 mg/kg。耕层土壤经风干过0.50 mm筛后装入试验盆钵内,每盆装25 kg风干土。
盆栽试验起始于2015年,采用春季种烟-冬季休闲的种植模式。设3种施肥处理,分别为:无机肥(WJ)、有机肥(YJ)和有机无机肥(YW),每种处理3次重复。其中WJ处理,基肥为烟草专用复混肥,追肥为烟草专用氮钾肥;YJ处理中,基肥为有机肥,追肥为有机水溶肥;YW处理中,基肥为烟草专用有机无机肥,追肥为有机无机氮钾肥。分别在移栽后7 ~ 10、14 ~ 17、21 ~ 28 d追肥,3个时期追肥量的比例为1:3:4。肥料养分含量比例及施肥量见表 1,其中有机肥和烟草专用有机无机肥是以发酵腐熟的油枯及生化黄腐酸钾制备。
|
|
表 1 试验用肥料养分含量及其施肥量 Table 1 Nutrient contents and application rates of fertilizers in greenhouse experiment |
2017年5月11日移栽烟苗,8月下旬试验结束,温室管理参照常规大田管理。
1.2 试验样品采集于2017年7月25日烟草成熟期采集土壤样品。每盆多点取样混合作为1个耕层土壤样品,充分混匀。所有样品去除植物根系后风干过2 mm筛混匀,一部分风干后用于土壤理化性质的测定,另一部分置于-80 ℃冰箱,用于土壤DNA提取。
1.3 测定项目与方法 1.3.1 土壤理化性质测定土壤pH按土水比1:2.5(质量体积比)充分混合后用pH计测定;土壤铵态氮(NH4+-N)采用纳氏试剂比色法测定,硝态氮(NO3--N)采用紫外分光光度法测定;有效磷(AP)采用0.50 mol/L碳酸氢钠浸提,钼锑抗比色法测定;全钾(TK)、速效钾(AK)和缓效钾(SLK)分别用NaOH熔融、1 mol/L乙酸铵浸提、1 mol/L热硝酸浸提,原子吸收分光光度法测定;有机质(OM)采用重铬酸钾容量法测定。具体方法参考鲁如坤[17]。
1.3.2 土壤DNA提取及实时荧光定量PCR称取约0.5 g新鲜土壤,土壤总DNA使用Fast DNA Spin Kit for Soil(MP Biomedicals, Santa Ana, CA, USA)试剂盒提取,同时用核酸定量仪(NanoDrop ND-1000)检测提取DNA的浓度和纯度,提取完成后,于-20 ℃冰箱保存备用。
采用实时荧光定量PCR法测定细菌16S rRNA基因丰度,采用引物338F(5’-ACTCCTA CGGGAGGCAGCAG-3’)和806R(5’-GGACTACHV GGGTWTCTAAT-3’)扩增细菌16S rRNA基因。测定标准质粒(内参)浓度并进行梯度稀释制备标准曲线,用Bio-Rad CFX96荧光定量PCR仪(Bio-Rad,CA,USA)进行测定,根据标准曲线中的基因拷贝数和Ct值计算样品中的基因拷贝数。反应体系为:SYBR® Premix Ex Taq Ⅱ(ThiRNaseH Plus)10 μl,上下游引物(10 μmol/L)各0.20 μl,DNA模板2.0 μl,ddH2O 7.6 μl。16S rRNA反应条件为:95 ℃ 3 min;95 ℃ 20 s,56 ℃ 45 s,72 ℃ 30 s,共34个循环。退火延伸时检测荧光信号。
1.3.3 高通量测序分析高通量测序委托北京诺禾致源生物公司进行,具体方法如下:①采用CTAB或SDS方法提取DNA,之后利用琼脂糖凝胶电泳法检测DNA的纯度和浓度,无菌水稀释样本至1 ng/μl;②以稀释后的DNA为模板,利用通用引物515F-806R对细菌16S rRNA基因的V4区进行扩增,在515F的前端插入barcode序列以区分各样本。PCR反应体系为30 µl,反应条件为:98 ℃ 1 min,30次循环(98 ℃ 10 s,50 ℃ 30 s,72 ℃ 30 s),72 ℃ 5 min。PCR产物使用2% 浓度的琼脂糖凝胶进行电泳检测,据其浓度进行等量混样,充分混匀后使用GeneJET™ PCR Purification kit试剂盒(Thermo Scientific,USA)对PCR产物进行纯化;③使用Ion Plus Fragment Library Kit 48 rxns试剂盒(Thermo Fisher,MA,USA)进行文库构建,构建好的文库经过Qubit定量和文库检测合格后,利用IonS5TMXL测序仪(Thermo Fisher,MA,USA)上机测序。
1.4 数据处理与分析土壤理化性质、细菌16S rRNA基因拷贝数的多重比较、方差分析和相关性分析用SPSS 24.0软件完成,相关性分析采用Pearson双尾检验,平均值多重比较采用Duncan检验法进行显著性检验(统计水准均为P < 0.05),并采用Origin 8.6和Adobe Illustrator CC 2019软件进行绘图。
使用QIIME 1.9.1按以下步骤进行高通量测序数据处理分析:①切除引物和低质量序列并根据barcode序列区分各样本数据;②基于SILVA[18]数据库去除嵌合体;③得到的高质量序列以97% 相似度聚类成为OTUs(operational taxonomic units,操作分类单元);④进行物种注释(设定阈值为0.8 ~ 1),将未注释到门水平及注释为古菌的序列删除后,所有样品随机抽取52 000条序列进行后续分析。计算细菌Chao1、Shannon、Simpson、ACE指数,使用R3.6.1软件agricolae包的Tukey检验和wilcox检验进行组间差异分析,基于Bray-Curtis、Weighted UniFrac、Unweighted UniFrac距离的主坐标分析(PCoA)使用WGCNA、stats和ggplot2包,Mantel test、ANOSIM分析和典范对应分析均使用vegan包进行,Pearson相关性分析采用psych和pheatmap包完成相关系数值的显著性检验及函数可视化,功能预测使用FAPROTAX软件进行。
2 结果与讨论 2.1 不同施肥处理对植烟土壤化学性质的影响经过连续3 a的施肥,与2015年本底土和YW处理相比,WJ和YJ处理均明显降低了土壤pH,WJ处理的土壤pH降低幅度最大,其次为YJ处理(表 2)。与WJ处理相比,YJ处理土壤中的铵态氮、速效钾和缓效钾含量显著较低,有机质含量显著较高;而YW处理除铵态氮含量显著较低外,其他养分含量与WJ处理无显著差异。
|
|
表 2 不同施肥处理下土壤主要化学性质 Table 2 Main soil chemical properties under different fertilization treatments |
YJ处理有机质含量的显著增加,可能是因为本试验中的有机肥是以发酵腐熟后的油枯及黄腐酸钾作为有机原料制备的,其中相当部分的有机物质分解缓慢,施用后导致土壤有机质积累,库存较高;此外,黄腐酸钾和油枯中含有小分子有机酸,可能促进烟株根系生长并影响微生物活动:分泌更多根系分泌物提高外源有机碳输入量[19-20]、微生物活动的增强导致土壤微生物量碳增加,从而提升根围土壤有机质含量[21]。YJ处理铵态氮、速效钾、缓效钾等养分均显著低于YW和WJ处理,这是因为无机肥料养分释放快,短时间内可迅速增加土壤速效养分含量,提高土壤供肥能力;而有机肥养分释放慢,虽可改善土壤养分的库容,提高土壤供肥容量,但速效养分较少;有机无机肥配施,速效和缓效养分互补,可提高作物对肥料养分的利用率。此外,YJ和YW处理土壤中的硝态氮和铵态氮比值均高于WJ处理,更能满足烟草喜硝的特点。
2.2 不同施肥处理对细菌群落数量的影响3种不同肥料施用3 a后土壤中细菌16S rRNA基因数量见图 1,与WJ处理相比,YW和YJ处理均显著增加了土壤中的细菌数量,分别增加了58.20% 和64.63%。相关性分析(表 3)表明,土壤细菌16S rRNA基因拷贝数与土壤NH4+-N呈显著负相关,与土壤pH、有机质含量显著正相关,说明肥料施用后引起的NH4+-N、pH和有机质含量的变化,可能是导致施肥土壤中细菌数量差异的主要原因。多项研究证明,有机物的添加(农作物残体、绿肥)对微生物数量的影响较大[22]。土壤有机质与农业或自然生态系统中的土壤微生物生物量之间存在着显著正相关关系[23],有机肥料的添加,为细菌生长提供了充足的碳、氮源,促进了细菌繁殖[24-25]。由于连续施用无机肥显著降低了土壤pH(表 2),而细菌数量与土壤酸碱度高度相关[26],较低的pH环境不利于细菌生长繁殖[27],这可能是本研究WJ处理土壤中的细菌16S rRNA拷贝数显著较低的原因。

|
(图中小写字母不同表示处理间差异达P < 0.05显著水平) 图 1 不同施肥处理土壤16S rRNA基因拷贝数 Fig. 1 16S rRNA gene copies in soils under different fertilization treatments |
|
|
表 3 16S rRNA基因拷贝数与土壤理化性质的相关性 Table 3 Correlations between 16S rRNA gene copies and soil properties |
土壤细菌对环境条件的变化十分敏感,长期施肥会显著影响微生物群落的多样性和结构[28]。通过高通量测序结果进行质控、降噪,共获得723 037条高质量序列,平均每个样本80 337条。稀释曲线分析表明,在52 000个随机选择的细菌序列中,曲线接近饱和稳定,表明测序深度符合下游分析要求。不同处理土壤的细菌群落alpha多样性指数见表 4,3个处理中,YW处理土壤中的细菌群落alpha多样性指数显著较高,而YJ和WJ处理之间无显著差异。说明YW处理能够提高土壤中细菌的丰富度和多样性。基于Bray-Curtis dissimilarity、Weighted UniFrac distance和Unweighted UniFrac distance 3种距离矩阵进行主坐标分析,结果如图 2所示,不同施肥处理下细菌群落结构明显分异(图 2A~2C)。ANOSIM检验表明,3种距离矩阵下各处理的组内差异均显著低于组间差异(图 2 D ~ 2F),表明不同施肥处理下的细菌群落结构差异显著。
|
|
表 4 不同施肥处理土壤细菌群落的alpha多样性指数 Table 4 Alpha diversity indices of soil bacterial communities under different fertilization treatments |
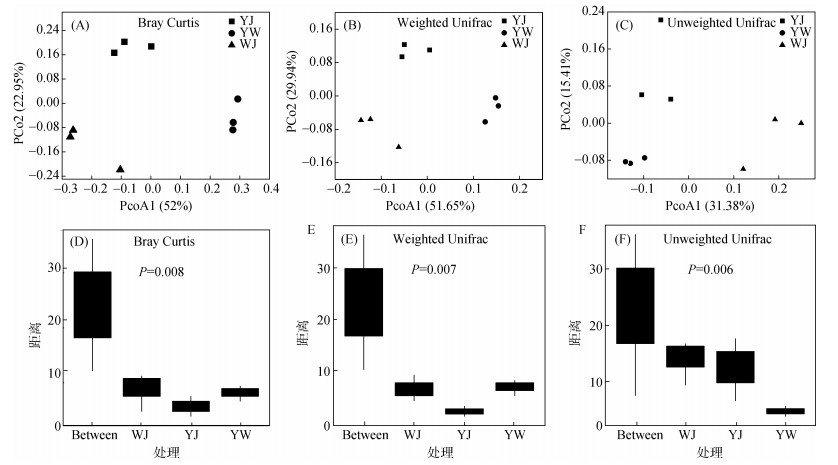
|
图 2 基于Bray-Curtis、Weighted UniFrac、Unweighted UniFrac距离矩阵的PCoA分析和ANOSIM检验 Fig. 2 Principal co-ordinates analysis and ANOSIM test based on Bray-Curtis, weighted UniFrac and unweighted UniFrac distance matrixes of soil bacterial community under different fertilization treatments |
分别在OTU水平、门水平和科水平上,采用Mantel test检验土壤细菌群落结构和土壤理化性质之间的相关性(表 5),结果表明土壤pH在各分类水平上均与土壤细菌群落结构高度相关(P < 0.001),在OTU水平上NH4+-N含量与土壤细菌群落结构显著相关(r = 0.391,P = 0.005)。进一步采用CCA分析土壤理化性质对细菌群落组成的影响(图 3)。结果显示,在OTU水平上,NH4+-N、AP和pH对第一轴贡献率较高,而NO3–-N、AK、SLK、TK和OM对第二轴贡献率较高,且pH和NH4+-N对施肥土壤细菌群落影响显著(图 3)。在门和科水平上,pH同样是显著影响土壤细菌群落结构的关键环境因子。有研究表明,不同的肥料类型会改变土壤的物理和化学性质,如土壤通气状况、pH、水分和养分固持能力等,进而影响微生物群落结构[28-30],本研究结果与上述研究结论一致。连续施用无机肥会导致土壤酸化,而土壤酸化会进一步引发一系列生物化学反应,尤其是强烈影响微生物活动,最终导致微生物区系多样性失衡[31]。与施用有机肥牛粪相比,施用无机肥可降低土壤微生物区系种群功能多样性[32]。而有机物料能增进土壤微生物多样性,微生物多样性的增加又可改进对土壤的能源和营养物质的利用,例如Peacock等[33]研究表明,长期施用牛粪会促进作物根系分泌物和土壤中可溶性有机碳积累,导致微生物生物量的增加和群落结构的变化。
|
|
表 5 土壤细菌群落结构与理化性质的Mantel检验 Table 5 Mantel test determining relations between soil properties and bacterial community sturctures |

|
图 3 土壤细菌群落与土壤因子的典范对应分析 Fig. 3 Canonical correspondence analysis (CCA) determining effects of soil factors on soil bacterial community structures |
将所获的高质量序列在97% 相似性水平上进行聚类,共得到2 661个OTUs,代表序列经物种注释后归属32个门、50个纲、112个目、187个科和360个属。在全部样品中,Proteobacteria (平均相对丰度为39.9%)是最丰富的门,其次是Actinobacteria (17.6%)、Acidobacteria(10.6%)、Gemmatimonadetes(7.19%)和Chloroflexi(8.57%),这5个优势菌门的累计相对丰度为83.8% (图 4A),与植烟黄壤中的优势菌门类似[34]。上述优势菌门的相对丰度在不同处理土壤中存在显著性差异,YJ处理土壤中Proteobacteria显著较高,分别比YW和WJ处理高16.20% 和13.86%;可能是因为大量有机质的投入有利于富营养微生物群落的富集[35]。YW处理的Acidobacteria和Gemmatimonadetes均显著高于其他处理,而Actinobacteria、Chloroflexi和Firmicutes的相对丰度在WJ处理中最高。上述结果表明,与WJ处理相比,YJ处理显著增加了土壤中的变形菌门相对丰度,而YW处理则显著增加了Acidobacteria和Gemmatimonadetes相对丰度,YJ和YW处理均显著降低了Actinobacteria、Chloroflexi和Firmicutes的相对丰度。
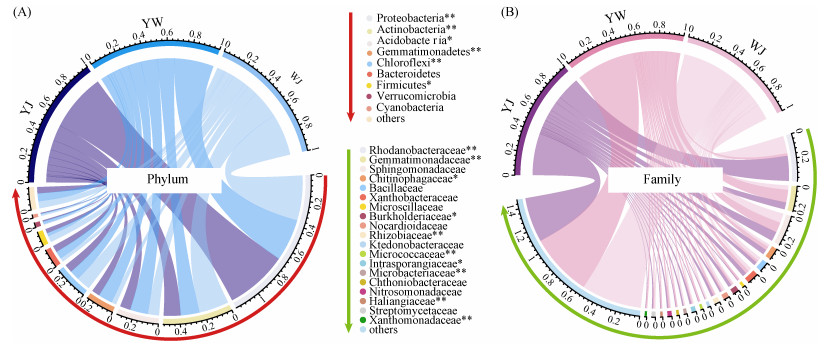
|
(样本与物种之间的关系,上半圆指示不同处理,下半圆指示不同物种,条带长度表示在相应处理中各优势门、科的相对丰度) 图 4 不同施肥处理土壤门和科分类水平上细菌物种相对丰度 Fig. 4 Relative abundances of soil bacteria communities at phylum and family levels under different fertilization treatments |
在科水平上(图 4B),Rhodanobacteraceae、Gemmatimonadaceae 和Sphingomonadaceae 是植烟土壤细菌群落中平均相对丰度最高的3个科,分别隶属于γ-Proteobacteria、Gemmatimonadetes和α- Proteobacteria。通过单因素方差分析,确定响应不同肥料处理的40个组间差异物种,并对差异物种与土壤理化因子进行相关性分析(图 5),结果表明:连续3 a施用YJ肥料,显著增加了土壤中Intrasporangiaceae、Burkholderiaceae、Chitinophagaceae和Xanthomonadaceae 的相对丰度,上述细菌均与土壤中的有机质和硝态氮含量正相关。Intrasporangiaceae对重金属有一定的耐受性[36],Burkholderiaceae是固氮菌[37],能够与植物寄主共生固氮,而Xanthomonadaceae[38]和 Chitinophagaceae[39]是植物病害生防细菌,可以产生许多具有重要生物活性的次生代谢产物从而抑制病原菌的生长。YW处理显著降低了Rhodanobacteraceae、Microbacteriaceae的相对丰度,显著增加了Gemmatimonadaceae、Micrococcaceae 和Haliangiaceae 的相对丰度,这3种相对丰度增加的细菌均与土壤pH呈正相关;Gemmatimonadaceae[40]、Micrococcaceae[41]和Haliangiaceae[42-43]被证明是植物促生菌(PGPR),能够产生GA和IAA并诱导根系生长。此外,YJ和YW处理均显著增加了Rhizobiaceae 的相对丰度,且与土壤中的有机质和硝态氮含量正相关。Rhizobiaceae是固氮菌[44],能附着在根上并有效地定殖于根表,与植物寄主共生固氮,是促进植物生长的益生菌。综上,3种施肥处理中,YJ和YW处理能够增加有益菌的相对丰度,更有利于烟草的生长。
2.5 不同施肥处理对细菌群落功能的影响使用FAPROTAX对微生物细菌群落进行功能预测,从35个功能中筛选出处理间有显著差异的8项功能进行分析(表 6),结果表明:与YJ和WJ处理相比,YW处理中需氧化能异养显著降低。相关性分析表明,需氧化能异养功能与可进行光合作用的自养营养微生物Gemmatimonadetes相对丰度呈负相关(r=–0.817,P=0.048)[45]。本研究中Gemmatimonadetes在有机无机处理中显著升高(图 4A),暗示土壤中的化能自养微生物与异养微生物可能存在着生态位的竞争作用。
|
|
表 6 不同处理微生物菌群功能预测 Table 6 Function prediction of soil microbial communities under different treatments |
本研究发现在3组施肥处理中,YW处理细菌群落的硝化功能显著高于YJ和WJ处理,可能是由于执行该功能的关键物种Nitrospira在YW处理中相对丰度显著高于YJ和WJ处理(图 6A)。相关性分析表明,土壤Nitrospira的相对丰度与土壤pH显著正相关(图 6B),因此,推测YJ和WJ处理导致土壤pH明显降低,进而减少了该菌的相对丰度,影响了土壤微生物的硝化功能。长期连作土壤中,WJ处理一方面降低了植烟土壤Burkholderiaceae、Rhizobiaceae等促进固氮作用的细菌丰度(图 4、图 5);另一方面会导致土壤严重酸化,减少硝化作用关键物种数量,抑制硝化细菌的活性,进而引发土壤微生物硝化功能降低;而施用YW肥,土壤硝化功能保持较高的状态,更能满足烟草喜硝的特点。

|
(下方的YJ、YW和WJ行表示的是3个处理土壤中各差异菌的平均相对丰度,其余各行表示各差异菌与土壤理化性质的相关系数(0 < r < 1)) 图 5 土壤理化性质与科水平差异菌相关性分析 Fig. 5 Correlations between soil properties and bacterial families |
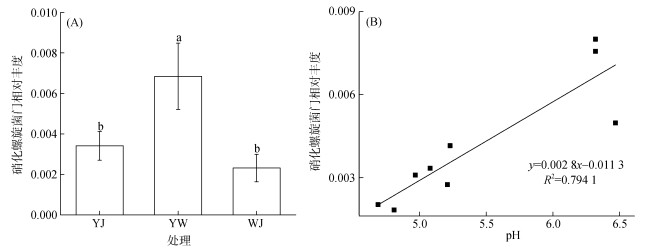
|
图 6 不同处理硝化螺旋菌门相对丰度及pH相关性 Fig. 6 Correlation between relative abundance of Nitrospira and pH under different treatments |
长期施用不同的烟草肥料会对土壤理化性质和细菌群落造成明显的影响。长期施用有机肥有助于提高土壤有机质含量,增加细菌数量;有机无机肥配施有利于维持土壤pH的稳定,还可提高土壤速效养分和有机质含量,增加土壤中的细菌数量和细菌群落的多样性。施用有机肥或有机无机肥配施均可以提高Gemmatimonadaceae、Rhizobiaceae和Micrococcaceae等植物促生菌的丰度;而连续施用无机肥则导致土壤酸化,降低土壤细菌数量和细菌群落的硝化功能。综上,建议云南紫色土区域烟草施肥采用无机肥和有机肥配施,更有利于维持植烟土壤质量的稳定和微生物区系的健康。
| [1] |
Zhong W H, Gu T, Wang W, et al. The effects of mineral fertilizer and organic manure on soil microbial community and diversity[J]. Plant and Soil, 2010, 326(1/2): 511-522 (  0) 0) |
| [2] |
Insam H, Hutchinson T C, Reber H H. Effects of heavy metal stress on the metabolic quotient of the soil microflora[J]. Soil Biology and Biochemistry, 1996, 28(4/5): 691-694 (  0) 0) |
| [3] |
Stewart W M, Dibb D W, Johnston A E, et al. The contribution of commercial fertilizer nutrients to food production[J]. Agronomy Journal, 2005, 97(1): 1-6 DOI:10.2134/agronj2005.0001 (  0) 0) |
| [4] |
黄国勤, 王兴祥, 钱海燕, 等. 施用化肥对农业生态环境的负面影响及对策[J]. 生态环境, 2004, 13(4): 656-660 DOI:10.3969/j.issn.1674-5906.2004.04.055 (  0) 0) |
| [5] |
张福锁, 王激清, 张卫峰, 等. 中国主要粮食作物肥料利用率现状与提高途径[J]. 土壤学报, 2008, 45(5): 915-924 DOI:10.3321/j.issn:0564-3929.2008.05.018 (  0) 0) |
| [6] |
Miao Y X, Stewart B A, Zhang F S. Long-term experiments for sustainable nutrient management in China. A review[J]. Agronomy for Sustainable Development, 2011, 31(2): 397-414 DOI:10.1051/agro/2010034 (  0) 0) |
| [7] |
Zhang S T, Song X N, Li N, et al. Influence of high-carbon basal fertiliser on the structure and composition of a soil microbial community under tobacco cultivation[J]. Research in Microbiology, 2018, 169(2): 115-126 DOI:10.1016/j.resmic.2017.10.004 (  0) 0) |
| [8] |
Li W T, Wu M, Liu M, et al. Responses of soil enzyme activities and microbial community composition to moisture regimes in paddy soils under long-term fertilization practices[J]. Pedosphere, 2018, 28(2): 323-331 DOI:10.1016/S1002-0160(18)60010-4 (  0) 0) |
| [9] |
苏贤坤, 张晓海, 廖德智. 烟草综合利用现状及其前景[J]. 贵州农业科学, 2006, 34(5): 120-123 DOI:10.3969/j.issn.1001-3601.2006.05.049 (  0) 0) |
| [10] |
彭智良, 黄元炯, 刘国顺, 等. 不同有机肥对烟田土壤微生物以及烟叶品质和产量的影响[J]. 中国烟草学报, 2009, 15(2): 41-45 (  0) 0) |
| [11] |
郭红祥, 刘卫群, 姜占省. 施用饼肥对烤烟根系土壤微生物的影响[J]. 河南农业大学学报, 2002, 36(4): 344-347 DOI:10.3969/j.issn.1000-2340.2002.04.010 (  0) 0) |
| [12] |
张晓海, 杨春江, 王绍坤, 等. 烤烟施用菜籽饼后根际微生物数量变化研究[J]. 云南农业大学学报, 2003, 18(1): 14-19 DOI:10.3969/j.issn.1004-390X.2003.01.004 (  0) 0) |
| [13] |
李想, 刘艳霞, 陆宁, 等. 综合生物防控烟草青枯病及其对土壤微生物群落结构的影响[J]. 土壤学报, 2017, 54(1): 216-226 (  0) 0) |
| [14] |
滕桂香, 邱慧珍, 张春红, 等. 微生物有机肥对烤烟育苗、产量和品质的影响[J]. 中国生态农业学报, 2011, 19(6): 1255-1260 (  0) 0) |
| [15] |
Ma J, Liu H, Zhang C, et al. Joint response of chemistry and functional microbial community to oxygenation of the reductive confined aquifer[J]. Science of the Total Environment, 2020, 720: 137587 DOI:10.1016/j.scitotenv.2020.137587 (  0) 0) |
| [16] |
赵文慧, 马垒, 徐基胜, 等. 秸秆与木本泥炭短期施用对潮土有机质及微生物群落组成和功能的影响[J]. 土壤学报, 2020, 57(1): 153-164 (  0) 0) |
| [17] |
鲁如坤. 土壤农业化学分析方法[M].
中国农业科技出版社, 北京, 2000
(  0) 0) |
| [18] |
Quast C, Pruesse E, Yilmaz P, et al. The SILVA ribosomal RNA gene database project: Improved data processing and web-based tools[J]. Nucleic Acids Research, 2013, 41(D1): D590-D596 (  0) 0) |
| [19] |
张伟明, 孟军, 王嘉宇, 等. 生物炭对水稻根系形态与生理特性及产量的影响[J]. 作物学报, 2013, 39(8): 1445-1451 (  0) 0) |
| [20] |
应多, 赵熙君, 张旭辉, 等. 添加玉米秸秆重金属污染对水稻土有机碳矿化的影响[J]. 土壤, 2020, 52(2): 340-347 (  0) 0) |
| [21] |
李典鹏, 王辉, 孙涛, 等. 机械压实对新疆绿洲农田土壤微生物活性及碳排放的影响[J]. 农业工程学报, 2018, 34(20): 124-131 DOI:10.11975/j.issn.1002-6819.2018.20.016 (  0) 0) |
| [22] |
N'Dayegamiye A, Tran T S. Effects of green manures on soil organic matter and wheat yields and N nutrition[J]. Canadian Journal of Soil Science, 2001, 81(4): 371-382 DOI:10.4141/S00-034 (  0) 0) |
| [23] |
第19届国际土壤学大会重点论文摘要选译[J]. 土壤, 2010, 42(5): 696-799.
(  0) 0) |
| [24] |
Demoling F, Figueroa D, Bååth E. Comparison of factors limiting bacterial growth in different soils[J]. Soil Biology and Biochemistry, 2007, 39(10): 2485-2495 DOI:10.1016/j.soilbio.2007.05.002 (  0) 0) |
| [25] |
Sradnick A, Murugan R, Oltmanns M, et al. Changes in functional diversity of the soil microbial community in a heterogeneous sandy soil after long-term fertilization with cattle manure and mineral fertilizer[J]. Applied Soil Ecology, 2013, 63: 23-28 DOI:10.1016/j.apsoil.2012.09.011 (  0) 0) |
| [26] |
Feng Y Z, Grogan P, Caporaso J G, et al. pH is a good predictor of the distribution of anoxygenic purple phototrophic bacteria in Arctic soils[J]. Soil Biology and Biochemistry, 2014, 74: 193-200 DOI:10.1016/j.soilbio.2014.03.014 (  0) 0) |
| [27] |
Bartram A K, Jiang X P, Lynch M D J, et al. Exploring links between pH and bacterial community composition in soils from the Craibstone Experimental Farm[J]. FEMS Microbiology Ecology, 2014, 87(2): 403-415 DOI:10.1111/1574-6941.12231 (  0) 0) |
| [28] |
Zimmerman A R. Abiotic and microbial oxidation of laboratory-produced black carbon (biochar)[J]. Environmental Science & Technology, 2010, 44(4): 1295-1301 (  0) 0) |
| [29] |
Jindo K, Hernández T, García C, et al. Influence of stability and origin of organic amendments on humification in semiarid soils[J]. Soil Science Society of America Journal, 2011, 75(6): 2178-2187 DOI:10.2136/sssaj2011.0094 (  0) 0) |
| [30] |
Chintala R, Mollinedo J, Schumacher T E, et al. Effect of biochar on chemical properties of acidic soil[J]. Archives of Agronomy and Soil Science, 2014, 60(3): 393-404 DOI:10.1080/03650340.2013.789870 (  0) 0) |
| [31] |
徐仁扣. 土壤酸化及其调控研究进展[J]. 土壤, 2015, 47(2): 238-244 (  0) 0) |
| [32] |
Ozlu E, Kumar S. Response of soil organic carbon, pH, electrical conductivity, and water stable aggregates to long-term annual manure and inorganic fertilizer[J]. Soil Science Society of America Journal, 2018, 1243-1251 (  0) 0) |
| [33] |
Peacock A D, Mullen M D, Ringelberg D B, et al. Soil microbial community responses to dairy manure or ammonium nitrate applications[J]. Soil Biology and Biochemistry, 2001, 33(7/8): 1011-1019 (  0) 0) |
| [34] |
陈懿, 吴春, 李彩斌, 等. 炭基肥对植烟黄壤细菌、真菌群落结构和多样性的影响[J]. 微生物学报, 2020, 60(4): 653-666 (  0) 0) |
| [35] |
Manzoni S, Porporato A. Soil carbon and nitrogen mineralization: Theory and models across scales[J]. Soil Biology and Biochemistry, 2009, 41(7): 1355-1379 DOI:10.1016/j.soilbio.2009.02.031 (  0) 0) |
| [36] |
丁苏丽, 张祁炅, 董俊, 等. 深港红树林沉积物微生物群落多样性及其与重金属的关系[J]. 生态学杂志, 2018, 37(10): 3018-3030 (  0) 0) |
| [37] |
成艳红, 黄欠如, 武琳, 等. 红壤旱地一株自生固氮菌的筛选鉴定及其固氮能力评估[J]. 中国农学通报, 2020, 36(9): 100-106 (  0) 0) |
| [38] |
Mhedbi-Hajri N, Jacques M A, Koebnik R. Adhesion mechanisms of plant-pathogenic xanthomonadaceae//Linke D, Goldman A. Bacterial adhesion: Chemistry, biology and physics[M]. Berlin Heidelberg: Springer-Verlag. 2011: 71-89.
(  0) 0) |
| [39] |
Choi J, Cha S, Chhetri G, et al. Edaphocola aurantiacus gen. nov., sp. nov., a new member of the family Chitinophagaceae isolated from wetland soil in South Korea[J]. Antonie Van Leeuwenhoek, 2019, 112(5): 687-694 DOI:10.1007/s10482-018-1199-1 (  0) 0) |
| [40] |
Jaiswal A K, Graber E R, Elad Y, et al. Biochar as a management tool for soilborne diseases affecting early stage nursery seedling production[J]. Crop Protection, 2019, 120: 34-42 DOI:10.1016/j.cropro.2019.02.014 (  0) 0) |
| [41] |
Hong S H, Ham S Y, Kim J S, et al. Application of sodium polyacrylate and plant growth-promoting bacterium, Micrococcaceae HW-2, on the growth of plants cultivated in the rooftop[J]. International Biodeterioration & Biodegradation, 2016, 113: 297-303 (  0) 0) |
| [42] |
Xiao M, Zhou X K, Chen X, et al. Lysobacter tabacisoli sp. nov., isolated from rhizosphere soil of Nicotiana tabacum L[J]. International Journal of Systematic and Evolutionary Microbiology, 2019, 69(7): 1875-1880 DOI:10.1099/ijsem.0.003164 (  0) 0) |
| [43] |
Hallmann J, Rodrıguez-Kábana R, Kloepper J W. Chitin-mediated changes in bacterial communities of the soil, rhizosphere and within roots of cotton in relation to nematode control[J]. Soil Biology and Biochemistry, 1999, 31(4): 551-560 DOI:10.1016/S0038-0717(98)00146-1 (  0) 0) |
| [44] |
Spaink H P, Kondorosi A, Hooykaas P J J. The rhizobiaceae: Molecular biology of model plant-associated bacteria[M].
Springer Netherlands, Dordretch, 1998: 155-172
(  0) 0) |
| [45] |
Butterfield N J. Proterozoic photosynthesis-a critical review[J]. Palaeontology, 2015, 58: 1-52 DOI:10.1111/pala.12143 (  0) 0) |
2. University of Chinese Academy of Sciences, Beijing 100049, China;
3. Jiangsu Open University, Nanjing 210036, China;
4. Yunnan Academy of Tobacco Agricultural Sciences, Kunming 650021, China;
5. Hongta Tobacco (Group) Co. Ltd, Yuxi, Yunnan 653100, China
 2021, Vol. 53
2021, Vol. 53


