土壤是元素生物地球化学循环过程的关键载体,具有高度的时空异质性[1-2]。传统的土壤研究手段往往依赖于破坏性采样和异位提取分析法,通常只考虑待测物在整个土体的平均浓度,无法反映待测参数的时空异质特征,从而忽略了土壤异质性的潜在影响。为解决土壤理化参数原位观测的难题,研究者开发了各种尖端的微米级传感微电极[3],为更好地理解土壤生物地球化学过程提供了宝贵的技术支撑。此外,人们又研发出具有比微电极更优越的长期稳定性且不消耗分析物的微型光纤电极(microoptode)[4]。然而,这些类型的微型传感器一般只能完成单点或单线观测,而无法对多点位的复杂动态变化过程进行即时监测,且在其实际应用过程中也可能会对土壤的微环境体系产生一定程度的破坏或干扰。随后,基于凝胶的薄膜扩散平衡法(diffusive equilibration in thin films,DET)[5]和薄膜扩散梯度法(diffusive gradient in thin films,DGT)[6]相继被提出。DGT和DET技术能够基于部分测定结果和最优假设条件下的模型较为真实地模拟原位条件下待测物在环境介质中的生物可利用性[7],但是基于理想假设而做出的预测并不能完全反映土壤溶质运移与反应动力学的真实信息。另外,原子力显微镜(atomic force microscopy,AFM)、X射线荧光光谱分析仪(X-ray fluorescence)等仪器也可提供待测分析物高分辨率的空间分布信息,不过其仪器相对昂贵且操作繁琐。因此,针对土壤的高度异质性与热点区域变化,需要一种结果可靠、价格相对低廉、能够实现实时原位监测并且具有较高分辨率的测量技术来获取土壤中关键分析物的信息。
20世纪90年代,Glud等[8]开发出平面光学电极(planar optrode)二维成像技术,实现了在亚毫米尺度上监测海底淤泥和水体中O2的二维空间动态分布。随后该技术逐渐发展为平面光极技术(planar optode,PO),且针对各种目标分析物(pH、pCO2、NH4+等)的平面光极也逐渐被开发出来,为揭示生物地球化学过程的微观机理提供了新的技术手段。平面光极早期主要应用于海洋、湖泊等水体,而随着前沿科学技术的跨学科发展,以及考虑到土壤热点区域和热点时刻在生物地球化学反应过程中的重要性,该技术逐渐被应用于土壤的微观异质性研究中,且取得了显著性成果[9-10]。
本文系统概述了平面光极的成像原理、测量方法以及特点和局限性,总结了平面光极在土壤学和农业环境研究领域中的多方面应用,讨论了平面光极进一步的发展方向和潜在应用,旨在为今后土壤相关理化参数的微观特性研究提供技术参考。
1 平面光极基本原理与系统组成平面光极技术是基于发光传感原理,将发光指示剂包埋在基质中制成传感膜,利用成像器件记录其激发的二维特征发射光谱,再依据像素标定的传递函数来量化待测分析物浓度。平面光极由发光传感系统和信号收集系统两部分组成(图 1)。发光传感系统包含光学平面传感器和激发光源。其中,激发光源主要为发光指示剂提供激发能量,通常是大功率的LED(发光二极管)[11]或卤素氙灯[8-12]。信号收集系统由CCD(电荷耦合装置)或CMOS(互补金属氧化物半导体)[13]与电脑终端连接组成,利用图像分析软件(如Image J)进行后期数据处理来获取待测物质的二维分布信息。

|
(光学平面传感器主要由支撑基材、传感膜和光学隔离层(隔离干扰信号)3部分组成。支撑基材主要是对传感膜起物理支撑作用,一般为透明聚酯片(PET)[8]和苯乙烯薄片(PS)[14],也可以使用其他耐有机溶剂、并且对发光指示剂具有惰性的透明材料。此外,传感膜还可以直接涂覆在成像装置的玻璃板上[14]。通常,为确保传感膜紧密附着在支撑基材表面,往往需要对基材表面进行硅烷化处理(例如:3-氨丙基三乙氧基硅烷(APTES)或二甲基二氯硅烷)[15]) 图 1 平面光极装置图(以室内观测生物质炭-土壤系统pH为例) Fig. 1 Schematic illustration of planar optode |
传感膜是平面光极的关键组成部分,它决定了光学平面传感器的灵敏度、选择性、动态范围、响应时间以及稳定性等特性。传感膜的制作方法与传统镀膜工艺类似:首先将发光指示剂、包埋剂、参比染料和一些光散射辅助粒子等按照一定的比例溶解于有机溶剂中,形成混合均匀的母液,然后利用刀涂[16]、旋涂[14]或喷涂[17]等镀膜方式将母液均匀地涂布在支撑基材表面,待溶剂挥发后形成厚度约小于10 μm的传感膜。其中,发光指示剂是传感膜的关键成分,也是扩展平面光极技术应用的研究核心(表 1)。由于土壤中的溶质大多无色或者本身不发荧光,所以不能用光学方法直接测定,而发光指示剂就是根据其发光特性和对待测分析物的特异敏感性,将土壤中的待测溶质浓度转换为可测量的光信号。一般来说,增大发光指示剂的浓度,可以增强光信号,但当浓度过高时会导致所发荧光的自淬灭[18]。因此,可以通过向基体溶液中添加纳米级的TiO2、钻石或黄金等光散射粒子来增加亮度,从而增强发光指示剂的能量吸收[19-20]。需注意的是,TiO2也可以起到光催化剂的作用,所以在一定程度上会降低光学平面传感器的稳定性[17]。另外一种常用的方法是向基体溶液中添加天线染料(如香豆素[16, 21]),香豆素可以有效地吸收激发光并将能量传递给发光指示剂从而增强发射光信号,目前这种方法已经应用到了O2、pH等平面光极传感器中。在实际应用过程中,传感膜的稳定性较高,其中的各个化学成分均不会扩散或泄露到土壤环境中[9]。
|
|
表 1 平面光极常用发光指示剂 Table 1 The luminescent indicators used for planar optode |
此外,基于荧光的测量可能受到土壤中具有荧光效应物质的干扰,特别是在根际土壤研究中,根系本身对激发光源的光学响应是否会干扰待测分析物的测定,还有待进一步的实验确认。因此,为了排除或者减少此类影响,通常在传感膜的表面涂覆一层光学隔离层,这种隔离层通常以硅/水凝胶嵌入炭黑、TiO2或ZnO2等纳米颗粒组成[16, 37]。如果待测分析物为气体分子(如:O2、CO2和H2S等)[32, 36],则可以在传感膜的表面覆盖一层透气不透离子的薄膜,以消除各种非挥发性的无机、有机离子或分子的干扰。需注意的是,光学隔离层会增加传感膜厚度进而减缓平面光极的响应速度。比如,具有硅胶隔离层的O2光极达到T90的响应时间(90% 全信号的时间)比没有隔离层的大10倍左右[37]。因此,光学隔离层的添加可能会降低平面光极的实际时空分辨率,一定程度上会限制其在具有快速动态变化的微环境体系中的应用。
2 成像定量方法 2.1 发光强度定量发光强度定量就是直接通过测量发射荧光的强度来定量每一个像素点的浓度分布信息[16]。该方法的优点是简单易于实现,但缺点是容易受背景环境、发光指示剂分布不均等因素的影响,导致测量精度及稳定性不高。虽然可以通过在传感膜上涂覆一层光学隔离层,并在使用前后对光学传感器进行点对点的像素校准来减小这些测量误差,但这会增加光极的响应时间以及测定程序的繁琐性,限制了该方法在实际中的应用。
2.2 发光寿命定量发光寿命是指电子从基态激发到返回基态的平均时间。荧光寿命较短(接近10–8 s),而磷光发光寿命相对较长(10–6 s至数小时不等)。基于发光寿命的测量方法包括荧光寿命频域测定法(frequency domain,FD)[38]和磷光寿命测定法(rapid lifetime determination,RLD)[39]。频域测定法是利用混合物中各荧光体荧光寿命的差异来进行荧光光谱的分辨,并利用激发光和荧光之间的相角和去调制因素来计算荧光寿命。而磷光寿命测定法是通过将磷光寿命衰减曲线(强度与时间)划分为至少两个相同宽度区域,然后用区域之间强度下降值来计算发光寿命。相比于发光强度的定量方法,基于发光寿命的定量克服了来自光学隔离层、不稳定的校准曲线以及非均质传感膜和激发光源等因素的限制。但由于缺少具有适宜发光寿命的荧光指示剂,目前基于发光寿命的定量仅用于O2、NH4+、温度等目标分析物。此外,基于发光寿命的定量通常需要搭配具有快速电子快门的CCD设备来捕捉发光寿命信号,价格相对昂贵,也限制了该方法的大范围推广使用。
2.3 强度比率定量比率测量法通常包括荧光波长比率定量和RGB(red、green、blue)颜色比率定量。荧光波长比率定量法就是利用记录在两个不同的激发波长[32-33]、两个不同的发射波长[40],以及双激发/双发射下[34]的两幅发射图像之间的强度比值来确定待测分析物的浓度。为了提高分析的准确性,便于分离荧光信号,通常加入不与待测分析物反应且具有较长发射波长的参比染料。外界干扰引起的光强变化会同时对荧光和参考光都产生影响,因此同步测量荧光染料和参考染料的发光强度可以极大地减少此类干扰的影响。采用波长比率定量法就可以有效地减少外界杂光的干扰,解决发光指示剂分布不均等问题。
RGB颜色比率法[16, 41]是利用数码相机的内置彩色滤光片,在激发光源下同时记录发射光的3种不同颜色(红、绿、蓝),利用单个图像所记录的3种不同颜色通道之间的强度比值来定量分析物的浓度。同时在图像处理中采用多帧图像平均的方法,提高了图像像素的信噪比。目前,这种方法主要用于O2、pH[16]测定。此外,RGB颜色比率法中的色调参数(色调、饱和度等)的应用使传感器的精度较波长比率定量法提高了3倍[42]。近年来,强度比率定量成像由于其低成本且不需要复杂的控制电路系统而越来越受欢迎,具有较高的实用性。
3 平面光极的主要特点及其局限性 3.1 空间分辨率与传统的微型传感器测量相比,平面光极技术的高空间分辨率(< 100 µm)和较大观测视野(>400 cm2)是其主要的两大优点。其中最大空间分辨率主要由成像设备本身像素大小以及实际的观测视野决定,如在理想状态下,高级CCD相机原始(RAW)文件格式的像素尺寸可以达到5.7 μm×5.7 μm[16, 43];数码单反相机原始文件格式的像素尺寸为11.4 μm×11.4 μm[16]。然而,由于光学信号可能会在传感膜层、支撑基材或容器壁的边界发生漏光效应等光学畸变,所得实际光学分辨率通常会低于理论计算所得分辨率[14]。对此,Fischer和Wenzhöfer等[14]利用数学模型计算发现O2光极的空间分辨率极限是其传感膜厚度的5倍。除此之外,涂有光学隔离层的光极将进一步降低空间分辨率。但在大多数平面光极的实际应用中,大约100 μm×100 μm的空间分辨率基本满足其对最小动态分辨率的要求。
3.2 时间分辨率平面光极具有较高的时间分辨率,能够持续实时地获取待测物的动态分布。基于发光寿命定量的光极系统通常采用具有高灵敏度、低噪声的CCD相机来捕捉短暂的磷光信号,其常用曝光时间在5 ~ 20 μs之间[39, 44]。由于短曝光时间的磷光信号强度较低,通常采用整合多个曝光时间帧来提高单张图像的信号强度。根据集成时间的不同,单个图像的总采集时间一般约为1 ~ 2 s[45]。然而,这种方式所得图像的信噪比普遍偏低,所以在实际应用中更多利用多幅图像(3 ~ 16)的像素平均来提高信噪比,使得复合图像的最终采集时间为10 ~ 40 s[46]。此外,还可以应用像素合并技术(binning)来提高信噪比和帧率。像素合并技术[39, 46]是指将CCD图像传感器相邻两个或多个像元所感应的电荷加在一起,以一个新像元的模式读出。像素合并可通过减少图像采集所需的时间来提高聚焦精度和灵敏度。理论上,一个2×2像素的电荷合并可以将灵敏度提高4倍,但可实现的最大空间分辨率会缩小2倍。而基于发光强度定量的光极系统需要较长的曝光时间,通常为0.1 ~ 1 s,但也有报道称可以高达30 s[47]。另外,时间分辨率还会受到平面光极传感膜响应时间的影响,其值取决于传感膜中待测分析物与环境介质达到热力学平衡所需的时间。因此,对于有较快响应时间要求的平面光极,需要尽量减小传感层的厚度,同时也要求发光指示剂的发光强度能够保证足量的信号输出[18]。大多数O2光极传感膜厚度约为10 ~ 40 μm,达到90% 信号强度所需时间是5 ~ 10 s[48],pH和pCO2光极响应通常比O2光极慢,一般为10 ~ 150 s[24, 35],而NH4+传感器的响应时间更长,需要3 ~ 4 min[34-35]。尽管如此,对于在土壤中的大多数实际应用,传感器响应时间并不是一个限制因素,所得时间分辨率仍然远远高于传统的破环性取样方法。
3.3 干扰信号环境温度是影响平面光极信号的重要因子。有研究发现温度对几乎所有的光极信号都存在干扰[49]。例如,Borisov和Klimant[50]发现,对于以PtTFPP为发光指示剂、聚苯乙烯为基体的O2平面光极,如果不进行温度校正,在85% 高溶解氧含量条件下的测量误差高达1.7%/℃,而在12% 的低氧含量条件下,测量误差相对较低,只有0.22%/℃。Rysgaard等[51]也报道了类似的结果,在相同条件下,以Ru-dpp为发光指示剂、聚苯乙烯为基体的O2平面光极也分别产生2.6%/℃和2.0%/℃的误差,且Ru-dpp的发光寿命也有0.3%/℃的下降。因此,在实际应用中必须保持温度恒定或者对其进行补偿校正。对于pH平面光极,当pH在5.5 ~ 8.0范围内且与校准温度相差小于5 ℃时,温度变化带来的干扰并不显著;随着温度的升高,pH发光指示剂HPTS的发光强度降低,但其发光强度在5 ~ 40 ℃区间对温度不敏感[52]。类似地,Rudolph等[30]发现pH发光染色剂H110在19 ~ 25 ℃范围内也不需要进行温度补偿。但是基于发光指示剂HPTS的pCO2传感器其发光强度随温度的升高而显著降低[33]。通常由温度变化引起的系统误差可以通过独立的温度测量[53-54]或添加对温度变化有明显响应的参比染料[55]来校正。
除温度外,背景环境中的溶质对光极测量的影响也不可忽视。pH光极基体的离子渗透特性使其对外界离子强度的变化非常敏感[56]。Zhu等[33, 52]发现,以HPTS为发光指示剂的pH光极,外界离子强度与指示剂表观解离常数pka呈非线性相关关系,且当离子强度超过50 mmol/L后将不再对表观解离常数pka产生影响。同样,随着离子强度的增加,基于DHFA的pH光极的表观解离常数pka也会增加[57],但外界离子强度变化对DHFAE和DHPDS光极的影响相对较小[28]。目前,已有研究证明常见溶质(如NH4+、Fe2+、Mn2+和HS–)不会对包埋于PVA、乙基纤维素或醋酸纤维素基体中pH指示剂的荧光信号产生显著影响[27, 52, 58]。同时由于包埋基体的离子不可渗透性,外界环境中的溶质不会对O2光极信号产生显著的干扰。尽管有报道称气态SO2、Cl2可能是O2光极的干扰源[59],但在大多数的土壤实际应用中,气态SO2、Cl2的含量极低,除了温度之外的干扰都可以忽略不计。与O2光极类似,pCO2光极的信号受外界的干扰较少,主要是因为传感膜表面的光学隔离层可以隔离大部分溶质离子的干扰[60]。然而,也有报道称气态H2S和NH3可以扩散进入光学隔离层[32],且当H2S浓度低于20 mmol/L时,其影响可忽略不计,但当其浓度大于100 mmol/L时,信号干扰较为严重。通常土壤环境中的NH3浓度对pCO2光极信号的影响并不显著[33]。到目前为止所开发的NH4+平面光极对6.0 ~ 7.8范围内的pH变化不敏感[35, 61],但是与pH平面光极类似,外界离子强度会对NH4+光极信号产生影响。一般在实验室设定条件下,环境介质中的离子强度在测定过程中不会发生很大变化,可在与应用环境相似的介质离子强度条件下进行传感膜标定,从而避免由离子强度引起的误差。且在野外现场条件下,也可通过重复标定来消除外界离子强度所产生的信号偏差。
3.4 局限性当评估平面光极技术的可靠性及准确性时,必须重视其可能的边界效应[62]。在大多数应用中,O2含量的动态分布是通过与光极传感器直接接触的物质及其结构来进行研究的,比如在研究生物膜的O2动力学时,生物膜直接生长在光极传感器上,有利于解析O2在非均相生物膜上的真实二维分布[12]。然而,在O2扩散呈径向或球形分布时,光极传感器本身的存在会对O2的三维分布产生畸变作用[63]。如果畸变有明确的几何形状,可以利用简单的扩散模型作为溶质运移和消耗率的函数进行量化,从而纠正传感器的边界影响[64]。但在大多数情况下,尤其是在复杂的土壤环境中,很难依靠简单的模型来实现信号校正。此外,由于光纤面板(fiber-optic face plates, FOFP)具有传光效率高、传像清晰真实以及在光学上具有零厚度等特点,有报道称可以将传感膜直接涂覆在光纤面板上使原始图像从FOFP的一侧以无畸变的方式转移到另一侧[14, 21],然而商用FOFP的尺寸通常较小(50 ~ 70 mm),限制了其在大尺寸区域的应用[14]。
如上所述,发光强度测量容易受到背景环境、发光指示剂分布不均等因素的影响,导致测量精度及稳定性下降。而基于磷光寿命的定量方法,尽管具有较好的准确性和稳定性,但通常需要配置复杂的触发控制电路,使得平面光极测量系统变得复杂。另外,平面光极的测量稳定性主要取决于包埋在基体中的发光指示剂的稳定性。在连续使用过程中,由于发光指示剂易发生光漂白以及泄露现象[29, 65],需要定期进行标定以保证测量结果的准确性,这增加了测量的繁琐性。除此之外,为了减少外界光源干扰,平面光极系统的运行通常需要一个独立的暗室,这意味着大多数的平面光极应用主要集中于实验室。但平面光极同时具备广泛适用性,通过针对性的调整,也可以应用于现场进行长期监测[66](图 2)。

|
图 2 氧气平面光极的现场装置图 Fig. 2 Field application of oxygen specific planar optode system |
土壤O2含量不仅影响作物根系的呼吸作用和土壤微生物活性等,而且对温室气体排放也起着至关重要的作用。得益于平面光极的高时空分辨率,研究者应用O2光极实现了对根土界面、土水界面等土壤微域内O2动态变化过程的原位观测。同时,O2光极也是目前应用最广、发展最完善的一类平面光极。
4.1.1 植物根系采用具有高时空分辨率的O2光极来监测具有高度异质性的根际氧动态,比如根系径向泌氧(radial oxygen loss,ROL),对于了解植物根系泌氧机理及其根际氧化还原特征具有重要作用。Larsen等[67]利用O2光极观察了水稻幼苗根际的O2动态变化(图 3A)。研究表明,根际不同区域O2含量表现出较高的时空异质性,在根尖和幼嫩根系周围有较强的泌氧区,同时根系径向泌氧会受到环境O2水平以及辐照度的调节,即光合作用对植物根系径向泌氧有直接影响。此外,在根系周围1 mm宽的区域还观察到根表金属膜,其分布与观察到的根际氧化带及宽度相对应,这种根表金属膜的形成是植物吸收养分的关键[68]。在另一项研究中,Marzocchi等[69]结合O2光极与15N同位素示踪技术,比较分析了苦草根系径向泌氧在不同光照强度、O2水平下的空间异质性及其对根际N、P循环的影响。研究发现根系径向泌氧主要通过调节根际硝化、反硝化微生物的活性以及根系吸收作用,从而影响根际NH4+和PO43-含量。这种O2水平的时空异质性确保了根际同时发生好氧和厌氧过程,减少了潜在的养分限制,同时最大限度地提高了植物在不同环境胁迫下的适应性。Williams等[70]又联合平面光极和薄膜扩散梯度技术,首次发现水稻根尖区域的O2含量更高,pH更低,一定程度上促进了As、Pb和Fe(Ⅱ)等金属离子的溶解扩散。此外,为了深入了解生物地球化学过程,O2光极常与其他光极传感器联合运用,如pH、CO2等。Blossfeld等[71]介绍了一种可同时用于根际pH和O2动态分析的复合平面光极技术,研究了在不同pH(3.9 ~ 5.9)的还原性缺氧土壤中,3种灯心草属植物根际泌氧对有机酸含量和分布的影响。研究发现伸长区的根际氧浓度日变化显著,且从8周以上的长期监测结果显示,龙须草植物根系泌氧引起的根际氧化酸化的作用明显,小花灯心草则使根际碱化,而片髓灯心草对根际pH无显著影响。Schreiber等[72]也结合pH和O2光极对中国三峡库区的两种耐涝蕨类植物进行了评估,发现光合作用产生的O2可以通过根系通气组织扩散到根际进而氧化根际还原性有毒物质,避免其诱发生理胁迫。Lenzewski等[73]利用平面光极对半边莲根际的O2和CO2含量的动态变化进行了观测,进一步验证了地上部叶片光合作用产生的O2可以通过体内通气组织运输到根部,而这部分O2可增强根际微生物活性,从而增加CO2在根周围的积累,并且在光照条件下,根际好氧微生物氧化分解产生的CO2能够被根系再次吸收,以此来增加无机碳供给、维持植物光合作用。
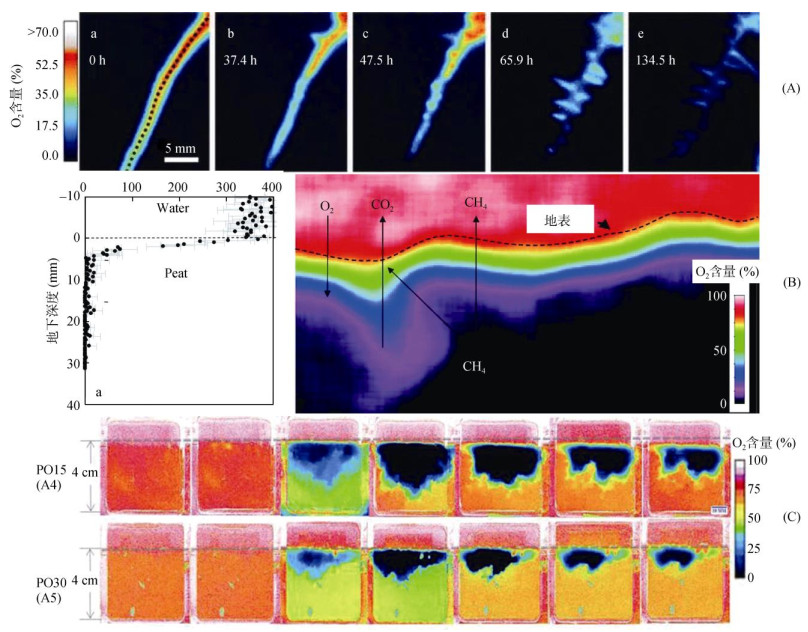
|
水稻根际ROL在5.5 d内的动态变化[67];B. 近地表O2的表观扩散率对CO2、CH4排放的影响[74];C. 不同沼渣施入土壤后O2的时空动态变化[77]) 图 3 O2光极在土壤微观异质性研究中的应用实例 Fig. 3 Application of O2 optodes in soil microscale heterogeneity |
O2平面光极的应用可以实现土壤与地下水位界面中O2含量和分布的实时监测。Rickelt等[54]提出一种将O2传感器和热电偶组合的新型O2光极,并对湿地土壤层的不同深度进行了O2动态和温度的原位测量,研究发现土壤剖面的缺氧界面低于地下水位。在另一项研究中,Askaer等[43]采用O2光极探讨了土壤异质性对泥炭土中O2分布的影响并得出相似的结果。Elberling等[74]研究了土壤水位显著变化后,近地表O2的表观扩散率对土壤CO2和CH4排放的影响(图 3B)。结果表明在排水条件下,O2的消耗量超过CO2的产量且当有氧区的范围大于40 cm时,CH4排放可忽略不计;在淹水条件下,除了简单的气体扩散,O2还可以在水相中通过植物通气组织进行传输。
4.1.3 土壤添加物土壤外源添加物会进一步提高土壤有机质和养分的空间异质性,并通过影响微生物生物量及其活性进而改变土壤O2的有效性和空间分布[75]。利用O2光极实时监测添加外源有机物后土壤O2的时空动态变化,对于揭示土壤氧化代谢异质性、农田温室气体减排以及土壤重金属修复等方面具有重要意义。Zhu等[17]探讨了不同的粪肥处理方法对土壤中O2分布及其对N2O和CO2等温室气体排放速率的影响,发现土壤中O2含量与N2O排放呈显著负相关关系。随后,Christel等[76]结合O2光极和薄膜扩散梯度技术,研究了粪肥和由固体粪肥制成的生物质炭在土壤中的异质分布对土壤O2含量的影响,发现施用固体粪肥和生物质炭均会不同程度导致土壤O2含量下降,且在第一周内平均下降幅度最大。Van Nguyen等[77]将水力停留时间(hydraulic retention time)分别为15 d(PO15)和30 d(PO30)的沼渣施入到土壤表面后,发现土壤的缺氧区域在土层深度1.5 ~ 2.0 cm处发生了显著变化(图 3C)。易降解有机碳含量越高,土壤O2消耗越快(PO15处理);而在试验后期,PO15和PO30处理的土壤O2含量都有所增加,这可能是环境O2的扩散输入以及土壤O2消耗(微生物呼吸和硝化作用)减弱共同作用的结果。Kravchenko等[78]利用O2光极监测了秸秆还田后土壤O2含量变化,揭示了微尺度下秸秆还田后N2O排放机制与土壤孔隙分布以及秸秆降解引发的厌氧微域之间的关系。Rubol等[79]比较分析了不同利用类型的土壤在添加葡萄糖后土壤O2的二维分布,发现外源葡萄糖的添加会在短时间(5 ~ 15 min)内提高局部微生物代谢活性,形成缺氧热点区域,随后土壤氧化还原态的空间异质性会随着O2浓度的下降而逐渐减小,且土壤的这种局部异质性与O2浓度之间的抛物线形关系在不同利用类型的土壤中具有普遍性。除了添加外源有机物外,Elberling等[80]还观察到蚯蚓分泌的黏液会在土壤中形成一个较大的缺氧微区(约0.1 cm2大小),这可能会对土壤中的一些厌氧过程(如反硝化作用等)产生影响。此外,Hoefer等[81]联合薄膜扩散梯度和O2光极研究单质硫(S0)的施用对重金属活化迁移和植物吸收的影响,发现硫的氧化会导致根部土壤酸化以及相关的金属元素Mn、Zn和Cd的活化迁移。
4.2 土壤pH采用pH光极技术可以在土壤以及根-土界面实时监测pH的动态变化,且不会对土壤本身的微环境体系产生干扰。
4.2.1 植物根系平面光极的应用首次实现了植物根际pH二维分布的定量可视化分析,表明植物根系可以驱动根际土壤pH变化,同时pH随距离根表面的远近、沿根轴位置的变化而变化[30, 82]。Blossfeld等[83]的研究结果表明,黑麦草和黑麦草幼根使根际pH分别提高了1.7和1.5个pH单位,而玉米则使根际酸化了0.7个pH单位,这种pH变化对根际痕量金属的溶解以及植物对重金属元素的吸收有显著影响。Hoefer等[84]结合平面光极与薄膜扩散梯度技术,发现沙柳根际土壤pH的下降会导致Al3+、Co2+、Cu2+、Mn2+、Ni2+、Pb2+等金属离子的溶解性升高(图 4A)。Rudolph-Mohr等[85]还发现玉米幼苗根际pH的动态变化主要取决于根系年龄和土壤含水量。还有一些研究强调了根际pH和O2浓度、有机酸之间的动态关系。例如,Schreiber等[72]结合平面pH、O2光极探究了两种耐涝植物在淹水过程以及淹水后其根际酸化的昼夜节律,结果发现由于大量低分子有机酸的积累导致根尖根际pH降低达0.8个单位,但对两种耐涝植物根系的生理生长没有影响。此外,Faget等[86]结合pH光极和绿色荧光蛋白标记(GFP)技术,对两种间作植物的根进行识别、鉴定并观察其根际的pH变化。研究发现菜豆和玉米间作时,其根际的酸化或碱化效应小于非根际土壤,且与二者独立生长时的根际酸化过程存在明显差异,这有助于理解不同物种根系之间以及与土壤之间的相互作用关系。
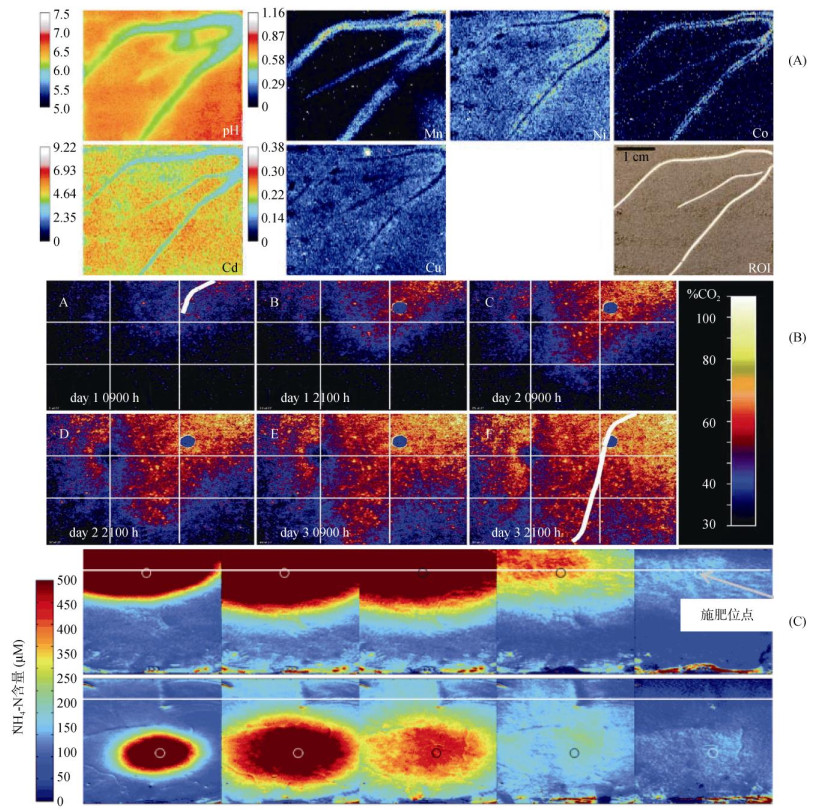
|
图 4 pH、CO2和NH4+平面光极在土壤微观异质性研究中的应用实例 Fig. 4 Application of pH, CO2 and NH4+ optodes in soil microscale heterogeneity |
农田土壤中的各种添加物(秸秆、化肥、生物质炭等)在很大程度上会影响土壤的酸碱平衡及其异质性。大量研究证明生物质炭可以提高酸性土壤pH,增强土壤抗酸化能力[87]。然而在生物质炭颗粒尺度上,有关生物质炭-土壤界面的pH分布以及这种空间分布如何随时间变化的研究还比较缺乏。Buss等[88]就利用pH光极实时监测了生物质炭颗粒-土壤界面的pH分布。他们将污泥生物质炭和麦秆生物质炭分别施用于酸性砂土,并在21 h后观察到土壤-生物质炭界面的pH分布从生物质炭颗粒边缘延伸至其粒径的1 ~ 1.3倍距离处。
4.3 土壤CO2目前,测量土壤CO2的传统分析技术所得时空分辨率通常较低,无法直接获取根际等土壤微域的实际CO2浓度及其异质分布。平面光极可以连续获得土壤CO2的二维分布信息,弥补了现有监测手段的不足。Blossfeld等[19]在淹水土壤中的芥菜根附近检测到高浓度的CO2,研究发现这与根呼吸以及局部微生物活性的增强紧密相关(图 4B)。在另一项研究中,Koop-Jakobsen等[89]在连续光照、黑暗循环处理下对大米草根际CO2动态进行了持续观测,发现大米草根际能够对距根表12.6 mm范围的土壤CO2产生影响,其CO2含量是非根际土壤的3倍且不受光照变化的影响。
4.4 土壤NH4+NH4+光极的开发极大地促进了根区氮素周转的研究。Strömberg等[90]对番茄植株的根际NH4+进行了定量研究,发现番茄的整个根系结构对NH4+都有较强的吸收,尤其是根尖区域对NH4+的获取起着重要作用,且横向细根的吸收效率是主根的两倍左右。Strömberg和Hulth[91-92]还利用NH4+光极记录了施肥后土壤NH4+的分布与扩散。此外,施肥技术的选用不仅会影响土壤NH4+的空间分布,也会影响氮素的净矿化,从而影响土壤有效氮转化的动态变化规律。Delin和Strömberg[34]利用NH4+光极比较了鸡粪和牛粪的施用对农田土壤的氮素矿化过程和NH4+空间分布的影响(图 4C)。结果表明,施肥后肥料中的大部分NH4+被快速吸附到黏粒中,因此黏粒含量较低的砂土NH4+含量显著高于黏土,同时深施有机肥有助于提高土壤NH4+含量。
4.5 其他除O2、pH、CO2等常用光极外,开发其他参数的二维监测是平面光极技术发展的主要方向之一。Pedersen等[13]开发了一种NO3-光极,对NO3-的有效响应范围可达1 ~ 50 mmol,这为实时监测植物根系或异养细菌在多孔介质中对NO3-的吸收提供了研究手段。此外,平面光极技术与其他技术的联合扩展了其在土壤微观异质性研究中的应用,也有利于进一步解析关键生物地球化学过程的空间异质性和动态变化。如前所述,目前已开发出O2-DGT、pH-DGT等[93]平面光极-DGT联用技术。Williams等[70]结合DGT、激光剥蚀(laser ablation)和平面光极3项技术,首次发现水稻根尖附近存在重金属释放通道,为研究元素地球化学循环提出了新思路。又如,结合O2光极和微流控技术,可同时获取微流控系统内的O2梯度分布和内部物理结构的动态信息[94]。再如,平面光极与酶谱技术的联合,促进了土壤酶学和土壤生物过程的研究。Ma等[95]结合土壤酶谱法和pH光极探讨了磷的有效性对羽扇豆排根形成前后的根际磷酸酶活性、pH以及根际扩展范围的影响。结果发现,在形成排根之前,根系吸收磷素的主要策略是增加磷酸酶活性,酸化根际土壤并扩大主根周围的根际范围;而在排根形成之后,根系会调整吸收磷素的关键机制,主要是增加排根周围磷酸酶活性热点区域的面积,并扩大根际有效范围。
5 展望传统技术的破坏性采样或者侵入性探测破坏了土壤微域的结构,影响了测量结果的可靠性,且无法反映土壤热点区域和热点时刻的动态变化过程。平面光极技术的原位、实时、无损、高时空分辨率等特点,弥补了现有监测手段的不足,可以准确获取土壤关键理化参数的微尺度变化过程和分布特征,这对于理解土壤复杂的生物地球化学过程具有重要意义。在技术发展和实际应用层面,以下几个方面将可能成为未来的重点发展方向。
1) 提高传感膜的光稳定性,改进制膜工艺,进一步提高传感器的使用寿命。同时,开展其他发光指示剂的制取及性能测试工作,用于开发其他参数监测的平面光极,如测量其他阴离子、金属阳离子和酶的活性等,也是后续工作的重点内容。
2) 平面光极荧光定量的特性参数有很多,除了激发与发射波长、荧光寿命之外,还有荧光量子产率、荧光偏振等。针对上述不同的荧光特征,可以开发同步扫描、导数光谱、三维光谱、时间分辨率和相分辨率等新技术,提高荧光分析的选择特异性。
3) 目前研究人员陆续开发了一系列包括双参数乃至于多参数同时分析的复合平面光极技术,例如:O2/pCO2、O2/pH、O2/pCO2/pH等,复合平面光极依据不同的荧光发射光谱进行区分,实现对不同化学组分的同步实时测量,这将是平面光极研究的一个重要方向。
4) 平面光极与其他多种技术手段联用,分析关键元素尤其是重金属、C、N、P的生物地球化学反应过程以及土壤酶活性等也是未来的研究热点之一。以目前已开发出的PO-DGT技术为例,可以在此基础上优化DGT容量和平面光极响应时间之间的权衡,以及开发PO-DGT联合技术对其他参数的研究,这对于PO-DGT技术的发展至关重要。
本文综述了国内外关于平面光极应用的创新研究,并展现了平面光极技术在复杂、异质的土壤环境中获取高分辨率数据的独特潜力。平面光极的持续应用与发展可以为复杂动态生境的生物地球化学研究提供强有力的工具,在土壤学研究领域有着广阔的发展空间,尤其是与其他分析技术相结合,有助于深入研究土壤关键元素的生物地球化学转化机制以及实现精细的模型模拟。
| [1] |
赵其国. 发展与创新现代土壤科学[J]. 土壤学报, 2003, 40(3): 321-327 DOI:10.3321/j.issn:0564-3929.2003.03.001 (  0) 0) |
| [2] |
李明辉, 何风华, 申卫军, 等. 基于土壤生物空间异质性分析的空间土壤生态学研究[J]. 土壤, 2005, 37(4): 375-381 DOI:10.3321/j.issn:0253-9829.2005.04.005 (  0) 0) |
| [3] |
季国亮, 王敬华. 用微电极研究碳铵粒肥在水稻土中的释放扩散问题[J]. 土壤学报, 1978, 15(2): 182-186 (  0) 0) |
| [4] |
Klimant I, Meyer V, Kühl M. Fiber-optic oxygen microsensors, a new tool in aquatic biology[J]. Limnology and Oceanography, 1995, 40(6): 1159-1165 DOI:10.4319/lo.1995.40.6.1159 (  0) 0) |
| [5] |
Davison W, Grime G W, Morgan J A W, et al. Distribution of dissolved iron in sediment pore waters at submillimetre resolution[J]. Nature, 1991, 352(6333): 323-325 DOI:10.1038/352323a0 (  0) 0) |
| [6] |
Davison W, Zhang H. In situ speciation measurements of trace components in natural waters using thin-film gels[J]. Nature, 1994, 367(6463): 546-548 DOI:10.1038/367546a0 (  0) 0) |
| [7] |
邓林, 李柱, 吴龙华, 等. 水分及干燥过程对土壤重金属有效性的影响[J]. 土壤, 2014, 46(6): 1045-1051 (  0) 0) |
| [8] |
Glud R N, Ramsing N B, Gundersen J K, et al. Planar optrodes: A new tool for fine scale measurements of two-dimensional O2 distribution in benthic communities[J]. Marine Ecology Progress Series, 1996, 140: 217-226 DOI:10.3354/meps140217 (  0) 0) |
| [9] |
Li C, Ding S M, Yang L Y, et al. Planar optode: A two-dimensional imaging technique for studying spatial-temporal dynamics of solutes in sediment and soil[J]. Earth-Science Reviews, 2019, 197: 102916 DOI:10.1016/j.earscirev.2019.102916 (  0) 0) |
| [10] |
Santner J, Larsen M, Kreuzeder A, et al. Two decades of chemical imaging of solutes in sediments and soils-a review[J]. Analytica Chimica Acta, 2015, 878: 9-42 DOI:10.1016/j.aca.2015.02.006 (  0) 0) |
| [11] |
Schröder C R, Polerecky L, Klimant I. Time-resolved pH/pO2mapping with luminescent hybrid sensors[J]. Analytical Chemistry, 2007, 79(1): 60-70 DOI:10.1021/ac0606047 (  0) 0) |
| [12] |
Glud R N, Santegoeds C M, de Beer D, et al. Oxygen dynamics at the base of a biofilm studied with planar optodes[J]. Aquatic Microbial Ecology, 1998, 14: 223-233 DOI:10.3354/ame014223 (  0) 0) |
| [13] |
Pedersen L L, Dechesne A, Smets B F. A nitrate sensitive planar optode; performance and interferences[J]. Talanta, 2015, 144: 933-937 DOI:10.1016/j.talanta.2015.07.046 (  0) 0) |
| [14] |
Fischer J P, Wenzhöfer F. A novel planar optode setup for concurrent oxygen and light field imaging: Application to a benthic phototrophic community[J]. Limnology and Oceanography: Methods, 2010, 8(6): 254-268 DOI:10.4319/lom.2010.8.254 (  0) 0) |
| [15] |
Kühl M, Rickelt L F, Thar R. Combined imaging of bacteria and oxygen in biofilms[J]. Applied and Environmental Microbiology, 2007, 73(19): 6289-6295 DOI:10.1128/AEM.01574-07 (  0) 0) |
| [16] |
Larsen M, Borisov S M, Grunwald B, et al. A simple and inexpensive high resolution color ratiometric planar optode imaging approach: Application to oxygen and pH sensing[J]. Limnology and Oceanography: Methods, 2011, 9(9): 348-360 DOI:10.4319/lom.2011.9.348 (  0) 0) |
| [17] |
Zhu K, Bruun S, Larsen M, et al. Spatial oxygen distribution and nitrous oxide emissions from soil after manure application: A novel approach using planar optodes[J]. Journal of Environmental Quality, 2014, 43(5): 1809-1812 DOI:10.2134/jeq2014.03.0125 (  0) 0) |
| [18] |
Mayr T, Borisov S M, Abel T, et al. Light harvesting as a simple and versatile way to enhance brightness of luminescent sensors[J]. Analytical Chemistry, 2009, 81(15): 6541-6545 DOI:10.1021/ac900662x (  0) 0) |
| [19] |
Blossfeld S, Schreiber C M, Liebsch G, et al. Quantitative imaging of rhizosphere pH and CO2 dynamics with planar optodes[J]. Annals of Botany, 2013, 112(2): 267-276 DOI:10.1093/aob/mct047 (  0) 0) |
| [20] |
Zhou Z, Shinar R, Allison A, et al. Enhanced photoluminescence of oxygen sensing films through doping with high dielectric constant particles[J]. Advanced Functional Materials, 2007, 17(17): 3530-3537 DOI:10.1002/adfm.200700324 (  0) 0) |
| [21] |
Hancke K, Sorell B K, Lund-Hansen L C, et al. Effects of temperature and irradiance on a benthic microalgal community: A combined two-dimensional oxygen and fluorescence imaging approach[J]. Limnology and Oceanography, 2014, 59(5): 1599-1611 DOI:10.4319/lo.2014.59.5.1599 (  0) 0) |
| [22] |
Behrens J W, Stahl H J, Steffensen J F, et al. Oxygen dynamics around buried lesser sandeels Ammodytes tobianus (Linnaeus 1785): Mode of ventilation and oxygen requirements[J]. The Journal of Experimental Biology, 2007, 210(Pt 6): 1006-1014 (  0) 0) |
| [23] |
König B, Kohls O, Holst G, et al. Fabrication and test of Sol-gel based planar oxygen optodes for use in aquatic sediments[J]. Marine Chemistry, 2005, 97(3/4): 262-276 (  0) 0) |
| [24] |
Kessler A J, Glud R N, Cardenas M B, et al. Quantifying denitrification in rippled permeable sands through combined flume experiments and modeling[J]. Limnology and Oceanography, 2012, 57(4): 1217-1232 DOI:10.4319/lo.2012.57.4.1217 (  0) 0) |
| [25] |
Rudolph N, Esser H G, Carminati A, et al. Dynamic oxygen mapping in the root zone by fluorescence dye imaging combined with neutron radiography[J]. Journal of Soils and Sediments, 2012, 12(1): 63-74 DOI:10.1007/s11368-011-0407-7 (  0) 0) |
| [26] |
Hakonen A, Hulth S. A high-precision ratiometric fluorosensor for pH: Implementing time-dependent non-linear calibration protocols for drift compensation[J]. Analytica Chimica Acta, 2008, 606(1): 63-71 DOI:10.1016/j.aca.2007.10.035 (  0) 0) |
| [27] |
Hakonen A, Hulth S, Dufour S. Analytical performance during ratiometric long-term imaging of pH in bioturbated sediments[J]. Talanta, 2010, 81(4/5): 1393-1401 (  0) 0) |
| [28] |
Weidgans B M, Krause C, Klimant I, et al. Fluorescent pH sensors with negligible sensitivity to ionic strength[J]. Analyst, 2004, 129(7): 645-650 DOI:10.1039/b404098h (  0) 0) |
| [29] |
Stahl H, Glud A, Schröder C R, et al. Time-resolved pH imaging in marine sediments with a luminescent planar optode[J]. Limnology and Oceanography: Methods, 2006, 4(10): 336-345 DOI:10.4319/lom.2006.4.336 (  0) 0) |
| [30] |
Rudolph N, Voss S, Moradi A B, et al. Spatio-temporal mapping of local soil pH changes induced by roots of lupin and soft-rush[J]. Plant and Soil, 2013, 369(1/2): 669-680 (  0) 0) |
| [31] |
Hakonen A, Hulth S. A high-performance fluorosensor for pH measurements between 6 and 9[J]. Talanta, 2010, 80(5): 1964-1969 DOI:10.1016/j.talanta.2009.10.055 (  0) 0) |
| [32] |
Zhu Q Z, Aller R C. A rapid response, planar fluorosensor for measuring two-dimensionalpCO2distributions and dynamics in marine sediments[J]. Limnology and Oceanography: Methods, 2010, 8(7): 326-336 DOI:10.4319/lom.2010.8.326 (  0) 0) |
| [33] |
Zhu Q Z, Aller R C, Fan Y Z. A new ratiometric, planar fluorosensor for measuring high resolution, two-dimensional pCO2 distributions in marine sediments[J]. Marine Chemistry, 2006, 101(1/2): 40-53 (  0) 0) |
| [34] |
Delin S, Strömberg N. Imaging-optode measurements of ammonium distribution in soil after different manure amendments[J]. European Journal of Soil Science, 2011, 62(2): 295-304 DOI:10.1111/j.1365-2389.2010.01326.x (  0) 0) |
| [35] |
Strömberg N, Hulth S. An ammonium selective fluorosensor based on the principles of coextraction[J]. Analytica Chimica Acta, 2001, 443(2): 215-225 DOI:10.1016/S0003-2670(01)01221-1 (  0) 0) |
| [36] |
Zhu Q Z, Aller R C. Planar fluorescence sensors for two-dimensional measurements of H2S distributions and dynamics in sedimentary deposits[J]. Marine Chemistry, 2013, 157: 49-58 DOI:10.1016/j.marchem.2013.08.001 (  0) 0) |
| [37] |
Glud R N, Tengberg A, Kühl M, et al. An in situ instrument for planar O2 optode measurements at benthic interfaces[J]. Limnology and Oceanography, 2001, 46(8): 2073-2080 DOI:10.4319/lo.2001.46.8.2073 (  0) 0) |
| [38] |
Chen R F, Knutson J R. Mechanism of fluorescence concentration quenching of carboxyfluorescein in liposomes: Energy transfer to nonfluorescent dimers[J]. Analytical Biochemistry, 1988, 172(1): 61-77 DOI:10.1016/0003-2697(88)90412-5 (  0) 0) |
| [39] |
Holst G, Kohls O, Klimant I, et al. A modular luminescence lifetime imaging system for mapping oxygen distribution in biological samples[J]. Sensors and Actuators B: Chemical, 1998, 51(1/2/3): 163-170 (  0) 0) |
| [40] |
Song A, Parus S, Kopelman R. High-performance fiber-optic pH microsensors for practical physiological measurements using a dual-emission sensitive dye[J]. Analytical Chemistry, 1997, 69(5): 863-867 DOI:10.1021/ac960917+ (  0) 0) |
| [41] |
Meier R J, Schreml S, Wang X D, et al. Simultaneous photographing of oxygen and pH In Vivo using sensor films[J]. Angewandte Chemie International Edition, 2011, 50(46): 10893-10896 DOI:10.1002/anie.201104530 (  0) 0) |
| [42] |
Hakonen A, Beves J E, Strömberg N. Digital colour tone for fluorescence sensing: A direct comparison of intensity, ratiometric and hue based quantification[J]. The Analyst, 2014, 139(14): 3524-3527 DOI:10.1039/C4AN00063C (  0) 0) |
| [43] |
Askaer L, Elberling B, Glud R N, et al. Soil heterogeneity effects on O2 distribution and CH4 emissions from wetlands: In situ and mesocosm studies with planar O2 optodes and membrane inlet mass spectrometry[J]. Soil Biology and Biochemistry, 2010, 42(12): 2254-2265 DOI:10.1016/j.soilbio.2010.08.026 (  0) 0) |
| [44] |
Holst G, Grunwald B. Luminescence lifetime imaging with transparent oxygen optodes[J]. Sensors and Actuators B: Chemical, 2001, 74(1/2/3): 78-90 (  0) 0) |
| [45] |
Precht E, Franke U, Polerecky L, et al. Oxygen dynamics in permeable sediments with wave-driven pore water exchange[J]. Limnology and Oceanography, 2004, 49(3): 693-705 DOI:10.4319/lo.2004.49.3.0693 (  0) 0) |
| [46] |
Oguri K, Kitazato H, Glud R N. Platinum octaetylporphyrin based planar optodes combined with an UV-LED excitation light source: An ideal tool for high-resolution O2 imaging in O2 depleted environments[J]. Marine Chemistry, 2006, 100(1/2): 95-107 (  0) 0) |
| [47] |
Pischedda L, Cuny P, Esteves J L, et al. Spatial oxygen heterogeneity in a Hediste diversicolor irrigated burrow[J]. Hydrobiologia, 2012, 680(1): 109-124 DOI:10.1007/s10750-011-0907-x (  0) 0) |
| [48] |
Kühl M, Polerecky L. Functional and structural imaging of phototrophic microbial communities and symbioses[J]. Aquatic Microbial Ecology, 2008, 53: 99-118 DOI:10.3354/ame01224 (  0) 0) |
| [49] |
Borisov S M, Seifner R, Klimant I. A novel planar optical sensor for simultaneous monitoring of oxygen, carbon dioxide, pH and temperature[J]. Analytical and Bioanalytical Chemistry, 2011, 400(8): 2463-2474 DOI:10.1007/s00216-010-4617-4 (  0) 0) |
| [50] |
Borisov S M, Klimant I. Ultrabright oxygen optodes based on cyclometalated iridium(Ⅲ) coumarin complexes[J]. Analytical Chemistry, 2007, 79(19): 7501-7509 DOI:10.1021/ac0710836 (  0) 0) |
| [51] |
Rysgaard S, Glud R N, Sejr M K, et al. Denitrification activity and oxygen dynamics in Arctic sea ice[J]. Polar Biology, 2008, 31(5): 527-537 DOI:10.1007/s00300-007-0384-x (  0) 0) |
| [52] |
Zhu Q Z, Aller R C, Fan Y Z. High-performance planar pH fluorosensor for two-dimensional pH measurements in marine sediment and water[J]. Environmental Science & Technology, 2005, 39(22): 8906-8911 (  0) 0) |
| [53] |
Lo Y L, Chu C S, Yur J P, et al. Temperature compensation of fluorescence intensity-based fiber-optic oxygen sensors using modified Stern-Volmer model[J]. Sensors and Actuators B: Chemical, 2008, 131(2): 479-488 DOI:10.1016/j.snb.2007.12.010 (  0) 0) |
| [54] |
Rickelt L F, Askaer L, Walpersdorf E, et al. An optode sensor array for long-term in situ oxygen measurements in soil and sediment[J]. Journal of Environmental Quality, 2013, 42(4): 1267-1273 DOI:10.2134/jeq2012.0334 (  0) 0) |
| [55] |
Coyle L M, Gouterman M. Correcting lifetime measurements for temperature[J]. Sensors and Actuators B: Chemical, 1999, 61(1/2/3): 92-99 (  0) 0) |
| [56] |
Wolfbeis O S, Offenbacher H. Fluorescence sensor for monitoring ionic strength and physiological pH values[J]. Sensors and Actuators, 1986, 9(1): 85-91 DOI:10.1016/0250-6874(86)80009-9 (  0) 0) |
| [57] |
Schröder C R, Weidgans B M, Klimant I. pH fluorosensors for use in marine systems[J]. The Analyst, 2005, 130(6): 907-916 DOI:10.1039/b501306b (  0) 0) |
| [58] |
Hulth S, Aller R C, Engström P, et al. A pH plate fluorosensor (optode) for early diagenetic studies of marine sediments[J]. Limnology and Oceanography, 2002, 47(1): 212-220 DOI:10.4319/lo.2002.47.1.0212 (  0) 0) |
| [59] |
Tengberg A, Hovdenes J, Andersson H J, et al. Evaluation of a lifetime-based optode to measure oxygen in aquatic systems[J]. Limnology and Oceanography: Methods, 2006, 4(2): 7-17 DOI:10.4319/lom.2006.4.7 (  0) 0) |
| [60] |
Schroeder C R, Neurauter G, Klimant I. Luminescent dual sensor for time-resolved imaging of pCO2 and pO2 in aquatic systems[J]. Microchimica Acta, 2007, 158(3/4): 205-218 (  0) 0) |
| [61] |
Strömberg N, Hulth S. A fluorescence ratiometric detection scheme for ammonium ions based on the solvent sensitive dye MC 540[J]. Sensors and Actuators B: Chemical, 2003, 90(1/2/3): 308-318 (  0) 0) |
| [62] |
Glud R N. Oxygen dynamics of marine sediments[J]. Marine Biology Research, 2008, 4(4): 243-289 DOI:10.1080/17451000801888726 (  0) 0) |
| [63] |
Polerecky L, Volkenborn N, Stief P. High temporal resolution oxygen imaging in bioirrigated sediments[J]. Environmental Science & Technology, 2006, 40(18): 5763-5769 (  0) 0) |
| [64] |
Frederiksen M S, Glud R N. Oxygen dynamics in the rhizosphere of Zostera marina: A two-dimensional planar optode study[J]. Limnology and Oceanography, 2006, 51(2): 1072-1083 DOI:10.4319/lo.2006.51.2.1072 (  0) 0) |
| [65] |
Lee S K, Okura I. Photostable optical oxygen sensing material: Platinum tetrakis(pentafluorophenyl) porphyrin immobilized in polystyrene[J]. Analytical Communications, 1997, 34(6): 185-188 DOI:10.1039/a701130j (  0) 0) |
| [66] |
Vieweg M, Trauth N, Fleckenstein J H, et al. Robust optode-based method for measuring in situ oxygen profiles in gravelly streambeds[J]. Environmental Science & Technology, 2013, 47(17): 9858-9865 (  0) 0) |
| [67] |
Larsen M, Santner J, Oburger E, et al. O2 dynamics in the rhizosphere of young rice plants (Oryza sativa L.) as studied by planar optodes[J]. Plant and Soil, 2015, 390(1/2): 279-292 (  0) 0) |
| [68] |
Wei X M, Zhu Z K, Wei L, et al. Biogeochemical cycles of key elements in the paddy-rice rhizosphere: Microbial mechanisms and coupling processes[J]. Rhizosphere, 2019, 10: 100145 DOI:10.1016/j.rhisph.2019.100145 (  0) 0) |
| [69] |
Marzocchi U, Benelli S, Larsen M, et al. Spatial heterogeneity and short-term oxygen dynamics in the rhizosphere of Vallisneria spiralis: Implications for nutrient cycling[J]. Freshwater Biology, 2019, 64(3): 532-543 DOI:10.1111/fwb.13240 (  0) 0) |
| [70] |
Williams P N, Santner J, Larsen M, et al. Localized flux maxima of arsenic, lead, and iron around root apices in flooded lowland rice[J]. Environmental Science & Technology, 2014, 48(15): 8498-8506 (  0) 0) |
| [71] |
Blossfeld S, Gansert D, Thiele B, et al. The dynamics of oxygen concentration, pH value, and organic acids in the rhizosphere of Juncus spp[J]. Soil Biology and Biochemistry, 2011, 43(6): 1186-1197 DOI:10.1016/j.soilbio.2011.02.007 (  0) 0) |
| [72] |
Schreiber C M, Zeng B, Blossfeld S, et al. Monitoring rhizospheric pH, oxygen, and organic acid dynamics in two short-time flooded plant species[J]. Journal of Plant Nutrition and Soil Science, 2012, 175(5): 761-768 DOI:10.1002/jpln.201000427 (  0) 0) |
| [73] |
Lenzewski N, Mueller P, Meier R J, et al. Dynamics of oxygen and carbon dioxide in rhizospheres of Lobelia dortmanna-a planar optode study of belowground gas exchange between plants and sediment[J]. The New Phytologist, 2018, 218(1): 131-141 DOI:10.1111/nph.14973 (  0) 0) |
| [74] |
Elberling B, Askaer L, Jørgensen C J, et al. Linking soil O2, CO2, and CH4 concentrations in a wetland soil: Implications for CO2 and CH4 fluxes[J]. Environmental Science & Technology, 2011, 45(8): 3393-3399 (  0) 0) |
| [75] |
Warkentin B P. The changing concept of soil quality[J]. Journal of Soil and Water Conservation, 1995, 50(3): 226-228 (  0) 0) |
| [76] |
Christel W, Zhu K, Hoefer C, et al. Spatiotemporal dynamics of phosphorus release, oxygen consumption and greenhouse gas emissions after localised soil amendment with organic fertilisers[J]. Science of the Total Environment, 2016, 554/555: 119-129 DOI:10.1016/j.scitotenv.2016.02.152 (  0) 0) |
| [77] |
Van Nguyen Q, Jensen L S, Bol R, et al. Biogas digester hydraulic retention time affects oxygen consumption patterns and greenhouse gas emissions after application of digestate to soil[J]. Journal of Environmental Quality, 2017, 46(5): 1114-1122 DOI:10.2134/jeq2017.03.0117 (  0) 0) |
| [78] |
Kravchenko A N, Toosi E R, Guber A K, et al. Hotspots of soil N2O emission enhanced through water absorption by plant residue[J]. Nature Geoscience, 2017, 10(7): 496-500 DOI:10.1038/ngeo2963 (  0) 0) |
| [79] |
Rubol S, Dutta T, Rocchini D. 2D visualization captures the local heterogeneity of oxidative metabolism across soils from diverse land-use[J]. Science of the Total Environment, 2016, 572: 713-723 DOI:10.1016/j.scitotenv.2016.06.252 (  0) 0) |
| [80] |
Elberling B, Kühl M, Glud R N, et al. Methods to assess high-resolution subsurface gas concentrations and gas fluxes in wetland ecosystems[M].
American Society of Agronomy and Soil Science Society of America, Madison, WI, USA, 2015: 949-970
(  0) 0) |
| [81] |
Hoefer C, Santner J, Puschenreiter M, et al. Localized metal solubilization in the rhizosphere of Salix smithiana upon sulfur application[J]. Environmental Science & Technology, 2015, 49(7): 4522-4529 (  0) 0) |
| [82] |
Kreuzeder A, Santner J, Scharsching V, et al. In situ observation of localized, sub-mm scale changes of phosphorus biogeochemistry in the rhizosphere[J]. Plant and Soil, 2018, 424(1/2): 573-589 (  0) 0) |
| [83] |
Blossfeld S, Perriguey J, Sterckeman T, et al. Rhizosphere pH dynamics in trace-metal-contaminated soils, monitored with planar pH optodes[J]. Plant and Soil, 2010, 330(1/2): 173-184 (  0) 0) |
| [84] |
Hoefer C, Santner J, Borisov S M, et al. Integrating chemical imaging of cationic trace metal solutes and pH into a single hydrogel layer[J]. Analytica Chimica Acta, 2017, 950: 88-97 DOI:10.1016/j.aca.2016.11.004 (  0) 0) |
| [85] |
Rudolph-Mohr N, Tötzke C, Kardjilov N, et al. Mapping water, oxygen, and pH dynamics in the rhizosphere of young maize roots[J]. Journal of Plant Nutrition and Soil Science, 2017, 180(3): 336-346 DOI:10.1002/jpln.201600120 (  0) 0) |
| [86] |
Faget M, Blossfeld S, von Gillhaussen P, et al. Disentangling who is who during rhizosphere acidification in root interactions: Combining fluorescence with optode techniques[J]. Frontiers in Plant Science, 2013, 4: 392 DOI:10.3389/fpls.2013.00392 (  0) 0) |
| [87] |
Chintala R, Schumacher T E, McDonald L M, et al. Phosphorus sorption and availability from biochars and soil/biochar mixtures[J]. CLEAN-Soil, Air, Water, 2014, 42(5): 626-634 DOI:10.1002/clen.201300089 (  0) 0) |
| [88] |
Buss W, Shepherd J G, Heal K V, et al. Spatial and temporal microscale pH change at the soil-biochar interface[J]. Geoderma, 2018, 331: 50-52 DOI:10.1016/j.geoderma.2018.06.016 (  0) 0) |
| [89] |
Koop-Jakobsen K, Mueller P, Meier R J, et al. Plant-sediment interactions in salt marshes-an optode imaging study of O2, pH, and CO2 gradients in the rhizosphere[J]. Frontiers in Plant Science, 2018, 9: 541 DOI:10.3389/fpls.2018.00541 (  0) 0) |
| [90] |
Strömberg N. Determination of ammonium turnover and flow patterns close to roots using imaging optodes[J]. Environmental Science & Technology, 2008, 42(5): 1630-1637 (  0) 0) |
| [91] |
Strömberg N, Hulth S. Assessing an imaging ammonium sensor using time correlated pixel-by-pixel calibration[J]. Analytica Chimica Acta, 2005, 550(1/2): 61-68 (  0) 0) |
| [92] |
Strömberg N, Hulth S. Time correlated pixel-by-pixel calibration for quantification and signal quality control during solute imaging[J]. Sensors and Actuators B: Chemical, 2006, 115(1): 263-269 DOI:10.1016/j.snb.2005.09.012 (  0) 0) |
| [93] |
李希媛, 滕辉, 赵玉杰, 等. 薄膜扩散梯度(DGT)技术在环境微界面物质运移过程研究中的应用[J]. 农业环境科学学报, 2020, 39(8): 1649-1660 (  0) 0) |
| [94] |
Grate J W, Liu B W, Kelly R T, et al. Microfluidic sensors with impregnated fluorophores for simultaneous imaging of spatial structure and chemical oxygen gradients[J]. ACS Sensors, 2019, 4(2): 317-325 DOI:10.1021/acssensors.8b00924 (  0) 0) |
| [95] |
Ma X M, Mason-Jones K, Liu Y, et al. Coupling zymography with pH mapping reveals a shift in lupine phosphorus acquisition strategy driven by cluster roots[J]. Soil Biology and Biochemistry, 2019, 135: 420-428 DOI:10.1016/j.soilbio.2019.06.001 (  0) 0) |
 2021, Vol. 53
2021, Vol. 53


