2. 中国科学院大学, 北京 100049;
3. 山东省济南市商河县农业农村局, 济南 251600
大豆(Glycine max)富含蛋白质、脂肪,是食品及饲料工业的重要原材料,也是我国重要的粮食和经济农作物。目前我国大豆的种植面积约在970万hm2以上,年均产量超过1 400万t[1]。随着经济社会的发展、人民生活水平的改善,大豆消费量急剧增加,富含营养的菜豆也日益改变着人们的膳食结构。据统计,我国的大豆消费量每年超过1亿t,高度依赖从国外进口,尤其面对当今错综复杂的国际形势,这无疑增加了粮食供应的风险,提高大豆产量迫在眉睫[2]。另外菜豆(Phaseolus vulgaris)是我国出口杂粮的重要组成部分,且其基因组小于大豆基因组,便于操作,可为大豆的研究提供参考[3]。除了培育高产大豆品种外,了解包括大豆及菜豆在内的豆科作物的氮素营养特征,从而进行科学的氮肥配施是提高大豆产量的又一重要途径。
氮是植物生长发育必需的大量元素,对高需氮的大豆来说更是尤为重要。大豆对氮的吸收依赖于生物固氮和土壤(包括肥料),这两部分氮源的相对贡献比率受环境条件、农艺管理和遗传因素的影响,一般来说,生物固氮占大豆不同生育期总吸氮量的40% ~ 80%[4]。有报道指出,大豆苗期和籽粒形成后期施用少量氮肥有利于植株的生长并延长根瘤固氮,最终贡献于籽粒的形成[5]。因此,若要实现大豆的高产还需配以氮肥的施用。
我国大豆生产主要集中在东北春大豆区和黄淮海夏大豆区,产量约占全国的65% ~ 80%[6],这些地区多为通气较好的旱地土壤,土壤中主要氮素形态是硝态氮(NO3--N),因此一般认为大豆对硝态氮有良好的吸收利用效率。但有研究表明,与施用硝态氮相比,单一施用铵态氮(NH4+-N)使大豆具有更高的根瘤干重、总氮积累和固氮量[7]。单一供应铵还可以增加大豆幼苗的硝酸还原酶活性,促进植物的氮素利用效率。植物根系在吸收NH4+的同时会释放H+,使根际土壤pH下降,活化铁等微量元素促进植株的生长[8-9]。目前农业生产上所用氮肥多为尿素,在刚施入土壤的短时间内以铵态氮为主,因此研究大豆对铵态氮的吸收利用效率也是了解其氮素营养特征的重要内容。植物对铵的吸收主要是由其体内的一些铵转运蛋白(ammonium transporter,AMT)介导的[10],研究AMT基因对外界pH条件的响应情况有助于深入了解大豆氮素营养的分子机制。
土壤中的铵态氮和硝态氮是植物吸收氮素的最主要的形式。目前的研究主要集中在大豆对硝态氮的利用上,关于其对铵态氮的吸收和利用研究还较为少见。而且前期研究显示,铵态氮对植物生长的抑制作用可能是由于pH的效应[11],但是具体的症状及两者之间的关系并不明确。本研究采用室内水培试验模拟田间铵硝营养环境,研究了大豆对氮素营养的响应情况,并实时监测其根际营养液pH的变化,进而在不同的pH条件下研究了大豆对铵态氮的利用效率,以及AMT基因的表达情况,明确了铵态氮与pH的关系,为田间大豆的施肥管理提出了一定的建议。
1 材料与方法 1.1 供试材料供试大豆品种为徐豆14,菜豆品种为81-6,由山东省济南市商河县农业农村局提供。
1.2 试验设计大豆和菜豆种子经2.5% 的次氯酸钠消毒15 min,蒸馏水清洗后浸种24 h,置于尼龙网上,暗处发芽。待其长出真叶后,选择长势一致的幼苗,移至长9.5 cm×宽9 cm×高12.5 cm、体积1.2 L的PVC(聚氯乙烯塑料制品)遮光培养罐中,每罐2穴,每穴2颗苗,后置于人工气候室培养。人工气候室昼夜温度设定为27℃/25℃,光暗周期为16 h/8 h,相对湿度为70%,光强为400 μmol/ (m2·s)。试验前期用改良的Hoagland (无氮)全营养液培养幼苗,两周后分别进行以下处理:①不同氮素形态对植株生长的影响:缺氮(其余营养元素同Hoagland全营养液)、单一供应铵态氮(0.5 mmol/L (NH4)2SO4)、单一供应硝态氮(1 mmol/L NaNO3),为防止营养液中硝化作用的发生,加入硝化抑制剂0.7 µmol/L二氰二氨(C2H4N4),用NaOH和HCl溶液调节营养液pH至6.5,7 d不更换营养液,并每12 h测定培养液中pH的变化;②不同pH对植株生长的影响:在单一供应铵态氮(0.5 mmol/L硫酸铵)的基础上,分别固定营养液pH 4.5和pH 6.5,并每天更换营养液,同时随机更换培养罐的位置。每个处理设3个重复,处理7 d后,收获植株并测定相关指标。
1.3 生理指标的测定水培处理7 d后收获各植株。首先,将根在0.1 mmol/L CaSO4溶液中浸泡5 min,双蒸水润洗擦干;然后,将整个植株分为地上部和根系,测量鲜物质量后,分别装入纸信封中,放入105℃烘箱杀青30 min,然后70℃烘至恒重并称重。干样经粉碎消煮(H2SO4-H2O2消煮法)后用化学分析仪(SmartChem 200, Analyzer Medical System Inc., Guidonia, Rome, Italy)测定全氮含量。
1.4 植株根系AMT基因表达丰度的测定将pH 4.5和pH 6.5处理24 h的植株根系,迅速置于液氮中冷冻后放入–80℃冰箱冻存,每个处理至少设3个重复。根系总RNA的提取利用TaKaRa公司的RNA提取TRizol试剂盒进行;定量PCR的cDNA模板制备用TaKaRa公司的反转录试剂盒进行,引物[12]根据AMT基因的DNA序列进行设计,见https://doi.org/10.6084/m9.figshare.16464885.v1,由南京金斯瑞生物科技有限公司合成,SYBR® Premix Ex TaqTM由TaKaRa公司生产,荧光定量PCR仪为BioRad CFX96TM Real-Time System C1000 Thermal Cycler。用2-CT方法分析目的基因的相对表达量。
1.5 大豆和菜豆的主要AMT与其他物种AMT家族的系统进化树分析与关键位点序列比对AMT序列由Phytozome(https://phytozome.jgi.doe.gov/index.html),NCBI(http://www.ncbi.nlm.nih.gov/)和UniProt(http://www.uniprot.org/)网站下载获得,利用DNAMAN对这些AMT序列进行比对分析,并构建AMT系统发育树。
1.6 数据处理与分析数据使用SPSS 16.0进行统计分析,采用独立样本t-检验分析不同pH间各项指标的差异显著性。多重比较采用Duncan法,差异显著水平为5%。使用SigmaPlot 12.5绘图。
2 结果与分析 2.1 大豆和菜豆幼苗生长对铵硝营养的响应与无氮对照处理相比,供给1 mmol/L纯硝形态的氮素营养均显著增加了大豆和菜豆的总生物量和总氮积累量,而供给1 mmol/L的纯铵无显著影响(图 1)。持续一周的供硝处理,大豆和菜豆植株鲜物质量比对照增加了70% 和51%,但连续供铵条件下,地上部分和根系鲜物质量与对照相比基本无显著性差异(图 1A和1D),说明单一铵营养对豆科作物的生长贡献较弱。另外,与对照相比,纯硝处理使大豆和菜豆干物质量增加了24% 和40%,但是纯铵处理并没有改变其地上部分和根系的干物质量(图 1B和1E)。进一步测定不同氮形态下植株地上部分和根系的氮积累量,发现供应铵、硝的处理,整个植株氮积累量均较无氮处理提高了1倍~ 2倍,但铵、硝处理之间没有显著性差异(图 1C和1F)。以上结果表明,与纯硝处理相比,单独供铵对植株生长的促进效果较弱。
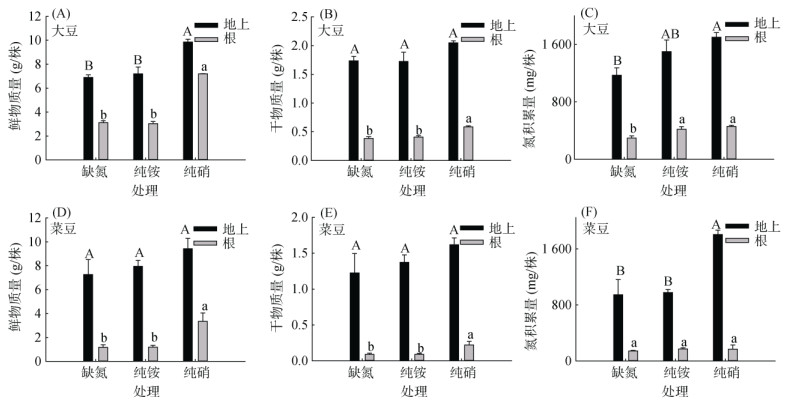
|
(图中不同大写或小写字母表示地上部分或根系在不同处理间差异达P < 0.05显著水平;下同) 图 1 不同氮素形态处理下大豆和菜豆植株的生物量及氮积累量 Fig. 1 Biomass and nitrogen accumulation of soybean and common soybean seedlings under different nitrogen sources |
为了更好地了解大豆和菜豆根系对不同氮素形态的响应特征,每隔12 h,对培养罐中的营养液进行根际pH监测(图 2)。在缺氮条件下,随着时间的推移,大豆和菜豆营养液中pH均急剧下降,24 h左右pH下降了1个单位,在72 ~ 96 h(3 ~ 4 d)左右趋于平缓(pH 3 ~ 4),溶液酸化严重(图 2)。纯铵供应下营养液pH的变化趋势与对照较为一致。单一供硝条件下,营养液pH变化缓慢,直到120 ~ 144 h(5 ~ 6 d)pH才下降1个单位(图 2)。基于此,本研究推测纯铵营养无法促进豆科作物的生长可能是由于溶液的酸化导致的。
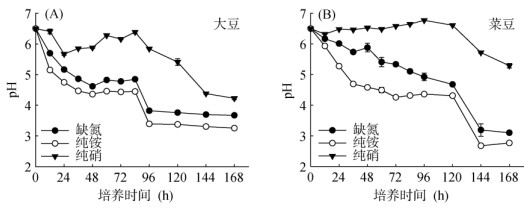
|
图 2 不同形态氮素处理大豆和菜豆培养液中pH的变化 Fig. 2 Changes of pH in culture mediums of soybean and common bean treated with different nitrogen sources |
为了进一步探究铵营养下豆科作物的生理响应机制,本研究设定了控制营养液pH的试验。在统一供应1 mmol/L NH4+的基础上,将pH分别固定为4.5和6.5,并每天更换营养液保持pH的恒定(图 3)。相比于pH 6.5,pH 4.5条件下显著降低了大豆和菜豆的总生物量和总氮积累量。与pH 6.5相比,pH 4.5处理下大豆和菜豆地上部分鲜物质量降低了31% 和18%,根系鲜物质量也降低了37% 和33%(图 3A和3D)。比较不同pH条件下的干物质量,pH 4.5处理下大豆和菜豆地上部分的干物质量较pH 6.5降低了27% 和15%,根系干物质量也降低了29% 和28%(图 3B和3E),大豆和菜豆植株的氮积累量也有45%和28%的降幅(图 3C和3F)。说明在单一供应铵态氮的状态下,相比于pH 6.5,较低的pH会影响大豆和菜豆植株对铵态氮的吸收。
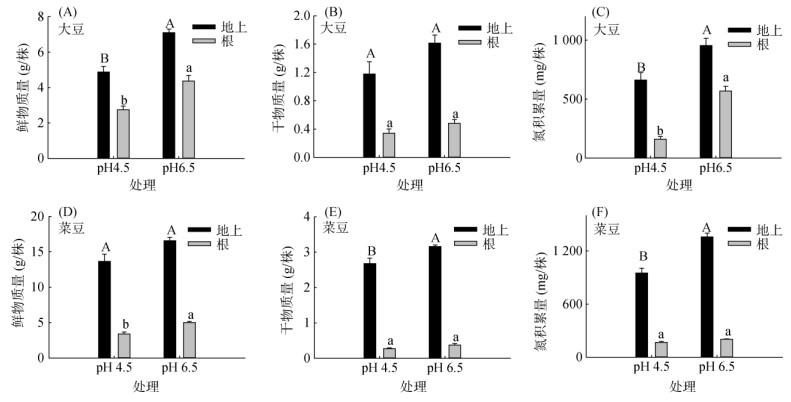
|
图 3 不同pH处理下大豆和菜豆幼苗的生物量及氮积累量 Fig. 3 Biomass and nitrogen accumulation of soybean and common soybean seedlings under different pH treatments |
上述结果表明,供铵状态下,较低的pH会抑制大豆和菜豆植株对铵态氮的吸收(图 3)。由于植物的吸铵过程主要是由AMT转运蛋白介导的,因此可以推测大豆和菜豆根系中可能存在着受低pH抑制的AMT系统。对不同物种的AMT基因进行了系统进化树分析,结果(图 4)显示,大豆中GmAMT1;2-1;6属于AMT1亚家族,GmAMT2;1-2;3,GmAMT4;3和GmAMT4;5属于AMT2亚家族;菜豆中PvAMT1;1-1;4属于AMT1亚家族,PvAMT2;2和PvAMT3;1属于AMT2亚家族(图 4)。大豆AMT和菜豆AMT亲缘关系较近,两者的AMT在亲缘关系上离喜铵作物水稻都较远,反映了AMT基因在物种进化上的分化。
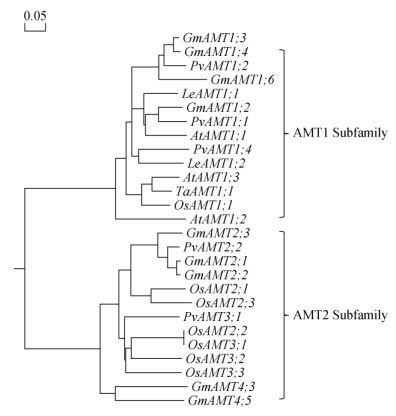
|
图 4 不同植物的AMT基因系统发育树分析 Fig. 4 Phylogenetic tree for the amino acid sequences of plant AMTs |
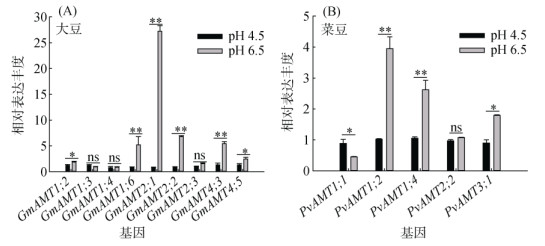
为了进一步了解pH对豆科作物铵营养的作用机制,本研究检测了大豆和菜豆体内主要的铵转运蛋白AMT在不同pH条件下的基因表达情况(图 5),在一定程度上反映了潜在的蛋白质表达水平[13]。相比于pH 6.5,大部分大豆的AMT基因(GmAMT1;2、GmAMT1;6、GmAMT2;1、GmAMT2;2、GmAMT4;3、GmAMT4;5)在pH 4.5时受到显著抑制,GmAMT1;3、GmAMT1;4、GmAMT2;3基本不受pH的调控(图 5A)。相比于pH 6.5,菜豆PvAMT1;2、PvAMT1;4、PvAMT3;1在pH 4.5时也受到显著抑制,PvAMT1;1则受到促进,这与Ortiz-Ramirez等[14]在蛋白水平对PvAMT1;1的研究较为一致;而PvAMT2;2不受pH的调控(图 5B)。以上结果说明,单一供铵时,豆科作物根系中的AMT基因在较低pH条件下受到抑制,这也解释了溶液酸化抑制豆科植物对铵的吸收。
|
(图中*、**分别表示同一基因在不同pH处理间差异在P < 0.05、P < 0.01水平显著;ns表示差异不显著) 图 5 不同pH处理下大豆和菜豆根系中铵转运蛋白基因的表达情况 Fig. 5 Expression of ammonium transporter gene in soybean and common soybean roots under different pH treatments |
目前报道的大多数植物AMT(番茄LeAMT1;1、番茄LeAMT1;2、拟南芥AtAMT1;1、水稻OsAMT1;1)转运活性不受pH调控,只有小麦TaAMT1;1和菜豆PvAMT1;1的转运活性受低pH促进。Søgaard等[15]和Ortiz-Ramirez等[14]的研究表明,H199E突变使PvAMT1;1不受pH影响,L56F突变也使TaAMT1;1失去了对pH的依赖性。为了进一步分析大豆和菜豆AMT响应低pH的关键位点,对不同植物AMT的上述两个关键位点区域进行了序列比对,发现在不同AMT中这两个位点高度保守(图 6),但是却导致了不同的pH响应模式,说明这两个位点并不具有普适性,可能还存在另外的关键位点有待发掘。

|
图 6 不同植物AMT基因的潜在pH调控关键位点比对 Fig. 6 Comparison of potential key residues for pH regulation of AMT gene in plants |
植物在生长发育过程中主要吸收两种矿质氮源,即铵态氮和硝态氮。大豆是典型的旱作植物,普遍认为其偏好硝态氮,而忽视了铵态氮对其生长的影响。近年来有研究表明,增施适量氮肥可促进植株的光合作用,提高大豆产量[5]。本文通过水培试验模拟了田间可能出现的铵态氮或是硝态氮为主导的氮素环境,发现铵态氮未能有效促进大豆的生长,但其植株积累的氮含量却与硝态氮供应时的植株氮积累量相近,暗示植株吸收铵态氮的过程中其生长受到了某种因素的限制,而在菜豆中相似的现象可为对大豆的研究提供参考。
根际pH调节植物根系质膜的电势及周围土壤环境,影响根系对氮素的吸收[16]。铵态氮和硝态氮作为两种主要的无机氮源,植物在吸收氮素营养的同时也会通过离子交换影响根际pH。其中NO3-的吸收伴随着HCO3-的释放,导致根系pH上升,不利于某些微量营养素的活化,植物需要消耗更多的能量来获取生长所需要的营养元素[17]。而单一的NH4+供应则导致了根系向土壤释放大量的H+,使得根际土壤酸化,pH过低会影响质膜的完整性和H+流入根细胞[18]。本试验中,纯硝处理中溶液的pH变化缓慢,植株生长良好。相比于纯硝处理,单一供铵处理显著降低了根际pH,在燕麦中也发现了相同的现象[19]。为了明确酸化是否影响了豆科作物对铵态氮的吸收,本试验在统一供铵的基础上,设置了不同的pH梯度,结果发现,较低的pH显著抑制了大豆和菜豆对铵态氮的吸收,从而限制植株的生长。有研究指出,在纯铵营养下,较高的pH增加了杜鹃根系中铁的浓度[20],在pH 6.0的土壤中施用铵态氮肥较有利于蓝浆果植株的生长[21]。此外,在同时供应铵态氮和硝态氮时,小麦在pH 6.5时的长势较好且总吸氮量较高,可以吸收等量的铵态氮、硝态氮[22];铵态氮作为氮源时小白菜根系生长的最适pH为弱碱性,铵硝配施可提高小白菜的品质[23]。本研究结果与前人报道的较为一致,但后者多为喜铵作物,而围绕大豆这种喜硝作物的相关研究较少。
生物固定的氮和土壤氮都可以作为豆科植物的有效氮源,但生物固氮过程需要消耗更多的能量和碳[24],因此,平衡好生物固氮与外源施氮之间的关系有利于豆科作物的生长及减少环境污染。有报道指出,土壤中的硝态氮对植物根瘤的形成及固氮有抑制作用[25],铵态氮条件更有利于紫花苜蓿的结瘤固氮和植株的正常生长。另外,局部施用铵态氮介导的根际pH的降低促进了玉米根系大量增生和磷等微量元素有效性的提高;铵态氮的存在使得植物叶绿素合成和叶面积发育增强,从而促进光合作用和干物质积累[26]。在pH相对较高的石灰性土壤中,铵态氮诱导的根际酸化可以提高植物对养分的吸收,尤其是对钙、磷等元素,且大豆慢生根瘤菌在偏酸的条件下竞争结瘤能力较强[27]。综上所述,通过优化氮素形态来刺激根系增殖和调控根际过程可能是改善植物生长和元素利用效率的有效途径,而豆科作物对铵态氮的吸收利用对于其以硝态氮为主导的氮素营养特征来说是一个重要的优化机制。
植物体内铵态氮的吸收主要是由铵转运蛋白AMT介导的,本研究中较低的pH显著抑制了铵转运蛋白的表达,表明较低的pH不利于植株对铵的吸收,限制了植株生长。目前已报道的植物AMT中只有小麦TaAMT1;1和菜豆PvAMT1;1的转运活性与pH相关,表现为酸刺激的调控模式,分别由L56和H199来调控,这两个位点都位于其铵转运通道的关键位置,且与H+的运输直接相关[14-15]。通过序列比对发现,这两个位点在受低pH抑制的大豆和菜豆AMT中高度保守,因此可能还存在其他决定低pH抑制AMT活性的关键氨基酸。而其他的AMT如番茄LeAMT1;1、番茄LeAMT1;2、拟南芥AtAMT1;1、水稻OsAMT1;1在蛙卵细胞中表达时转运活性不受pH影响[28]。结合本研究中大多数大豆和菜豆的AMT受到酸抑制的现象,表明不同物种的AMT中存在不同的pH调节模式,其以此来规避外界胁迫环境。
近年来,由酸沉降和过度施用化肥造成的土壤酸化日趋严重,无论是北方大豆主产区还是南方黄淮海区域均有土壤酸化的风险,且有报道指出豆科作物的种植会加剧土壤酸化[29-30]。研究表明,施用有机肥可以提高土壤pH,且有机肥中常含有大量有效碳和其他养分,可提高土壤铵态氮初级同化速率[31]。另外,施用石灰性物质、农作物秸秆以及生物质炭均可有效地缓解农田土壤酸化[32]。考虑到豆科作物所生长的环境,虽然在大部分生长周期内,其根系周围占主导地位的氮源是硝态氮,但是目前实际田间生产中氮肥多施用尿素,尿素施用到土壤中,先水解为铵,因而在短时间内土壤中会存在大量的铵态氮,本研究模拟的就是这样一种情况,如何使植物及时、高效利用这部分铵态氮值得注意。本文猜测,豆科作物对铵的吸收利用(有时限性)可能是其以硝为主导的氮素营养机制的一个重要补充。本研究发现较低pH会抑制豆科作物对铵态氮的吸收转化,那么田间可以通过增施少量的有机肥或石灰性物质缓解土壤酸化以促进作物对铵态氮的高效利用。
4 结论相比于硝态氮为主导的氮素环境,铵态氮显著降低了营养液pH,抑制大豆的生长。而若保持较高的pH,豆科作物的铵转运蛋白被明显激活,植株也可以很好地吸收利用铵态氮,从而促进植株的生长。可见,田间可配施一定量的碱性肥料来缓解土壤酸化,减少氮损失,从而促进豆科作物对铵态氮的吸收利用效率。
| [1] |
中华人民共和国国家统计局. 中国统计年鉴——2017[EB/OL]. [2021-09-10] http://www.stats.gov.cn/tjsj/ndsj/2017/indexch.htm.
(  0) 0) |
| [2] |
盖钧镒. 盖钧镒: 中国大豆产业发展很大程度上取决于政策调控[J]. 黑龙江粮食, 2018(9): 40-45 (  0) 0) |
| [3] |
孙海燕, 杜丹凤, 郭伟. 腐植酸浸种对低温胁迫下菜豆幼苗抗氧化系统的影响[J]. 植物生理学报, 2020, 56(11): 2408-2416 (  0) 0) |
| [4] |
Santachiara G, Borrás L, Salvagiotti F, et al. Relative importance of biological nitrogen fixation and mineral uptake in high yielding soybean cultivars[J]. Plant and Soil, 2017, 418(1/2): 191-203 DOI:10.1007/s11104-017-3279-9 (  0) 0) |
| [5] |
丁娇, 韩晓增, 邹文秀, 等. 长期施肥对大豆生长状况及产量的影响[J]. 大豆科学, 2012, 31(5): 778-783 DOI:10.3969/j.issn.1000-9841.2012.05.019 (  0) 0) |
| [6] |
杨文钰, 雍太文, 任万军, 等. 发展套作大豆, 振兴大豆产业[J]. 大豆科学, 2008, 27(1): 1-7 (  0) 0) |
| [7] |
Gan Y B, Stulen I, van Keulen H, et al. Low concentrations of nitrate and ammonium stimulate nodulation and N2 fixation while inhibiting specific nodulation (nodule DW g-1 root dry weight) and specific N2 fixation (N2 fixed g-1 root dry weight) in soybean[J]. Plant and Soil, 2004, 258(1): 281-292 DOI:10.1023/B:PLSO.0000016558.32575.17 (  0) 0) |
| [8] |
邹春琴, 张福锁. 叶片质外体pH降低是铵态氮改善植物铁营养的重要机制[J]. 科学通报, 2003, 48(16): 1791-1795 DOI:10.3321/j.issn:0023-074X.2003.16.016 (  0) 0) |
| [9] |
Zhang X J, Liu H, Zhang S J, et al. NH4+-N alleviates iron deficiency in rice seedlings under calcareous conditions[J]. Scientific Reports, 2019, 9: 12712 DOI:10.1038/s41598-019-49207-9 (  0) 0) |
| [10] |
Wirén N V, Merrick M. Regulation and function of ammonium carriers in bacteria, fungi, and plants//Boles E, Krämer R. Molecular mechanisms controlling transmembrane transport[M]. Berlin Heidelberg: Springer, 2004: 95-120.
(  0) 0) |
| [11] |
Schroder J L, Zhang H L, Girma K, et al. Soil acidification from long-term use of nitrogen fertilizers on winter wheat[J]. Soil Science Society of America Journal, 2011, 75(3): 957-964 DOI:10.2136/sssaj2010.0187 (  0) 0) |
| [12] |
Kobae Y, Tamura Y, Takai S, et al. Localized expression of arbuscular mycorrhiza-inducible ammonium transporters in soybean[J]. Plant and Cell Physiology, 2010, 51(9): 1411-1415 DOI:10.1093/pcp/pcq099 (  0) 0) |
| [13] |
Salmon K, Hung S P, Mekjian K, et al. Global gene expression profiling in Escherichia coli K12:The effects of oxygen availability and fnr[J]. Journal of Biological Chemistry, 2003, 278(32): 29837-29855 DOI:10.1074/jbc.M213060200 (  0) 0) |
| [14] |
Ortiz-Ramirez C, Mora S I, Trejo J, et al. PvAMT1;1, a highly selective ammonium transporter that functions as H+/NH4+ symporter[J]. Journal of Biological Chemistry, 2011, 286(36): 31113-31122 DOI:10.1074/jbc.M111.261693 (  0) 0) |
| [15] |
Søgaard R, Alsterfjord M, MacAulay N, et al. Ammonium ion transport by the AMT/Rh homolog TaAMT1;1 is stimulated by acidic pH[J]. Pflügers Archiv-European Journal of Physiology, 2009, 458(4): 733-743 DOI:10.1007/s00424-009-0665-z (  0) 0) |
| [16] |
Zhu Y Y, Di T J, Xu G H, et al. Adaptation of plasma membrane H+-ATPase of rice roots to low pH as related to ammonium nutrition[J]. Plant, Cell & Environment, 2009, 32(10): 1428-1440 (  0) 0) |
| [17] |
马庆旭. 植物对氨基酸的吸收及pH和Cd胁迫对其吸收的影响机制[D]. 杭州: 浙江大学, 2019.
(  0) 0) |
| [18] |
Brix H, Dyhr-Jensen K, Lorenzen B. Root-zone acidity and nitrogen source affects Typha latifolia L. growth and uptake kinetics of ammonium and nitrate[J]. Journal of Experimental Botany, 2002, 53(379): 2441-2450 DOI:10.1093/jxb/erf106 (  0) 0) |
| [19] |
孙亚卿, 邵金旺, 王莹, 等. 氮素形态对燕麦生长和根际pH值的影响[J]. 华北农学报, 2004, 19(3): 59-61 (  0) 0) |
| [20] |
Turner A J, Arzola C I, Nunez G H. High pH stress affects root morphology and nutritional status of hydroponically grown Rhododendron (Rhododendron spp.)[J]. Plants, 2020, 9(8): 1019 DOI:10.3390/plants9081019 (  0) 0) |
| [21] |
刘星凡, 姜燕琴, 韦继光, 等. 在不同pH值土壤中铵硝比对南方高丛蓝浆果生长的影响[J]. 植物资源与环境学报, 2014, 23(2): 60-64 (  0) 0) |
| [22] |
何文寿, 李生秀, 李辉桃. 营养液pH对小麦生长及吸收铵、硝态氮的影响[J]. 土壤, 1998, 30(3): 143-146, 124 (  0) 0) |
| [23] |
马庆旭, 吴良欢, 曹小闯, 等. 营养液pH和氮形态对小白菜生长、氮素吸收及品质的影响[J]. 水土保持学报, 2015, 29(6): 64-68, 177 (  0) 0) |
| [24] |
Lambers H, Shane M W, Cramer M D, et al. Root structure and functioning for efficient acquisition of phosphorus: Matching morphological and physiological traits[J]. Annals of Botany, 2006, 98(4): 693-713 (  0) 0) |
| [25] |
王骁. 几种豆科植物固氮作用对不同环境因子的响应研究[D]. 济南: 山东大学, 2018.
(  0) 0) |
| [26] |
Jing J, Rui Y, Zhang F, et al. Localized application of phosphorus and ammonium improves growth of maize seedlings by stimulating root proliferation and rhizosphere acidification[J]. Field Crops Research, 2010, 119(2/3): 355-364 (  0) 0) |
| [27] |
杨江科, 周琴, 周俊初. pH对土壤中土著快、慢生大豆根瘤菌结瘤的影响[J]. 应用生态学报, 2001, 12(4): 639-640 (  0) 0) |
| [28] |
Yang S Y, Hao D L, Cong Y, et al. The rice OsAMT1;1 is a proton-independent feedback regulated ammonium transporter[J]. Plant Cell Reports, 2015, 34(2): 321-330 (  0) 0) |
| [29] |
孟红旗, 刘景, 徐明岗, 等. 长期施肥下我国典型农田耕层土壤的pH演变[J]. 土壤学报, 2013, 50(6): 1109-1116 (  0) 0) |
| [30] |
徐仁扣. 土壤酸化及其调控研究进展[J]. 土壤, 2015, 47(2): 238-244 (  0) 0) |
| [31] |
Zhang J B, Cai Z C, Yang W Y, et al. Long-term field fertilization affects soil nitrogen transformations in a rice-wheat-rotation cropping system[J]. Journal of Plant Nutrition and Soil Science, 2012, 175(6): 939-946 (  0) 0) |
| [32] |
鲁艳红, 廖育林, 聂军, 等. 长期施用氮磷钾肥和石灰对红壤性水稻土酸性特征的影响[J]. 土壤学报, 2016, 53(1): 202-212 (  0) 0) |
2. University of Chinese Academy of Sciences, Beijing 100049, China;
3. Shanghe County Bureau of Agriculture and Rural Affairs, Jinan 251600, China
 2021, Vol. 53
2021, Vol. 53


