2. 杂交水稻国家重点实验室, 湖南杂交水稻研究中心, 长沙 410125;
3. 湖南美鑫隆生态环保科技有限公司, 长沙 410125
镉(Cd)是人体非必需元素,在自然界中常以化合物状态存在,一般含量很低,正常环境状态下,不会影响人体健康。20世纪以来,随着现代工业的发展,Cd广泛应用于半导体、电镀、饲料化肥等领域,同时大气[1-2]、水体[3]Cd污染也日益严重,进而造成农田土壤中Cd含量的积累。牲畜粪便、矿质肥料的使用也加剧了农田Cd积累。据调查中国土壤中的Cd 55% 源于牲畜粪便,35% 源于大气沉降,8% 源于肥料[4]。Cd迁移率高、毒性大,易通过食物链富集于人体。Cd在人体内的生物半衰期为10 ~ 30 a,会造成人体肝脏、肾脏功能障碍,破坏人体的免疫系统,造成骨骼软化和恶性肿瘤的产生,早在1993年就被国际癌症研究机构列为1类致癌物[5-6]。
根据国家环境保护部和国土资源部2014年发布的《全国土壤污染状况调查公报》[7],我国7%的土壤存在Cd污染,其中0.5% 的土壤存在重度污染。20世纪50年代,日本富山县神通川流域居民出现了肾小管功能障碍和骨骼软化等疾病,研究发现该疾病是由Cd在人体内的大量积累引起的,其中当地居民长期食用Cd含量超标的大米是造成体内Cd大量积累的主要原因[8]。调查表明,在以大米为主食的地区,人均每天从大米中摄入20 ~ 40 μg Cd[9],对人类健康系统造成了极大威胁。雷鸣等[10]测定了湖南市场上112份大米的Cd含量,其平均Cd含量为0.28 mg/kg,超过国家标准(0.20 mg/kg),而其中21% 的大米Cd含量超过平均值。
减少稻米Cd含量对于稻谷食用安全和人类健康具有重要意义。前人从生理生化、遗传等不同角度对水稻Cd积累机制进行研究,提出一系列Cd污染治理策略,但许多观点仍存在争论。本文将在Cd从土壤装载到水稻植株、Cd从根向地上部及茎叶向籽粒转运3个方面深入探讨相关研究进展,以期为水稻Cd污染治理提供参考。
1 水稻根部对Cd的吸收机理 1.1 水稻根部对Cd的吸收方式土壤中的Cd存在多种形式,包括:可交换态Cd(CdEX)、碳酸盐结合态Cd(CdCB)、铁锰结合态Cd(CdOX)、有机结合态Cd(CdOC)、残渣态Cd(CdRES)。其中可交换态Cd易被植物体吸收、移动性高,可用于衡量土壤Cd的活性,是生物有效态Cd [11-12]。土壤有效态Cd以主动运输与被动运输两种形式进入水稻,主动运输即跨膜运输,需要转运蛋白的参与,是水稻吸收Cd2+的主要途径;而被动运输是通过细胞间隙的自由扩散进入植物体内[13]。
1.2 参与水稻Cd吸收相关基因目前鉴定出的Cd吸收基因(表 1),大多也参与Fe2+、Zn2+、Mn2+等二价阳离子的吸收转运。例如,锌铁调控蛋白ZIP(ZRT,IRT-like protein)家族部分基因,Cd2+能够利用OsIRT1与OsIRT2进入水稻根部,并利用OsIRT1向地上部运输。培养液中缺乏Fe元素会诱导这两个基因的表达,激活Fe吸收系统,导致更多的Cd2+被吸收至根部,但没有增加向地上部转运;在缺Fe培养液中施加Fe后,根部积累的Cd2+向地上部转运,地上部Cd含量增加,根部Cd含量下降[14]。OsZIP6参与水稻对Cd2+、Co2+、Fe2+的吸收与转运,在根茎叶中均有表达,在Fe2+、Mn2+、Zn2+缺乏时其表达量增加,在酸性条件下其转运增强[15]。OsZIP5、OsZIP9是两个串联重复的基因,协同调节Cd和Zn的吸收,基因敲除后会减少水稻对Cd和Zn的摄取,过表达OsZIP9显著提高了地上部组织的Cd和Zn含量[16]。与Fe转运有关的自然抗性相关巨噬细胞蛋白NRAMP(natural resistance- associated macrophage protein)家族中的OsNRAMP1[17]、OsNRAMP5[18]被证实参与水稻对Cd的吸收与转运,它们功能相似,在某些功能上能够互补。Chang等[19]通过基因敲除试验发现这两个基因的双敲突变体降Cd效率最大,单独敲除OsNRAMP5的降Cd效率高于单独敲除OsNRAMP1。Cd含量高的品种根部OsNRAMP1表达量高于Cd含量较低的品种,过表达OsNRAMP1会增加植物体内Cd的含量;OsNRAMP1的作用机制可能是将Cd2+转运至细胞质然后进入木质部,并能够控制Cd2+的有效性[17]。OsNRAMP5在水稻的穗和根部大量表达,有助于水稻对Cd2+的吸收与转运[18]。OsNRAMP5除了吸收转运Cd2+,还参与Fe2+、Mn2+的吸收转运,由于金属阳离子之间的竞争作用,地上部Mn与Cd吸收积累呈现负相关。Wang等[20]研究表明,OsNRAMP5的失活导致Cd含量显著降低,但对产量与米质造成了影响,产量与整精米率下降,垩白度与垩白粒率上升。
|
|
表 1 水稻中已被克隆的参与Cd吸收的基因 Table 1 Cloned genes involved in Cd uptake in rice |
OsHKT2;4是高亲和性K+转运蛋白(high-affinity K+ transport proteins)家族中的一员,编码一个非选择性的阳离子通道,可以渗透Ca2+、Fe2+、Mn2+、Zn2+、Cd2+等二价阳离子[21]。OsCd1是一种质膜蛋白,参与水稻Cd的吸收及其在籽粒中的积累,主要在根的外皮层、皮层、内皮层、中柱细胞表达;OsCd1的第8外显子的SNP22的错位突变导致了Cd转运能力的差异。OsCd1存在两种基因型,在950个水稻品种中,粳型水稻品种基因型均为OsCd1v449,99% 的籼稻品种基因型为OsCd1D449。对127个水稻进行单倍型分析后,分别测定了OsCd1v449和OsCd1D449品系的籽粒Cd含量,结果表明OsCd1D449品系的籽粒Cd含量约为OsCd1v449品系的2倍。直接敲除OsCd1会对水稻生长产生影响,将粳稻中等位基因OsCd1v449导入到籼稻中是改良籼稻Cd积累特性更有效的方法[22]。OsO3L2、OsO3L3是两个细胞核基因,Cd处理会诱导它们在根部表达,Wang等[23]认为它们可能与组蛋白H2A相互作用修饰染色质,从而调节下游基因表达,进而调控Cd2+的吸收与籽粒Cd积累。
2 Cd2+向水稻茎叶转运的机理 2.1 Cd2+向茎叶转运的方式Cd由根部进入木质部并向茎部的转运主要包括共质体途径和质外体途径,共质体途径是跨膜运输,质外体运输是利用水稻的细胞间隙、细胞壁和导管等结构进行运输[25]。茎部向地上部的运输主要是通过木质部进行的,前人研究表明,籽粒Cd含量的关键决定因素是根到茎的木质部运输而不是根对土壤Cd的吸收[26]。
2.2 水稻Cd向茎叶转运的相关基因前人鉴定的Cd茎叶转运相关基因主要有OsHMA2、OsHMA3、LCD、OsCCX2、OsZIP7和CAL1。Takahashi等[27]发现重金属ATP酶基因OsHMA2,主要在根维管束表达,调控Cd和Zn的木质部运输,并参与向地上部的运输。缺Fe时OsHMA2在根中表达增加,在茎中表达减少。OsHMA2过表达植株叶片Cd含量显著降低,根部Cd含量没有显著变化。Yamaji等[28]认为OsHMA2野生型上端茎的Cd含量高于下端茎,而OsHMA2突变体各个茎的Cd含量没有显著差异;突变体木质部Cd含量与野生型相差不大,但茎上部的剑叶、糙米等器官Zn含量低于野生型,表明OsHMA2主要在茎节韧皮部优先向生殖器官转运Cd、Zn中发挥作用,促进了籽粒Cd含量的增加。但突变体由于缺乏Zn元素生长受到了抑制,产量与生物量均显著降低。OsHMA3是重金属ATP酶(heavy metal ATPase)家族的一员,主要在根部表达,OsHMA3能将Cd2+转运到液泡中,功能缺失后,Cd在茎中积累,导致根到茎的迁移率升高[29]。过表达OsHMA3能显著降低籽粒Cd含量并增加对Cd的耐受力[30]。Liu等[31]利用93-11和PA64s的重组自交系在7号染色体定位并克隆了GCC7(OsHMA3)。由于启动子区域7个核苷酸的变化,等位基因GCC7PA64s的启动子转录活性高于GCC793-11,最终导致GCC7PA64s减少了籽粒Cd含量,GCC793-11增加了籽粒Cd含量。随后作者研究了2 543份种质资源的OsHMA3启动子区域7个核苷酸的序列类型,发现81.9% 的籼稻品种与93-11相同,9.9% 与PA64s相同;而粳稻中48.2% 的品种与PA64s相同,32.4% 与93-11相同。证明OsHMA3也是影响籼粳亚种Cd积累差异的重要基因。
低Cd基因LCD参与Cd的地上部转运与籽粒积累,在根维管束和茎的韧皮部伴胞中表达,LCD突变体的生物量、产量与野生型没有明显差异,但籽粒Cd含量下降了55%(2009年)和43%(2010年),Shimo等[32]推测LCD在维管中表达的可溶性蛋白质改变了Cd2+的转运。OsCCX2主要在茎节的木质部表达,是一个Ca2+交换基因,负责将Cd2+转运至木质部。敲除该基因后,根部向地上部的Cd转运减少,进而减少了籽粒Cd含量[33]。OsZIP7在Zn和Cd的根部木质部转运和茎维管束转运中发挥关键作用,负责向发育中的水稻组织和籽粒转运Cd2+。敲除该基因后,新叶Cd含量下降,而根部和茎基部积累大量Cd2+[34]。CAL1是一个调控叶片Cd积累的基因,不会影响籽粒中的Cd含量;CAL1蛋白螯合细胞质中的Cd,并将其分泌到胞外进入木质部,利用蒸腾作用进行长距离运输进入叶片,不参与韧皮部Cd的转运,因此不会影响籽粒Cd含量[35]
3 Cd2+由茎叶向籽粒转运的机理 3.1 籽粒Cd的来源Rodda等[36]提出籽粒中的Cd2+有可能的两个来源:①Cd2+从根茎木质部直接转运至籽粒;②茎秆、剑叶中的Cd被重新活化,由韧皮部直接转运至籽粒,韧皮部的转运可能是籽粒Cd积累的主要途径,籽粒中91% ~ 100% 的Cd来自韧皮部[37]。Zhang等[38]发现糙米Cd含量与叶片Cd含量显著正相关,认为糙米中的Cd主要来源于叶片而不是茎。Wang等[39]通过对不同生育时期Cd胁迫水稻喷施外源水杨酸(SA)发现:在灌浆期,水稻叶片是主要的籽粒Cd来源器官,SA的施用能阻隔Cd2+从叶片向籽粒的转运。
3.2 水稻Cd由茎叶向籽粒转运的相关基因目前鉴定的与Cd由茎叶向籽粒转运相关的基因有OsLCT1[40]、OsPCS1[41]、OsPCS2[41]等。OsLCT1是一个低亲和性阳离子转运体基因,参与Ca2+、Zn2+的转运及韧皮部Cd2+转运。该基因在灌浆期茎节和叶片中大量表达,而营养生长期表达量较低。沉默OsLCT1减少了韧皮部Cd的转运,从而降低了籽粒Cd含量,但不影响木质部的Cd运输[40]。OsPCS1、OsPCS2是两个编码螯合肽(PC)的基因,Das等人[41]利用RNAi沉默OsPCS1、OsPCS2后,籽粒Cd含量比野生型降低了51%,As含量降低了35%,分析认为当它们被沉默后,合成的PC减少,PC-Cd与PC-As复合物的合成随之减少并积累在液泡,从而导致了籽粒中Cd和As含量降低。
4 影响Cd吸收与转运的因素 4.1 影响水稻Cd吸收的因素影响水稻Cd吸收的因素主要是外部环境与自身遗传背景,而外部环境主要是指土壤Cd的总量与有效性。因此为了减少水稻对Cd的吸收,可以通过杂交育种改良水稻的基因型,也可以通过施用土壤调理剂等农艺措施将Cd固定从而减少进入水稻体内的Cd。
4.1.1 土壤理化性质土壤理化性质包括pH、氧化还原电位(Eh)、有机质含量等指标,是决定土壤Cd溶解度与有效性的主要因素。前人研究表明随着土壤pH的升高,Cd被固定和吸附为结合态,生物有效态Cd含量会逐渐降低,籽粒中的Cd含量也会随之降低[42]。对于pH调控Cd有效性的机制,前人从土壤微生物、Cd2+的螯合等多个角度做了研究。Zhang等[43]推测pH的升高导致了土壤中铁还原菌丰度降低,进而降低了Cd的有效性。Huang等[12]在Cd污染实验田连续4 a施用石灰,结果表明土壤pH升高,Cd被固定为其他形态,有效态Cd含量降低,糙米Cd含量也随之下降。Park等[44]认为土壤pH升高时,羧基、酚基、羟基、羰基等官能团与>H+分离,与Cd2+的络合增加。Yang等[45]研究表明,施用石灰会增加Cd吸收基因OsIRT1、OsNRAMP5的表达,甚至低剂量(0.2 g/kg)的生石灰会增加Cd2+在精米及茎叶上的积累。
Eh是衡量土壤溶液氧化还原状态的指标,而水分管理会直接影响土壤氧化还原电位。土壤水分较少时,Eh值升高,此时土壤处于氧化状态,S元素多以SO42-存在,Cd以Cd2+存在,Cd的溶解度升高;在淹水状态下,Eh值较低,土壤处于还原状态,SO42-被还原为S2-,与Cd2+结合形成CdS沉淀,Cd在土壤溶液中的溶解度降低[46]。氧化还原电位还会影响氢氧化铁等矿物相的稳定,氧化还原电位降低时矿物相增加了对Cd2+吸附,Cd由生物有效态转变为铁锰结合态[42]。淹水灌溉处理可以降低水稻对Cd吸收积累,但也会造成其他重金属有效性上升、产量降低、水资源浪费等问题。Arao等[46]研究结果表明,在抽穗前后3周淹水,能够有效降低籽粒Cd含量,但籽粒中的As含量却显著增加,产量也有所降低。Wan等[47]利用江西与湖南两种土壤进行试验,发现保持淹水能使江西土壤栽培水稻各部位的Cd含量降低,但湖南土壤栽培水稻的籽粒Cd含量没有显著降低,暗示淹水能否减少水稻籽粒Cd吸收可能与土壤类型、结构、状态有关。
不同类型与组分的土壤固定吸附Cd2+的能力存在差异。例如:细粒土因其包含大量的Fe、Mn(OH)2等活性矿物,具有更多的有效性位点,所以更易与Cd2+结合;土壤中的有机质可吸附土壤中Cd2+,促进土壤微生物的增殖,微生物分泌的多糖、脂多糖、糖蛋白等物质的官能团可吸附络合Cd2+,降低Cd2+的生物有效性,即有机质含量较高的细粒土更易固定Cd2+ [44]。根据前人在不同类型土壤种植水稻的研究发现:不同类型的土壤Cd积累能力从强到弱依次为:红壤、青紫泥、乌栅土;而红壤强于水稻土强于潮土[48]。在施用牲畜粪便、作物秸秆等有机肥时,要注意其本身的重金属含量,选用合格产品;还应考虑有机肥与土壤重金属之间的互作效应。越来越多的研究表明,秸秆还田会降低土壤pH、增加氧化还原电位,导致有效态Cd2+含量增加[49]。
4.1.2 土壤共存离子土壤中的共存离子,一方面作为营养成分为植物生长提供必需的营养元素,另一方面可以与Cd相互作用,影响水稻对Cd的吸收。它们的作用方式主要包括:竞争阳离子通道、调控抗氧化、调控基因表达、调控氧化还原、物理吸附和络合等。
NO3-是水稻重要的氮素来源,Yang等人[50]研究表明施用过量NO3-会增加根尖OsIRT1的表达和Cd的吸收,增加水稻茎叶及籽粒中的Cd含量。万亚男[13]在较高Cd浓度(5 μmol/L)培养液中添加硒酸盐,降低了水稻对Cd2+的吸收及转运;在低Cd浓度(0.1 μmol/L和1 μmol/L)培养液中添加亚硒酸盐能显著降低水稻对Cd2+的吸收与转运,而硒酸盐的作用不显著。Cui等[51]通过在Cd胁迫水稻细胞悬浮液中添加Se2+,发现Se2+可以调节木质素合成基因与OsNRAMP5、OsHMA2等Cd吸收转运相关基因的表达,并增强了细胞壁的厚度,减少了水稻对Cd2+的吸收,降低了Cd2+对水稻的毒性。
王耀晶等[52]研究发现:在Cd胁迫下施用硅肥,能显著提高水稻的产量,降低糙米Cd含量。彭华等[53]研究发现施用硅肥可以提高土壤pH,降低Cd2+的有效性,减少Cd2+由茎秆向叶片及籽粒的转运,最终显著降低稻米中的Cd含量。Chen等人[54]利用水培试验研究发现,Si和B具有减少Cd2+的毒害、减少地下部与地上部Cd含量的功能,同时施用Si和B时,其功能更加显著。Chen等提出Si和B能够相互作用,提高水稻的抗氧化能力,抑制Cd吸收相关基因的表达,进而减少水稻中Cd2+的含量,推测这种离子间的相互作用在Cd2+吸收转运过程中普遍存在。
Zn是水稻生长的必需元素,但过量的Zn会对水稻生长造成毒害。张涵彤等[55]通过水培研究发现,低浓度的Zn2+与Cd2+协同作用,促进了水稻对Cd2+的吸收;中等浓度(100 μmol/L)的Zn2+与Cd2+产生拮抗,减少水稻对Cd2+的吸收,有利于水稻生长;但当Zn2+浓度过大(如3.06×103 μmol/L)时,会对水稻生长造成抑制。硫(S)是重要的必需元素,Cao等人[56]研究认为,S可以促进根表铁膜的形成,促进与Cd的螯合并将Cd固定在液泡中,减少了Cd的积累。
4.1.3 根表铁膜水稻为了适应长期淹水环境,根系形成大量通气组织进行根际泌氧(ROL),氧气释放到根际组织时会氧化Fe2+、Mn2+等还原物,形成一层红棕色的膜,称为根表铁膜。根表铁膜的形成受多种因素调控,磷肥[55]、油菜籽饼[57]、Fe2+[58]等均会促进根表铁膜形成。
目前对于根表铁膜的研究仍存在争议,一般认为,根表铁膜是根系的屏障,可以阻绝部分重金属进入根系。万亚男[13]、Zhao等[59]、Liu等[60]认为根表铁膜的形成增加了根表Cd含量,但抑制了根系对Cd的吸收。Fu等[58]则认为在Cd胁迫时添加Fe2+促进根表铁膜的形成,使根表Cd积累量减少了54.8%,进而减少地上部Cd含量。董明芳等[61]研究也认为含Cd培养液中添加Fe2+、Mn2+能够降低根表铁膜中的Cd含量,减少了地上部的Cd积累。Zhang等[38]则研究认为根表铁膜有一定的阻隔Cd2+的功能,但其效果有限,且当根表铁膜中的Fe3+ 含量达到22.5 g/kg后,会增加Cd2+在叶片中的积累。也有部分学者认为,根表铁膜中富集的重金属会促进根系中重金属的积累。Zhou等[62]研究表明根表铁膜可以抑制Cd与Cu的吸收,但会增加Pb的地上部积累。Zeng等[63]认为根表铁膜Cd含量与水稻体内Cd含量呈正比,根表铁膜促进了Cd的吸收与转运。Deng等[64]认为,直播稻根表铁膜中的Fe、Mn含量显著低于抛秧和移栽稻,导致了直播稻积累的Cd和Pb显著提高。总的来说,目前对于根表铁膜的认识与研究仍存在许多不足,得出的结论存在争议,缺乏系统性研究,根表铁膜对重金属的作用可能与重金属种类及胁迫程度等外界环境因素有关。
4.2 影响水稻Cd转运的因素Cd2+的转运,易受外源物质调控。外源的叶面阻隔剂可以通过调控基因表达、清除活性氧、增强Cd2+的螯合等作用减少Cd2+的地上部运输,是一种有效的Cd污染治理策略。目前应用的叶面阻隔剂主要可以分为3类:阳离子矿质元素、阴离子矿质元素、有机物。
目前研究的阳离子矿质元素主要有:Si、Mn、Zn等,阳离子矿质元素降Cd的作用机理大多为离子间转运的协同作用和拮抗作用。Rizwan等[65]利用盆栽试验喷施纳米二氧化硅与二氧化钛,提高了水稻的光合作用和生物量,增强了抗氧化能力,进而降低了水稻组织中的Cd含量。Wang等[66]在灌浆早期喷施ZnSO4显著降低了糙米、精米Cd含量。Ali等[67]在移栽后喷施100 mg/L纳米级ZnO显著降低了地上部和地下部的Cd含量,推测其作用的机理是Zn2+与Cd2+间吸收转运存在拮抗作用。Lv等[68]在水稻灌浆期喷施ZnSO4、ZnSO4+MnSO4、ZnSO4+KH2PO4 3组叶面阻隔剂,均能显著降低糙米Cd含量,其中ZnSO4+MnSO4降Cd效率最显著,达到36.63% ~ 55.78%,可能是由于Zn2+与Mn2+存在协同作用,Zn2+、Mn2+与Cd2+存在拮抗作用。周一敏等[69]在孕穗早期喷施纳米MnO2,MnO2增强了叶片光合作用和抗氧化能力,促进了根表铁膜的形成,进而显著降低了糙米Cd含量。阴离子矿质元素降Cd的机制是与Cd2+进行螯合、减轻Cd2+毒害等。Liu等[70]在叶片喷施Na2S显著降低了籽粒Cd含量,S2–通过增强光合作用、调控蛋白合成、维持细胞正常形态,通过将Cd2+隔离在液泡与细胞壁来减少Cd积累。Liu等[71]在水稻分蘖期和扬花期喷施Na2HPO4、Na2S、Na2SiO3、Na2SeO3等物质,也均能显著降低籽粒Cd含量,其中阴离子矿质元素S、P通过竞争Cd2+的吸收转运、调控Cd2+吸收转运相关蛋白结构与功能、减轻Cd2+毒害3种途径减少Cd2+的积累。施用有机物可以降低Cd的生物有效性,增强水稻抗氧化能力。张烁等[72]在水稻齐穗期喷施苹果酸,显著降低了Cd在植株地上部各器官的积累,抑制了Cd从剑叶到穗的转运,推测其作用机理可能是苹果酸与Cd2+结合降低了Cd的有效性,因此降低了Cd2+的转运。Yang等[73]在灌浆期一次性喷施0.4 ~ 50 mmol/L的甘油,使糙米Cd含量降低28.5% ~ 60.4%,甘油将Cd阻隔在液泡中并降低Cd的生物有效性,抑制了Cd向籽粒的转运。Rizwan等[74]在移栽后4次喷施天门冬氨酸,增强了水稻的抗氧化能力、光合作用,保障了水稻正常的生理功能,进而水稻植株的生物量增加,Cd含量降低。
水稻不同品种及不同亚种间,均存在Cd吸收、转运与积累能力的差异。总体而言,水稻籽粒Cd积累能力表现为籼稻>籼粳中间型>粳稻[75-76]。同一品种在不同环境下,也显示出不同的Cd积累特征,籽粒Cd含量与土壤Cd含量呈正比[77],且一般而言酸性土壤中生长的水稻籽粒Cd含量高于中性和碱性土壤[78]。籽粒Cd积累量是基因与环境互作的结果,是吸收、转运共同作用的结果。剖析吸收转运生理过程的机理,能够加速筛选关键生理指标;解析不同品种间遗传背景的差异、鉴定与Cd吸收转运积累相关的基因,将促进低Cd品种的选育。
5 研究展望如何保障稻米中安全的Cd含量是亟待解决的问题。降低稻米Cd含量不仅可以通过降低稻米的Cd积累效率来实现,也可以通过降低土壤有效态Cd含量和降低相关吸收转运基因的表达,从而减少籽粒Cd积累来实现(图 1)。
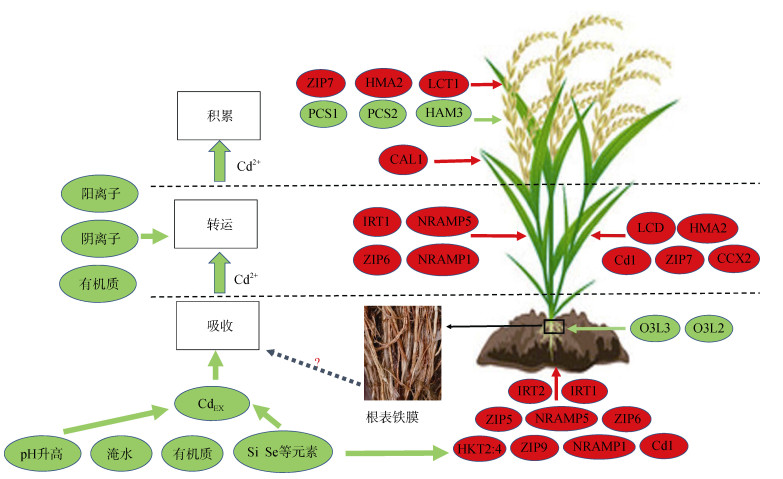
|
(红色箭头及示意图表示促进Cd的吸收、转运、积累;绿色箭头及示意图表示抑制Cd的吸收、转运、积累) 图 1 水稻Cd吸收、转运、积累机制示意图 Fig. 1 Schematic diagram of absorption, transport and accumulation mechanism of rice Cd |
综合分析水稻对Cd吸收、Cd2+在水稻中转运积累的特征和影响因素,实现稻米低Cd积累的途径可以从4个方面着手(表 2)。一是Cd污染土地的治理。土壤治理包括生物修复、物理治理、化学淋洗,主要应用于高度污染土壤的修复。生物修复主要是指利用超积累植物去富集土壤中的Cd,进而降低土壤Cd含量。物理治理是利用电场驱动Cd2+的富集。化学淋洗是基于化学淋洗剂对于Cd2+的吸附作用,将Cd2+从土壤中萃取出来。土壤修复成本高、易造成二次污染、生物修复周期长,化学淋洗易破坏土壤结构,不适宜在水稻生产上大面积推广。二是Cd2+的钝化。实现Cd2+钝化的措施可以分为农艺措施和土壤调理剂,前人研究认为可以降低Cd有效性的农艺措施有深耕、人工插秧、后期淹水灌溉等,人工插秧相较于直播增加了劳动成本,后期淹水则会降低水稻产量。土壤钝化剂的主要作用机理是降低Cd的生物有效性,是目前应用范围较广的Cd污染治理方法。主要应用的土壤钝化剂主要有:生石灰、海泡石、钙镁磷肥等。连续施用石灰等碱性材料可能会造成土壤板结、盐碱化、增大种植成本、钝化效果不稳定等问题。三是Cd2+的阻隔。土壤螯合剂、叶面阻隔剂能够螯合Cd2+,将Cd2+阻隔在土壤和营养器官,降低籽粒Cd含量。土壤螯合剂一般富含有机物质和阴离子矿质元素,有机物的官能团能够与Cd2+结合,阴离子矿质元素可以与Cd2+共沉淀,均可减少根系对Cd的吸收。基于各种离子的复杂性,在利用离子进行土壤治理时要考虑不同元素作用机理的差异、不同离子间的相互作用及施用量等问题。四是Cd低积累品种的选育。Cd低积累品种能从根本上控制Cd的积累,在不同环境下均能减少Cd在籽粒的积累,是最有效最稳定的降Cd措施。随着越来越多的水稻Cd积累相关基因被挖掘,低Cd积累水稻品种的选育具有巨大前景。
|
|
表 2 Cd污染治理途径及其优缺点 Table 2 Methods of Cd pollution control and their advantages and disadvantages |
在Cd污染稻田大面积生产时,应结合实际情况综合应用多种技术措施,才能高效、低耗地降低稻米中的Cd含量。笔者认为从长久治理效果与经济成本等多个角度考量,选育Cd低积累品种能从根本上解决Cd污染治理的难题,是目前最具前景与价值的Cd污染稻区水稻安全生产途径。然而,选育低Cd品种也面临一些挑战,比如传统育种周期过长、水稻Cd低积累相关基因的挖掘难度大等。因此,今后的育种工作中应以传统育种手段为主,结合分子标记辅助选择、诱变育种等现代育种手段,缩短育种年限的同时规避生态风险,加速低Cd、广适、高产、优质水稻品种的选育。
| [1] |
Cui J, Wang W Q, Peng Y, et al. Effects of simulated Cd deposition on soil Cd availability, microbial response, and crop Cd uptake in the passivation-remediation process of Cd-contaminated purple soil[J]. Science of the Total Environment, 2019, 683: 782-792 DOI:10.1016/j.scitotenv.2019.05.292 (  0) 0) |
| [2] |
Coudon T, Hourani H, Nguyen C, et al. Assessment of long-term exposure to airborne dioxin and cadmium concentrations in the Lyon metropolitan area (France)[J]. Environment International, 2018, 111: 177-190 DOI:10.1016/j.envint.2017.11.027 (  0) 0) |
| [3] |
张金彪, 黄维南. 镉对植物的生理生态效应的研究进展[J]. 生态学报, 2000, 20(3): 514-523 DOI:10.3321/j.issn:1000-0933.2000.03.030 (  0) 0) |
| [4] |
Luo L, Ma Y B, Zhang S Z, et al. An inventory of trace element inputs to agricultural soils in China[J]. Journal of Environmental Management, 2009, 90(8): 2524-2530 DOI:10.1016/j.jenvman.2009.01.011 (  0) 0) |
| [5] |
Templeton D M, Liu Y. Multiple roles of cadmium in cell death and survival[J]. Chemico-Biological Interactions, 2010, 188(2): 267-275 DOI:10.1016/j.cbi.2010.03.040 (  0) 0) |
| [6] |
Nordberg G F. Historical perspectives on cadmium toxicology[J]. Toxicology and Applied Pharmacology, 2009, 238(3): 192-200 DOI:10.1016/j.taap.2009.03.015 (  0) 0) |
| [7] |
中华人民共和国环境保护部, 中华人民共和国国土资源部. 全国土壤污染状况调查公报[OL]. 2014-4-17. http://www.gov.cn/xinwen/2014-04/17/content_2661765.htm.
(  0) 0) |
| [8] |
Kobayashi E, Suwazono Y, Dochi M, et al. Influence of consumption of cadmium-polluted rice or Jinzu river water on occurrence of renal tubular dysfunction and/or itai-itai disease[J]. Biological Trace Element Research, 2009, 127(3): 257-268 DOI:10.1007/s12011-008-8239-z (  0) 0) |
| [9] |
Sebastian A, Prasad M N V. Cadmium minimization in rice. A review[J]. Agronomy for Sustainable Development, 2014, 34(1): 155-173 DOI:10.1007/s13593-013-0152-y (  0) 0) |
| [10] |
雷鸣, 曾敏, 王利红, 等. 湖南市场和污染区稻米中As、Pb、Cd污染及其健康风险评价[J]. 环境科学学报, 2010, 30(11): 2314-2320 (  0) 0) |
| [11] |
窦韦强, 安毅, 秦莉, 等. 土壤pH对镉形态影响的研究进展[J]. 土壤, 2020, 52(3): 439-444 (  0) 0) |
| [12] |
Huang Y, Sheng H, Zhou P, et al. Remediation of Cd-contaminated acidic paddy fields with four-year consecutive liming[J]. Ecotoxicology and Environmental Safety, 2020, 188: 109903 DOI:10.1016/j.ecoenv.2019.109903 (  0) 0) |
| [13] |
万亚男. 硒对水稻吸收、转运及累积镉的影响机制[D]. 北京: 中国农业大学, 2018.
(  0) 0) |
| [14] |
Nakanishi H, Ogawa I, Ishimaru Y, et al. Iron deficiency enhances cadmium uptake and translocation mediated by the Fe2+ transporters OsIRT1 and OsIRT2 in rice[J]. Soil Science and Plant Nutrition, 2006, 52(4): 464-469 DOI:10.1111/j.1747-0765.2006.00055.x (  0) 0) |
| [15] |
P G K, Kuruvilla S, Mathew M K. Functional characterization of a transition metal ion transporter, OsZIP6 from rice (Oryza sativa L.)[J]. Plant Physiology and Biochemistry, 2015, 97: 165-174 DOI:10.1016/j.plaphy.2015.10.005 (  0) 0) |
| [16] |
Tan L T, Qu M M, Zhu Y X, et al. ZINC TRANSPORTER5 and ZINC TRANSPORTER9 function synergistically in zinc/cadmium uptake[J]. Plant Physiology, 2020, 183(3): 1235-1249 DOI:10.1104/pp.19.01569 (  0) 0) |
| [17] |
Takahashi R, Ishimaru Y, Senoura T, et al. The OsNRAMP1 iron transporter is involved in Cd accumulation in rice[J]. Journal of Experimental Botany, 2011, 62(14): 4843-4850 DOI:10.1093/jxb/err136 (  0) 0) |
| [18] |
Yang M, Zhang Y Y, Zhang L J, et al. OsNRAMP5 contributes to manganese translocation and distribution in rice shoots[J]. Journal of Experimental Botany, 2014, 65(17): 4849-4861 DOI:10.1093/jxb/eru259 (  0) 0) |
| [19] |
Chang J D, Huang S, Yamaji N, et al. OsNRAMP1 transporter contributes to cadmium and manganese uptake in rice[J]. Plant, Cell & Environment, 2020, 43(10): 2476-2491 (  0) 0) |
| [20] |
Wang T K, Li Y X, Fu Y F, et al. Mutation at different sites of metal transporter gene OsNramp5 affects Cd accumulation and related agronomic traits in rice (Oryza sativa L.)[J]. Frontiers in Plant Science, 2019, 10: 1081 DOI:10.3389/fpls.2019.01081 (  0) 0) |
| [21] |
Lan W Z, Wang W, Wang S M, et al. A rice high-affinity potassium transporter (HKT) conceals a calcium-permeable cation channel[J]. Proceedings of the National Academy of Sciences of the United States of America, 2010, 107(15): 7089-7094 DOI:10.1073/pnas.1000698107 (  0) 0) |
| [22] |
Yan H L, Xu W X, Xie J Y, et al. Variation of a major facilitator superfamily gene contributes to differential cadmium accumulation between rice subspecies[J]. Nature Communications, 2019, 10: 2562 DOI:10.1038/s41467-019-10544-y (  0) 0) |
| [23] |
Wang C H, Guo W L, Cai X Z, et al. Engineering low-cadmium rice through stress-inducible expression of OXS3-family member genes[J]. New Biotechnology, 2019, 48: 29-34 DOI:10.1016/j.nbt.2018.04.004 (  0) 0) |
| [24] |
Ishimaru Y, Takahashi R, Bashir K, et al. Characterizing the role of rice NRAMP5 in manganese, iron and cadmium transport[J]. Scientific Reports, 2012, 2: 286 DOI:10.1038/srep00286 (  0) 0) |
| [25] |
Li H, Luo N, Li Y W, et al. Cadmium in rice: Transport mechanisms, influencing factors, and minimizing measures[J]. Environmental Pollution, 2017, 224: 622-630 DOI:10.1016/j.envpol.2017.01.087 (  0) 0) |
| [26] |
Uraguchi S, Mori S, Kuramata M, et al. Root-to-shoot Cd translocation via the xylem is the major process determining shoot and grain cadmium accumulation in rice[J]. Journal of Experimental Botany, 2009, 60(9): 2677-2688 DOI:10.1093/jxb/erp119 (  0) 0) |
| [27] |
Takahashi R, Ishimaru Y, Shimo H, et al. The OsHMA2 transporter is involved in root-to-shoot translocation of Zn and Cd in rice[J]. Plant, Cell & Environment, 2012, 35(11): 1948-1957 (  0) 0) |
| [28] |
Yamaji N, Xia J X, Mitani-Ueno N, et al. Preferential delivery of zinc to developing tissues in rice is mediated by P-type heavy metal ATPase OsHMA2[J]. Plant Physiology, 2013, 162(2): 927-939 DOI:10.1104/pp.113.216564 (  0) 0) |
| [29] |
Miyadate H, Adachi S, Hiraizumi A, et al. OsHMA3, a P1B-type of ATPase affects root-to-shoot cadmium translocation in rice by mediating efflux into vacuoles[J]. The New Phytologist, 2011, 189(1): 190-199 DOI:10.1111/j.1469-8137.2010.03459.x (  0) 0) |
| [30] |
Sasaki A, Yamaji N, Ma J F. Overexpression of OsHMA3 enhances Cd tolerance and expression of Zn transporter genes in rice[J]. Journal of Experimental Botany, 2014, 65(20): 6013-6021 DOI:10.1093/jxb/eru340 (  0) 0) |
| [31] |
Liu C L, Gao Z Y, Shang L G, et al. Natural variation in the promoter of OsHMA3 contributes to differential grain cadmium accumulation between Indica and Japonica rice[J]. Journal of Integrative Plant Biology, 2020, 62(3): 314-329 DOI:10.1111/jipb.12794 (  0) 0) |
| [32] |
Shimo H, Ishimaru Y, An G, et al. Low cadmium (LCD), a novel gene related to cadmium tolerance and accumulation in rice[J]. Journal of Experimental Botany, 2011, 62(15): 5727-5734 DOI:10.1093/jxb/err300 (  0) 0) |
| [33] |
Hao X H, Zeng M, Wang J, et al. A node-expressed transporter OsCCX2 is involved in grain cadmium accumulation of rice[J]. Frontiers in Plant Science, 2018, 9: 476 DOI:10.3389/fpls.2018.00476 (  0) 0) |
| [34] |
Tan L T, Zhu Y X, Fan T, et al. OsZIP7 functions in xylem loading in roots and inter-vascular transfer in nodes to deliver Zn/Cd to grain in rice[J]. Biochemical and Biophysical Research Communications, 2019, 512(1): 112-118 DOI:10.1016/j.bbrc.2019.03.024 (  0) 0) |
| [35] |
Luo J S, Huang J, Zeng D L, et al. A defensin-like protein drives cadmium efflux and allocation in rice[J]. Nature Communications, 2018, 9: 645 DOI:10.1038/s41467-018-03088-0 (  0) 0) |
| [36] |
Rodda M S, Li G, Reid R J. The timing of grain Cd accumulation in rice plants: The relative importance of remobilisation within the plant and root Cd uptake post-flowering[J]. Plant and Soil, 2011, 347(1/2): 105-114 (  0) 0) |
| [37] |
Tanaka K, Fujimaki S, Fujiwara T, et al. Quantitative estimation of the contribution of the phloem in cadmium transport to grains in rice plants (Oryza sativa L.)[J]. Soil Science and Plant Nutrition, 2017, 53(1): 72-77 (  0) 0) |
| [38] |
Zhang J Y, Zhou H, Gu J F, et al. Effects of nano-Fe3O4-modified biochar on iron plaque formation and Cd accumulation in rice (Oryza sativa L.)[J]. Environmental Pollution, 2020, 260: 113970 DOI:10.1016/j.envpol.2020.113970 (  0) 0) |
| [39] |
Wang F J, Tan H F, Huang L H, et al. Application of exogenous salicylic acid reduces Cd toxicity and Cd accumulation in rice[J]. Ecotoxicology and Environmental Safety, 2021, 207: 111198 DOI:10.1016/j.ecoenv.2020.111198 (  0) 0) |
| [40] |
Uraguchi S, Kamiya T, Sakamoto T, et al. Low-affinity cation transporter (OsLCT1) regulates cadmium transport into rice grains[J]. Proceedings of the National Academy of Sciences of the United States of America, 2011, 108(52): 20959-20964 DOI:10.1073/pnas.1116531109 (  0) 0) |
| [41] |
Das N, Bhattacharya S, Bhattacharyya S, et al. Identification of alternatively spliced transcripts of rice phytochelatin synthase 2 gene OsPCS2 involved in mitigation of cadmium and arsenic stresses[J]. Plant Molecular Biology, 2017, 94(1/2): 167-183 (  0) 0) |
| [42] |
Hu Y, Cheng H F, Tao S. The challenges and solutions for cadmium-contaminated rice in China: A critical review[J]. Environment International, 2016, 92/93: 515-532 DOI:10.1016/j.envint.2016.04.042 (  0) 0) |
| [43] |
Zhang Q, Zhang L, Liu T T, et al. The influence of liming on cadmium accumulation in rice grains via iron-reducing bacteria[J]. Science of the Total Environment, 2018, 645: 109-118 DOI:10.1016/j.scitotenv.2018.06.316 (  0) 0) |
| [44] |
Park J H, Lamb D, Paneerselvam P, et al. Role of organic amendments on enhanced bioremediation of heavy metal(loid) contaminated soils[J]. Journal of Hazardous Materials, 2011, 185(2/3): 549-574 (  0) 0) |
| [45] |
Yang Y J, Chen J M, Huang Q N, et al. Can liming reduce cadmium (Cd) accumulation in rice (Oryza sativa) in slightly acidic soils? A contradictory dynamic equilibrium between Cd uptake capacity of roots and Cd immobilisation in soils[J]. Chemosphere, 2018, 193: 547-556 DOI:10.1016/j.chemosphere.2017.11.061 (  0) 0) |
| [46] |
Arao T, Kawasaki A, Baba K, et al. Effects of water management on cadmium and arsenic accumulation and dimethylarsinic acid concentrations in Japanese rice[J]. Environmental Science & Technology, 2009, 43(24): 9361-9367 (  0) 0) |
| [47] |
Wan Y N, Camara A Y, Yu Y, et al. Cadmium dynamics in soil pore water and uptake by rice: Influences of soil-applied selenite with different water managements[J]. Environmental Pollution, 2018, 240: 523-533 DOI:10.1016/j.envpol.2018.04.044 (  0) 0) |
| [48] |
叶新新, 孙波. 品种和土壤对水稻镉吸收的影响及镉生物有效性预测模型研究进展[J]. 土壤, 2012, 44(3): 360-365 DOI:10.3969/j.issn.0253-9829.2012.03.002 (  0) 0) |
| [49] |
Su Y, Kwong R W M, Tang W L, et al. Straw return enhances the risks of metals in soil?[J]. Ecotoxicology and Environmental Safety, 2021, 207: 111201 DOI:10.1016/j.ecoenv.2020.111201 (  0) 0) |
| [50] |
Yang Y J, Xiong J, Chen R J, et al. Excessive nitrate enhances cadmium (Cd) uptake by up-regulating the expression of OsIRT1 in rice (Oryza sativa)[J]. Environmental and Experimental Botany, 2016, 122: 141-149 DOI:10.1016/j.envexpbot.2015.10.001 (  0) 0) |
| [51] |
Cui J H, Liu T X, Li Y D, et al. Selenium reduces cadmium uptake into rice suspension cells by regulating the expression of lignin synthesis and cadmium-related genes[J]. Science of the Total Environment, 2018, 644: 602-610 DOI:10.1016/j.scitotenv.2018.07.002 (  0) 0) |
| [52] |
王耀晶, 马樱馨, 李彩, 等. 镉胁迫下硅对不同品种水稻镉积累的影响[J]. 沈阳农业大学学报, 2020, 51(3): 364-369 (  0) 0) |
| [53] |
彭华, 田发祥, 魏维, 等. 不同生育期施用硅肥对水稻吸收积累镉硅的影响[J]. 农业环境科学学报, 2017, 36(6): 1027-1033 (  0) 0) |
| [54] |
Chen D M, Chen D Q, Xue R R, et al. Effects of boron, silicon and their interactions on cadmium accumulation and toxicity in rice plants[J]. Journal of Hazardous Materials, 2019, 367: 447-455 DOI:10.1016/j.jhazmat.2018.12.111 (  0) 0) |
| [55] |
张涵彤, 何巧, 倪妍霞, 等. 锌对水稻幼苗镉积累及抗氧化系统的影响研究[J]. 农产品质量与安全, 2019(1): 55-61 DOI:10.3969/j.issn.1674-8255.2019.01.011 (  0) 0) |
| [56] |
Cao Z Z, Qin M L, Lin X Y, et al. Sulfur supply reduces cadmium uptake and translocation in rice grains (Oryza sativa L.) by enhancing iron plaque formation, cadmium chelation and vacuolar sequestration[J]. Environmental Pollution, 2018, 238: 76-84 DOI:10.1016/j.envpol.2018.02.083 (  0) 0) |
| [57] |
Yang W T, Zhou H, Gu J F, et al. Influence of rapeseed cake on iron plaque formation and Cd uptake by rice (Oryza sativa L.) seedlings exposed to excess Cd[J]. Bulletin of Environmental Contamination and Toxicology, 2017, 99(5): 601-606 DOI:10.1007/s00128-017-2151-1 (  0) 0) |
| [58] |
Fu Y Q, Yang X J, Shen H. Root iron plaque alleviates cadmium toxicity to rice (Oryza sativa) seedlings[J]. Ecotoxicology and Environmental Safety, 2018, 161: 534-541 DOI:10.1016/j.ecoenv.2018.06.015 (  0) 0) |
| [59] |
Zhao Y L, Zhang C B, Wang C R, et al. Increasing phosphate inhibits cadmium uptake in plants and promotes synthesis of amino acids in grains of rice[J]. Environmental Pollution, 2020, 257: 113496 DOI:10.1016/j.envpol.2019.113496 (  0) 0) |
| [60] |
Liu H J, Zhang J L, Zhang F S. Role of iron plaque in Cd uptake by and translocation within rice (Oryza sativa L.) seedlings grown in solution culture[J]. Environmental and Experimental Botany, 2007, 59(3): 314-320 DOI:10.1016/j.envexpbot.2006.04.001 (  0) 0) |
| [61] |
董明芳, 郭军康, 冯人伟, 等. Fe2+和Mn2+对水稻根表铁膜及镉吸收转运的影响[J]. 环境污染与防治, 2017, 39(3): 249-253 (  0) 0) |
| [62] |
Zhou H, Zeng M, Zhou X, et al. Heavy metal translocation and accumulation in iron plaques and plant tissues for 32 hybrid rice (Oryza sativa L.) cultivars[J]. Plant and Soil, 2015, 386(1/2): 317-329 (  0) 0) |
| [63] |
Zeng T, Khaliq M A, Li H L, et al. Assessment of Cd availability in rice cultivation (Oryza sativa): Effects of amendments and the spatiotemporal chemical changes in the rhizosphere and bulk soil[J]. Ecotoxicology and Environmental Safety, 2020, 196: 110490 DOI:10.1016/j.ecoenv.2020.110490 (  0) 0) |
| [64] |
Deng X, Yang Y, Zeng H Y, et al. Variations in iron plaque, root morphology and metal bioavailability response to seedling establishment methods and their impacts on Cd and Pb accumulation and translocation in rice (Oryza sativa L.)[J]. Journal of Hazardous Materials, 2020, 384: 121343 DOI:10.1016/j.jhazmat.2019.121343 (  0) 0) |
| [65] |
Rizwan M, Ali S, Rehman M Z, et al. Effect of foliar applications of silicon and titanium dioxide nanoparticles on growth, oxidative stress, and cadmium accumulation by rice (Oryza sativa)[J]. Acta Physiologiae Plantarum, 2019, 41(3): 1-12 DOI:10.1007/s11738-019-2828-7 (  0) 0) |
| [66] |
Wang H, Xu C, Luo Z C, et al. Foliar application of Zn can reduce Cd concentrations in rice (Oryza sativa L.) under field conditions[[J]. Environmental Science and Pollution Research, 2018, 25(29): 29287-29294 DOI:10.1007/s11356-018-2938-6 (  0) 0) |
| [67] |
Ali S, Rizwan M, Noureen S, et al. Combined use of biochar and zinc oxide nanoparticle foliar spray improved the plant growth and decreased the cadmium accumulation in rice (Oryza sativa L.) plant[J]. Environmental Science and Pollution Research, 2019, 11: 11288-11299 DOI:10.1007/s11356-019-04554-y?utm_content=null&utm_medium=cpc&utm_source=trendmd (  0) 0) |
| [68] |
Lv G, Wang H, Xu C, et al. Effectiveness of simultaneous foliar application of Zn and Mn or P to reduce Cd concentration in rice grains: A field study[J]. Environmental Science and Pollution Research, 2019, 26(9): 9305-9313 DOI:10.1007/s11356-019-04412-x (  0) 0) |
| [69] |
周一敏, 黄雅媛, 刘晓月, 等. 叶面喷施纳米MnO2对水稻富集镉的影响机制[J]. 环境科学, 2021, 42(2): 932-940 (  0) 0) |
| [70] |
Liu J H, Hou H, Zhao L, et al. Protective Effect of foliar application of sulfur on photosynthesis and antioxidative defense system of rice under the stress of Cd[J]. Science of the Total Environment, 2020, 710: 136230 DOI:10.1016/j.scitotenv.2019.136230 (  0) 0) |
| [71] |
Liu J H, Hou H, Zhao L, et al. Mitigation of Cd accumulation in rice from Cd-contaminated paddy soil by foliar dressing of S and P[J]. Science of the Total Environment, 2019, 690: 321-328 DOI:10.1016/j.scitotenv.2019.06.332 (  0) 0) |
| [72] |
张烁, 陆仲烟, 唐琦, 等. 水稻叶面调理剂的降Cd效果及其对营养元素转运的影响[J]. 农业环境科学学报, 2018, 37(11): 2507-2513 DOI:10.11654/jaes.2018-0864 (  0) 0) |
| [73] |
Yang J Y, Chen X, Lu W C, et al. Reducing Cd accumulation in rice grain with foliar application of glycerol and its mechanisms of Cd transport inhibition[J]. Chemosphere, 2020, 258: 127135 DOI:10.1016/j.chemosphere.2020.127135 (  0) 0) |
| [74] |
Rizwan M, Ali S, Akbar M, et al. Foliar application of aspartic acid lowers cadmium uptake and Cd-induced oxidative stress in rice under Cd stress[J]. Environmental Science and Pollution Research, 2017, 24(27): 21938-21947 DOI:10.1007/s11356-017-9860-1 (  0) 0) |
| [75] |
李坤权, 刘建国, 陆小龙, 等. 水稻不同品种对镉吸收及分配的差异[J]. 农业环境科学学报, 2003, 22(5): 529-532 DOI:10.3321/j.issn:1672-2043.2003.05.004 (  0) 0) |
| [76] |
Yan Y F, Choi D H, Kim D S, et al. Genotypic variation of cadmium accumulation and distribution in rice[J]. Journal of Crop Science and Biotechnology, 2010, 13(2): 69-73 DOI:10.1007/s12892-010-0036-5 (  0) 0) |
| [77] |
周静, 杨洋, 孟桂元, 等. 不同镉污染土壤下水稻镉富集与转运效率[J]. 生态学杂志, 2018, 37(1): 89-94 (  0) 0) |
| [78] |
Wang Y F, Su Y, Lu S G. Predicting accumulation of Cd in rice (Oryza sativa L.) and soil threshold concentration of Cd for rice safe production[J]. Science of the Total Environment, 2020, 738: 139805 DOI:10.1016/j.scitotenv.2020.139805 (  0) 0) |
2. State Key Laboratory of Hybrid Rice, Hunan Hybrid Rice Research Center, Changsha 410125, China;
3. Hunan Meixinlong Ecological Environmental Protection Technology Co., Ltd, Changsha 410125, China
 2021, Vol. 53
2021, Vol. 53


