2. 土壤与农业可持续发展国家重点实验室(中国科学院南京土壤研究所), 南京 210008;
3. 中国科学院华南植物园, 广州 510650;
4. 山东省蚕业研究所, 山东烟台 264002;
5. 安徽师范大学生态与环境学院, 安徽芜湖 241002
全球超过一半的人口以稻米为主食。全世界的稻田面积约为1.35亿hm2。其中,超过88% 的稻田是水田,即长期处于淹水状态。对于水稻来说,氮素是最重要的产量限制因子[1]。因此,氮肥的施用对于满足水稻生长发育、保证一定稻米产量至关重要。然而,淹水稻田氮肥利用率一直较低,一般情况下大约为30% ~ 40%,甚至更低[2-3]。导致该现象的主要原因是淹水稻田气态氮损失严重[4-7]。
在稻田气态氮损失中,除了氨挥发以外,反硝化作用是另一个重要途径,损失氮量约占施氮量的14% ~ 40%[4-5, 8-11]。主要原因是稻田土壤兼具氧化层和还原层,硝化–反硝化耦合作用强烈[12-13]。土壤反硝化过程指反硝化微生物将硝酸盐(NO3–)经由亚硝酸盐(NO2–)、一氧化亚氮(NO)、氧化亚氮(N2O)等中间产物最终还原为N2的过程。由于稻田长期处于淹水厌氧状态,其反硝化作用产生的气态氮约98% 为N2[4]。因此,稻田反硝化作用一方面导致肥料氮的损失,其中间产物会引发生态环境污染;另一方面把活性氮(包括肥料氮)以惰性氮(N2)的形式返还大气,从而降低排入外部环境的活性氮量及其导致的环境危害[14-15]。
采用正确、有效的反硝化测定方法是开展稻田反硝化作用研究的基础。尽管稻田反硝化研究已经取得了很大进展,然而至今仍然没有一种被统一认可的标准方法用来准确测定反硝化。主要原因有两个:①大气中氮气含量高达79%,在如此高背景下测定反硝化作用的主要产物N2对于测定方法的精度要求很高;②反硝化具有高度时空异质性[16]。
本文综述了目前在湿地生态系统中应用的反硝化速率测定方法及其优缺点,旨在为今后稻田反硝化测定方法的合理选用和进一步发展提供参考资料。
1 稻田反硝化作用的测定方法以下是目前包括稻田在内的湿地生态系统中应用的4种反硝化速率测定方法介绍,包括:①乙炔抑制法;②15N同位素示踪法;③密闭培养–氦气环境法;④N2 /Ar比值–膜进样质谱法。
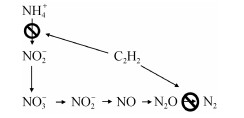
1.1 乙炔抑制法方法原理:一定浓度的乙炔(体积浓度>1%, 常为10%)能够抑制土壤中氧化亚氮还原酶的活性,阻断N2O向N2的还原,从而使得N2O成为反硝化的主要终产物(图 1)。由于N2O的大气背景值很低,容易测定,可以通过测定N2O的产生量来间接推算出反硝化速率[17-18]。该方法具有简单、直接、检测灵敏度高、成本低等优点,适用于大批量样品测定[16]。因此,乙炔抑制法被广泛用于反硝化作用研究,特别是反硝化潜势和反硝化酶活性的测定[19-20]。例如:丁洪等[21]采用乙炔抑制法比较了福建省4种主要红壤性水稻土的反硝化潜势,发现灰泥土、浅灰黄泥沙土和灰黄泥土的反硝化潜势无显著差异,而黄泥土的反硝化潜势则显著高于以上3种水稻土。
|
图 1 乙炔抑制法测定反硝化原理[16] Fig. 1 Principle of acetylene inhibition method |
最早使用的乙炔抑制法是原位箱法[22-23]。由于该法存在费时费力、难以操作的问题,后面发展了动态土柱法。该法采用通气泵迫使乙炔在土柱中扩散,然后通过连续测定N2O浓度来获得反硝化速率。该法由于采用通气泵,对于土壤扰动大,导致测定结果的真实性难以保证。因此,而后又发展了现在普遍采用的静态土柱法。该法把乙炔注入到密闭的培养容器中,通过测定N2O的积累速率来计算反硝化速率[24-25]。静态土柱法相比于动态土柱法无需强制性通气,可进行大批量样品测定。例如:Aulakh等[26]采用静态土柱法研究了小麦秸秆还田和绿肥作物种植对于印度旁遮普邦稻麦轮作体系反硝化损失氮量的影响,发现:相比于单施尿素,减量施用尿素结合小麦秸秆还田和绿肥作物种植可以降低气态氮(N2+N2O)损失量约N 7 kg/hm2;水稻季的气态氮损失(N2+N2O)比小麦季高出约8 ~ 10倍。
乙炔抑制法存在难以克服的缺陷:①乙炔同时抑制土壤硝化过程, 导致反硝化的底物硝酸盐的供给减少,可能低估反硝化强度[27];②在土壤碳含量较高而NO3–-N浓度较低时(上覆水NO3–-N浓度小于10 μmol/L),部分对乙炔不敏感的微生物对于N2O的还原作用可能会有所增加,从而使得乙炔抑制效果下降[28];③乙炔在好氧和厌氧条件下都能发生降解,特别在厌氧条件下的稻田土壤中,导致抑制效果下降,可能低估反硝化强度[29];④高浓度乙炔(大于0.1 kPa)可能促进反硝化产生的NO分解或者氧化,使得产生N2O的底物减少,最终低估反硝化作用[30];⑤此外,乙炔在饱和沉积物/土壤中扩散速率很慢,也是导致反硝化强度被低估的重要原因[16]。李飞跃等[31]采用乙炔抑制法测定我国南方一个典型稻作农业流域内湿地(池塘、河流、水库)的反硝化强度仅为N 1.3 kg/(hm2·a)。该结果远低于相同流域分别采用质量平衡法和N2/Ar法的估算值,分别约为N 66和106 kg/(hm2·a) [14, 32]。显然,乙炔抑制法可能严重低估了该流域内湿地的反硝化强度。因此,乙炔抑制法可能不适用于测定淹水环境下(例如稻田)的土壤反硝化实际损失氮量[33]。
1.2 15N同位素示踪法15N示踪法包括15N平衡差值法(15N-balance technique)和15N示踪气体直接测定法(15N-(N2+ N2O)),是目前稻田反硝化测定的常用方法[13, 34-35]。15N平衡差值法的基本原理:假设稻田微区试验氮素的径流、淋洗损失可忽略不计,气态氮损失可以视为唯一氮素损失途径。将施入土壤的15N标记肥料氮总量减去水稻吸收、土壤残留、氨挥发的15N量之和,最后结果作为反硝化损失量,也称为表观反硝化损失量。该方法的主要优点是水稻吸收、土壤残留、氨挥发的15N量测定结果较为可靠,在不存在淋洗和径流损失时结果可信度好[5, 15]。主要缺点是施入土壤的肥料15N与土壤中的背景14N会发生交换效应,再加上同位素分馏效应,最终可能导致测定结果相比于真实情况有所低估。此外,水稻吸收、土壤残留、氨挥发等15N量的测定误差直接导致间接推算的反硝化损失氮量累计误差偏高[15]。
15N示踪气体直接测定法原理:假设添加到土壤中的15N标记肥料可以在土壤中快速均匀扩散。向土壤中添加高丰度的15N-NO3–-N,然后通过质谱仪直接测定排放的15N-(N2+N2O) 来计算反硝化速率[34]。该方法出现于20世纪50年代,具有灵敏度高、土壤扰动较小的优点,广泛应用于各种类型土壤的反硝化速率测定。主要缺点:①土壤的高度异质性导致15N标记底物很难在目标土壤中快速均匀扩散, 也就很难确保外加15N-NO3–-N与土壤中原有NO3–-N快速均匀混合,最终导致测定结果可能与真实情况有偏差[36]。Steingruber等[37]报道由非均匀混合效应带来的反硝化速率测定误差小于10%, 小于试验系统误差;②同位素分馏效应的发生,例如土壤微生物优先利用轻质同位素, 也可能增加该方法测定结果的不确定性[16];③外加15N标记NO3– -N增加土壤反硝化作用底物浓度, 对于反硝化作用产生刺激作用。该现象在氮源相对比较匮乏的土壤尤甚。因此,该方法更适用于氮源相对充裕的农田土壤,例如稻田[16]。
然而,作为以往稻田反硝化测定的两种常用方法,二者测定结果迥异。在国际上,Buresh和de Datta[38]的研究表明,向稻田土壤中施用15N标记尿素后,直接回收的15N-(N2+N2O) 仅占施氮量的0.1% ~ 2.2%,但同时采用15N平衡差值法获得的反硝化损失氮量却占到施氮量的10% ~ 56%。de Datta等[39]的另一项研究也发现,用15N标记法直接测得的稻田表施尿素处理15N-(N2+N2O) 释放量仅为施氮量的0.1%,而15N质量收支差额扣除氨挥发和15N-(N2+ N2O) 损失氮量后仍有6% 的肥料氮去向不明。国内的研究结果也与此类似,朱兆良[33]总结指出国内用差值法测得稻田反硝化损失氮量占施氮量的14% ~ 41%,而用15N标记法测得的反硝化损失氮量仅为0.1% ~ 3.7%。同样地,邹国元等[35]直接测定15N-(N2+ N2O) 获得的稻田土壤反硝化氮素损失量占施氮量的10.7%,而通过差减法测得的损失量占施氮量的85.7%。
究其原因,一方面,稻田土壤本身(例如土壤空隙和土壤溶液)会截留储藏相当大一部分反硝化产物;相当一部分反硝化产物会通过水稻植株通气组织排放进入大气而未被监测到。因此,15N示踪气体直接测定法很可能严重低估反硝化损失氮量;另一方面,15N平衡差值法中的总15N损失量是基于氮素各个去向的测定结果来推算的。考虑到径流和淋洗损失氮量在该方法中被忽略,再加上氮素各个去向的测定结果不可避免存在偏差,最终导致总15N损失量计算结果具有较大的累计误差(特别是土壤和植株的采样过程来源误差高),导致结果变异性高、可信度低[33, 38]。
1.3 密闭培养-氦气环境法方法原理:将土柱置于密闭体系中培养,采用惰性气体(He或者Ar)充分置换土柱内部空气以降低背景N2浓度,进而采用气相色谱直接测定土壤产生的N2O和N2来计算反硝化速率[40]。密闭培养–氦气环境法的主要优点:①采用原状土柱,对于土壤扰动相对较小;②相比于乙炔抑制法,无需添加抑制剂,测定结果与实际情形更加接近;③无需额外加入15N标记底物,避免了15N同位素示踪法的诸多缺陷;④由于是室内培养,易于控制环境条件,对于研究反硝化的影响因素具有突出优势。例如:Arth等[41]采用He+O2(79%/21%)密闭培养法直接测定了水稻淹水种植体系的N2通量,并且通过添加硝化抑制剂和剪断水下水稻茎秆处理发现硝化作用是反硝化作用的主要底物供给来源、水稻根际是硝化–反硝化耦合作用发生的主要区域。
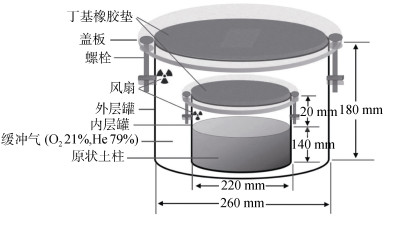
Scholefield等[40]在20多年前将该法成功运用于土壤N2排放速率的测定,检测限约为N 50 g(/hm2·d)。Butterbach-Bahl等[42]对密闭培养体系进行了改进,成功把土壤N2排放通量检测限降到N 24 g(/hm2·d)。而后,Molstad等[43]建立了Robot培养系统,该试验体系可以实现自动采集和测定培养体系中N2、N2O、O2、CO2、CH4与NO的排放通量。该方法被广泛运用于土壤N2排放通量研究[44-46]。针对培养体系的固有气密性难题,Qin等[47]将培养装置进一步加以改进,利用两层密封罐体之间的无N2缓冲夹层来降低大气中高浓度N2渗入对土壤排放N2的污染, 最终大幅提高了培养体系的气密性,进一步降低了检测限, 成功实现对大直径原状土柱N2通量的直接测定(图 2)。
|
图 2 双密闭气体缓冲装置示意图[47] Fig. 2 Schematic diagram of cylinder-in-cylinder set |
然而,密闭培养–氦气环境法也有其自身不足:①保证培养体系的气密性以及气体取样免受大气中N2污染是成功应用该方法的关键前提,这对于体系建立以及操作者的实验技能都具有较高的要求;②该方法对于培养系统中背景N2的置换耗时耗力;③培养体系中气体置换可能会对土壤水分、微结构等产生未知影响;④培养体系在密闭环境下无法与外界进行正常的物质和能量交换,例如反硝化作用产生的N2无法进入大气,在密闭体系内累积,影响测定结果的可信度[16, 48]。
1.4 N2/Ar比值-膜进样质谱法方法原理:由于自然水体中的溶解性N2背景浓度低于大气,淹水环境(包括稻田)反硝化作用产生的溶解性N2也相对易测。自然水体中的溶解性N2同时源于生物过程(主要是反硝化)和物理过程(水气平衡);Ar是惰性气体,不参与生物反应,其在水体中浓度只受温度和盐度的影响。因此,水样N2/Ar值的变化可以一定程度上排除物理因子变化(如温度和盐度等变化)所导致的N2浓度波动,从而更好反映了源自生物过程的N2浓度变化(主要是反硝化作用)。基于此,可以通过测定水样中N2/Ar值,获取水样中N2的浓度,进而计算反硝化速率[49]。
Kana等[49]最早将膜进样质谱法(membrane inlet mass spectrometry, MIMS)应用于水体N2/Ar的测定。MIMS主要由蠕动泵、恒温水浴、液氮冷阱、四级杆质谱管、信号收集器、计算机系统组成。工作原理:待测水样在蠕动泵作用下进入温度调节水浴装置,经过温度平衡的水样进入真空冷阱系统并与半透膜接触。水样中部分气体透过半透膜进入四级杆质谱管,首先在电离装置作用下进行离子化,而后不同质量的离子经过震荡电场分离后进入检测器。N2/Ar法可在无需添加15N-标记底物的前提下实现对反硝化主要产物N2的直接精确测定,可以在很大程度上降低15N示踪法的系统误差。另外,该方法对于溶解水体中N2/Ar的测定精度可达0.03%,测定速度快(小于3 min)、进样量小(小于7 ml)、操作简单、适用于大批量样品测定,被美国自然科学基金委员会成立的反硝化研究协作网专门推荐使用。MIMS目前广泛应用于不同类型水体环境的反硝化研究,有力推动了淹水环境反硝化研究[32, 50-52]。
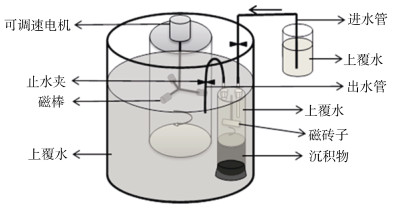
应用MIMS进行N2通量测定大多需要建立可以模拟原位淹水环境的密闭培养系统(图 3)。该培养系统可以模拟自然水体环境,使用原位水体流经原状沉积物柱样,定期采集培养水样,采用MIMS测定水样的N2/Ar比值,结合土柱横截面积和上覆水体积来计算反硝化速率[53]。该培养装置不仅避免了对土壤物理性状的破坏,而且有利于实现对于影响反硝化环境因子的精确控制。
|
图 3 模拟原位淹水环境的反硝化培养装置[53] Fig. 3 Experimental incubation system used to measure denitrification rate |
南京土壤研究所较早将可以模拟原位淹水环境的培养装置结合MIMS应用于淹水稻田N2通量的直接测定[4, 53-56],报道淹水稻田施肥后21 d反硝化累计除氮量占施氮量的4.7%,介于以往研究采用15N平衡差值法和15N示踪气体直接测定法(15N-(N2+N2O))获得的结果之间。此外,MIMS所测定的施肥后10 d内反硝化平均速率为N 0.48 kg/(hm2·d),小于Arth等[41]采用He+O2(79%/21%)密闭培养–N2通量法直接测定施用尿素后5 d内稻田土壤反硝化强度(N 1.15 kg/(hm2·d))。考虑到前者施氮量小于后者(N 110和190 kg/hm2),两种方法所测定的结果较为接近。作者通过比较氮肥深施和表施两种不同施肥方式,证实了稻田反硝化与氨挥发确实存在互为消长关系,即:深施虽然减少了氨挥发,同时却促进了反硝化。该工作为准确量化稻田反硝化损失氮量提供了关键技术支持[54]。在有效解决N2通量测定难题的基础上,作者对整个水稻生长季的3种含氮气体(N2、NH3和N2O)进行了同步监测,发现:从整个水稻生长季来看,传统表施氮肥下3种含氮气体损失量分别占施氮量的13.5% (N2)、19.1% (NH3) 和0.2% (N2O),共计占施氮量的32.8%;从不同氮肥施用时期来看,总气态氮损失量按照基肥期、分蘖肥期、穗肥期依次降低;结合淋洗和径流损失氮量,除去气态氮损失量和水稻吸收氮量,推算出整个水稻生长季结束后约20% 的肥料氮留存在土壤中。此外,与表施相比,氮肥深施同时降低了3种气态氮损失量,降幅分别为13.3% (N2)、14.2% (NH3) 和42.5% (N2O),共计降低13.8%。同时,深施分别提高水稻产量和氮肥利用率13.9% 和14.4%。该工作进一步厘清了稻田氮收支,揭示了深施氮肥有助于减氮增效的科学内涵[4]。此外,基于MIMS技术,王书伟等[55-56]同样发现太湖流域典型稻田反硝化和氨挥发损失氮量相当,分别占尿素氮施用量的11.9% ~ 21.8% 和11.5% ~ 22.0%;优化施肥模式(前氮后移)可以在降低一定氮肥用量条件下同时实现产量增加和气态氮损失量降低[56];生物质炭添加同时增加反硝化和氨挥发损失氮量;硝化抑制剂添加在降低反硝化同时反而增加氨挥发,但是总体上减少气态氮损失量[55]。
然而,需要指出的是,N2/Ar法无法测定通过非溶解途径(如气泡)排出土体的N2,可能会低估实际反硝化速率;原状土柱培养法毕竟不是原位测定,无法在实验室内实现稻田系统实际环境条件的原样模拟,获得的结果也只能尽可能接近于真实情形。例如:原状土柱培养忽视了水稻通气组织可能发挥的重要作用,无法模拟水稻通气组织向根系输送O2,进而可能削弱硝化–反硝化耦合作用[41, 57];此外,原状土柱培养法排除了水稻根系对于无机氮的竞争吸收,可能会高估反硝化作用强度[58-59]。因此,为了尽量使N2/Ar法测定的反硝化速率接近于实际情况,从田间采样到室内培养取样的时间间隔在实际操作中应尽量缩短。
综上所述,表 1比较了淹水稻田反硝化速率不同测定方法的主要优缺点和适用性。
|
|
表 1 稻田反硝化速率不同测定方法比较 Table 1 Comparison of denitrification determination methods in flooded rice paddies |
水稻生产对于肥料氮的利用率较低,反硝化作用是淹水稻田氮素损失的重要途径。研究方法的不断改进是推动稻田反硝化作用研究的基础。目前有待深入开展以下几个方面的研究:
1) 如何实现田间原位无扰动直接测定反硝化依旧是稻田反硝化研究所面临的关键难题。
2) 水稻植株可以通过自身通气组织把空气中的O2源源不断输送到根系。因此,在水稻根际,硝化–反硝化耦合反应活跃。另外,水稻植株本身有利于反硝化产物N2从根系向大气排放。未来研究应该综合考虑稻田土壤和水稻植株的整体N2排放能力。
3) 结合现有不同测定方法的优缺点,根据具体研究目标选取合适的方法或者联合运用多种方法有望进一步推进稻田反硝化研究。例如:水稻整个生育期并不完全处于淹水状态,烤田是水稻生产上的一项重要的农业措施。因此,淹水期采用N2/Ar法,烤田期则考虑选用密闭培养–氦气环境法,可能会提高稻田反硝化测定精度。
4) 稻田反硝化具有高度时空异质性,而现有反硝化测定方法并不适用于高频度大批量测定。未来研究可以通过建立反硝化速率与关键控制因子的数学关系模型来获取整个水稻生长季的反硝化动态变化规律,从而提高反硝化损失氮量的估算精度。
5) 反硝化–分解模型(denitrification-decompo-sition model, DNDC模型)是农业生态系统中一系列控制碳和氮迁移转化的生物化学及地球化学反应机制的计算机模拟表达。反硝化是导致氮素从土壤丢失而进入大气的主要生物地球化学过程。目前,DNDC模型还未见用于稻田反硝化终产物N2量化研究。因此,可以尝试把DNDC模型发展应用于稻田反硝化定量研究。
| [1] |
Buresh R J, de Datta S K. Nitrogen dynamics and management in rice-legume cropping systems[J]. Advances in Agronomy, 1991, 45: 1-59 (  0) 0) |
| [2] |
Cao Z H, de Datta S K, Fillery I R P. Effect of placement methods on floodwater properties and recovery of applied nitrogen (15N-labeled urea) in wetland rice[J]. Soil Science Society of America Journal, 1984, 48(1): 196-203 DOI:10.2136/sssaj1984.03615995004800010036x (  0) 0) |
| [3] |
Choudhury T M A, Khanif Y M. Evaluation of effects of nitrogen and magnesium fertilization on rice yield and fertilizer nitrogen efficiency using 15N tracer technique[J]. Journal of Plant Nutrition, 2001, 24(6): 855-871 DOI:10.1081/PLN-100103778 (  0) 0) |
| [4] |
Xia L L, Li X B, Ma Q Q, et al. Simultaneous quantification of N2, NH3 and N2O emissions from a flooded paddy field under different N fertilization regimes[J]. Global Change Biology, 2019 DOI:10.1111/gcb.14958 (  0) 0) |
| [5] |
Zhao X, Zhou Y, Wang S Q, et al. Nitrogen balance in a highly fertilized rice-wheat double-cropping system in Southern China[J]. Soil Science Society of America Journal, 2012, 76(3): 1068-1078 DOI:10.2136/sssaj2011.0236 (  0) 0) |
| [6] |
颜晓元, 周伟. 长江三角洲农田地下水反硝化对硝酸盐的去除作用[J]. 土壤学报, 2019, 56(2): 350-362 (  0) 0) |
| [7] |
朱兆良. 稻田土壤中氮素的转化与氮肥的合理施用[J]. 化学通报, 1994, 57(9): 15-22 (  0) 0) |
| [8] |
Choudhury A T M A, Kennedy I R. Nitrogen fertilizer losses from rice soils and control of environmental pollution problems[J]. Communications in Soil Science and Plant Analysis, 2005, 36(11/12): 1625-1639 (  0) 0) |
| [9] |
Freney J R, Trevitt A C F, Datta S K, et al. The interdependence of ammonia volatilization and denitrification as nitrogen loss processes in flooded rice fields in the Philippines[J]. Biology and Fertility of Soils, 1990, 9(1): 31-36 DOI:10.1007/BF00335858 (  0) 0) |
| [10] |
Ju X T, Xing G X, Chen X P, et al. Reducing environmental risk by improving N management in intensive Chinese agricultural systems[J]. PNAS, 2009, 106(9): 3041-3046 DOI:10.1073/pnas.0813417106 (  0) 0) |
| [11] |
Xing G X, Zhu Z L. An assessment of N loss from agricultural fields to the environment in China[J]. Nutrient Cycling in Agroecosystems, 2000, 57(1): 67-73 DOI:10.1023/A:1009717603427 (  0) 0) |
| [12] |
Ishii S, Ikeda S, Minamisawa K, et al. Nitrogen cycling in rice paddy environments: Past achievements and future challenges[J]. Microbes and Environments, 2011, 26(4): 282-292 DOI:10.1264/jsme2.ME11293 (  0) 0) |
| [13] |
倪吾钟, 沈仁芳, 朱兆良. 不同氧化还原电位条件下稻田土壤中15N标记硝态氮的反硝化作用[J]. 中国环境科学, 2000, 20(6): 519-523 DOI:10.3321/j.issn:1000-6923.2000.06.009 (  0) 0) |
| [14] |
Yan X Y, Cai Z C, Yang R, et al. Nitrogen budget and riverine nitrogen output in a rice paddy dominated agricultural watershed in Eastern China[J]. Biogeochemistry, 2011, 106(3): 489-501 DOI:10.1007/s10533-010-9528-0 (  0) 0) |
| [15] |
李振高, 俞慎. 土壤硝化-反硝化作用研究进展[J]. 土壤, 1997, 29(6): 281-286 (  0) 0) |
| [16] |
Groffman P M, Altabet M A, Bö hlke J K, et al. Methods for measuring denitrification: Diverse approaches to a difficult problem[J]. Ecological Applications, 2006, 16(6): 2091-2122 DOI:10.1890/1051-0761(2006)016[2091:MFMDDA]2.0.CO;2 (  0) 0) |
| [17] |
Balderston W L, Sherr B, Payne W J. Blockage by acetylene of nitrous oxide reduction in Pseudomonas perfectomarinus[J]. Applied and Environmental Microbiology, 1976, 31(4): 504-508 DOI:10.1128/aem.31.4.504-508.1976 (  0) 0) |
| [18] |
Yoshinari T, Knowles R. Acetylene inhibition of nitrous oxide reduction by denitrifying bacteria[J]. Biochemical and Biophysical Research Communications, 1976, 69(3): 705-710 DOI:10.1016/0006-291X(76)90932-3 (  0) 0) |
| [19] |
Gross P J, Bremner J M. Acetone problem in use of the acetylene blockage method for assessment of denitrifying activity in soil[J]. Communications in Soil Science and Plant Analysis, 1992, 23(13/14): 1345-1358 (  0) 0) |
| [20] |
NANANG Zulkarnaen, 程谊, 张金波. 不同利用方式红壤反硝化势和气态产物排放特征[J]. 土壤, 2020, 52(2): 348-355 (  0) 0) |
| [21] |
丁洪, 王跃思, 项虹艳, 等. 福建省几种主要红壤性水稻土的硝化与反硝化活性[J]. 农业环境科学学报, 2003, 22(6): 715-719 DOI:10.3321/j.issn:1672-2043.2003.06.019 (  0) 0) |
| [22] |
Ryden J C, Dawson K P. Evaluation of the acetylene-inhibition technique for the measurement of denitrification in grassland soils[J]. Journal of the Science of Food and Agriculture, 1982, 33(12): 1197-1206 DOI:10.1002/jsfa.2740331205 (  0) 0) |
| [23] |
Ryden J C, Lund L J, Focht D D. Direct measurement of denitrification loss from soils: I. laboratory evaluation of acetylene inhibition of nitrous oxide reduction[J]. Soil Science Society of America Journal, 1979, 43(1): 104-110 DOI:10.2136/sssaj1979.03615995004300010019x (  0) 0) |
| [24] |
Ryden J C, Skinner J H, Nixon D J. Soil core incubation system for the field measurement of denitrification using acetylene-inhibition[J]. Soil Biology and Biochemistry, 1987, 19(6): 753-757 DOI:10.1016/0038-0717(87)90059-9 (  0) 0) |
| [25] |
邹国元, 赵紫娟, 张福锁, 等. 运用乙炔抑制-静态土柱培养法测定旱地土壤氮素反硝化损失[J]. 土壤通报, 2002, 33(5): 381-384 DOI:10.3321/j.issn:0564-3945.2002.05.016 (  0) 0) |
| [26] |
Aulakh M S, Khera T S, Doran J W, et al. Denitrification, N2O and CO2 fluxes in rice-wheat cropping system as affected by crop residues, fertilizer N and legume green manure[J]. Biology and Fertility of Soils, 2001, 34(6): 375-389 DOI:10.1007/s003740100420 (  0) 0) |
| [27] |
Seitzinger S P, Nielsen L P, Caffrey J, et al. Denitrification measurements in aquatic sediments: A comparison of three methods[J]. Biogeochemistry, 1993, 23(3): 147-167 DOI:10.1007/BF00023750 (  0) 0) |
| [28] |
Rudolph J, Frenzel P, Pfennig N. Acetylene inhibition technique underestimates in situ denitrification rates in intact cores of freshwater sediment[J]. FEMS Microbiology Letters, 1991, 85(2): 101-106 DOI:10.1111/j.1574-6968.1991.tb04702.x (  0) 0) |
| [29] |
Nielsen T H, Nielsen L P, Revsbech N P. Nitrification and coupled nitrification-denitrification associated with a soil-manure interface[J]. Soil Science Society of America Journal, 1996, 60(6): 1829-1840 DOI:10.2136/sssaj1996.03615995006000060031x (  0) 0) |
| [30] |
Bollmann A, Conrad R. Acetylene blockage technique leads to underestimation of denitrification rates in oxic soils due to scavenging of intermediate nitric oxide[J]. Soil Biology and Biochemistry, 1997, 29(7): 1067-1077 DOI:10.1016/S0038-0717(97)00007-2 (  0) 0) |
| [31] |
李飞跃, 杨绒, 遆超普, 等. 秦淮河流域句容水库农业流域水体沉积物的反硝化作用[J]. 环境科学学报, 2009, 29(4): 854-860 DOI:10.3321/j.issn:0253-2468.2009.04.027 (  0) 0) |
| [32] |
Li X B, Xia Y Q, Li Y F, et al. Sediment denitrification in waterways in a rice-paddy-dominated watershed in Eastern China[J]. Journal of Soils and Sediments, 2013, 13(4): 783-792 DOI:10.1007/s11368-013-0651-0 (  0) 0) |
| [33] |
朱兆良. 农田中氮肥的损失与对策[J]. 土壤与环境, 2000, 9(1): 1-6 DOI:10.3969/j.issn.1674-5906.2000.01.001 (  0) 0) |
| [34] |
Hauck R D, Melsted S W. Some aspects of the problem of evaluating denitrification in soils[J]. Soil Science Society of America Journal, 1956, 20(3): 361-364 DOI:10.2136/sssaj1956.03615995002000030017x (  0) 0) |
| [35] |
邹国元, 李新慧, 张琳. 水稻土氮素硝化-反硝化损失的直接测定初报[J]. 中国农业大学学报, 1997, 2(S2): 79-82 (  0) 0) |
| [36] |
Siegel R S, Hauck R D, Kurtz L T. Determination of 30N2 and application to measurement of N2 evolution during Denitrification1[J]. Soil Science Society of America Journal, 1982, 46(1): 68 DOI:10.2136/sssaj1982.03615995004600010013x (  0) 0) |
| [37] |
Steingruber S M, Friedrich J, Gä chter R, et al. Measurement of denitrification in sediments with the 15N isotope pairing technique[J]. Applied and Environmental Microbiology, 2001, 67(9): 3771-3778 DOI:10.1128/AEM.67.9.3771-3778.2001 (  0) 0) |
| [38] |
Buresh R J, de Datta S K. Denitrification losses from puddled rice soils in the tropics[J]. Biology and Fertility of Soils, 1990, 9(1): 1-13 DOI:10.1007/BF00335854 (  0) 0) |
| [39] |
de Datta S K, Samson M I, Obcemea W N, et al. Direct measurement of ammonia and denitrification fluxes from urea applied to rice[J]. Soil Science Society of America Journal, 1991, 55(2): 543 DOI:10.2136/sssaj1991.03615995005500020043x (  0) 0) |
| [40] |
Scholefield D, Hawkins J M B, Jackson S M. Development of a helium atmosphere soil incubation technique for direct measurement of nitrous oxide and dinitrogen fluxes during denitrification[J]. Soil Biology and Biochemistry, 1997, 29(9/10): 1345-1352 (  0) 0) |
| [41] |
Arth I, Frenzel P, Conrad R. Denitrification coupled to nitrification in the rhizosphere of rice[J]. Soil Biology and Biochemistry, 1998, 30(4): 509-515 DOI:10.1016/S0038-0717(97)00143-0 (  0) 0) |
| [42] |
Butterbach-Bahl K, Willibald G, Papen H. Soil core method for direct simultaneous determination of N2 and N2O emissions from forest soils[J]. Plant and Soil, 2002, 240(1): 105-116 DOI:10.1023/A:1015870518723 (  0) 0) |
| [43] |
Molstad L, Dö rsch P, Bakken L R. Robotized incubation system for monitoring gases (O2, NO, N2O N2) in denitrifying cultures[J]. Journal of Microbiological Methods, 2007, 71(3): 202-211 DOI:10.1016/j.mimet.2007.08.011 (  0) 0) |
| [44] |
Qin S P, Hu C S, Oenema O. Quantifying the underestimation of soil denitrification potential as determined by the acetylene inhibition method[J]. Soil Biology and Biochemistry, 2012, 47: 14-17 DOI:10.1016/j.soilbio.2011.12.019 (  0) 0) |
| [45] |
Wang R, Willibald G, Feng Q, et al. Measurement of N2, N2O, NO, and CO2 emissions from soil with the gas-flow-soil-core technique[J]. Environmental Science & Technology, 2011, 45(14): 6066-6072 (  0) 0) |
| [46] |
Wu D, Wei Z J, Well R, et al. Straw amendment with nitrate-N decreased N2O/(N2O+N2) ratio but increased soil N2O emission: A case study of direct soil-born N2 measurements[J]. Soil Biology and Biochemistry, 2018, 127: 301-304 DOI:10.1016/j.soilbio.2018.10.002 (  0) 0) |
| [47] |
Qin S P, Clough T, Luo J F, et al. Perturbation-free measurement of in situ di-nitrogen emissions from denitrification in nitrate-rich aquatic ecosystems[J]. Water Research, 2017, 109: 94-101 DOI:10.1016/j.watres.2016.11.035 (  0) 0) |
| [48] |
张志君, 秦树平, 袁海静, 等. 土壤氮气排放研究进展[J]. 中国生态农业学报, 2018, 26(2): 182-189 (  0) 0) |
| [49] |
Kana T M, Darkangelo C, Hunt M D, et al. Membrane inlet mass spectrometer for rapid high-precision determination of N2, O2, and Ar in environmental water samples[J]. Analytical Chemistry, 1994, 66(23): 4166-4170 DOI:10.1021/ac00095a009 (  0) 0) |
| [50] |
Shan J, Yang P P, Shang X X, et al. Anaerobic ammonium oxidation and denitrification in a paddy soil as affected by temperature, pH, organic carbon, and substrates[J]. Biology and Fertility of Soils, 2018, 54(3): 341-348 DOI:10.1007/s00374-018-1263-z (  0) 0) |
| [51] |
Zhao Y Q, Xia Y Q, Kana T M, et al. Seasonal variation and controlling factors of anaerobic ammonium oxidation in freshwater river sediments in the Taihu Lake region of China[J]. Chemosphere, 2013, 93(9): 2124-2131 DOI:10.1016/j.chemosphere.2013.07.063 (  0) 0) |
| [52] |
Zhao Y Q, Xia Y Q, Ti C P, et al. Nitrogen removal capacity of the river network in a high nitrogen loading region[J]. Environmental Science & Technology, 2015, 49(3): 1427-1435 (  0) 0) |
| [53] |
李晓波, 夏永秋, 郎漫, 等. N2: Ar法直接测定淹水环境反硝化产物N2的产生速率[J]. 农业环境科学学报, 2013, 32(6): 1284-1288 (  0) 0) |
| [54] |
Li X B, Xia L L, Yan X Y. Application of membrane inlet mass spectrometry to directly quantify denitrification in flooded rice paddy soil[J]. Biology and Fertility of Soils, 2014, 50(6): 891-900 DOI:10.1007/s00374-014-0910-2 (  0) 0) |
| [55] |
Wang S W, Shan J, Xia Y Q, et al. Different effects of biochar and a nitrification inhibitor application on paddy soil denitrification: A field experiment over two conescutive rice-growing seasons[J]. Science of the Total Environment, 2017, 593/594: 347-356 DOI:10.1016/j.scitotenv.2017.03.159 (  0) 0) |
| [56] |
王书伟, 颜晓元, 单军, 等. 利用膜进样质谱法测定不同氮肥用量下反硝化氮素损失[J]. 土壤, 2018, 50(4): 664-673 (  0) 0) |
| [57] |
Reddy K R, Patrick W H Jr, Lindau C W. Nitrification-denitrification at the plant root-sediment interface in wetlands[J]. Limnology and Oceanography, 1989, 34(6): 1004-1013 DOI:10.4319/lo.1989.34.6.1004 (  0) 0) |
| [58] |
Barton L, McLay C D A, Schipper L A, et al. Denitrification rates in a wastewater-irrigated forest soil in new Zealand[J]. Journal of Environmental Quality, 1999, 28(6): 2008-2014 (  0) 0) |
| [59] |
Nicolaisen M H, Risgaard-Petersen N, Revsbech N P, et al. Nitrification-denitrification dynamics and community structure of ammonia oxidizing bacteria in a high yield irrigated Philippine rice field[J]. FEMS Microbiology Ecology, 2004, 49(3): 359-369 DOI:10.1016/j.femsec.2004.04.015 (  0) 0) |
2. State Key Laboratory of Soil and Sustainable Agriculture, Institute of Soil Science, Chinese Academy of Sciences, Nanjing 210008, China;
3. South China Botanical Garden, Chinese Academy of Sciences, Guangzhou 510650, China;
4. Shandong Institute of Sericulture, Yantai, Shandong 264002, China;
5. School of Ecology and Environment, Anhui Normal University, Wuhu, Anhui 241002, China
 2021, Vol. 53
2021, Vol. 53


