2. 中国科学院大学, 北京 100049
砷是地球上广泛存在的类金属元素,痕量的砷会导致人体急性和慢性中毒,属于一级致癌物[1]。近年来,由于含砷农药施用、矿山开采、有色金属冶炼等行为,造成土壤砷污染[2]。我国土壤砷污染十分突出,2014年《全国土壤污染状况调查公报》[3]显示,全国土壤中砷的点位超标率为2.7%。土壤中砷的形态影响着其毒性和迁移转化过程,因此其在土壤中的地球化学行为备受关注。研究发现土壤氧化还原电位、金属矿物和硫元素含量等对砷的迁移转化过程具有重要的影响[4-6]。由于水稻的特殊培育方式,稻田土壤频繁的干湿交替会显著影响砷的氧化和固定过程,如淹水期会导致大量三价砷(As(Ⅲ))释放到水体中,增大其生物有效性及生物毒性,从而对植物及人体造成危害[7]。因此,对于稻田土壤中砷的转化固定过程引起了广泛关注。
稻田的干湿交替过程还会影响其他元素比如铁、硫的转化过程。淹水还原条件下,铁与硫元素在土壤中易形成硫化亚铁(FeS)二次沉淀,黄铁矿(FeS2)、磁黄铁矿(Fe1-xS)、黄铜矿(CuFeS2)等矿物,且由于砷具有亲硫性,通常会与这些还原性硫化矿伴生存在[4, 8-9]。当还原环境受到扰动时,例如水位波动和稻田干湿交替等,土壤或矿物中还原性的硫会发生氧化溶解,形成不同价态的硫中间体如硫代硫酸根、亚硫酸根等,最终生成硫酸根离子,并且将砷释放到环境中,造成砷污染[4, 10-11]。然而,目前大多的研究只关注此过程中砷的溶解释放,有关砷特别是As(Ⅲ) 在此过程的氧化机制并不清楚。Jeong等[12]发现FeS氧化溶出的Fe2+在接触氧气过程中可以将环境中的As(Ⅲ) 共氧化成As(Ⅴ),并固定在生成的二次沉淀上;Cheng等[13]研究发现在FeS氧化溶解过程中会产生羟基自由基(·OH),具有较高氧化还原电位,可以有效地氧化As(Ⅲ) 成As(Ⅴ)。综上可以发现,环境中的铁和氧气参与了砷的迁移转化。然而大部分研究主要关注Fe2+和氧气的作用,较少关注这些还原性物质在接触氧气时与环境中的一些组分之间的相互作用。例如在金属硫化矿物的氧化溶解过程中能产生一系列中间体如多硫化物、单质硫、亚硫酸根、连二亚硫酸氢盐等,但是这些中间体对砷转化作用贡献和机制的研究较少[14-16]。
近年研究发现,亚硫酸盐可以和一些金属耦合,产生一系列高活性的自由基,如SO3·–、SO5·–、SO4·– 和·OH,具有高氧化还原电位,对一些有机污染物的降解去除有着重要的贡献[17-20]。且亚硫酸盐可以通过酸雨沉降、施用含烟气脱硫副产物的化肥、隐性硫循环等过程进入土壤。为了探究硫中间体在厌氧缺氧环境中的循环,Thamdrup等[16]检测了海洋沉积物的孔隙水中的连二亚硫酸盐和亚硫酸盐的浓度,发现随着深度增加至10 cm,亚硫酸盐的浓度从420 nmol/L增加至1 425 nmol/L,显著高于连二亚硫酸盐的浓度,且二者存在一定的耦合。
基于此,我们推测土壤中硫转化的重要中间体亚硫酸盐与土壤中某些组分如金属离子或还原性矿物如硫铁矿等在接触氧气时会发生相互作用,从而影响土壤中As(Ⅲ) 的氧化和固定过程。本研究拟以浙江嘉兴水稻土为研究对象,探究亚硫酸氢盐对土壤中As(Ⅲ) 转化的过程机制,揭示亚硫酸盐在土壤中产生自由基的过程及其对砷的氧化固定作用,为理解土壤中硫、砷的地球化学循环过程提供新的思路。
1 材料与方法 1.1 试验材料所用试剂主要有NaOH、亚硫酸氢钠、FeSO4·7H2O,硫酸铁、抗坏血酸、叔丁醇、硫脲,购自国药集团化学试剂有限公司。NaAsO2、5, 5-二甲基-1-吡咯啉-N-氧化物(DMPO)购自百灵威科技有限公司。甲醇和2-吗啉乙磺酸(MES)购自南京化学试剂有限公司。试验所用溶液均用超纯水配制,以亚硫酸氢钠作为亚硫酸根的离子源。
土壤样品采自浙江嘉兴某稻田土壤,土壤质地为粉砂壤土。采样深度为0 ~ 20 cm。对土壤样品进行风干,部分研磨过60目筛保存备用。对土壤基本理化性质参照GB 7859—1987[21]测定:pH为6.82,有机质含量33.43 g/kg,阳离子交换量20.42 cmol/kg,As含量4.82 mg/kg。课题组前期的研究发现亚硫酸盐可以被微量过渡金属活化,因此测定土壤中无定形铁、锰的含量:无定形铁的含量6.11 g/kg,无定形锰含量0.21 g/kg。
1.2 试验方法 1.2.1 试验设计反应具体步骤为:称取0.25 g土壤样品于10 ml离心管中,反应体系土水比为1:20(m: V),除特定说明外,均用MES缓冲溶液反应,调控pH在6.0±0.1范围内。溶液中含有一定浓度的亚硫酸盐,以及初始浓度为1.0 mg/L的含As(Ⅲ) 溶液。黑暗中震荡反应,反应温度为(25±2)℃,在特定的反应时间取出,用1.0 ml甲醇猝灭该反应。随后在13 000 r/min转速下离心,取2 ml上清液过0.22 μm PTFE滤膜,用于测定水溶态的砷、溶液中的亚硫酸盐及溶出铁。
1.2.2 亚硫酸盐的测定参照文献[22]方法,亚硫酸盐由紫外分光光度计检测:亚硫酸根离子用DTNB显色,显色5 ~ 10 min内在波长为412 nm处检测。
1.2.3 土壤砷形态检测土壤中吸附态的砷采用磷酸盐提取[23-24],吸附态的砷和水溶态的砷一起被认作土壤有效砷,易被生物吸收[25]。为了保证As(Ⅲ) 在提取24 h的过程中不发生氧化,加入一定量的抗坏血酸[25],具体步骤为:0.1 mol/L KH2PO4和0.1 mol/L抗坏血酸混合溶液(pH为5)黑暗中提取24 h,提取之后13 000 r/min转速离心,取上清液过0.22 μm PTFE滤膜。对于与无定形铁氧化物共沉淀的砷用草酸提取[23],具体操作为:将磷酸盐提取后剩余沉淀用0.2 mol/L草酸黑暗中提取2 h,重复上一操作获得上清液。
1.2.4 砷的分析方法上述上清液中的砷均采用原子荧光法测定[26]。As(Ⅲ) 用0.4 mol/L柠檬酸盐稀释,总砷(As(tot))用1.62 mol/L盐酸稀释并用硫脲-抗坏血酸还原剂还原;测定时,还原剂为硼氢化钾,载流液分别为0.1 mol/L柠檬酸盐(测定As(Ⅲ))和1.62 mol/L盐酸(测定As(tot))。
1.2.5 自由基检测方法将一定浓度亚硫酸盐加入土壤悬液中,黑暗条件下震荡反应一定时间,取出与自由基捕获剂5, 5-二甲基-1-吡咯琳氮氧化物(DMPO)混合,使捕获剂浓度为0.1 mol/L。用电子顺磁共振波谱仪Bruker E500-9.5/12 E5010003(德国)检测,检测条件为:谐振频率9.84 kHz,微波功率6.33 mW,调制频率100 kHz,调制幅度1.0 G。
2 结果与分析 2.1 亚硫酸盐对三价砷的氧化与总砷固定的影响 2.1.1 反应溶液中As(Ⅲ) 的氧化与总砷的固定反应温度为室温,砷初始浓度为1 mg/L,亚硫酸盐浓度分别为1 mmol/L和2 mmol/L,亚硫酸盐对砷的氧化固定结果如图 1所示。在48 h反应时间内,悬液上清液中的As(Ⅲ) 和As(tot) 均逐渐降低,As(Ⅲ)和总砷的浓度分别降低至140.19 ~ 149.24 μg/L和183.55 ~ 221.34 μg/L,变化趋势相似。未加亚硫酸盐的对照体系中,As(Ⅲ) 和As(tot) 的降低可能是由于As(Ⅲ) 在氧气的作用下发生了快速的氧化,氧化后形成的As(Ⅴ) 被快速固定在土壤中。另外,As(Ⅲ) 也可以被逐渐吸附到土壤中,但As(Ⅴ) 在土壤中的吸附固定能力高于As(Ⅲ)[27-28]。对不同浓度亚硫酸盐体系前10 h的As(Ⅲ) 浓度进行准一级动力学拟合,结果如图 1C所示,发现加入1 mmol/L亚硫酸盐后,体系中As(Ⅲ) 降低速率显著增加,从0.043 9 h–1增加至0.215 5 h–1,且As(Ⅲ) 和As(tot) 变化趋势相近。说明亚硫酸盐加入显著促进As(Ⅲ)的氧化,且加速As(tot)的固定(图 1B)。加入2 mmol/L亚硫酸盐体系中的As(Ⅲ) 和As(tot) 降低速率和不加亚硫酸盐的趋势相近,但由于土壤可以同时吸附As(Ⅲ) 和As(Ⅴ),其具体氧化作用需要结合吸附态的结果分析。

|
(A. 水溶态As(Ⅲ);B. 水溶态As(tot);C. 水溶态As(Ⅲ)动力学拟合) 图 1 不同体系下砷浓度变化 Fig. 1 Variations of As concentrations in different systems |
为了进一步解析As(Ⅲ) 的氧化固定机制,分析了土壤中不同形态砷在反应过程的变化,结果如图 2所示。所有处理中,磷酸提取的吸附态As(Ⅲ) 均随着反应时间的延长而逐渐升高,这与图 1上清液中As(Ⅲ) 和总砷降低的趋势是一致,进一步说明了As(Ⅲ) 在反应过程中被逐渐吸附固定在土壤中。与对照处理相比,亚硫酸盐的加入显著降低了吸附态As(Ⅲ) 的浓度,加入1 mmol/L和2 mmol/L亚硫酸盐反应48 h后As(Ⅲ) 浓度从73.53 μg/L分别降低至46.91 μg/L和35.27 μg/L,吸附态As(Ⅲ) 的占比从对照处理的40.40% 降低至24.69% 和20.31%。且在反应24 ~ 48 h,加入2 mmol/L亚硫酸盐体系中的As(Ⅲ) 又发生了降低,说明亚硫酸盐的加入也促进了吸附态As(Ⅲ) 的氧化。此外,对于非晶体结合的草酸提取态As(Ⅲ) 也存在着类似的规律,未加入亚硫酸盐体系中As(Ⅲ) 浓度为11.60 μg/L,加入1 mmol/L和2 mmol/L亚硫酸盐的体系中As(Ⅲ) 浓度分别为7.47和7.22 μg/L。结合上述两种土壤中砷主要存在形态的结果可得,亚硫酸盐的加入有效促进了土壤中As(Ⅲ) 的氧化,进一步说明了亚硫酸盐促进了As(Ⅲ) 的氧化过程。
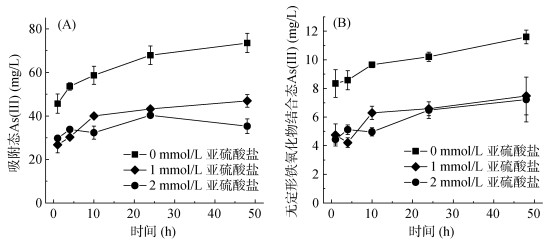
|
(A. 吸附态As(Ⅲ);B. 与无定形铁氧化物结合态As(Ⅲ)) 图 2 土壤中不同形态As(Ⅲ) 浓度变化 Fig. 2 Variations of concentrations of different soil As phases |
为了进一步解析上述砷的氧化固定过程,将3部分的砷进行总量换算,结果如图 3所示,可以看出,砷主要以吸附态形式存在,占总砷的78.07%,无定形铁铝氧化物结合态的砷较少,仅占4.80%(由于其较稳定,后续试验省略其分析),而水溶态的砷占17.13%,且主要以As(Ⅲ) 存在。
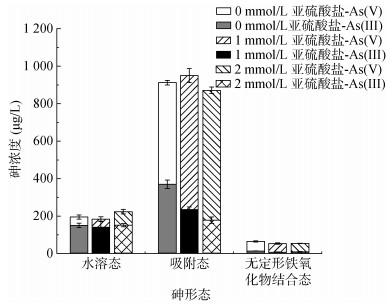
|
图 3 反应48 h时不同形态砷浓度 Fig. 3 Concentrations of different As phases after 48 h reaction time |
前人文献[4]也报道过As(Ⅲ) 的迁移能力大于As(Ⅴ),通过吸附态中As(Ⅴ) 占比较大也可推测出As(Ⅴ)更容易吸附到土壤中。加入亚硫酸盐会加速As(Ⅲ) 转化为As(Ⅴ),从而增加As(Ⅴ) 在吸附态砷中的占比。与对照相比,As(Ⅴ) 吸附至土壤中的占比从59.60% 增加至75.31%(1 mmol/L亚硫酸盐体系)和79.69%(2 mmol/L亚硫酸盐体系)。上述结果证明了亚硫酸盐加入不仅能够促进As(Ⅲ) 的氧化,还能够促进总砷在土壤中的吸附和固定。因此,亚硫酸盐与土壤中的组分相互作用,促进As(Ⅲ) 转化As(Ⅴ),减少As(Ⅲ)在土壤中的含量,一定程度上降低砷的生态环境风险。
2.2 亚硫酸盐对土壤溶液中三价砷氧化的自由基机制研究表明,亚硫酸根离子能够与金属离子如Fe3+或Fe2+反应形成自由基降解有机污染物[18, 29],因此我们推测土壤中亚硫酸根会与溶出的金属离子或矿物反应形成自由基,从而氧化As(Ⅲ),为了证实这一过程,电子顺磁共振技术用于检测体系中自由基的形成。土壤样品为0.25 g,分别加入1 mmol/L和2 mmol/L亚硫酸盐反应一定时间,加入自由基的捕获剂后,用电子顺磁共振波谱仪检测。所得图谱如图 4所示,加入亚硫酸盐的体系中均检测到自由基的EPR信号,通过其超精细分裂常数的分析(aN =14.55G,aH =16.16G),发现此信号主要是DMPO捕获亚硫酸根自由基(SO3·–)后所形成的信号(DMPO-SO3),说明了该体系有SO3·–的产生。反应进行3 min时,对比加入1 mmol/L亚硫酸盐的体系,加入2 mmol/L亚硫酸盐体系的信号显著增强,且反应1 h仍有DMPO-SO3的信号被检测到,虽然强度明显减弱。因此,上述结果证实了亚硫酸根的加入诱导产生了氧化性的SO3·–,从而快速将As(Ⅲ) 氧化为As(Ⅴ),并加速砷的固定。土壤矿物或金属离子如铁离子可能是驱动SO3·–形成的主要动力。
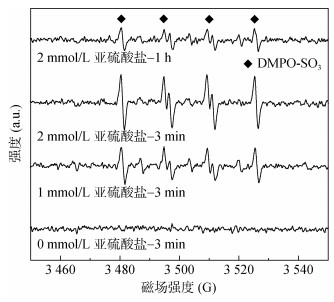
|
图 4 不同亚硫酸盐浓度体系活化的自由基信号 Fig. 4 EPR spectra of different sulfite concentration systems |
为了进一步探究土壤中铁离子对亚硫酸根自由基形成和砷氧化的贡献,考察了在反应体系中加入Fe3+对亚硫酸根氧化土壤中As(Ⅲ) 的影响。结果如图 5所示,加入2 g/kg土壤的Fe3+到1 mmol/L亚硫酸盐体系中,可以发现单独Fe3+加入不能促进As(Ⅲ) 的吸附固定作用,反应24 h时,水溶态的As(Ⅲ) 浓度为131.90 μg/L,与未加铁盐的结果相近(147.98 μg/L);而当Fe3+和亚硫酸盐同时加入到体系中,水溶液的As(Ⅲ) 在反应1 h内迅速降低,说明了Fe3+的加入显著促进亚硫酸盐对As(Ⅲ) 的氧化效果。并对土壤吸附态As(Ⅲ)进行检测,结果如图 5B所示,Fe3+与亚硫酸盐的加入显著降低了土壤吸附态As(Ⅲ)的量,说明Fe3+的加入可以促进As(Ⅲ) 被快速氧化固定至土壤。
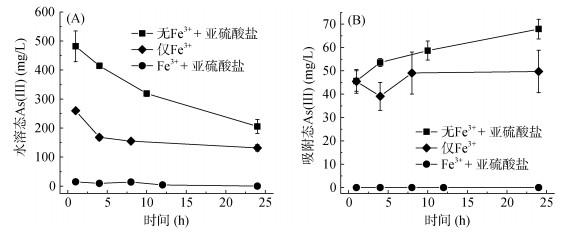
|
(A. 水溶态As(Ⅲ);B. 磷酸提取态As(Ⅲ)) 图 5 不同形态铁对亚硫酸盐活化氧化As(Ⅲ)的影响 Fig. 5 Effects of different iron phases on As oxidation by sulfite |
研究了亚硫酸盐浓度对土壤中As(Ⅲ)氧化固定的影响,结果如图 6所示。与图 1A的缓冲体系相比,2 mmol/L亚硫酸盐加入可以更快氧化土壤悬液中的As(Ⅲ),反应24 h后,水溶态的As(Ⅲ) 均降低至30 μg/L以下,而对应缓冲体系As(Ⅲ) 的浓度为149.24 μg/L。对比缓冲体系,磷酸盐提取态As(Ⅲ) 的浓度也有下降,反应24 h后的As(Ⅲ) 从46.91 μg/L (1 mmol/L亚硫酸盐体系)和35.27 μg/L(2 mmol/L亚硫酸盐体系)分别降低至37.08 μg/L和31.35 μg/L。
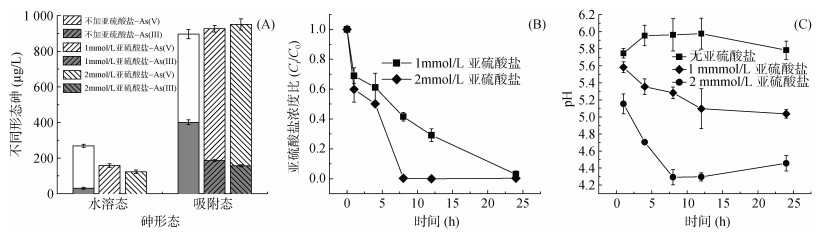
|
图 6 无缓冲体系中反应24 h时各形态砷的浓度(A)、亚硫酸盐浓度比变化(B)及pH的变化(C) Fig. 6 Distributions of different As phases after 24 h reaction time (A), variations of sulfite concentrations (B) and variations of pH in systems without buffer (C) |
无缓冲盐参与时,亚硫酸盐被活化的效率增加,推测其主要与加入亚硫酸盐后pH迅速降低有关。经测定发现,加入2 mmol/L亚硫酸盐的体系,pH在前8 h内迅速降低至4.5左右(图 6C),亚硫酸盐也在前8 h内迅速消耗完全(图 6B),说明pH降低促进亚硫酸盐活化。前人研究[18, 30]曾报导过在铁活化亚硫酸盐的体系中,降解污染物最佳pH为4左右,主要是由于铁离子的溶出。而加入1 mmol/L亚硫酸盐的体系pH从1 h时刻的5.58降至24 h的5.04,可能因其尚未降低至最佳pH范围内,故亚硫酸盐消耗速率较2 mmol/L亚硫酸盐体系的慢。
2.5 金属-亚硫酸盐耦合产生自由基的途径综合上述试验结果以及已报道的文献,可以推测出亚硫酸盐在土壤中加速砷氧化固定的机制。土壤中的某些金属离子,比如铁元素,可以有效活化亚硫酸盐,通过公式(1)产生自由基SO3·–,启动自由基链式反应,生成一系列活性氧自由基SO5·–、SO4·–和·OH(公式(2) ~ (4))[18]。自旋顺磁共振仅检测到SO3·–的信号,未检测到SO4·–和·OH的信号,可能是由于捕获剂DMPO与SO3·–反应,阻断其下一步反应。
| $ {\text{M}}{{\text{e}}^{{\text{n}} + }} + {\text{HSO}}_{\text{3}}^ - \to {\text{SO}}_3^ - + {\text{M}}{{\text{e}}^{({\text{n}} - 1) + }} $ | (1) |
| $ {\text{SO}}_3^ - + {{\text{O}}_2} \to {\text{SO}}_5^ - , \;{K_3} = 1.5 \times {10^9}\;{\text{mol/}}({\text{L}} \cdot {\text{s}}) $ | (2) |
| $ \begin{gathered} {\text{SO}}_5^ - {\text{ + HSO}}_3^ - \to {\text{SO}}_4^{2 - } + {\text{SO}}_4^ - + \hfill \\ {{\text{H}}^ + }, \;{K_4} = ({10^4} - {10^7})\;{\text{mol/}}({\text{L}} \cdot {\text{s}}) \hfill \\ \end{gathered} $ | (3) |
| $ {\text{SO}}_4^ - {\text{ + }}{{\text{H}}_{\text{2}}}{\text{O}} \to {\text{SO}}_4^{2 - } + \cdot {\text{OH}}, \;{K_5} = 6.6 \times {10^2}\;{\text{mol/}}({\text{L}} \cdot {\text{s}}) $ | (4) |
因此,亚硫酸盐可以活化产生自由基加速氧化土壤悬液中的As(Ⅲ)。而由于在土壤中As(Ⅴ) 可以被多种铁铝氧化物优先吸附,因此更容易被吸附固定在土壤中。综上,亚硫酸盐的加入可以被土壤中的某些组分活化,生成活性自由基非生物氧化As(Ⅲ) 为As(Ⅴ),进而加速砷在土壤中固定。
3 结论本文系统阐述了土壤中普遍存在的硫转化中间体亚硫酸盐对土壤中砷的转化和固定,发现亚硫酸盐的加入可以有效促进As(Ⅲ) 氧化至As(Ⅴ),并固定在土壤中。铁-亚硫酸根耦合产生的自由基是As(Ⅲ) 氧化的主要驱动力,在多数土壤pH范围(4 ~ 6),As(Ⅲ) 均能够被氧化固定,偏酸性环境下可以促进亚硫酸盐对As(Ⅲ) 的氧化;Fe3+的加入也可以显著提高亚硫酸盐氧化As(Ⅲ) 和体系砷固定的效率。本研究将为理解土壤中硫循环影响砷的迁移转化过程提供新的思路,并以此为基础发展基于硫源投加控制土壤砷污染提供潜在的理论支撑。
| [1] |
Zhao F J, McGrath S P, Meharg A A. Arsenic as a food chain contaminant: Mechanisms of plant uptake and metabolism and mitigation strategies[J]. Annual Review of Plant Biology, 2010, 61: 535-559 DOI:10.1146/annurev-arplant-042809-112152 (  0) 0) |
| [2] |
Qin W X, Wang Y J, Fang G D, et al. Oxidation mechanism of As(Ⅲ) in the presence of polyphenols: New insights into the reactive oxygen species[J]. Chemical Engineering Journal, 2016, 285: 69-76 DOI:10.1016/j.cej.2015.09.095 (  0) 0) |
| [3] |
全国土壤污染状况调查公报[EB/OL]. (2014-04-17). http://www.zhb.gov.cn/gkml/hbb/qt/201404/t20140417_270670.htm.
(  0) 0) |
| [4] |
Cheng H F, Hu Y, Luo J, et al. Geochemical processes controlling fate and transport of arsenic in acid mine drainage (AMD) and natural systems[J]. Journal of Hazardous Materials, 2009, 165(1/2/3): 13-26 (  0) 0) |
| [5] |
Farquhar M L, Charnock J M, Livens F R, et al. Mechanisms of arsenic uptake from aqueous solution by interaction with goethite, lepidocrocite, mackinawite, and pyrite: An X-ray absorption spectroscopy study[J]. Environmental Science & Technology, 2002, 36(8): 1757-1762 (  0) 0) |
| [6] |
Jang J H, Dempsey B A. Coadsorption of arsenic(Ⅲ) and arsenic(Ⅴ) onto Hydrous ferric oxide: Effects on abiotic oxidation of arsenic(Ⅲ), extraction efficiency, and model accuracy[J]. Environmental Science & Technology, 2008, 42(8): 2893-2898 (  0) 0) |
| [7] |
Honma T, Ohba H, Kaneko-Kadokura A, et al. Optimal soil eh, pH, and water management for simultaneously minimizing arsenic and cadmium concentrations in rice grains[J]. Environmental Science & Technology, 2016, 50(8): 4178-4185 (  0) 0) |
| [8] |
Chiriţă P, Descostes M. Anoxic dissolution of troilite in acidic media[J]. Journal of Colloid and Interface Science, 2006, 294(2): 376-384 DOI:10.1016/j.jcis.2005.07.047 (  0) 0) |
| [9] |
Xu X W, Wang P, Zhang J, et al. Microbial sulfate reduction decreases arsenic mobilization in flooded paddy soils with high potential for microbial Fe reduction[J]. Environmental Pollution, 2019, 251: 952-960 DOI:10.1016/j.envpol.2019.05.086 (  0) 0) |
| [10] |
An X L, Huang F G, Ren H T, et al. Oxidative dissolution of amorphous FeS and speciation of secondary Fe minerals: Effects of pH and As(Ⅲ) concentration[J]. Chemical Geology, 2017, 462: 44-54 DOI:10.1016/j.chemgeo.2017.04.025 (  0) 0) |
| [11] |
Zhu J, Zhang P, Yuan S H, et al. Arsenic oxidation and immobilization in acid mine drainage in Karst areas[J]. Science of the Total Environment, 2020, 727: 138629 DOI:10.1016/j.scitotenv.2020.138629 (  0) 0) |
| [12] |
Jeong H Y, Han Y S, Park S W, et al. Aerobic oxidation of mackinawite (FeS) and its environmental implication for arsenic mobilization[J]. Geochimica et Cosmochimica Acta, 2010, 74(11): 3182-3198 (  0) 0) |
| [13] |
Cheng D, Yuan S H, Liao P, et al. Oxidizing impact induced by mackinawite (FeS) nanoparticles at oxic conditions due to production of hydroxyl radicals[J]. Environmental Science & Technology, 2016, 50(21): 11646-11653 (  0) 0) |
| [14] |
Wang Q W, Morse J W. Pyrite formation under conditions approximating those in anoxic sediments I. Pathway and morphology[J]. Marine Chemistry, 1996, 52(2): 99-121 DOI:10.1016/0304-4203(95)00082-8 (  0) 0) |
| [15] |
Schippers A, Sand W. Bacterial leaching of metal sulfides proceeds by two indirect mechanisms via thiosulfate or via polysulfides and sulfur[J]. Applied and Environmental Microbiology, 1999, 65(1): 319-321 DOI:10.1128/AEM.65.1.319-321.1999 (  0) 0) |
| [16] |
Thamdrup B, Finster K, Fossing H, et al. Thiosulfate and sulfite distributions in porewater of marine sediments related to manganese, iron, and sulfur geochemistry[J]. Geochimica et Cosmochimica Acta, 1994, 58(1): 67-73 DOI:10.1016/0016-7037(94)90446-4 (  0) 0) |
| [17] |
Neta P, Huie R E. One-electron redox reactions involving sulfite ions and aromatic amines[J]. The Journal of Physical Chemistry, 1985, 89(9): 1783-1787 DOI:10.1021/j100255a049 (  0) 0) |
| [18] |
Xu J, Ding W, Wu F, et al. Rapid catalytic oxidation of arsenite to arsenate in an iron(Ⅲ)/sulfite system under visible light[J]. Applied Catalysis B: Environmental, 2016, 186: 56-61 DOI:10.1016/j.apcatb.2015.12.033 (  0) 0) |
| [19] |
吴根华, 王肖磊, 方国东, 等. 硫化铜活化过氧化氢降解邻苯二甲酸二乙酯的研究[J]. 农业环境科学学报, 2020, 39(11): 2532-2538 (  0) 0) |
| [20] |
魏海江, 杨兴伦, 叶茂, 等. 活化过硫酸钠氧化法修复DDTs污染场地土壤研究[J]. 土壤, 2014, 46(3): 504-511 (  0) 0) |
| [21] |
GB 7859-1987, 森林土壤pH值的测定[S].
(  0) 0) |
| [22] |
Dong H Y, Chen J, Feng L Y, et al. Degradation of organic contaminants through activating bisulfite by cerium(Ⅳ): A sulfate radical-predominant oxidation process[J]. Chemical Engineering Journal, 2019, 357: 328-336 DOI:10.1016/j.cej.2018.09.024 (  0) 0) |
| [23] |
Keon N E, Swartz C H, Brabander D J, et al. Validation of an arsenic sequential extraction method for evaluating mobility in sediments[J]. Environmental Science & Technology, 2001, 35(16): 3396 (  0) 0) |
| [24] |
Bok Jung H, Zheng Y. Enhanced recovery of arsenite sorbed onto synthetic oxides by l-ascorbic acid addition to phosphate solution: Calibrating a sequential leaching method for the speciation analysis of arsenic in natural samples[J]. Water Research, 2006, 40(11): 2168-2180 (  0) 0) |
| [25] |
谢伟, 谭向平, 田海霞, 等. 土壤水分对稻田土壤有效砷及碱性磷酸酶活性影响[J]. 中国环境科学, 2016, 36(8): 2418-2424 (  0) 0) |
| [26] |
Guo H M, Zhou Y Z, Jia Y F, et al. Sulfur cycling-related biogeochemical processes of arsenic mobilization in the western Hetao basin, China: Evidence from multiple isotope approaches[J]. Environmental Science & Technology, 2016, 50(23): 12650-12659 (  0) 0) |
| [27] |
Redman A D, Macalady D L, Ahmann D. Natural organic matter affects arsenic speciation and sorption onto hematite[J]. Environmental Science & Technology, 2002, 36(13): 2889-2896 (  0) 0) |
| [28] |
Masscheleyn P H, Delaune R D, Patrick W H Jr. Effect of redox potential and pH on arsenic speciation and solubility in a contaminated soil[J]. Environmental Science & Technology, 1991, 25(8): 1414-1419 (  0) 0) |
| [29] |
Chen L, Tang M, Chen C, et al. Efficient bacterial inactivation by transition metal catalyzed auto-oxidation of sulfite[J]. Environmental Science & Technology, 2017, 51(21): 12663-12671 (  0) 0) |
| [30] |
Xie P C, Guo Y Z, Chen Y Q, et al. Application of a novel advanced oxidation process using sulfite and zero-valent iron in treatment of organic pollutants[J]. Chemical Engineering Journal, 2017, 314: 240-248 (  0) 0) |
2. University of Chinese Academy of Sciences, Beijing 100049, China
 2022, Vol. 54
2022, Vol. 54


