微塑料是粒径小于5 mm的塑料纤维、颗粒和薄膜[1],广泛存在于海洋、淡水及陆地生态系统中[2-4],甚至在大气中也发现了微塑料[5]。塑料在环境中极不易分解,且因其具有尺寸小和比表面积大等特性,微塑料的环境危害普遍被认为比大型塑料更大。微塑料的小尺寸使得它们很容易被环境中各种各样的生物摄取,不仅对生物具有生长发育毒性,且对动物的选择性取食行为也造成了一定影响,如在浓度为50个/ml、粒径为10 ~ 30 μm的聚酰胺纤维中暴露后,冷水桡足类对猎物的选择性发生了显著改变,对藻类的摄取率下降了40%[6]。Rotjan等[7]发现摄入微塑料后的珊瑚(Astrangia poculata)抑制了对其食物盐水虾卵的摄入。动物的选择性取食行为在自然界十分普遍,不管是拥有味觉的高等生物还是低等生物(如原生动物和线虫等)在取食时都会依据本能选择能够为自身生长提供均衡营养的食物,并且具有独特的偏好性[8]。微塑料对动物选择性取食行为的改变可以显著影响动物的进食和健康,对该种动物发挥重要作用的食物网和生态过程产生潜在的连锁效应,最终对生态系统产生影响[6]。
微塑料也被发现对土壤模式生物秀丽隐杆线虫具有生理与神经毒性,聚酰胺、聚乙烯、聚氯乙烯微塑料暴露均能缩短线虫寿命,抑制线虫繁殖,引起线虫体内氧化应激反应,并能引发线虫慢性神经毒性,使线虫的运动发生障碍[9-12]。但目前微塑料对线虫的取食偏好方面产生的影响暂未见报道,食细菌线虫对微生物的选择性取食不仅影响到线虫自身的健康及生存适应性[13-15],还会改变微生物种间竞争的结果,并影响微生物在土壤中的分布,微生物的数量、活性以及群落结构,对分析土壤食物网的能量流动与养分转化具有重要意义[16],因此研究微塑料对线虫取食偏好的影响及其机制可以为微塑料在环境中潜在的生态风险评价提供科学依据。
故本文选择1 μm和5 μm两种粒径,1、10、100 mg/L 3个浓度以及短期和长期两种暴露时间来研究环境中较为常见塑料类型——聚苯乙烯微塑料对秀丽隐杆线虫取食偏好的影响,并从生化水平和分子水平探讨了聚苯乙烯微塑料对秀丽隐杆线虫的取食偏好的影响机制,以期为微塑料的毒性评价和风险评估提供新的思路和依据。
1 材料与方法 1.1 培养基及溶液线虫培养基1 L (NGM,nematode growth medium):称取NaCl 3 g、蛋白胨2.5 g、琼脂粉17 g,加入975 ml去离子水,121 ℃高温灭菌20 min,冷却至55 ℃左右,分别加入过0.22 μm无菌滤膜的1 ml 1 mol/L MgSO4、1 ml 1 mol/L CaCl2、1 ml 5 mg/ml胆固醇、25 ml 1 mol/L KPO4缓冲液(pH 6.0)。1 mol/L KPO4缓冲液(pH 6.0):称取108.3 g KH2PO4、35.6 g K2HPO4,加入去离子水超声溶解并定容至1 L。细菌培养基1 L (LB培养基,Luria-Bertani medium):称取NaCl 10 g、胰蛋白胨Tryptone 10 g、酵母膏5 g,用去离子水溶解并定容至1 L,121 ℃高温灭菌20 min。M9缓冲液1 L:NaCl 5 g、KH2PO4 3 g、Na2HPO4 6 g、MgSO4 (1 mol/L) 1 ml,加入去离子水溶解并定容至1 L,121 ℃高温灭菌20 min,常温放置备用。线虫裂解液(9 ml):7 ml无菌水中加入1 ml 5 mol/L的NaOH、1 ml 10% NaClO,混匀,现配现用。
1.2 微塑料及其表征测定聚苯乙烯(PS) 颗粒购于天津倍思乐色谱技术开发中心,分为两种直径:1 μm和5 μm,均匀分散在水溶液中,带有绿色荧光便于查看微塑料在线虫体内的分布,最大激发波长和最大发射波长分别为488 nm和518 nm。利用扫描电子显微镜(scanning electron microscope,SEM) 对微塑料颗粒的形貌进行了表征(S4800,日立高科技公司,Japan)。使用激光粒度仪(Mastersizer 2000,英国马尔文仪器有限公司,UK) 对微塑料颗粒的粒径进行分析。
1.3 线虫及菌株的培养Caenorhabditis elegans N2 (简称C. elegans)来源于CGC (Caenorhabditis Genetics Center,Minneapolis,MN,USA)。3株供试细菌(表 1):Escherichia coli OP50 (以下简称OP50)来源于CGC,B. amyloliquefaciens JX1 (以下简称X1)和P. fluorescens Y1 (以下简称Y1)均为本实验室筛选出来的土壤优势细菌。供试土壤采自江苏省南京市雨花台区板桥镇长江南岸冲积地的灰潮土。
|
|
表 1 供试细菌的基本性质 Table 1 Description of bacteria used in experiment |
OP50为秀丽隐杆线虫的实验室标准食物,37 ℃培养;X1和Y1作为取食偏好实验中线虫的两种食物,均为30 ℃培养。线虫以OP50喂养,长至产卵期后进行同步化,将虫体用裂解液裂解后,5 000 g离心1 min,弃上清。将得到的卵置于M9缓冲液中孵化,24 h后将得到的L1期幼虫置于涂布有OP50并加入了不同浓度和粒径的PS微塑料的线虫培养基(NGM) 中20 ℃培养,以供试验。
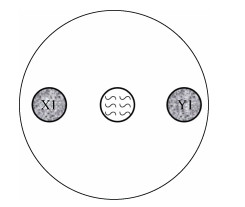
1.4 PS微塑料短期暴露对秀丽隐杆线虫取食偏好的影响将秀丽隐杆线虫同步化后置于含有不同粒径和浓度的PS微塑料的培养基中培养36 h,长至L4期时用M9缓冲液将虫子冲洗下来,并将附着的OP50清洗干净。X1、Y1用液体LB在30 ℃培养至对数期,用分光光度计调节OD600值为1,在同一90 mm的NGM两端等距圈中添加X1、Y1各20 μl,将得到的L4期线虫置于培养基中心位置(图 1,每个圈的直径为15 mm,两端圈与中心点的距离为20 mm)。将培养基置于20 ℃培养箱中黑暗培养,让线虫自由取食两种细菌。接种线虫后,于12 h后在体视显微镜下观察线虫迁移取食情况并记录线虫迁移至各个菌区的数目,统计分析线虫对不同细菌的选择性和偏好性。每组设置8个重复。计算C. elegans对某种细菌的偏好比例:PI=N/Nt。式中:PI (preference Index) 表示某一时刻线虫对某种细菌的偏好比例,N表示该时刻该种细菌菌区线虫的数目,Nt表示该时刻两种细菌菌区线虫数总和。
|
图 1 线虫取食偏好的试验示意图 Fig. 1 Feeding preferences experiment |
将线虫在含有不同粒径和浓度的PS微塑料平板上传代培养15 d,同步化后待线虫置于含有不同粒径和浓度的PS微塑料的培养基中培养36 h,长至L4期洗下备用,取食偏好试验方法同上。
1.6 PS微塑料长期暴露对秀丽隐杆线虫氧化应激水平的影响将线虫在含有不同粒径和浓度的PS微塑料平板上传代培养15 d,同步化后待线虫置于含有不同粒径和浓度的PS微塑料的培养基中培养36 h,长至L4期洗下备用。按照线虫活性氧(ROS) ELISA试剂盒、超氧化物歧化酶(SOD) ELISA试剂盒、过氧化氢酶(CAT) 活性检测试剂盒说明书使用酶标仪确定对照组和各暴露组的活性氧自由基水平、超氧化物歧化酶活性和过氧化氢酶活性。试剂盒购于江苏酶标生物科技有限公司。每个样设置3个重复。
1.7 荧光定量PCR用Trizol法提取PS微塑料处理15 d并同步化后培养至L4期的秀丽隐杆线虫的总RNA,按照PrimeScriptTM RT reagent Kit with gDNA Eraser (Perfect Real Time)试剂盒(TARAKA,RR047Q)操作说明将线虫的RNA反转录成cDNA,选取cat-4、egl-4、gcy-28、daf-7、dbl-1、tir-1和tol-1这7个与取食行为相关的基因作为靶基因,其中cat-4基因参与五羟色胺信号通路,gcy-28编码鸟苷酸环化酶,tir-1和tol-1基因共同编码TOLL样受体信号通路中一个含TIR结构域的蛋白质,daf-7、dbl-1和egl-4均参与转化生长因子-β (TGF-β)信号通路[17-21]。使用ABI StepOne PLUS荧光定量PCR仪对这些基因的表达量进行相对定量分析,内参基因为cdc-42,每个样设置3个重复。基因的引物序列见表 2。
|
|
表 2 取食相关功能基因的引物及产物预期大小 Table 2 Primers of feeding related functional genes of C. elegans and expected product size used for quantitative real-time PCR amplification |
采用单因素方差分析法(One-way ANOVA)分析,用Duncan检验法对不同处理间平均值的显著性差异(P < 0.05)进行检验。数据统计分析均使用SPSS 20统计软件,使用Origin和Excel软件作图。
2 结果与分析 2.1 不同粒径的PS微塑料的表征污染物的毒性与其本身的理化性质密切相关,PS微塑料的形貌用扫描电镜观察结果如图 2A和2B所示,两种粒径的PS微塑料均呈规则的圆球形;PS微塑料的粒径使用粒径分析仪进行分析,结果如图 2C和2D,图 2C显示1 μm的PS微塑料粒径呈正态分布,d(0.5) = 1.145 μm,图 2D显示5 μm的PS微塑料粒径呈正态分布,d(0.5) = 4.724 μm。

|
(图A、B分别表示粒径为1 μm和5 μm的PS颗粒的电镜扫描图;图C,D分别表示粒径为1 μm和5 μm的PS颗粒的粒径分析仪图) 图 2 不同粒径PS颗粒的扫描电镜图和粒径分析图 Fig. 2 SEM images and particle size distributions of different-size polystyrene particles |
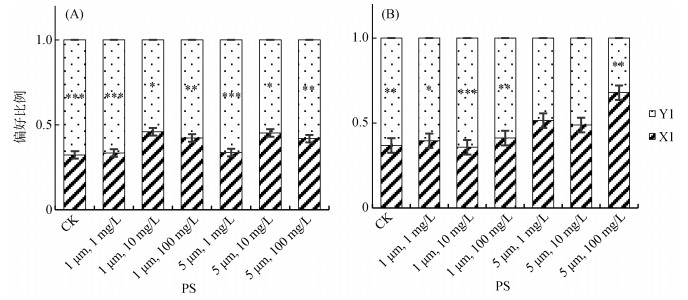
秀丽隐杆线虫分别在未添加PS微塑料的培养基和含有不同浓度和粒径的PS微塑料培养基中短期暴露36 h后,将线虫同步化后进行取食偏好试验(图 3A)。鉴于此取食偏好试验中4、8、12、24 h时线虫对X1、Y1的偏好性趋势较为一致,均偏好Y1,故在此只列出最具代表性的12 h时的取食数据。试验结果显示,对照组和所有处理组的线虫均表现出对Y1的明显偏好,即1 μm和5 μm的PS微塑料在1、10、100 mg/L这3个浓度下均对线虫对X1、Y1的取食偏好行为无明显影响。在中高浓度(10 mg/L和100 mg/L)下,尽管线虫仍然偏好取食Y1,但1 μm和5 μm的PS微塑料暴露组的线虫对Y1的偏好性相较于对照组显著降低(P < 0.05)。
|
(A. 不同粒径和浓度的PS微塑料短期暴露;B. 不同粒径和浓度的PS微塑料长期暴露;图中误差线表示标准误,*、**、***分别表示每组内X1与Y1菌区线虫数量的差异达P < 0.05、P < 0.01和P < 0.001显著水平) 图 3 不同粒径和浓度的PS微塑料暴露后线虫对X1、Y1的取食偏好 Fig. 3 Feeding preferences of C. elegans after exposure to polystyrene particles with different-sizes and concentrations |
试验结果表明,1 μm和5 μm的PS微塑料短期暴露对线虫取食偏好行为并未有明显改变,猜测可能是暴露时间较短。
2.3 PS微塑料长期暴露对秀丽隐杆线虫取食偏好的影响将秀丽隐杆线虫在含有不同浓度和粒径的PS微塑料培养基中长期暴露约15 d后,将线虫同步化后进行取食偏好试验(图 3B)。未经PS微塑料暴露的线虫对X1、Y1的取食偏好结果显示,线虫更加偏好取食Y1 (PI为0.63);长期暴露在粒径为1 μm的PS微塑料环境中的线虫对X1、Y1的取食偏好性未发生改变,仍显著偏好Y1,1、10、100 mg/L的暴露组线虫对Y1的PI分别为0.60 (P < 0.05)、0.64 (P < 0.001)、0.59 (P < 0.01);而长期暴露在粒径为5 μm的PS微塑料环境中的线虫对X1、Y1的取食偏好行为发生了改变,具体表现为:1 mg/L和10 mg/L的两个暴露组的线虫对X1、Y1的取食未见明显偏好性,而较高浓度即100 mg/L的暴露组的线虫显示出对X1的显著偏好(PI为0.68,P < 0.01)。这表明,PS微塑料能够改变线虫的取食偏好,且与微塑料的粒径和浓度相关,较大粒径、较高浓度的PS微塑料对秀丽隐杆线虫的取食偏好行为影响程度较大。
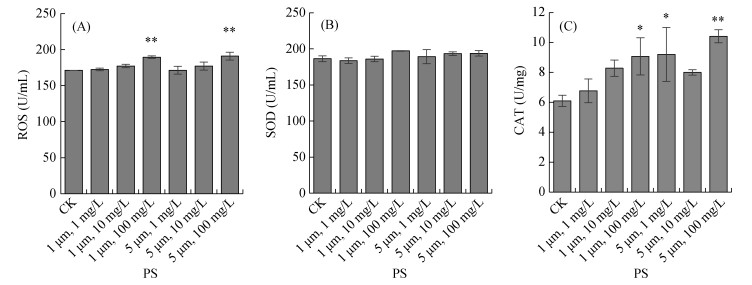
2.4 PS微塑料长期暴露对秀丽隐杆线虫氧化应激水平的影响对在不同粒径和浓度的PS微塑料中暴露15 d的秀丽隐杆线虫体内的活性氧自由基(ROS)水平进行测定,结果表明,PS微塑料浓度为100 mg/L时,粒径为1 μm和5 μm的PS微塑料暴露组的线虫体内的活性氧自由基水平显著提高(P < 0.01),其中1 μm、100 mg/L的暴露组线虫体内的ROS水平与对照组相比提高了10.62%;5 μm、100 mg/L的暴露组线虫体内的ROS水平与对照组相比提高了11.48%,与1 μm、100 mg/L的暴露组相比线虫体内的ROS含量升高了0.78% (图 4A)。
|
(A. 活性氧自由基水平;B. 超氧化物歧化酶活性;C. 过氧化氢酶活性;误差棒表示标准误,*、**、***分别表示处理与对照组差异达P < 0.05、P < 0.01和P < 0.001显著水平,下图同) 图 4 不同粒径和浓度的PS微塑料长期暴露后线虫的氧化应激水平 Fig. 4 Oxidative stress levels of C. elegans after chronic exposure to polystyrene particles with different-sizes and concentrations |
对在不同粒径和浓度的PS微塑料中暴露15 d的秀丽隐杆线虫体内的超氧化物歧化酶(SOD)活性进行测定,结果表明,秀丽隐杆线虫在粒径为1 μm和5 μm,浓度为1、10和100 mg/L的6个PS微塑料处理组中暴露15 d,对线虫体内的SOD酶活的影响均无显著差异(图 4B)。但是可以看到,PS微塑料粒径为1 μm和5 μm时,线虫体内SOD酶活均随着PS微塑料浓度的升高而升高。
对在不同粒径和浓度的PS微塑料中暴露15 d的秀丽隐杆线虫体内的过氧化氢酶(CAT)活性进行测定,结果显示,当PS微塑料粒径为1 μm时,各浓度暴露组的线虫体内CAT的含量随着PS微塑料浓度的升高而升高,1 mg/L和10 mg/L的PS微塑料暴露组与对照组相比无显著差异(图 4C);但100 mg/L的PS微塑料暴露组则与对照差异显著(P < 0.05),与对照组相比,线虫体内CAT含量升高了0.4889%。当PS微塑料粒径为5 μm时,低暴露浓度(1 mg/L)和高浓度暴露组(100 mg/L)线虫体内的CAT含量与对照组相比均有显著差异,分别比对照组升高了51.12% (P < 0.05)和70.92% (P < 0.01)。
2.5 取食相关功能基因的表达为了阐明PS微塑料改变线虫取食行为的分子机制,我们选取了一些与线虫取食行为相关的基因,提取经过PS微塑料长期暴露的线虫RNA进行荧光定量PCR,对这些基因的表达量进行相对定量分析(图 5)。研究结果显示,粒径为1 μm的PS微塑料暴露组,大部分基因的表达量与对照组相比均无明显差异,只有10 mg/L暴露组的dbl-1、egl-4和gcy-28 3个基因的表达量和100 mg/L暴露组的dbl-1基因表达量与对照组相比显著降低(P < 0.05);而5 μm的PS微塑料暴露组在1、10和100 mg/L浓度下,cat-4、egl-4、gcy-28、daf-7、dbl-1、tir-1和tol-1这7个基因表达量均明显上调,其中cat-4基因表达量上调幅度最大,1、10和100 mg/L暴露组与对照组相比分别上调195.14% (P < 0.05)、202.36% (P < 0.05)和488.21% (P < 0.001),且cat-4、egl-4、gcy-28、daf-7、tir-1和tol-1这6个基因表达量的上调均表现出对暴露浓度的依赖性,即PS微塑料暴露浓度越高,基因表达量越高。

|
图 5 不同粒径和浓度的PS微塑料长期暴露后线虫取食相关功能基因的相对表达量 Fig. 5 Relative expression of target genes in C. elegans after chronic exposure to polystyrene particles with different sizes and concentrations |
试验结果显示,5 μm的PS微塑料长期暴露15 d后,线虫对X1、Y1的取食偏好发生了明显改变,这表明PS微塑料对线虫取食偏好的影响与PS微塑料的暴露时间、粒径和浓度均有关联。与1 μm相比,5 μm的PS微塑料对线虫取食偏好的影响更大,且随着暴露时间的延长和暴露浓度的增大,其影响也越大。猜测可能是由于较大粒径的微塑料更易累积阻塞肠道,使机体产生饱腹感,从而影响线虫的取食,有研究也发现微塑料易积累在鱼类的鳃部和消化道,阻塞消化系统并使其产生饱腹感,且对食物的摄入量减少[22]。微塑料长期暴露对线虫取食偏好的影响较短期来讲更大,这与一些环境毒物相一致,如曹雪[23]发现壬基酚对秀丽隐杆线虫的毒性是时间依赖性的,急性暴露以刺激效应为主,而慢性暴露则以抑制效应为主,且随着壬基酚暴露时间的延长,线虫生理生化指标的负面影响更为明显,本文研究与此相印证,即长期PS微塑料暴露对线虫取食偏好的影响较短期更大。
PS微塑料长期暴露后线虫体内的ROS水平明显升高,且抗氧化酶CAT的水平也显著升高,表明PS微塑料使线虫产生了氧化应激反应并激发了抗氧化系统。但1 μm和5 μm的PS微塑料在高浓度(100 mg/L)下均与对照组有显著差异,这与只有5 μm的PS微塑料能够改变线虫取食偏好的现象并不完全一致,虽然氧化应激效应常与神经行为学上的异常紧密关联[24],但在此试验中,氧化应激并不是PS微塑料改变线虫取食偏好的直接机制。
Abada等[25]指出,线虫的基因调控是食细菌线虫进行选择性和偏好性取食的主要原因。Coolon等[26]也发现,C. elegans取食不同的细菌后,其许多基因表达量会发生变化,他们通过某些基因缺失的C. elegans突变体证明了这些基因与C. elegans的取食偏好性有关。本试验中5 μm的PS微塑料也是由于直接影响到线虫取食偏好相关的功能基因的表达,从而改变了线虫对X1、Y1的取食偏好。荧光定量PCR试验结果显示,5 μm的PS微塑料颗粒长期暴露后的线虫与取食相关的功能基因表达量上调。荧光假单胞菌已被发现是秀丽隐杆线虫的一种病原菌,并且基于本实验室之前的研究结果,秀丽隐杆线虫以荧光假单胞菌Y1作为食物时,存活率明显低于以解淀粉芽孢杆菌X1作为食物时[27],故可以认为,相较于X1,Y1对秀丽隐杆线虫有一定的毒害作用。而cat-4基因参与合成的五羟色胺调节线虫运动行为来应对环境刺激[18],gcy-28编码的鸟苷酸环化酶参与线虫的嗅觉吸引行为,当cat-4基因突变时,线虫会出现嗅觉学习逃避缺陷[28],而gcy-28基因突变体也被发现无法感知气味偏好[17],故当tax-4基因和gcy-28基因表达上调时,线虫对病原菌Y1的嗅觉识别增强,从而逃离对它有害的病原菌Y1。tir-1和tol-1基因共同编码的TOLL样受体信号通路中一个含TIR结构域的蛋白质,该信号通路也与线虫的物理性逃避行为相关,可以识别病原菌分泌的模式分子从而识别和逃避有害因素[19]。同样地,当tol-1和tir-1基因表达上调后,线虫识别和分辨病原菌Y1的能力增强,可以有效避开有害菌Y1。daf-7、dbl-1和egl-4均参与转化生长因子-β (TGF-β)信号通路,该信号通路是参与调控细胞的生长、分化和死亡的非常重要的信号通路之一[21]。根据文献[29]报道,基因dbl-1突变后,出现了学习型逃避缺陷;egl-4基因突变后,线虫出现了嗅觉适应性损伤[30]。在5 μm的微塑料中暴露的线虫体内egl-4、dbl-1和daf-7基因表达量上调后,线虫的学习型逃避能力增强,此时若线虫取食了病原菌Y1后,能够增加趋避Y1的能力,从而取食偏好发生改变。以上这些与取食相关的基因的表达量均随着5 μm的PS微塑料的浓度升高而增大,表明微塑料的浓度越大,对线虫取食相关基因的影响越大,这些均与线虫取食偏好改变的行为相一致,表明微塑料确实是通过影响线虫的取食功能基因从而影响对X1和Y1的取食偏好行为,但是线虫中这些取食相关功能基因具体如何协调起作用还有待深入研究。
综上所述,微塑料暴露能够改变线虫的取食偏好,且较大粒径的微塑料长期暴露对秀丽隐杆线虫的影响更大,这种改变并不是由氧化应激引起的,而是由与偏好性取食相关的功能基因直接调控的,而线虫的取食偏好对细菌的数量、活性及群落结构有重要影响[16],且自然界中的塑料极不易分解,在环境中长期存在,这暗示了微塑料对整个土壤生态系统可能产生的影响。
| [1] |
Thompson R C, Olsen Y, Mitchell R P, et al. Lost at sea: Where is all the plastic?[J]. Science, 2004, 304(5672): 838 DOI:10.1126/science.1094559 (  0) 0) |
| [2] |
Ivar do Sul J A, Costa M F. The present and future of microplastic pollution in the marine environment[J]. Environmental Pollution, 2014, 185: 352-364 DOI:10.1016/j.envpol.2013.10.036 (  0) 0) |
| [3] |
Knepper T P. Martin Wagner, Scott Lambert (Eds.): Freshwater microplastics: Emerging environmental contaminants?[J]. Analytical and Bioanalytical Chemistry, 2018, 410(25): 6337-6338 DOI:10.1007/s00216-018-1203-7 (  0) 0) |
| [4] |
Nizzetto L, Futter M, Langaas S. Are agricultural soils dumps for microplastics of urban origin?[J]. Environmental Science & Technology, 2016, 50(20): 10777-10779 (  0) 0) |
| [5] |
Dris R, Gasperi J, Saad M, et al. Synthetic fibers in atmospheric fallout: A source of microplastics in the environment?[J]. Marine Pollution Bulletin, 2016, 104(1/2): 290-293 (  0) 0) |
| [6] |
Cole M, Coppock R, Lindeque P K, et al. Effects of nylon microplastic on feeding, lipid accumulation, and moulting in a coldwater copepod[J]. Environmental Science & Technology, 2019, 53(12): 7075-7082 (  0) 0) |
| [7] |
Rotjan R D, Sharp K H, Gauthier A E, et al. Patterns, dynamics and consequences of microplastic ingestion by the temperate coral, Astrangia poculata[J]. Proceedings Biological Sciences, 2019, 286(1905): 20190726 (  0) 0) |
| [8] |
Bendesky A, Bargmann C I. Genetic contributions to behavioural diversity at the gene–environment interface[J]. Nature Reviews Genetics, 2011, 12(12): 809-820 DOI:10.1038/nrg3065 (  0) 0) |
| [9] |
Yu Y J, Chen H B, Hua X, et al. Polystyrene microplastics (PS-MPs) toxicity induced oxidative stress and intestinal injury in nematode Caenorhabditis elegans[J]. Science of the Total Environment, 2020, 726: 138679 DOI:10.1016/j.scitotenv.2020.138679 (  0) 0) |
| [10] |
Qu M, Kong Y, Yuan Y J, et al. Neuronal damage induced by nanopolystyrene particles in nematode Caenorhabditis elegans[J]. Environmental Science: Nano, 2019, 6(8): 2591-2601 DOI:10.1039/C9EN00473D (  0) 0) |
| [11] |
Schöpfer L, Menzel R, Schnepf U, et al. Microplastics effects on reproduction and body length of the soil-dwelling nematode caenorhabditis elegans[J]. Frontiers in Environmental Science, 2020, 8: 41 DOI:10.3389/fenvs.2020.00041 (  0) 0) |
| [12] |
Li D, Ji J, Yuan Y J, et al. Toxicity comparison of nanopolystyrene with three metal oxide nanoparticles in nematode Caenorhabditis elegans[J]. Chemosphere, 2020, 245: 125625 DOI:10.1016/j.chemosphere.2019.125625 (  0) 0) |
| [13] |
Zubkov M V, Sleigh M A. Comparison of growth efficiencies of protozoa growing on bacteria deposited on surfaces and in suspension[J]. The Journal of Eukaryotic Microbiology, 2000, 47(1): 62-69 DOI:10.1111/j.1550-7408.2000.tb00012.x (  0) 0) |
| [14] |
Blanc C, Sy M, Djigal D, et al. Nutrition on bacteria by bacterial-feeding Nematodes and consequences on the structure of soil bacterial community[J]. European Journal of Soil Biology, 2006, 42: S70-S78 DOI:10.1016/j.ejsobi.2006.06.003 (  0) 0) |
| [15] |
Jousset A, Lara E, Wall L G, et al. Secondary metabolites help biocontrol strain Pseudomonas fluorescens CHA0 to escape protozoan grazing[J]. Applied and Environmental Microbiology, 2006, 72(11): 7083-7090 DOI:10.1128/AEM.00557-06 (  0) 0) |
| [16] |
Newsham K K, Rolf J, Pearce D A, et al. Differing preferences of Antarctic soil Nematodes for microbial prey[J]. European Journal of Soil Biology, 2004, 40(1): 1-8 DOI:10.1016/j.ejsobi.2004.01.004 (  0) 0) |
| [17] |
Tsunozaki M, Chalasani S H, Bargmann C I. A behavioral switch: CGMP and PKC signaling in olfactory neurons reverses odor preference in C. elegans[J]. Neuron, 2008, 59(6): 959-971 DOI:10.1016/j.neuron.2008.07.038 (  0) 0) |
| [18] |
Chase D L, Koelle M R. Biogenic amine neurotransmitters in C. elegans. WormBook, 2007: 1–15.
(  0) 0) |
| [19] |
Tenor J L, Aballay A. A conserved Toll-like receptor is required for Caenorhabditis elegans innate immunity[J]. EMBO Reports, 2008, 9(1): 103-109 DOI:10.1038/sj.embor.7401104 (  0) 0) |
| [20] |
温凤玲. TGF-β信号途径在秀丽隐杆线虫逃避行为中的作用[D]. 昆明: 云南大学, 2015.
(  0) 0) |
| [21] |
Patterson G I, Padgett R W. TGF beta-related pathways. Roles in Caenorhabditis elegans development[J]. Trends in Genetics, 2000, 16(1): 27-33 DOI:10.1016/S0168-9525(99)01916-2 (  0) 0) |
| [22] |
Derraik J G B. The pollution of the marine environment by plastic debris: A review[J]. Marine Pollution Bulletin, 2002, 44(9): 842-852 DOI:10.1016/S0025-326X(02)00220-5 (  0) 0) |
| [23] |
曹雪. 环境激素壬基酚对秀丽隐杆线虫的多毒性效应及组学机制研究[D]. 上海: 华东理工大学, 2020.
(  0) 0) |
| [24] |
Nuttley W M, Atkinson-Leadbeater K P, van der Kooy D. Serotonin mediates food-odor associative learning in the nematode Caenorhabditis elegans[J]. PNAS, 2002, 99(19): 12449-12454 DOI:10.1073/pnas.192101699 (  0) 0) |
| [25] |
Abada E A E, Sung H, Dwivedi M, et al. C. elegans behavior of preference choice on bacterial food[J]. Molecules and Cells, 2009, 28(3): 209-213 DOI:10.1007/s10059-009-0124-x (  0) 0) |
| [26] |
Coolon J D, Jones K L, Todd T C, et al. Caenorhabditis elegans genomic response to soil bacteria predicts environment-specific genetic effects on life history traits[J]. PLoS Genetics, 2009, 5(6): e1000503 DOI:10.1371/journal.pgen.1000503 (  0) 0) |
| [27] |
Yu L, Yan X M, Ye C L, et al. Bacterial respiration and growth rates affect the feeding preferences, brood size and lifespan of Caenorhabditis elegans[J]. PLoS One, 2015, 10(7): e0134401 DOI:10.1371/journal.pone.0134401 (  0) 0) |
| [28] |
Zhang Y, Lu H, Bargmann C I. Pathogenic bacteria induce aversive olfactory learning in Caenorhabditis elegans[J]. Nature, 2005, 438(7065): 179-184 DOI:10.1038/nature04216 (  0) 0) |
| [29] |
Zhang X D, Zhang Y. DBL-1, a TGF-β, is essential for Caenorhabditis elegans aversive olfactory learning[J]. Proceedings of the National Academy of Sciences of the United States of America, 2012, 109(42): 17081-17086 DOI:10.1073/pnas.1205982109 (  0) 0) |
| [30] |
L'Etoile N D, Coburn C M, Eastham J, et al. The cyclic GMP-dependent protein kinase EGL-4 regulates olfactory adaptation in C. elegans[J]. Neuron, 2002, 36(6): 1079-1089 DOI:10.1016/S0896-6273(02)01066-8 (  0) 0) |
 2022, Vol. 54
2022, Vol. 54


