土壤线虫作为种类最丰富和功能最多样的动物之一,是根际系统中生物多样性的关键群体[1],也是土壤健康评价体系中的类群之一[2]。植物寄生线虫是引起植物侵染性病害的病原物之一,普遍生存于植物根系土壤环境中,寄生在大多数经济作物上,造成一定的损失。其中研究最为广泛的根际线虫是食根线虫,许多以根为食的线虫是农业系统中众所周知的害虫,例如短体属(Pratylenchus spp.)和根结线虫属(Meloidogyne spp.)[3]。越来越多的证据表明,土壤线虫通过造成负面的植物–土壤反馈、改变根际微生物群落和养分循环来影响植物的表型[1, 4],如根结属植物寄生线虫,通过侵染植物根部,形成根结,改变宿主正常生长,导致宿主植物黄化、矮小和减产等。
连作这一种植制度可导致土壤中植物寄生线虫相对丰度增加,引起植物寄生线虫病害的爆发。除此之外,连作还会引起包括土壤养分不平衡、土壤盐碱化、次生代谢物自毒、根际微生物失调和再植作物根腐病、枯萎病和青枯病等相关疾病[5-8]。与连作不同,轮作是能促进土壤生物区系和土壤性质之间正反馈的一个可行的替代办法。大多数研究表明,轮作能增强土壤微生物活性,增加有益微生物,减少有害微生物和病原线虫[9-10];通过与非寄主植物轮作防治孢囊线虫的实例常有报道,如燕麦孢囊线虫专性寄主为燕麦、大麦等部分禾本科植物,与非禾本科植物轮作能有效遏制燕麦孢囊线虫繁殖和危害[11];万寿菊与芹菜轮作对根结线虫病的防控效果优于农药噻唑膦的使用[12];Neher等[13]证明轮作比使用杀虫剂对线虫群落的影响更大。可见合理轮作是防控土传连作病虫害的有效途径之一,并能提高作物产量[10]。
经调查发现,广西百色市田阳区部分番茄种植连续多年实行水旱轮作,番茄根结线虫病害程度明显轻于连作田块,其机理不详。由于土壤中线虫和微生物群落与其周围环境密切联系,能对环境变化和胁迫迅速做出反应[14],是土壤质量变化和植物健康与否的理想生物指标。前人研究轮作对线虫的影响主要集中在旱地轮作土壤微生物群落结构或线虫病害的防治方面[11, 15-16],而对水旱轮作模式下的线虫和微生物群落结构差异未见报道。因此,通过研究连作番茄和水稻–番茄轮作中土壤线虫群落及微生物结构,探索水旱轮作下番茄线虫病害减轻的原因,揭示水旱轮作条件下的土壤微生物群落和植物寄生线虫群落的变化,为农业生产水旱轮作防治线虫病害提供参考价值。
1 材料与方法 1.1 试验设计及试验地试验地位于广西百色市田阳县东旺村(106° 91 E,23° 71 N)农田种植区,该区域为受植物线虫病危害的田块。试验田依次设水稻–番茄轮作、番茄连作和休耕3个处理区,每区3次重复,每个区面积为3.0 m×8.0 m,分别编号轮作为FS,连作为FF,休耕为CK。试验区土壤基本理化性质碱解氮139.8 mg/kg,有效磷116.9 mg/kg,速效钾148 mg/kg,全氮1.37 g/kg,有机质56.5 g/kg,pH 5.6。
1.2 土壤样品采集2018年,番茄收获后,各个试验区进行随机多点定位取样,样方内种植2垄番茄,每垄以中间点选取第一个样,左右间隔2.5 m分别取另外两个样,每个试验区共取20 cm土壤样品6个。将同一处理各试验区土壤样品充分混匀,分成两份,一份碾碎过筛后装入50 ml离心管置于冰箱–80 ℃,用于真菌和细菌群落分析,另一份直接用于土壤中线虫的分离鉴定。
1.3 土壤中线虫的优势度和生态指数每个处理用于土壤线虫分离的样品全部混匀,分4个亚样作为4次重复,每次重复量取土壤100 cm3,采用高糖离心法[17]进行土壤中线虫的分离和收集,然后保存于4 ℃冰箱。取分离样品,挑取线虫于显微镜(尼康Eclipse Ti)下进行形态鉴定[18-19]和计数。
根据土壤线虫的食性将线虫分为植物寄生类线虫Plant-Parasites(PP)、食真菌类线虫Fungivores(Fu)、食细菌类线虫Bacterivores(Ba)和杂食–捕食类线虫Omnivores-Predators(Op)等4种营养类群[20]。根据各属数量的优势鉴定度划分为优势类群(+ + +),即每属线虫数量占比10% 以上;常见类群(+ +),即每属线虫数量占比1% ~ 10%;稀有类群(+),即每属线虫数量占比1% 以下[21]。
不同类群相对丰度是指每100 g干土中此类群线虫数占总线虫数量的百分比,单位为条/100 g干土。线虫群落的生态指数常参考侯磊等[21]用Shannon- Wiener多样性指数、成熟度指数(Maturity index)、通路比值(Nematode channel ratio)和丰富度指数(Margalef index)表征。①Shannon-Wiener多样性指数的计算公式:H′=–∑Pi(lnPi),Pi是第i个分类单元中个体占总个体数量的比例。②Pielou均匀度指数(J′)计算公式:J′=H'/lnS,S是所鉴定属数。③Nematode channel ratio (NCR)通路比值计算公式:NCR=NB/(NB+NF),NB和NF分别代表食细菌和食真菌线虫数量。④Margalef index(SR)丰富度指数计算公式:Margalef=(g–1)/lnn,n表示线虫群落的总数,g表示线虫群落的总属数量。
1.4 土壤微生物分析 1.4.1 土壤中总DNA提取及纯度检验每个处理土壤样品3次生物学重复,每个取0.25 g土壤,选用Powersoil® DNA Extraction Kit (Mo Bio, Carlsbad, USA) 试剂盒提取土壤总DNA。采用NanoDrop2000超微量分光光度计检测DNA纯度和浓度。
1.4.2 土壤真菌和细菌DNA扩增以土壤基因组DNA为模板,利用高保真的酶和特异性引物,使用PCR仪(ABI GeneAmp® 9700, American Life Inc., America)扩增相应序列。真菌引物为ITS1F_ITS2R:ITS1FCTTGGTCATTTAGAGGAAGTAA/ITS2R GCT GCGTTCTTCATCGATGC;细菌引物为338F_806R:ACTCCTACGGGAGGCAGCAG/806R GGACTACHV GGGTWT CTAAT。PCR产物经凝胶电泳检测,后续高通量测序委托上海美吉生物医药科技有限公司。测序结果基于OTUs对不同种植制度土壤微生物Alpha多样性、物种组成和物种差异进行了分析。
1.5 数据分析试验数据采用SPSS16.0软件Duncan新复极差法检验在P < 0.05水平上不同处理间差异显著性。
2 结果与分析 2.1 不同种植制度土壤中线虫的种类不同种植制度中FF土壤中含有线虫20个属,FS仅有9个,CK含有14个,FF检出最多,FS最少(图 1A,表 1)。根结线虫属、潜根属、丝尾垫刃属、小环属和小杆属等5个植物寄生性线虫在3个处理的土壤中均出现。FF土壤线虫的优势属为根结线虫属、潜根属和小杆属,分别占土壤中线虫总捕获个体数的29.7%、13.8%和10.9%(表 1)。FF、FS和CK土壤中植物寄生线虫检出率分别为9.7、4.7、6.3个属(图 1B)。FS土壤中的植物寄生线虫个数显著低于FF,特别是根结属。在FF分离的所有线虫中,植物寄生线虫种类最多,占土壤线虫总捕获个体数的76.3%,且多为优势属和常见属(表 1)。FF和FS土壤的食真菌线虫属和捕食/杂食线虫属的个数无显著差异。CK土壤中,除了食细菌线虫属的个数显著高于FF和FS外,其他属与FS均无显著差异,各优势属、常见属差异较小。
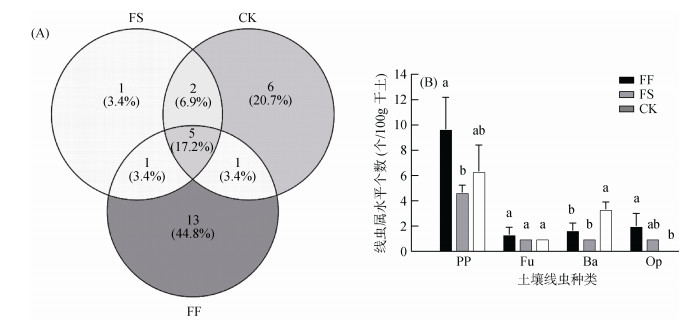
|
(FF为番茄连作,FS为水稻-番茄轮作,CK为休耕;Ba为食细菌线虫,Fu为食真菌线虫,PP为植物寄生线虫,Op为捕食/杂食线虫,下同。图柱上方小写字母不同表示不同种植制度间差异显著(Duncan新复极差法检验,P < 0.05) 图 1 不同种植制度土壤中线虫在属水平上的图解(A)及各营养类群属的数量变化(B) Fig. 1 Venn diagrams of soil nematodes at genus level (A) and changes in number of genera in various trophic groups (B) |
|
|
表 1 不同种植制度土壤中各线虫的占比和优势度 Table 1 Percentages and dominances of soil nematodes under different cropping patterns |
不同种植制度下土壤线虫群落样性指数差异较大(表 2),FS的Shannon(H′)多样性指数和Margalef (SR)丰富度指数显著低于FF。FF土壤线虫群落的各项生态指数数值均为最高,FF土壤线虫群落Shannon多样性指数、Pielou均匀度指数(J′)和Margalef丰富度指数3个指数均显著高于CK。FS的Shannon多样性指数和Pielou均匀度指数显著高于CK。CK的各项生态指数指标均为最小。FF和FS的通路比值与CK均无显著差异。
|
|
表 2 不同种植制度土壤线虫群落多样性指数 Table 2 Diversity indices of soil nematode communities under different cropping patterns |
Alpha多样性结果表明(表 3),FS处理中Sobs、Ace、Chao和Shannon均显著高于FF。FS土壤中真菌OTUs种类最多,为889个,是FF(444个)的两倍(图 2A);FS和CK共享OTUs数量最多,为总量的38.4%,FF分别与FS和CK共享占总OTUs数量均小于26.0%。不同种植制度下土壤中检出细菌OTUs种类约2 500 ~ 3 000个(图 2B);FS和CK共享占总OTUs数量最多,FF和FS共享占比最少。
|
|
表 3 不同种植制度土壤微生物Alpha多样性分析 Table 3 α diversities of microbes under different cropping patterns |
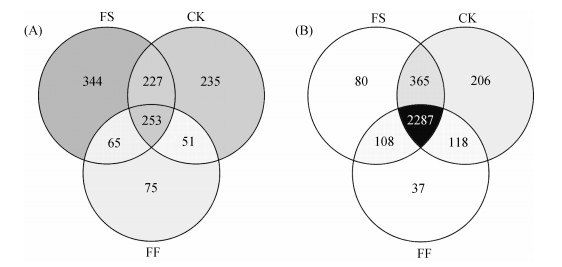
|
图 2 不同种植制度土壤中真菌(A)和细菌(B)在OTUs水平上的Venn图解 Fig. 2 Venn diagrams of soil fungi (A) and bacteria (B) at OTUs level under different cropping systems |
PCoA分析结果显示(图 3),FF、FS和CK土壤真菌和细菌群落组成分别位于不同象限,每个处理两两之间距离较远,各处理间的物种组成存在较大差异。每处理3个重复样本相似性距离接近,具有良好的可重复性。
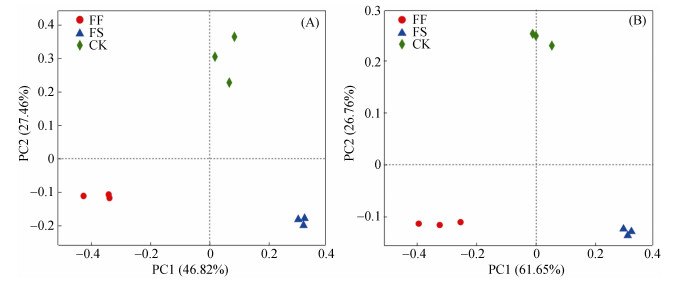
|
图 3 不同种植制度土壤真菌(A)和细菌(B)群落的PCoA图 Fig. 3 PCoA diagram of soil fungi (A) and bacteria (B) under different planting patterns |
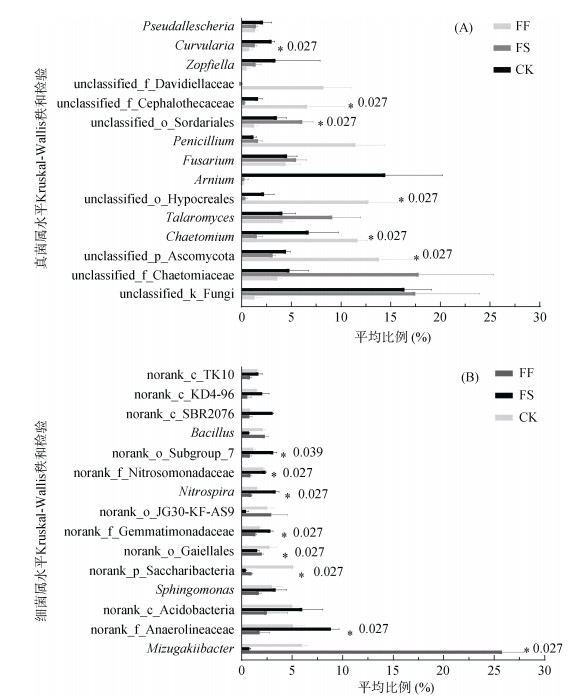
各处理真菌群落属水平组成相似,但相对丰度存在一定差异。在不同土样中主要优势类群有Arnium(阿尼菌属)、Chaetomium(毛壳菌属)、Talaromyces(篮状菌属),以及Ascomycota(子囊菌门)、Sordariales(粪壳菌目)和Chaetomiaceae(毛壳菌科)下未分类类群(图 4)。相对丰度前15个真菌类群Kruskal-Wallis秩和检验结果显示(图 5A),FS土壤中、Sordariales和Curvularia(弯孢属)均明显高于FF(图 5A中带*)和CK处理组。FS土壤中Ascomycota(子囊菌门)、Chaetomium(毛壳属)、Hypocreales(肉坐菌目)、Cephalothecaceae(黄丝菌科)的平均丰度均显著低于FF和CK处理组。FF与FS在属水平上真菌相对丰度差异明显。
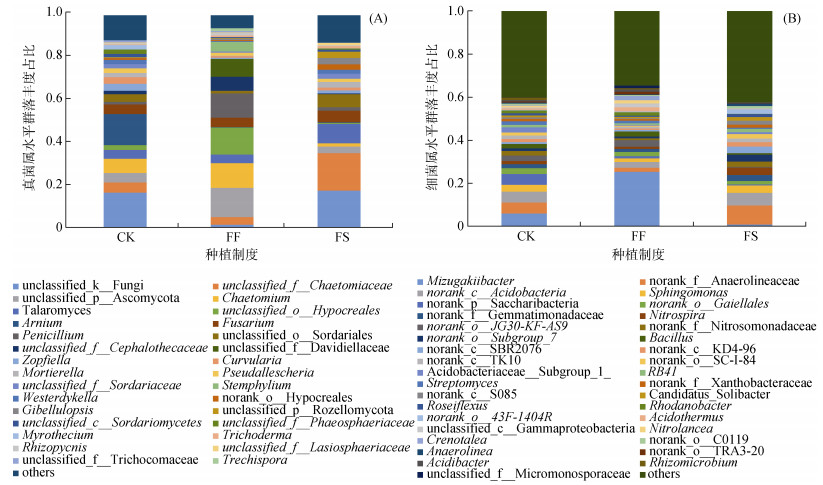
|
(Unclassified在数据库中没对应的分类信息,Norank在某个分类学水平上没明确的分类信息,下同) 图 4 不同土壤的真菌(A)和细菌(B)在属水平的相对丰度 Fig. 4 Relative abundances of soil fungi (A) and bacteria (B) at genus levels under different planting patterns |
|
(柱状图右边数值为P值,* 表示在0.01 < P ≤ 0.05水平上差异显著) 图 5 不同土壤的真菌(A)和细菌(B)主要属的相对丰度分析 Fig. 5 Relative abundances of main genera of soil fungi (A) and bacteria (B) under different planting patterns |
不同种植制度中细菌优势类群主要有Mizugakiibacter(水恒杆菌属)、Sphingomonas(鞘脂单胞菌属)及Anaerolineaceae(厌氧绳菌科)、Acidobacteria(酸杆菌纲)下未分类类群等。相对丰度前15的细菌类群Kruskal-Wallis秩和检验显示(图 5B),FS土壤中Anaerolineaceae、Gemmatimonadaceae(芽单胞菌科)、Nitrospira(硝化螺菌属)、Nitrosomonadaceae(亚硝化单胞菌科)、Subgroup_7均显著高于FF和CK处理组,而Mizugakiibacter、Saccharibacteria(螺旋体菌门)、Gaiellales显著低于FF和CK。FF与FS在属水平上细菌丰度同样差异明显。
3 讨论为了探索实施水稻–番茄水旱轮作的田块植物寄生线虫病害少的根本原因,本研究水旱轮作和连作土壤中植物寄生线虫和微生物群落之间的差异支持了前期实地调查所持观点,即实施水旱轮作中有效减少番茄寄生线虫病害的发生。传统上,易感宿主的单一化连续种植是侵染性病害加重的主要原因。作为病害防控策略,轮换种植非寄主作物是一种集防病、稳产增产、改善土壤质量和生态环境友好等优点的重要方法。
本研究结果显示水旱轮作能显著降低植物寄生线虫属的个数,提高自由生活线虫的占比。主要原因可能是水稻–番茄轮作包含了不同作物轮换种植和水旱轮换耕作两种方式,大幅度降低了土壤中植物寄生线虫(除了以水稻为寄主的潜根属和小环属),而连作土壤中的根结属、潜根属、小环属、短体属、剑属、鞘属、矮化属和垫刃属的线虫仍普遍存在,均为农业生产上危害植物的寄生线虫。此外,番茄是根结线虫的寄主,连作使根结线虫发生为害严重。水旱轮作后,潜根属和小环属仍为优势类群,主要危害水稻,可见该轮作方式下仍需加强上述两类线虫的管理。危害番茄的根结线虫属在水旱轮作检出为常见类群(++),较连作优势类群(+++)降低一个级别,结果与武超[16]对水稻–马铃薯水旱轮作防治马铃薯根结线虫病害研究结果类似。多数情况下,旱地轮作模式能有效提高线虫多样性指数[15, 22],而本研究结果轮作后线虫的丰富度指数低于连作,可能因为水稻种植过程的长时间淹水导致部分种类的线虫死亡,另外水稻是很多植物寄生线虫的非寄主植物,使部分种类的寄生线虫不能繁殖。据报道,在淹水的稻田中,捕食性线虫的数量显著低于草地,水稻的生长极大地影响了线虫摄食群体的相对丰度[23]。可见,水旱轮作降低了土壤线虫多样性指数和丰富度指数,可能也是抑制植物寄生线虫病害发生的有效途径,但对于线虫生态多样性的影响有待评价。土壤中线虫不同营养类群之间相互影响,轮作中自由生活的线虫,包括食真菌类线虫、食细菌类线虫和杂食-捕食类线虫的相对丰度占比达39.1%,高于连作(23.8%),这也可能在一定程度上参与到抑制植物寄生线虫。
微生物与线虫之间存在共生、共栖、寄生和拮抗等关系。研究显示土壤微生物群落在控制线虫群落中发挥作用。Wang等[24]研究显示当微生物存在时,食根线虫的数量较少,说明微生物对植物线虫有潜在的抑制作用。本研究结果显示,轮作土壤中微生物Sobs、Ace、Chao、Shannon表征群落多样性和丰富度指标显著高于连作,表明土壤微生物多样性在抑制植物寄生线虫发挥潜在作用。相反,连作土壤中微生物丰富和多样性低,植物寄生线虫种类多。Zhou等[25]认为土壤微生物可能调节植物中的根结线虫群体,并参与根结线虫的生物防治。已经从芽孢杆菌属、假单胞菌属、链霉菌属和巴氏杆菌属中鉴定出寄生线虫的细菌和拮抗细菌[26],芽孢杆菌属部分菌株已注册为商业生物杀线虫剂。轮作与连作中真菌与细菌一些主要群落结构存在较大差异,这可能与线虫群落的改变存在一定相关性。常见拮抗线虫的真菌主要包括Purpureocillium,Pochonia,Hirsutella,Nematophthora,Arthrobotrys,Drechmeria,Fusarium,Dactylellina等类群[27]。Chaetomium和Talaromyces已有报道其代谢产物对南方根结线虫和大豆胞囊线虫等具有杀线虫活性[28-30]。在本研究轮作中,Chaetomium,Talaromyces,Fusarium为优势类群,说明轮作地块中上述真菌可能参与拮抗线虫的作用。试验期未发现田间有Fusarium引起的番茄根腐病和枯萎病危害,说明本研究中Fusarium是有益的菌群。轮作土壤中丰度较高的厌氧绳菌纲(Anaerolineaceae)、酸杆菌门(Acidobacteria)均为水稻田中主要类群。有研究显示,厌氧菌也可能影响线虫的存活和产生杀死线虫的有毒物质[31],芽孢杆菌属是兼性厌氧菌,可拮抗植物寄生线虫,已开发为商用生物杀线剂[32]。刘文静等[33]研究表明,水旱轮作生态系统下,随机性生态过程的增强,有利于微生物抵御外部扰动,维持农田生态系统功能稳定性。
4 结论水稻–番茄水旱轮作能构建土壤线虫群落占比,包括提高自由生活线虫的比重,降低植物寄生线虫的比重;其次,水旱轮作还能改变微生物类群多样性,提高寄生线虫拮抗微生物类群丰富度,有利于降低和控制植物寄生线虫病害的发生和蔓延,为番茄生产提供良好的土壤种植环境。
| [1] |
Van den Hoogen J, Geisen S, Routh D, et al. Soil nematode abundance and functional group composition at a global scale[J]. Nature, 2019, 572(7768): 194-198 DOI:10.1038/s41586-019-1418-6 (  0) 0) |
| [2] |
土壤动物与土壤健康[J]. 土壤学报, 2021, 58(5): 1073-1083 (  0) 0) |
| [3] |
Nicol J M, Turner S J, Coyne D L, et al. Current nematode threats to world agriculture[M]//Genomics and Molecular Genetics of Plant-Nematode Interactions. Dordrecht: Springer Netherlands, 2011: 21–43.
(  0) 0) |
| [4] |
Wilschut R A, Geisen S. Nematodes as drivers of plant performance in natural systems[J]. Trends in Plant Science, 2021, 26(3): 237-247 DOI:10.1016/j.tplants.2020.10.006 (  0) 0) |
| [5] |
Tian Y Q, Liu J, Zhang X Y, et al. Effects of summer catch crop, residue management, soil temperature and water on the succeeding cucumber rhizosphere nitrogen mineralization in intensive production systems[J]. Nutrient Cycling in Agroecosystems, 2010, 88(3): 429-446 DOI:10.1007/s10705-010-9367-3 (  0) 0) |
| [6] |
Tian Y Q, Zhang X Y, Liu J, et al. Effects of summer cover crop and residue management on cucumber growth in intensive Chinese production systems: Soil nutrients, microbial properties and Nematodes[J]. Plant and Soil, 2011, 339(1/2): 299-315 (  0) 0) |
| [7] |
Tian Y Q, Zhang X Y, Wang J G, et al. Soil microbial communities associated with the rhizosphere of cucumber under different summer cover crops and residue management: A 4-year field experiment[J]. Scientia Horticulturae, 2013, 150: 100-109 DOI:10.1016/j.scienta.2012.10.025 (  0) 0) |
| [8] |
植物次生代谢物的自毒作用及其与连作障碍的关系[J]. 土壤, 2010, 42(1): 1-7 (  0) 0) |
| [9] |
D'Acunto L, Andrade J F, Poggio S L, et al. Diversifying crop rotation increased metabolic soil diversity and activity of the microbial community[J]. Agriculture, Ecosystems & Environment, 2018, 257: 159-164 (  0) 0) |
| [10] |
长期连作和轮作对农田土壤生物学特性的影响研究进展[J]. 中国农学通报, 2015, 31(3): 173-178 (  0) 0) |
| [11] |
休闲与轮作对燕麦孢囊线虫种群动态的影响[J]. 麦类作物学报, 2013, 33(5): 1048-1053 (  0) 0) |
| [12] |
轮作万寿菊对芹菜根结线虫病的防控效果[J]. 中国植保导刊, 2020, 40(12): 46-48 (  0) 0) |
| [13] |
Neher D A, Nishanthan T, Grabau Z J, et al. Crop rotation and tillage affect nematode communities more than biocides in monoculture soybean[J]. Applied Soil Ecology, 2019, 140: 89-97 DOI:10.1016/j.apsoil.2019.03.016 (  0) 0) |
| [14] |
Lichtfouse E. Biodiversity, biofuels, agroforestry and conservation agriculture[M].
Springer Netherlands, Dordrecht, 2011
(  0) 0) |
| [15] |
轮作方式对甘薯根际土壤线虫群落结构及甘薯产量的影响[J]. 中国生态农业学报(中英文), 2019, 27(1): 20-29 (  0) 0) |
| [16] |
马铃薯不同品种(系)和稻、薯轮作模式对根结线虫病的防治效果[J]. 作物学报, 2020, 46(9): 1456-1463 (  0) 0) |
| [17] |
Zheng G D, Shi L B, Wu H Y, et al. Nematode communities in continuous tomato-cropping field soil infested by root-knot Nematodes[J]. Acta Agriculturae Scandinavica, Section B — Soil & Plant Science, 2012, 62(3): 216-223 (  0) 0) |
| [18] |
植物线虫分类学[M].
安徽科学技术出版社, 合肥, 2000
(  0) 0) |
| [19] |
中国土壤动物检索图鉴[M].
科学出版社, 北京, 1998
(  0) 0) |
| [20] |
科尔沁沙地黑沙蒿人工植被土壤线虫群落特征[J]. 土壤通报, 2007, 38(2): 314-317 (  0) 0) |
| [21] |
西藏林芝市米瑞乡青稞农田土壤线虫的群落结构[J]. 高原农业, 2018, 2(2): 132-137 (  0) 0) |
| [22] |
万寿菊-烟草轮作对土壤线虫群落的影响[J]. 西南农业学报, 2019, 32(2): 342-348 (  0) 0) |
| [23] |
Korobushkin D I, Butenko K O, Gongalsky K B, et al. Soil nematode communities in temperate rice-growing systems[J]. European Journal of Soil Biology, 2019, 93: 103099 (  0) 0) |
| [24] |
Wang M G, de Deyn G B, Bezemer T M. Separating effects of soil microorganisms and Nematodes on plant community dynamics[J]. Plant and Soil, 2019, 441(1/2): 455-467 DOI:10.1007/s11104-019-04137-3 (  0) 0) |
| [25] |
Zhou D M, Feng H, Schuelke T, et al. Rhizosphere microbiomes from root knot nematode non-infested plants suppress nematode infection[J]. Microbial Ecology, 2019, 78(2): 470-481 (  0) 0) |
| [26] |
Tian B Y, Cao Y, Zhang K Q. Metagenomic insights into communities, functions of endophytes and their associates with infection by root-knot nematode, Meloidogyne incognita, in tomato roots[J]. Scientific Reports, 2015, 5: 17087 (  0) 0) |
| [27] |
Jiang X Z, Xiang M C, Liu X Z. Nematode-trapping fungi[J]. Microbiology Spectrum, 2017, 5(1) DOI:10.1128/microbiolspec.funk-0022-2016 (  0) 0) |
| [28] |
Khan B, Yan W, Wei S, et al. Nematicidal metabolites from endophytic fungus Chaetomium globosum YSC5[J]. FEMS Microbiology Letters, 2019, 366(14): fnz169 (  0) 0) |
| [29] |
黄瓜内生Ch1001菌株种子处理防治根结线虫的施用剂量研究[J]. 中国农学通报, 2011, 27(22): 263-267 (  0) 0) |
| [30] |
Guo J P, Zhu C Y, Zhang C P, et al. Thermolides, potent nematocidal PKS-NRPS hybrid metabolites from thermophilic fungus Talaromyces thermophilus[J]. Journal of the American Chemical Society, 2012, 134(50): 20306-20309 (  0) 0) |
| [31] |
Hollis J P, Johnston T. Microbiological reduction of nematode populations in water-saturated soils[J]. Phytopathology, 1957, 47: 16 (  0) 0) |
| [32] |
Xiang N, Lawrence K S, Donald P A. Biological control potential of plant growth-promoting rhizobacteria suppression of Meloidogyne incognitaon cotton and Heterodera glycines on soybean: A review[J]. Journal of Phytopathology, 2018, 166(7/8): 449-458 (  0) 0) |
| [33] |
水旱轮作对土壤微生物群落构建过程的影响机制[J]. 土壤, 2020, 52(4): 710-717 (  0) 0) |
 2022, Vol. 54
2022, Vol. 54


