2. 北京林业大学林学院,国家林业局森林经营工程技术研究中心,北京 100083;
3. 北京大学城市与环境学院,地表过程分析与模拟教育部重点实验室,北京 100871
退耕还林还草是治理水土流失和改善生态环境的重要战略举措,也是结合保护基本农田、增加植被覆盖、提高粮食产量、调整农村产业结构、发展农村经济等一系列措施的重大生态修复工程[1-2]。自1999年我国启动实施退耕还林试点工程以来,森林面积已从1985年的5.14×105 hm2增加到2015年的2.20×106 hm2[2],森林覆盖率也从1960年的8% 恢复到2010年的21%[3]。河北省坝上地区位于我国北方农牧交错带中段和北方沙漠南侵的前缘地带,该地自然条件相对恶劣,土地沙化面积大,生态禁牧与农户饲养牲畜矛盾尖锐,生态护养恢复速度远不及生态的逆转退化速度[4],是典型的生态环境脆弱区。因此,在坝上地区实施退耕还林还草工程对该地区生态环境的恢复与保护十分关键。
土壤微生物可以调节多种生态系统功能,是生物化学过程中的主要驱动力和影响因素[5]。土壤中不同类群的微生物在能量流动、物质循环和植被恢复中均发挥特定的作用,土壤微生物群落的恢复是土壤恢复的关键过程[6]。因此,探索不同植被恢复措施与土壤微生物群落之间的关系可以为生态恢复提供重要参考。土壤微生物群落的变化往往与植物群落结构以及土壤理化性质密切相关[7],植被类型可以在不同程度上影响土壤微生物多样性[8-9]。此外,不同恢复阶段土壤微生物功能多样性的变化也反映了微生物对地上植被、土壤微生物组成和土壤养分的响应[10]。土壤微生物群落的组成和多样性还会随着土壤深度、土地利用方式、土壤类型和管理状态等的变化而变化[11-13]。因此,土壤理化性质和土壤微生物群落可以作为土壤环境变化的主要指标,其变化可为植被恢复后的土壤肥力和土壤质量提供评价依据[14]。
以往的研究对退耕还林还草恢复效果的评价主要集中在土壤理化性质、生态化学计量特征、土壤微生物量以及地上生物量等方面[15-17],而关于生态环境脆弱区土壤微生物群落的组成和多样性评价尚不太明确。高通量测序技术的发展极大地提高了人们对微生物群落结构特征的认识,目前已广泛应用于研究海洋、土壤和人体等多种来源的微生物多样性[18]。
本研究对坝上地区4个不同植被类型(耕地、林地、灌丛和草地)的土壤进行传统的土壤理化性质及微生物生物量碳、氮等的测定,并且结合高通量测序技术分析土壤总DNA中16S rRNA基因,以探究坝上地区退耕还林还草措施对土壤细菌的影响,为今后改善以坝上为代表的农牧交错带的生态环境和优化土地资源利用提供科学支持。
1 研究区概况与研究方法 1.1 研究区概况康保县(114°11′~114°56′E, 41°25′~ 42°08′N)地处河北省张家口市西北部的坝上高原,平均海拔1 450 m,地势由东北向西南缓缓倾斜。栗钙土占土壤总面积的99% 以上,土粒间黏结力小,结构松散,稳定性差,易受风蚀。该地属东亚大陆性季风气候中温带亚干旱区,夏季凉爽,雨热同期,年均气温3.0 ℃,年均降水量355 mm,是农牧过渡带的典型生态脆弱区。全年平均蒸发量1 762.7 mm,是降水量的5倍,年干燥度达2.15[19]。康保县原有植被类型属于半干旱草原,由于人类活动的影响,逐渐被农业生态系统所代替,但自2000年实施退耕还林还草试点工程以来,康保县累计完成退耕还林110.3万亩(1亩=667 m2),林地和草地面积逐年增加,整体生态环境得到明显改善[20]。
1.2 样地选择与土样采集考虑到耕地施肥带来的大部分碳和氮在秋收后被农作物吸收利用,对土壤理化性质和土壤微生物生物量的影响较小,本研究在2018年9月对康保县的土壤进行取样,选取空间分布相邻的耕地(主要种植土豆)、退耕还林地(主要种植杨树)、退耕还灌地(主要种植柠条)和退耕还草地(主要种植芨芨草、羊草以及苜蓿)作为4种不同植被恢复类型。每个植被恢复类型设置3个重复,采用5点法对表层0 ~ 20 cm的土壤进行采样,共采集12份土壤样品。采集的土壤样品迅速转移到-4℃冰盒中运回实验室,去除凋落物、石块、根系等杂质,过2 mm筛后用于后续试验。
1.3 样品测试 1.3.1 土壤理化性质和微生物生物量的测定称取新鲜土壤在105℃烘箱中烘干至恒重,测定土壤含水量; 利用pH计(SevenCompact S210-K pH计,Switzerland)测定土壤pH(土∶水质量比为1∶2.5)。取自然风干的土壤样品用于测定土壤养分含量,利用碳氮元素分析仪(Elementar vario EL III, Germany)测定全碳、氮; 利用碱解扩散法测定速效氮; 利用碳酸氢钠浸提法测定有效磷; 利用醋酸铵-原子吸收光谱仪法测定速效钾。利用氯仿熏蒸浸提法测定土壤微生物生物量碳(MBC)、氮(MBN),在计算土壤微生物生物量碳、氮时,熏蒸土壤和未熏蒸土壤碳、氮含量插值的转换系数分别采用0.54和0.45。
1.3.2 土壤细菌多样性的测定首先利用Mo Bio的DNA提取试剂盒(PowerSoil® DNA Isolation Kit, USA)进行DNA提取,之后利用1% 琼脂糖凝胶电泳检测抽提的基因组DNA。在指定测序区域,合成带有barcode的特异引物或合成带有错位碱基的融合引物,将同一样本聚合酶链反应(polymerase chain reaction, PCR)产物混合后用2% 琼脂糖凝胶电泳检测,使用AxyPrep DNA凝胶回收试剂盒切胶回收PCR产物,经Tris_HCl洗脱后再次用2% 琼脂糖凝胶电泳检测。随后利用Illumina Mi Seq PE300平台进行土壤微生物高通量测序(北京奥维森生物公司)。
1.4 数据处理与统计分析 1.4.1 土壤细菌OTU(operational taxonomic unit)与Alpha多样性分析对通过质量控制和筛选获取而得的高质量序列进行归类操作,将序列按照97% 的相似水平分归为一个OTU,视为一个微生物物种。基于OTU聚类结果计算得出的Alpha多样性指数可以反映微生物群落的丰富度和多样性。其中,Chao1指数可以用来估计群落中的OTU数目,其计算公式如下:
| $S_{\text {chaol }}=S_{\mathrm{obs}}+n_{1}\left(n_{1}-1\right) / 2\left(n_{2}+1\right) $ | (1) |
式中:Schao1为估计的OTU数目; Sobs为观测到的OTU数目; n1为只有一条序列的OTU数目,n2为只有两条序列的OTU数目。
Shannon-Wiener多样性指数是反映样本中微生物多样性的指数之一,其计算公式如下:
| $ H=-\sum\limits_{i=1}^{s}\left(p_{i}\right)\left(\ln P_{i}\right) $ | (2) |
式中:Pi=ni/N,N为所有种的个体总数,ni为第i个种的个体数; s为种的数目。
1.4.2 土壤细菌Beta多样性分析采用非度量多维尺度(nonmetric multidimensional scaling, NMDS)法对4种植被恢复类型的细菌群落结构进行比较。
1.4.3 统计分析采用Brown-Forsythe检验,对比4种不同植被恢复类型的土壤理化性质、土壤细菌多样性(Chao1指数和Shannon-Wiener多样性指数)与土壤微生物生物量碳、氮等的差异。当P < 0.05时,认为不同植被恢复类型下土壤各指标的差异显著。所有统计分析均采用R程序(R core Team, 2020)完成,分析结果利用R程序的ggplot2软件包以及Origin Pro 2016绘图予以呈现。
2 结果 2.1 土壤理化性质4种植被类型下的土壤含水量未呈现明显差异(表 1)。与其他3种植被类型相比,林地的土壤含水量有微弱的下降趋势但不显著。经Brown-Forsythe检验发现,不同植被恢复措施下的土壤有效磷、速效钾、速效氮、全碳和全氮含量的差异均不显著,但土壤pH差异显著,尤其是灌丛的土壤pH要高于耕地和林地。
|
|
表 1 不同植被恢复类型下土壤理化性质的差异(平均值±标准误差) Table 1 Differences of soil physiochemical properties under different vegetation restorations |
4种植被类型下的土壤微生物生物量碳(P=0.010)、氮(P=0.006)含量均存在显著差异。耕地的土壤微生物生物量碳含量最低,约(69.374 ± 4.700) mg/kg(平均值±标准误差); 林地、灌丛和草地植被类型下的土壤微生物生物量碳含量逐渐升高,分别为(149.453 ± 17.031)、(170.645 ± 10.719)、(203.010 ± 23.820) mg/kg (图 1A)。耕地的土壤微生物生物量氮含量显著低于灌丛(P=0.032)和草地(P=0.038)(图 1B)。土壤微生物生物量碳/氮比在4种植被恢复类型下无显著性差异(图 1C)。
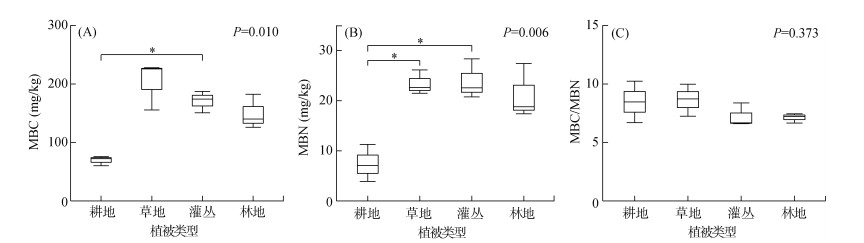
|
(图中“*”表示不同植被恢复类型间的差异显著(P < 0.05);下同) 图 1 不同植被恢复类型下土壤微生物生物量的差异 Fig. 1 Differences of soil microbial biomass under different vegetation restorations |
对4种不同植被类型下的土壤细菌序列按97% 的相似性进行聚类,共获得3 464个OTU,其中耕地、草地、灌丛、林地OTU数分别为2 828、2 706、2 642和2 675个,4种植被类型下共有的土壤细菌OTU数1 851个,约占全部的53.44%,耕地土壤独有的土壤细菌OTU数最多,约占全部的5.95%,林地土壤独有的土壤细菌OTU数最少,约占全部的1.73%(图 2A)。
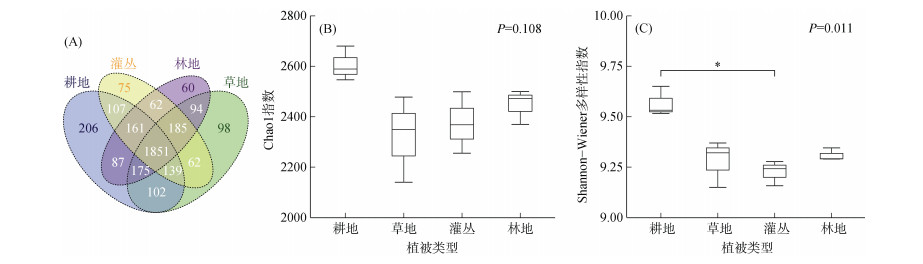
|
图 2 不同植被恢复类型下土壤细菌群落的OTU韦恩图(A)、Chao1指数(B)和Shannon-Wiener多样性指数(C) Fig. 2 Venn diagram of unique and shared OTUs (A), Chao1 index (B) and Shannon-Wiener diversity index (C) of soil bacterial communities under different vegetation restorations |
经Brown-Forsythe检验可知,耕地与灌丛的土壤细菌Shannon-Wiener多样性指数差异显著(P=0.011),其变化趋势与Chao1指数基本接近。与耕地相比,其他植被类型下土壤细菌OTU丰富度与多样性均较低(图 2B、2C)。
2.4 土壤细菌群落组成本研究基于OTU水平,利用NMDS分析了不同植被恢复类型下土壤细菌群落结构的差异,如图 3所示,NMDS排序的stress值为0.068,小于0.1,表明排序效果良好,分组具有科学性。耕地与灌丛相距较远,但不同植被恢复类型下的微生物群落结构差异尚不明显。
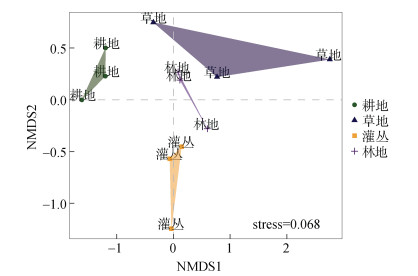
|
图 3 不同植被恢复类型下土壤细菌群落的NMDS分析 Fig. 3 NMDS analysis of soil bacterial communities under different vegetation restorations |
在门水平上(图 4A),退耕还林还草植被恢复类型与耕地土壤细菌群落组成均以酸杆菌门(Acidobacteria)、放线菌门(Actinobacteria)、变形菌门(Proteobacteria)和绿弯菌门(Chloroflexi)为主,共计占所有OTU数的85% 以上。仅有少数类群的土壤细菌在不同植被类型下所占比例存在差异,在前10个细菌门中,酸杆菌门和放线菌门的相对丰度在不同植被恢复类型中差异显著,如与耕地相比,灌丛土壤放线菌的相对丰度显著升高(P=0.003)。
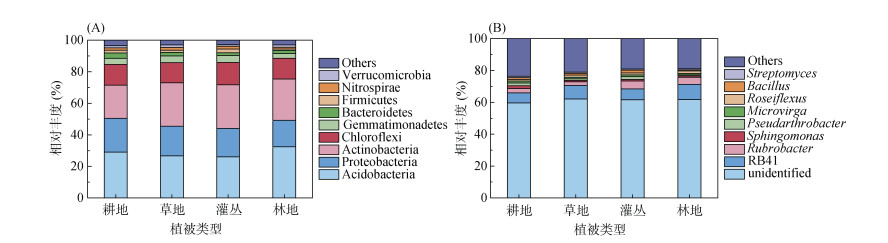
|
图 4 不同植被恢复类型下土壤细菌群落在门水平(A)和属水平(B)上的相对丰度(前10种) Fig. 4 Relative abundances of soil bacteria at phylum and genus level under different vegetation restorations (top 10) |
细分到属水平,在不同植被恢复类型下,未分类的土壤细菌群落占74.95%,已分类的土壤细菌群落的平均相对丰度均小于10%(图 4B)。其中,RB41属占7.81%,是不同植被恢复类型下共同的土壤优势菌群,其次是占3.59% 的红色杆菌属(Rubrobacter)和占1.31% 的玫瑰弯菌属(Roseiflexus)。RB41属在耕地和灌丛土壤中的相对丰度显著低于林地,假节杆菌属(Pseudarthrobacter)在耕地和灌丛土壤中的相对丰度显著高于林地,鞘脂单胞菌属(Sphingomonas)在耕地土壤中的相对丰度显著高于退耕土壤,但后两个属的平均相对丰度均小于2%。
3 讨论 3.1 退耕还林还草对土壤理化性质的影响植被恢复措施可以在不同程度上改变土壤理化性质[21]。了解土壤理化性质(尤其是土壤含水量的变化)是干旱半干旱地区进行植被恢复的重要步骤。本研究发现,与耕地相比,林地土壤含水量轻微下降,灌丛和草地土壤含水量无明显变化,这可能是因为杨树林地的植被根部对土壤水分竞争激烈,发达的表层土壤根系不断吸收土壤水分,使得土壤含水量较低,这可能也是坝上地区人工林多次被报道出现枯死现象的重要原因[22]; 而灌木和草地经过多年生长后地表覆盖度增加,能有效减少地表蒸发,同时减少强降雨对地表的冲刷,减缓地表径流,使土壤含水量增加[23-24]。由于该地区属于河北盐碱地分布区之一,极易发生土地次生盐渍化,使得土壤总体pH偏高,尤其是灌丛土壤pH高于耕地和林地,这还需重视和进一步研究。
总体而言,与耕地相比,退耕还林还草后土壤的理化性质改善不明显,这说明坝上地区遭风蚀沙化后,退耕对于土壤性质的恢复较为漫长[25]。苑依笑等[26]的研究表明,即使是恢复35年以上的退耕地,土壤性质的改善也没有达到显著性水平,更难以恢复到开垦前状态,但退耕对地表土壤的保护作用持续时间较长,土壤理化性质持续恶化的趋势可得到有效控制。因此,建议禁止在坝上地区进一步开垦现有天然草地和灌丛地,坚持长期退耕。
3.2 退耕还林还草对土壤微生物生物量的影响土壤微生物生物量是连接土壤与植被的重要参数,也是土壤生态系统的动态组成部分,与陆地生态系统的多项功能特性相关[27]。本研究表明,草地、灌丛、林地的土壤微生物生物量碳、氮含量均高于耕地,与Deng等[28]的研究较为一致,表明进行植被恢复可改善土壤生物量的输入,将土壤微生物生物量恢复到一定水平。草地和灌丛植被类型下的土壤微生物生物量碳、氮含量又高于林地,这表明在坝上地区发展灌丛和草地等植被类型更有利于恢复和改善土壤微生物生物量,促使生态系统良性发展。耕地的土壤微生物生物量碳、氮含量最低,可能是因为耕地向外输出生物量而补充不足,导致土壤微生物能源的缺乏[29]。
3.3 退耕还林还草对土壤细菌群落结构的影响采取退耕还林还草措施的土壤细菌OTU多样性与耕地相比呈下降趋势,但差异不显著,NMDS分析结果与之类似,这表明耕地微生物生物量的增加主要集中在某些类群的OTU上,退耕还林还草尚不能明显恢复土壤细菌群落结构。这与徐飞等[30]的研究结果类似:植被恢复可以促进土壤细菌群落多样性的恢复,但是土壤细菌群落结构一旦受到耕地等人类活动的干扰,便很难恢复到原始状态。Buckley和Schmidt[31]的研究也表明,细菌群落对植被群落变化的响应不敏感,而植被主要通过植被凋落物以及根系分泌物改良土壤性质,该过程耗时较长。从土壤细菌的丰富度和多样性来看,不同退耕措施下的土壤细菌多样性和丰富度减少,但变化差异不大,这与张露琪等[32]的研究结果类似:细菌多样性在农田土壤中偏高,而在天然林土壤中偏低,说明地下生态系统受人为扰动后,较难恢复到理想状态,甚至很可能滞后于地上植被的恢复。
在门水平上,不同植被恢复下的土壤细菌群落优势组成类似,均以酸杆菌门、放线菌门、变形菌门和绿弯菌门等为主,这与Hou等[33]和Li等[34]的研究结果一致,主要是由于这几类细菌具有较宽的生态位,并且对复杂环境的适应性较强[35-36]。放线菌门的土壤生物类群通常含有大量抗菌素,能在一定程度上抑制根际植物病原体的生长,促进土壤腐殖质的进一步分解,有助于改善土壤质量[37]。本研究中灌丛土壤放线菌的相对丰度显著高于耕地,表明灌丛土壤的抗菌性很可能强于耕地,退耕还灌模式可能更有利于恢复土壤细菌群落。细分到属,酸杆菌门中的RB41属在不同植被恢复模式下均占有绝对优势,可能是因为酸杆菌门是贫瘠土壤中的先锋类群,RB41能在土壤养分贫瘠的情况下维持土壤代谢和生物地球化学循环[38-39]。虽然坝上地区的植被恢复已近20年,对某些土壤细菌类群的相对丰度有一定影响,但是土壤细菌群落结构组成和种类没有明显变化,尚未出现独有类群,对土壤理化性质的影响也不明显,这与Li等[34]的研究结论较为一致。同时,这还与本研究中土壤养分含量无显著变化的结果吻合,说明在近20年的退耕还林还草措施下,地上部植被变化虽然促进了土壤微生物生物量的升高,但未明显改变土壤的细菌群落结构,应继续坚持退耕进行后续监测。建议未来进一步研究土壤理化性质、土壤微生物生物量与地表植被三者之间的关系,优化适合半干旱地区退耕还林还草工程的生态恢复措施。
4 结论坝上地区的植被恢复措施对土壤理化性质的影响不大,但对微生物生物量具有显著影响。在耕地、林地、灌丛和草地4种植被类型下,林地土壤含水量呈微弱下降趋势,灌丛土壤pH显著高于其余3种植被类型,土壤养分差异不显著。土壤微生物生物量的结果表明,不同植被恢复措施存在显著差异,其中耕地土壤微生物生物量碳、氮含量最低,林地、灌丛和草地土壤微生物生物量碳、氮含量逐渐升高。不同植被恢复类型下土壤细菌群落组成均以酸杆菌门、放线菌门、变形菌门和绿弯菌门为主,属水平的主要优势细菌类群为RB41属、红色杆菌属和玫瑰弯菌属。与耕地相比,不同植被恢复类型细菌OTU数、群落丰富度与多样性呈现下降趋势,但尚未明显改变土壤细菌的群落结构组成。总之,坝上地区近20年来退耕还林还草显著提升了土壤微生物生物量,但对土壤养分和土壤微生物多样性的影响较小。地下生态系统一旦受到耕作干扰将很难恢复到原始状态,退耕对土壤性质的恢复是一个相对较长的过程。
致谢: 感谢中国科学院植物研究所公共技术服务中心(分析测试中心)和中国农业科学院分析测试中心在土壤各指标测定中提供的仪器支持; 感谢首都师范大学资源与环境学院研究生孙浩和唐莹在野外土壤样品采集中给予的帮助。
| [1] |
Li W Q, Chen J H, Zhang Z M. Forest quality-based assessment of the Returning Farmland to Forest Program at the community level in SW China[J]. Forest Ecology and Management, 2020, 461: 117938 DOI:10.1016/j.foreco.2020.117938 (  0) 0) |
| [2] |
Li Z Y, Sun X T, Huang Z H, et al. Changes in nutrient balance, environmental effects, and green development after returning farmland to forests: A case study in Ningxia, China[J]. Science of the Total Environment, 2020, 735: 139370 DOI:10.1016/j.scitotenv.2020.139370 (  0) 0) |
| [3] |
Robbins A S T, Harrell S. Paradoxes and challenges for China's forests in the reform era[J]. The China Quarterly, 2014, 218: 381-403 DOI:10.1017/S0305741014000344 (  0) 0) |
| [4] |
赵胜. 张家口坝上生态工程建设研究——从"退耕还林"到"退耕还草"[J]. 河北北方学院学报(社会科学版), 2014, 30(2): 91-94 (  0) 0) |
| [5] |
Steenwerth K L, Jackson L E, Calderón F J, et al. Soil microbial community composition and land use history in cultivated and grassland ecosystems of coastal California[J]. Soil Biology and Biochemistry, 2002, 34(11): 1599-1611 DOI:10.1016/S0038-0717(02)00144-X (  0) 0) |
| [6] |
Delgado-Baquerizo M, Eldridge D J, Ochoa V, et al. Soil microbial communities drive the resistance of ecosystem multifunctionality to global change in drylands across the globe[J]. Ecology Letters, 2017, 20(10): 1295-1305 DOI:10.1111/ele.12826 (  0) 0) |
| [7] |
Mahnert A, Moissl-Eichinger C, Berg G. Microbiome interplay: Plants alter microbial abundance and diversity within the built environment[J]. Frontiers in Microbiology, 2015, 6: 887 (  0) 0) |
| [8] |
Xue L, Ren H D, Li S, et al. Soil bacterial community structure and co-occurrence pattern during vegetation restoration in Karst rocky desertification area[J]. Frontiers in Microbiology, 2017, 8: 2377 DOI:10.3389/fmicb.2017.02377 (  0) 0) |
| [9] |
Deng J J, Bai X J, Zhou Y B, et al. Variations of soil microbial communities accompanied by different vegetation restoration in an open-cut iron mining area[J]. Science of the Total Environment, 2020, 704: 135243 DOI:10.1016/j.scitotenv.2019.135243 (  0) 0) |
| [10] |
胡雷, 阿的鲁骥, 字洪标, 等. 高原鼢鼠扰动及恢复年限对高寒草甸土壤养分和微生物功能多样性的影响[J]. 应用生态学报, 2015, 26(9): 2794-2802 (  0) 0) |
| [11] |
Fry E L, Pilgrim E S, Tallowin J R B, et al. Plant, soil and microbial controls on grassland diversity restoration: A long-term, multi-site mesocosm experiment[J]. Journal of Applied Ecology, 2017, 54(5): 1320-1330 DOI:10.1111/1365-2664.12869 (  0) 0) |
| [12] |
Dang Q L, Tan W B, Zhao X Y, et al. Linking the response of soil microbial community structure in soils to long-term wastewater irrigation and soil depth[J]. Science of the Total Environment, 2019, 688: 26-36 DOI:10.1016/j.scitotenv.2019.06.138 (  0) 0) |
| [13] |
Sun Y T, Luo C L, Jiang L F, et al. Land-use changes alter soil bacterial composition and diversity in tropical forest soil in China[J]. Science of the Total Environment, 2020, 712: 136526 DOI:10.1016/j.scitotenv.2020.136526 (  0) 0) |
| [14] |
Dong S K, Wen L, Li Y Y, et al. Soil-quality effects of grassland degradation and restoration on the Qinghai-Tibetan Plateau[J]. Soil Science Society of America Journal, 2012, 76(6): 2256-2264 DOI:10.2136/sssaj2012.0092 (  0) 0) |
| [15] |
鹿士杨, 彭晚霞, 宋同清, 等. 喀斯特峰丛洼地不同退耕还林还草模式的土壤微生物特性[J]. 生态学报, 2012, 32(8): 2390-2399 (  0) 0) |
| [16] |
常海涛, 赵娟, 刘佳楠, 等. 退耕还林与还草对土壤理化性质及分形特征的影响——以宁夏荒漠草原为例[J]. 草业学报, 2019, 28(7): 14-25 (  0) 0) |
| [17] |
贾昭, 简春霞, 熊沛枫, 等. 黄土丘陵区退耕草地群落盖度与地上生物量关系[J]. 水土保持研究, 2020, 27(1): 319-327 (  0) 0) |
| [18] |
Reuter J A, Spacek D V, Snyder M P. High-throughput sequencing technologies[J]. Molecular Cell, 2015, 58(4): 586-597 DOI:10.1016/j.molcel.2015.05.004 (  0) 0) |
| [19] |
刘姣娜, 马礼. 康保县生态工程实施对农村影响的实证调查与分析[J]. 首都师范大学学报(自然科学版), 2012, 33(5): 56-61 (  0) 0) |
| [20] |
闫树英. 浅谈张家口坝上地区巩固退耕还林成果后续产业发展的研究[J]. 现代农业, 2015(6): 75 (  0) 0) |
| [21] |
Zhang Y H, Xu X L, Li Z W, et al. Effects of vegetation restoration on soil quality in degraded Karst landscapes of southwest China[J]. Science of the Total Environment, 2019, 650: 2657-2665 DOI:10.1016/j.scitotenv.2018.09.372 (  0) 0) |
| [22] |
张欢, 曹俊, 王化冰, 等. 张北地区退化杨树防护林的水分利用特征[J]. 应用生态学报, 2018, 29(5): 1381-1388 (  0) 0) |
| [23] |
王红营, 郭中领, 王仁德, 等. 河北坝上植被恢复措施对土壤性质的影响[J]. 水土保持研究, 2016, 23(5): 74-79, 84 (  0) 0) |
| [24] |
张静, 刘任涛, 赵娟, 等. 宁夏农牧交错带土地利用变化对土壤质量的影响[J]. 生态科学, 2019, 38(2): 94-104 (  0) 0) |
| [25] |
Fryrear D W, Saleh A. Field wind erosion[J]. Soil Science, 1993, 155(4): 294-300 DOI:10.1097/00010694-199304000-00008 (  0) 0) |
| [26] |
苑依笑, 王仁德, 常春平, 等. 坝上地区不同年限退耕工程对土壤的保护作用[J]. 干旱区资源与环境, 2018, 32(9): 84-89 (  0) 0) |
| [27] |
Devi N B, Yadava P S. Seasonal dynamics in soil microbial biomass C, N and P in a mixed-oak forest ecosystem of Manipur, North-east India[J]. Applied Soil Ecology, 2006, 31(3): 220-227 DOI:10.1016/j.apsoil.2005.05.005 (  0) 0) |
| [28] |
Deng Q, Cheng X L, Hui D F, et al. Soil microbial community and its interaction with soil carbon and nitrogen dynamics following afforestation in central China[J]. Science of the Total Environment, 2016, 541: 230-237 DOI:10.1016/j.scitotenv.2015.09.080 (  0) 0) |
| [29] |
何振立. 土壤微生物量及其在养分循环和环境质量评价中的意义[J]. 土壤, 1997, 29(2): 61-69 (  0) 0) |
| [30] |
徐飞, 蔡体久, 杨雪, 等. 三江平原沼泽湿地垦殖及自然恢复对土壤细菌群落多样性的影响[J]. 生态学报, 2016, 36(22): 7412-7421 (  0) 0) |
| [31] |
Buckley D H, Schmidt T M. The structure of microbial communities in soil and the lasting impact of cultivation[J]. Microbial Ecology, 2001, 42(1): 11-21 DOI:10.1007/s002480000108 (  0) 0) |
| [32] |
张露琪, 张志明, 张丽梅, 等. 典型农田退耕后土壤真菌与细菌群落的演替[J]. 生态学报, 2019, 39(8): 2715-2722 (  0) 0) |
| [33] |
Hou X L, Han H, Tigabu M, et al. Changes in soil physico-chemical properties following vegetation restoration mediate bacterial community composition and diversity in Changting, China[J]. Ecological Engineering, 2019, 138: 171-179 DOI:10.1016/j.ecoleng.2019.07.031 (  0) 0) |
| [34] |
Li, Zhang, Hao, et al. Erratum: Li, P.; Zhang, X.; et al. effects of vegetation restoration on soil bacterial communities, enzyme activities, and nutrients of reconstructed soil in a mining area on the loess plateau, China. sustainability 2019, 11, 2295[J]. Sustainability, 2019, 11(19): 5171.
(  0) 0) |
| [35] |
Eichorst S A, Kuske C R, Schmidt T M. Influence of plant polymers on the distribution and cultivation of bacteria in the Phylum Acidobacteria[J]. Applied and Environmental Microbiology, 2011, 77(2): 586-596 DOI:10.1128/AEM.01080-10 (  0) 0) |
| [36] |
Pankratov T A, Ivanova A O, Dedysh S N, et al. Bacterial populations and environmental factors controlling cellulose degradation in an acidic Sphagnum peat[J]. Environmental Microbiology, 2011, 13(7): 1800-1814 DOI:10.1111/j.1462-2920.2011.02491.x (  0) 0) |
| [37] |
Bhatti A A, Haq S, Bhat R A. Actinomycetes benefaction role in soil and plant health[J]. Microbial Pathogenesis, 2017, 111: 458-467 DOI:10.1016/j.micpath.2017.09.036 (  0) 0) |
| [38] |
Fierer N, Bradford M A, Jackson R B. Toward an ecological classification of soil bacteria[J]. Ecology, 2007, 88(6): 1354-1364 DOI:10.1890/05-1839 (  0) 0) |
| [39] |
Foesel B U, Rohde M, Overmann J. Blastocatella fastidiosa gen. nov., sp. nov., isolated from semiarid savanna soil - The first described species of Acidobacteria subdivision 4[J]. Systematic and Applied Microbiology, 2013, 36(2): 82-89 DOI:10.1016/j.syapm.2012.11.002 (  0) 0) |
2. Research Center of Forest Management Engineering of State Forestry and Grassland Administration, College of Forestry, Beijing Forestry University, Beijing 100083, China;
3. College of Urban and Environmental Sciences, Key Laboratory for Earth Surface Processes of the Ministry of Education, Peking University, Beijing 100871, China
 2022, Vol. 54
2022, Vol. 54


