土壤中有机碳储量是决定土壤质量、支持土地可持续利用的关键因素。提高土壤有机碳固存有助于稳定大气CO2含量,提高土壤质量[1]。土壤微生物作为组成土壤生态系统的重要成员,不仅是土壤质量变化的指标,同时是推动土壤有机碳和养分转化的主要驱动力[2]。
生物质炭作为生物质热解炭化产生的稳定富碳固体产物,含大量惰性碳基质[3]。施用于土壤中的生物质炭有助于形成难降解土壤有机碳,从而增加土壤总有机碳储量,减缓大气CO2浓度的上升,是一种稳定碳汇的有效措施。目前,添加生物质炭对土壤有机碳矿化影响的研究结论尚不一致。研究显示,添加生物质炭显著降低了中性土壤的CO2通量,但增加了酸性土壤的CO2通量[4]。尽管生物质炭的物理保护和化学稳定性对土壤有机碳的稳定和累积起着关键作用,但微生物的丰度和活性是主导有机碳矿化的主要因素[5]。微生物通过直接或间接参与生物质炭在土壤中的降解、迁移和转化过程进而影响土壤有机碳储量[6]。大量研究表明,生物质炭强烈地改变了土壤的物理化学条件,从而迅速改变了微生物群落结构与丰度[7]。因此,了解生物质炭对土壤微生物群落结构和动态的影响,有助于更好地预测土壤碳循环动态。
有机矿物复合体的形成是保护和稳定有机碳的关键机制。研究表明,具有高比表面积和高金属氧化物含量的矿物改良剂,如木灰,可与有机残留物结合,增强土壤固碳能力[8]。在钙质土壤中,木灰中钙镁的碳化作用固定了土壤呼吸产生的CO2,从而降低了CO2的排放,同时增加了土壤无机碳的含量[9]。其他研究也报道,高CaO含量的树皮、锯末和树枝的木灰是低成本CO2封存的选择[10]。此外,施用木灰可以通过诱导土壤pH的增加和土壤环境元素组成的变化,直接或间接地影响土壤微生物过程[11]。然而,有关木灰对土壤微生物群落影响的研究多集中在酸性或森林土壤中,同时,近年有关生物质炭的研究也主要集中在酸性或中性土壤中,因此,研究石灰性土壤条件下生物质炭配施木灰对土壤CO2排放、碳固存及其微生物群落的影响,对于预测生物质炭与木灰的固碳潜力和农业大规模应用具有重要意义。
基于以上原因,本研究拟通过室内培养试验,以黄土塬区黑垆土为研究对象,以生物质炭和木灰为供试材料,探讨生物质炭配施木灰对石灰性土壤碳固存、微生物群落结构及酶活性的影响,以为评估生物质炭和木灰添加对土壤质量的改善提供理论依据,这对废弃物资源的高效循环利用具有重要意义。
1 材料与方法 1.1 供试材料供试土壤于2017年10月采自长武农业生态试验站(35.14°N, 107.40°E)表层(0 ~ 20 cm),土壤类型为黄盖黑垆土。土壤经自然风干,研磨过2 mm筛备用。供试土壤基本化学性质为:pH 8.1,全氮1.2 g/kg、有效磷18.3 mg/kg、有效钾152 mg/kg、有机碳8.9 g/kg、CaCO3 67 g/kg。
供试生物质炭由小麦秸秆在350℃限氧条件下热裂解所得,研磨过1 mm筛备用。生物质炭的有机碳含量为598 g/kg,全氮含量为12.23 g/kg,碳氮比为48.90,比表面积为24 m2/g,pH为8.1。供试木灰采自杨凌,为猕猴桃枝条燃烧后的灰烬,风干后的木灰经研磨,过0.25 mm筛装在密封塑料瓶中备用。木灰的有机碳含量为3.2 g/kg,全氮含量为0.8 g/kg,CaO含量为43.4%,pH为12.4。
1.2 试验设计试验共设3个处理,即对照(CK)、单施生物质炭(B)、生物质炭配施木灰(B+W),每个处理重复6次,生物质炭、木灰的用量都为12 g/kg。采用室内模拟恒温(25℃)培养方法进行试验,具体操作如下:称取250 g风干土壤,生物质炭、木灰与培养土混匀后装入1 L带密闭封盖的的培养瓶(高15 cm、直径9 cm)中,将尿素和磷酸二铵配成浓度为N 4.4 g/L、P2O5 2.1 g/L的溶液,然后每瓶加入5 ml(折纯为每瓶22.0 mg N和10.3 mg P2O5); 将培养土含水量调至田间持水量的70%;将装有20 ml 1 mol/L NaOH溶液的塑料瓶悬挂于密闭培养瓶中,分别在培养2、3、4、5、7、10、13、18、23、28、35、42、49、56、70、86和118 d时取下已吸收CO2的20 ml 1 mol/L NaOH溶液塑料瓶,将NaOH溶液用蒸馏水冲洗至三角瓶中,用20 ml 1 mol/L的BaCl2沉淀捕获CO2,加2滴酚酞指示剂,然后用0.1 mol/L的HCl滴定至红色消失,计算CO2的释放量。每次测量气体时打开盖子一段时间以保证气体交换,然后加入新的NaOH溶液继续培养,期间用质量差值法校准调节土壤含水量。
1.3 指标测定及方法分别在培养7、118 d时,对土壤样品进行破坏性取样(每个处理取3个重复)。一部分储存在4℃下用于土壤微生物生物量碳、溶解性有机碳含量和酶活性分析; 一部分储存在-80℃下用于土壤DNA提取; 剩余土壤风干用于土壤化学性质测定。
1.3.1 土壤化学性质测定土壤有机碳(SOC)采用重铬酸钾-浓硫酸外加热法[12]; 土壤无机碳(SIC)采用改良气量法[12]; 土壤溶解性有机碳(DOC)和微生物生物量碳(MBC)分别采用蒸馏水浸提法和氯仿熏蒸法[13]; 土壤微生物熵(q)计算为MBC和SOC的比值(MBC/SOC,%); 土壤pH采用水土质量比2.5∶1 pH计法[14]; β-1, 4-木糖苷酶(BXYL)、β-1, 4-葡萄糖苷酶(BG)、纤维二糖水解酶(CBH)以及蔗糖酶(Invertase)活性采用微孔板荧光法[15]。
1.3.2 土壤微生物测定采用FastDNA Spin Kit for Soil试剂盒(MP Biomedicals,Illkirch,France)提取土壤样品的DNA。每个样品取0.5 g土样,按照说明书完成操作。使用超净DNA纯化试剂盒(MoBio, Carlsbad, CA, USA)纯化提取DNA,然后进行1%琼脂糖凝胶电泳检测,最后将样品于20℃保存以备后续试验使用。选用引物338F(5’-ACTCCTA CGGGAGGCAGCAG-3’)和806R(5’-GGACTACNN GGG TATCTAAT-3’)扩增16S rRNA基因的V3 ~ V4区域; 选用引物ITS1(5’-CTTGGTCATTTAGA GGAAGTAA-3’)和ITS2(5’-TGCGTTCTTCATCG ATGC-3’)扩增真菌ITS rDNA的ITS1区,将纯化后的扩增产物等摩尔数混合,并在Illumina MiSeq平台(Illumina, San Diego, California, USA)上进行配对末端测序(2×250)。Illumina MiSeq测序是在北京奥维森基因科技有限公司,利用Illumina Miseq PE250高通量测序平台完成。
Illumina MiSeq测序原始数据经过QIIME(v1.8.0)软件过滤、拼接、去除质量分数 < 20和序列长度 < 150 bp的序列; 将有效序列按照97% 相似性进行操作分类单元(OTU)聚类分析,对比silva数据库,得到每个OTU对应的物种分类信息; 再利用Mothur软件(version 1.31.2)进行α多样性分析(包括Shannon、Ace和Chao13个指数)
1.4 统计分析试验数据的整理以及图表的绘制采用Microsoft Excel 2016,所有数据均采用DPS统计软件(DPS7.05)进行分析,差异显著性检验采用LSD法(P < 0.05),并利用CANOCO 5.0软件进行细菌和真菌群落组成的冗余分析。
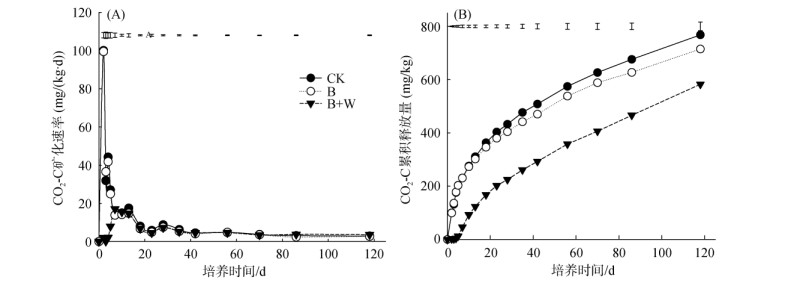
2 结果 2.1 生物质炭配施木灰对土壤CO2释放及碳组分的影响不同处理土壤有机碳矿化动态如图 1所示,可见,对照(CK)和单施生物质炭处理(B)的土壤有机碳矿化速率在培养2 d时出现CO2-C矿化速率高峰,分别为100.04和99.51 mg/(kg·d),后随着时间的推移而降低(图 1A)。而生物质炭配施木灰处理(B+W)推迟CO2释放速率峰值的出现。与CK相比,B处理降低了CO2-C释放速率,B+W处理则进一步降低了CO2-C释放速率。
|
图 1 CO2-C矿化速率(A)、累积释放量(B)的动态变化 Fig. 1 CO2-C emission rates (A) and dynamics of cumulative CO2-C emissions (B) |
|
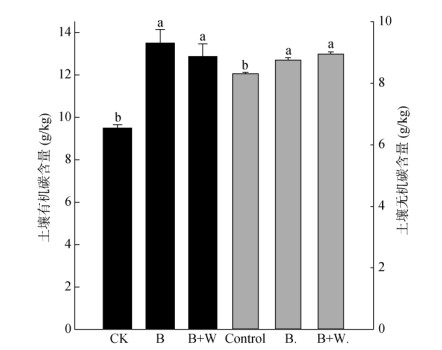
(误差线表示标准差; 不同小写字母表示同一指标处理间差异显著(P < 0.05)) 图 2 各处理土壤有机碳、无机碳含量 Fig. 2 Contents of soil organic carbon and inorganic carbon in each treatment |
各处理土壤CO2-C累积释放量的变化趋势一致,呈现前期增长迅速,后期增长缓慢的规律(图 1B)。在培养的0 ~ 10 d,除B+W处理外,CK和B+W处理的CO2-C累积释放量基本相同; 整个培养期内,各处理土壤CO2-C的累积释放量大小顺序为:CK > B > B+W。
B、B+W处理的有机碳含量分别较CK增加48.26% 和30.56%,无机碳含量分别较CK提高5.42% 和7.70%。但B+W处理与B处理的有机碳、无机碳含量无显著性差异。
2.2 生物质炭配施木灰对土壤化学性质及酶活性的影响表 1反映了添加生物质炭和木灰后土壤微生物熵(q)、微生物生物量碳(MBC)、溶解性有机碳(DOC)、pH的变化(表 1)。随着培养时间的延长,q、MBC、DOC整体呈下降趋势。在培养7 d时,B+W处理MBC含量较CK降低43.56%,至培养118 d时,B、B+W处理的MBC含量显著高于CK,且B处理的MBC含量高于B+W处理。此外,培养118 d时,B+W处理的DOC含量、pH分别较CK提高47.14% 和2.08%。
|
|
表 1 生物质炭配施木灰对土壤化学性质的影响 Table 1 Effects of biochar combined with wood ash on soil chemical properties |
如表 2所示,不同处理间土壤酶活性变化不同,在培养7 d时,B+W处理降低了β-1, 4-葡萄糖苷酶、纤维二糖水解酶、蔗糖酶活性; 至118 d时,B处理的β-1, 4-葡萄糖苷酶活性较CK提高10.9%,B+W处理的β-1, 4-木糖苷酶、β-1, 4-葡萄糖苷酶活性分别较CK降低38.4% 和15.3%,且B+W处理的蔗糖酶活性显著高于CK和B处理。
|
|
表 2 生物质炭配施木灰对土壤酶活性的影响 Table 2 Effects of biochar combined with wood ash on soil enzyme activities |
土壤细菌α多样性指数如表 3所示,Chao1、Ace指数以及Shannon指数分别表征土壤微生物类群的丰富度和多样性。在培养118 d时,相较CK处理,B处理对细菌Chao1、Ace指数无显著性影响; 而B+W处理的Chao1、Ace、Shannon指数显著低于CK与B处理。
|
|
表 3 生物质炭与木灰配施下细菌、真菌α多样性指数 Table 3 α diversity indexes of soil bacteria and fungi under combined application of biochar and wood ash |
真菌α多样性指数对B和B+W处理具有不同的响应(表 3)。培养118 d时,B处理的真菌Chao1、Ace指数分别较CK降低29.95% 和37.78%,B+W处理不但将Chao1、Ace指数维持在与CK相似的水平上,同时提高了Shannon指数。
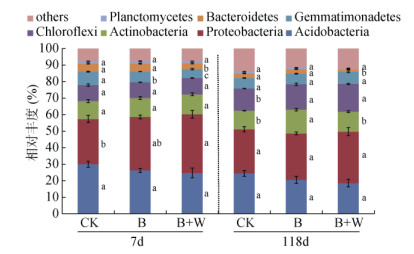
2.4 生物质炭配施木灰对土壤微生物相对丰度的影响土壤细菌种类门水平丰度在1% 以上的有7种(图 3),其中,变形菌门(Proteobacteria)、酸杆菌门(Acidobacteria)为优势菌门,其相对丰度分别为26.72% ~ 35.47%、18.58% ~ 29.98%。在培养7 d时,B+W处理提高了变形菌门相对丰度,B、B+W处理的芽单胞菌门(Gemmatimonadetes)相对丰度分别较CK降低20.61% 和35.09%。在培养118 d时,B处理提高了放线菌门(Actinobacteria)相对丰度,B+W处理降低了拟杆菌门(Bacteroidetes)相对丰度; B、B+W处理的绿弯菌门(Chloroflexi)相对丰度分别较CK提高14.18% 和24.50%。
|
(图中误差线表示标准差; 不同小写字母表示同一时间处理间差异显著(P < 0.05),下同) 图 3 生物质炭配施木灰对细菌主要门水平相对丰度的影响 Fig. 3 Effects of biochar combined with wood ash on relative abundances of main phylum levels of bacteria |
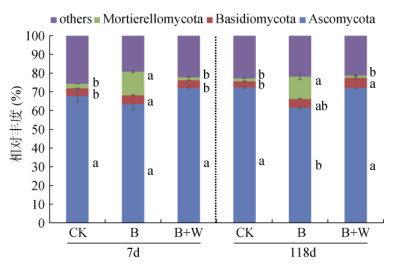
B、B+W处理对土壤真菌门水平相对丰度的影响如图 4所示。各处理下子囊菌门(Ascomycota)保持了较高的相对丰度。培养7 d时,B处理显著提高了被孢霉菌门(Mortierellomycota)和担子菌门(Basidiomycota)的相对丰度。培养118 d时,B+W处理的子嚢菌门相对丰度较B处理增加17.43%,且B+W处理的担子菌门相对丰度显著高于CK。
|
图 4 生物质炭配施木灰对土壤真菌主要门水平相对丰度的影响 Fig. 4 Effects of biochar combined with wood ash on relative abundances of major phyla of soil fungi |
由图 5A可知,土壤环境因子共同解释了75.15% 的细菌群落组成变异,其中RDA1和RDA2分别解释了细菌群落68.02% 和7.13% 的变异。Invertase(蔗糖酶)、BXLY(β-1, 4-木糖苷酶)、CBH(纤维二糖水解酶、BG(β-1, 4-葡萄糖苷酶)活性与土壤pH呈负相关关系,变形菌门相对丰度与土壤pH、DOC含量呈正相关关系,绿弯菌门、放线菌门相对丰度与土壤SOC含量、CO2释放量呈正相关关系,在土壤细菌门水平上,SOC含量对细菌的群落分布影响最为显著( F = 21.6,P = 0.002)。通过对各土壤环境因子与土壤真菌群落结构关系的冗余分析(图 5B)发现,土壤环境因子解释了真菌群落总变化的58.35%。BXLY、CBH、BG活性与CO2释放量呈正相关关系,子囊菌门相对丰度与pH、SOC含量呈正相关关系,担子菌门相对丰度与DOC、SOC含量呈正相关关系,与土壤pH呈负相关关系。在土壤真菌门水平上,pH对真菌的群落分布影响最为显著( F = 6.7,P = 0.026)。
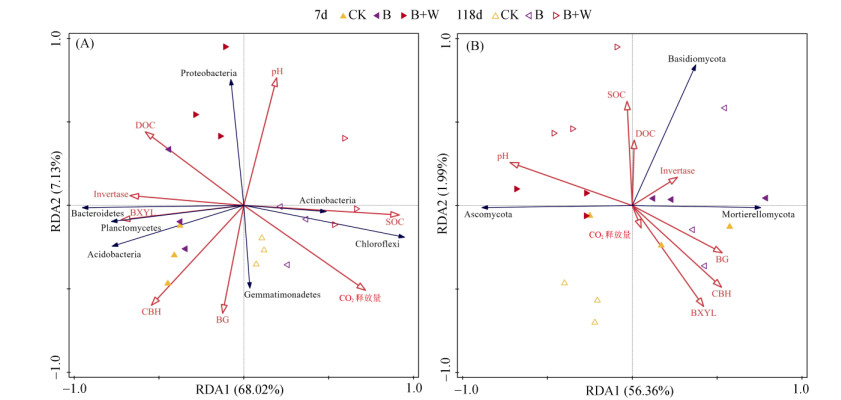
|
(图A代表土壤性质与细菌相对丰度的相关性; 图B代表土壤性质与真菌菌相对丰度的相关性; Proteobacteria为变形菌门; Bacteroidetes为拟杆菌门; Planctomycetes为浮霉菌门; Acidobacteria为酸杆菌门; Gemmatimonadetes为芽单胞菌门; Chloroflexi为绿弯菌门; Actinobacteriota为放线菌门; Ascomycota为子囊菌门; Mortierellomycota为被孢霉菌门; Basidiomycota为担子菌门) 图 5 土壤性质与细菌、真菌相对丰度的冗余分析 Fig. 5 Redundancy analysis (RDA) of soil properties with enzyme activities and relative abundances of bacteria and fungi |
本研究发现,各处理CO2矿化速率均表现为前期(前7 d)急速增加,然后降低,最后趋于平稳的现象,这是因为添加外源物料后,前期土壤微生物可迅速利用易分解组分,土壤有机碳的矿化速率迅速增长,但随着培养时间的延长,易分解组分逐渐被消耗,矿化速率随之减缓。单施生物质炭(B处理),CO2释放量降低,表明土壤有机碳矿化降低,这与生物质炭的自身结构特性有关。生物质炭强大的孔隙结构和表面积,通过包封和吸附作用与土壤有机质结合,强烈抑制被吸附有机质的降解[16]。生物质炭配施木灰处理(B+W)较B处理进一步降低了CO2的释放量(图 1B),说明木灰具有长期稳定CO2的独特优势。原因可能是与木灰中的CaO促进了土壤无机碳(如CaCO3)的形成有关。此外,在钙质土壤中,木灰中的矿物质与土壤中的有机质结合形成有机-矿物组合,增强了有机质抗分解能力[17]。
添加生物质炭(B、B+W处理)提高了土壤有机碳含量,这与其他学者研究结果一致[18]。除生物质炭自身结构特性外,生物质炭含有大量惰性碳基质,一定程度上可以抵抗微生物对它的分解作用,增加土壤有机碳的同时降低土壤碳矿化。土壤有机碳矿化是微生物参与下,对土壤中易分解组分进行分解利用并释放CO2的过程,B+W处理提高土壤有机碳含量的原因可能是木灰通过间接增加土壤pH或直接影响土壤微生物和酶的活性,进而调控土壤碳矿化。
微生物生物量碳(MBC)是重要的活性有机碳组分,其含量高低可表征土壤微生物活性的强弱。土壤微生物熵q作为MBC含量与SOC含量的比值,其大小变化反映了SOC向MBC的转化效率。在培养至7 d时,B+W处理提高了土壤pH,降低了土壤微生物活性、MBC含量和q值; B处理对土壤DOC、MBC含量没有显著影响,与Zhao等[19]研究结果一致。这是因为大多数生物质炭的碳是难降解的,短时间内限制了其对DOC和MBC水平的贡献能力。在培养至118 d时,B+W处理显著提高了DOC含量,这可能与施用木灰提高土壤pH有关。Andersson等[20]也研究发现,土壤pH高于土壤微生物活性对DOC含量的影响,并且pH的增加可以提高土壤有机质的溶解度。此外,生物质炭在土壤中并不是一成不变的,它也可以被缓慢分解,只是其降解速度比土壤中的一般有机质要慢得多[21]。B、B+W处理土壤中微生物可分解利用的有机质含量相对高于CK,因此,培养至118 d时,两处理的MBC含量显著高于CK,而木灰的强碱性减弱了微生物活性,导致B+W处理的MBC含量低于B处理。
土壤酶活性主要来源于微生物的代谢活动,在一定程度上可反映土壤微生物活性[22]。在培养至7 d时,B+W处理的β-1, 4-葡萄糖苷酶、纤维二糖水解酶、蔗糖酶活性显著降低,原因可能是施用木灰提高了土壤pH,减弱了土壤微生物活性,进而减少土壤酶的分泌,降低了土壤酶活性。此外,β-1, 4-葡萄糖苷酶、纤维二糖水解酶、蔗糖酶作为参与碳循环的主要水解酶类,其活性降低表明土壤有机碳矿化程度低,这与本试验观察到的B+W处理对CO2累积释放量的影响是一致的。在培养至118 d时,B处理β-1, 4-葡萄糖苷酶活性增加,证实了先前的研究[23],原因可能与生物质炭制备条件有关,在低温(350 ~ 500℃)下产生的生物质炭中的挥发性化合物可以刺激β-1, 4-葡萄糖苷酶活性[24]; B+W处理较B处理进一步提高了蔗糖酶活性,这是因为施用木灰后土壤DOC含量较高,DOC有利于直接为土壤微生物提供碳源,促进微生物繁殖,刺激了微生物对酶的分泌,进而提高土壤酶活性[25]。此外,冗余分析也表明,蔗糖酶的活性与DOC含量呈正相关关系。
3.2 生物质炭配施木灰对土壤微生物多样性的影响与CK相比,B处理对细菌丰富度无显著影响,却显著降低了真菌Chao1、Ace指数,这主要是与培养时间和土壤pH有关。首先,生物质炭自身结构相对稳定,且含有大量不易被分解利用的多环芳香族化合物,对土壤细菌的影响是一个漫长的过程[26]; 此外,土壤理化环境,尤其土壤pH,是细菌丰富度和多样性变化的主要驱动因素[27],本研究供试土壤呈碱性,添加生物质炭后土壤pH没有显著变化,故B处理对细菌丰富度和多样性没有显著影响。此外,细菌比真菌更容易被生物质炭吸附[28],在一定程度上使细菌比真菌更能适应生物质炭引起的土壤环境变化[29],进而导致B处理下真菌Chao1、Ace指数降低。B+W处理下土壤pH显著增加,导致细菌多样性降低,这与Bang-Andreasen等[30]的研究结果一致。然而,B+W处理不仅将真菌Chao1、Ace指数恢复到与CK相似的水平,同时显著提高了Shannon指数,表明木灰的石灰效应和养分投入可提高真菌群落稳定性[31]。
3.3 生物质炭配施木灰对微生物群落结构的影响土壤微生物群落结构对B和B+W处理的不同响应可能与其生态特性和生态功能有关,因为微生物在营养需求、胁迫耐受性方面存在较大差异。本研究中,优势门变形菌门保持了较高的相对丰度,这种高丰度可能是由于变形菌门对环境变化的普遍抗性导致的。在培养7 d时,B+W处理提高了变形菌门相对丰度,这是由于木灰保留了除氮以外的大多数主要矿质营养物质,而变形菌门能够迅速利用这些营养[32],从而优化了细菌群落; 另一方面,由于木灰的强碱性及其丰富的碱金属,B+W处理降低了芽单胞菌门和拟杆菌门相对丰度。在培养118 d时,与CK相比,B和B+W处理提高了绿弯菌门的相对丰度,同样,Chen等[33]也报道了生物质炭对这一群体的积极影响。绿弯菌门被认为是相对难降解碳的潜在降解者,可氧化芳香族化合物,将难降解碳源作为代谢底物[32]。放线菌在有机物转化中发挥着重要作用,放线菌分泌的胞外酶可参与复杂芳香物质的降解过程,因此B处理提高了其相对丰度[34]。本研究发现,B和B+W处理拟杆菌门相对丰度显著降低,类似的细菌群落组成变化在石灰性土壤中也有记录[35]。这可能与土壤类型、土壤理化环境以及细菌群落内的相互竞争有关。
子囊菌门的高丰度可能是由于它们易于进行繁殖和快速生长,而不像担子菌门生长缓慢[36]。被孢霉菌具有将生物质炭中难分解有机物降解为不稳定纤维素类化合物的能力[37],因此,B处理提高了培养过程中被孢霉菌门的相对丰度。在培养7 d时,B处理中活性碳组分可在施用初期降解,为微生物提供碳源进而促进担子菌门相对丰度的增加。此外,担子菌门相对丰度的增加有利于土壤中难降解化合物的降解和促进土壤碳循环[38]。在培养118 d时,B+W处理增加了土壤微生物能够吸收利用的可溶性碳源,导致子囊菌门相对丰度显著高于B处理。
4 结论1) 单施生物质炭、生物质炭配施木灰处理均能降低石灰性土壤有机碳的矿化,减少CO2的释放,且生物质炭配施木灰的效果优于单施生物质炭处理。
2) 单施生物质炭对细菌丰富度没有影响,但在一定程度上改变了细菌群落结构,体现在单施生物质炭显著提高了放线菌门和绿弯菌门相对丰度; 生物质炭配施木灰降低了细菌α多样性,同时,可维持真菌丰富度,并提高真菌多样性。
3) 冗余分析表明,单施生物质炭、生物质炭配施木灰可以通过改变土壤的理化性质间接引起微生物群落结构的变化,其中SOC、pH分别对细菌、真菌群落结构影响最显著,且生物质炭配施木灰在降低石灰性土壤碳矿化、维持真菌群落稳定性方面效果更佳。
| [1] |
王昆艳, 官会林, 卢俊, 等. 生物质炭施用量对旱地酸性红壤理化性质的影响[J]. 土壤, 2020, 52(3): 503-509 (  0) 0) |
| [2] |
袁晶晶, 同延安, 卢绍辉, 等. 生物炭与氮肥配施改善枣区土壤微生物学特性[J]. 植物营养与肥料学报, 2018, 24(4): 1039-1046 (  0) 0) |
| [3] |
Xiao X, Chen B L, Chen Z M, et al. Insight into multiple and multilevel structures of biochars and their potential environmental applications: A critical review[J]. Environmental Science & Technology, 2018, 52(9): 5027-5047 (  0) 0) |
| [4] |
Sheng Y Q, Zhan Y, Zhu L Z. Reduced carbon sequestration potential of biochar in acidic soil[J]. Science of the Total Environment, 2016, 572: 129-137 DOI:10.1016/j.scitotenv.2016.07.140 (  0) 0) |
| [5] |
Zheng H, Wang X, Luo X X, et al. Biochar-induced negative carbon mineralization priming effects in a coastal wetland soil: Roles of soil aggregation and microbial modulation[J]. Science of the Total Environment, 2018, 610/611: 951-960 DOI:10.1016/j.scitotenv.2017.08.166 (  0) 0) |
| [6] |
胡瑞文, 刘勇军, 周清明, 等. 生物炭对烤烟根际土壤微生物群落碳代谢的影响[J]. 中国农业科技导报, 2018, 20(9): 49-56 (  0) 0) |
| [7] |
Pan F X, Li Y Y, Chapman S J, et al. Microbial utilization of rice straw and its derived biochar in a paddy soil[J]. Science of the Total Environment, 2016, 559: 15-23 DOI:10.1016/j.scitotenv.2016.03.122 (  0) 0) |
| [8] |
Reed E Y, Chadwick D R, Hill P W, et al. Critical comparison of the impact of biochar and wood ash on soil organic matter cycling and grassland productivity[J]. Soil Biology and Biochemistry, 2017, 110: 134-142 DOI:10.1016/j.soilbio.2017.03.012 (  0) 0) |
| [9] |
Zhao H L, Tian X H, Chen Y L, et al. Effect of exogenous substances on soil organic and inorganic carbon sequestration under maize stover addition[J]. Soil Science and Plant Nutrition, 2017, 63(6): 591-598 DOI:10.1080/00380768.2017.1409603 (  0) 0) |
| [10] |
Guo Y F, Zhao C W, Chen X P, et al. CO2 capture and sorbent regeneration performances of some wood ash materials[J]. Applied Energy, 2015, 137: 26-36 DOI:10.1016/j.apenergy.2014.09.086 (  0) 0) |
| [11] |
Peltoniemi K, Pyrhönen M, Laiho R, et al. Microbial communities after wood ash fertilization in a boreal drained peatland forest[J]. European Journal of Soil Biology, 2016, 76: 95-102 DOI:10.1016/j.ejsobi.2016.08.004 (  0) 0) |
| [12] |
鲍士旦. 土壤农化分析[M].
中国农业出版社, 北京, 2010
(  0) 0) |
| [13] |
Huang Z S, Fu Y H, Yu L F. Characteristics of soil microbial biomass carbon and soil water soluble organic carbon in the process of natural restoration of Karst forest[J]. The Journal of Applied Ecology, 2012, 23(10): 2715-2720 (  0) 0) |
| [14] |
马列, 刘金华, 杨靖民, 等. 新型复合改良剂对苏打盐碱土的改良效果研究[J]. 中国土壤与肥料, 2021(5): 144-149 (  0) 0) |
| [15] |
DeForest J L. The influence of time, storage temperature, and substrate age on potential soil enzyme activity in acidic forest soils using MUB-linked substrates and l-DOPA[J]. Soil Biology and Biochemistry, 2009, 41(6): 1180-1186 DOI:10.1016/j.soilbio.2009.02.029 (  0) 0) |
| [16] |
Zimmerman A R, Gao B, Ahn M Y. Positive and negative carbon mineralization priming effects among a variety of biochar-amended soils[J]. Soil Biology and Biochemistry, 2011, 43(6): 1169-1179 DOI:10.1016/j.soilbio.2011.02.005 (  0) 0) |
| [17] |
Kleber M, Eusterhues K, Keiluweit M, et al. Mineral-organic associations: Formation, properties, and relevance in soil environments[J]. Advances in Agronomy, 2015, 130: 1-140 (  0) 0) |
| [18] |
杜倩, 黄容, 李冰, 等. 生物炭还田对植烟土壤活性有机碳及酶活性的影响[J]. 核农学报, 2021, 35(6): 1440-1450 (  0) 0) |
| [19] |
Zhao C S, Zhang Y P, Liu X B, et al. Comparing the effects of biochar and straw amendment on soil carbon pools and bacterial community structure in degraded soil[J]. Journal of Soil Science and Plant Nutrition, 2020, 20(2): 751-760 DOI:10.1007/s42729-019-00162-4 (  0) 0) |
| [20] |
Andersson S, Nilsson S I, Saetre P. Leaching of dissolved organic carbon (DOC) and dissolved organic nitrogen (DON) in mor humus as affected by temperature and pH[J]. Soil Biology and Biochemistry, 2000, 32(1): 1-10 DOI:10.1016/S0038-0717(99)00103-0 (  0) 0) |
| [21] |
章明奎, Walelign D Bayou, 唐红娟. 生物质炭对土壤有机质活性的影响[J]. 水土保持学报, 2012, 26(2): 127-131, 137 (  0) 0) |
| [22] |
张帅, 成宇阳, 吴行, 等. 生物炭施用下潮土团聚体微生物量碳氮和酶活性的分布特征[J]. 植物营养与肥料学报, 2021, 27(3): 369-379 (  0) 0) |
| [23] |
Song X N, Razavi B S, Ludwig B, et al. Combined biochar and nitrogen application stimulates enzyme activity and root plasticity[J]. Science of the Total Environment, 2020, 735: 139393 DOI:10.1016/j.scitotenv.2020.139393 (  0) 0) |
| [24] |
Ameloot N, De Neve S, Jegajeevagan K, et al. Short-term CO2 and N2O emissions and microbial properties of biochar amended sandy loam soils[J]. Soil Biology and Biochemistry, 2013, 57: 401-410 DOI:10.1016/j.soilbio.2012.10.025 (  0) 0) |
| [25] |
张桃香, 郑钰铟, 陈辉. 不同温度生物炭对油茶林红壤呼吸作用和酶活性的影响研究[J]. 土壤通报, 2019, 50(1): 96-102 (  0) 0) |
| [26] |
Dong X L, Li G T, Lin Q M, et al. Quantity and quality changes of biochar aged for 5 years in soil under field conditions[J]. CATENA, 2017, 159: 136-143 DOI:10.1016/j.catena.2017.08.008 (  0) 0) |
| [27] |
Joa J H, Weon H Y, Hyun H N, et al. Effect of long-term different fertilization on bacterial community structures and diversity in Citrus orchard soil of volcanic ash[J]. Journal of Microbiology, 2014, 52(12): 995-1001 DOI:10.1007/s12275-014-4129-6 (  0) 0) |
| [28] |
Pietikäinen J, Kiikkilä O, Fritze H. Charcoal as a habitat for microbes and its effect on the microbial community of the underlying humus[J]. Oikos, 2000, 89(2): 231-242 DOI:10.1034/j.1600-0706.2000.890203.x (  0) 0) |
| [29] |
Lehmann J, Rillig M C, Thies J, et al. Biochar effects on soil biota - A review[J]. Soil Biology and Biochemistry, 2011, 43(9): 1812-1836 DOI:10.1016/j.soilbio.2011.04.022 (  0) 0) |
| [30] |
Bang-Andreasen T, Nielsen J T, Voriskova J, et al. Wood ash induced pH changes strongly affect soil bacterial numbers and community composition[J]. Frontiers in Microbiology, 2017, 8: 1400 DOI:10.3389/fmicb.2017.01400 (  0) 0) |
| [31] |
Augusto L, Bakker M R, Meredieu C. Wood ash applications to temperate forest ecosystems-potential benefits and drawbacks[J]. Plant and Soil, 2008, 306(1/2): 181-198 (  0) 0) |
| [32] |
Fierer N, Bradford M A, Jackson R B. Toward an ecological classification of soil bacteria[J]. Ecology, 2007, 88(6): 1354-1364 DOI:10.1890/05-1839 (  0) 0) |
| [33] |
Chen J H, Liu X Y, Li L Q, et al. Consistent increase in abundance and diversity but variable change in community composition of bacteria in topsoil of rice paddy under short term biochar treatment across three sites from South China[J]. Applied Soil Ecology, 2015, 91: 68-79 DOI:10.1016/j.apsoil.2015.02.012 (  0) 0) |
| [34] |
顾美英, 唐光木, 刘洪亮, 等. 施用棉秆炭对新疆连作棉花根际土壤微生物群落结构和功能的影响[J]. 应用生态学报, 2016, 27(1): 173-181 (  0) 0) |
| [35] |
Cheng J Z, Lee X, Tang Y, et al. Long-term effects of biochar amendment on rhizosphere and bulk soil microbial communities in a Karst region, southwest China[J]. Applied Soil Ecology, 2019, 140: 126-134 DOI:10.1016/j.apsoil.2019.04.017 (  0) 0) |
| [36] |
Liu D, Keiblinger K M, Schindlbacher A, et al. Microbial functionality as affected by experimental warming of a temperate mountain forest soil-A metaproteomics survey[J]. Applied Soil Ecology, 2017, 117/118: 196-202 DOI:10.1016/j.apsoil.2017.04.021 (  0) 0) |
| [37] |
Koechli C, Campbell A N, Pepe-Ranney C, et al. Assessing fungal contributions to cellulose degradation in soil by using high-throughput stable isotope probing[J]. Soil Biology and Biochemistry, 2019, 130: 150-158 DOI:10.1016/j.soilbio.2018.12.013 (  0) 0) |
| [38] |
Ren C J, Zhao F Z, Kang D, et al. Linkages of C: N stoichiometry and bacterial community in soil following afforestation of former farmland[J]. Forest Ecology and Management, 2016, 376: 59-66 DOI:10.1016/j.foreco.2016.06.004 (  0) 0) |
 2022, Vol. 54
2022, Vol. 54


