番茄青枯病是一种全球性的土传细菌性病害,一旦发生难以控制且极具毁灭性,往往会造成巨大的经济损失[1],严重破坏土壤的健康状况,制约着番茄的生产[2-3]。连作土壤中微生物多样性下降,微生物间相互作用减少是导致不同类型连作障碍的主要原因[4]。另外,连作在导致土传病害的同时,由于植株对养分的选择性吸收,容易导致一些元素的缺乏,造成养分失衡[5],导致土壤退化,引起植株发育不良[6],产量和品质下降[7]。土壤微生物与植株的养分吸收息息相关[8-10],然而,不同发病程度的土壤对作物养分吸收效率的影响,土壤初始微生物群落与植物养分吸收间的关系,尚缺乏系统研究。
氮是植物体内许多重要有机化合物的成分,影响着植物的代谢过程和生长发育[11],它是植物体内蛋白质、核酸、磷脂和某些生长激素的重要组分之一[12],也是某些植物激素、维生素等对生命活动起调节作用物质的主要成分[13],且对作物最终产量的贡献约为40% ~ 50%[14]。植株的氮素吸收受多种因素影响,研究表明,连作会使土壤中的氮素形态和积累发生变化,进而影响作物的生长过程和产量形成[15-16];土壤微生物也会影响植株的氮素吸收利用[17],对土壤氮素的有效性及其在地上、地下的循环特征方面起着调控作用[18]。此外,目前我国的氮肥利用率低于发达国家[19]。因此,研究不同连作障碍土壤下的植株氮素吸收效率及其影响因素,具有重要意义。
综上,目前国内外研究已经发现,长期连作造成土壤健康状况变化,进而影响植株的生长,然而从障碍土壤氮素含量及细菌群落出发,探究连作障碍对植物氮素吸收利用的影响还很少。本文旨在从不同发病率的番茄青枯土出发,研究不同发病率土壤氮素含量及初始细菌群落对植株氮素吸收效率的影响,以期为通过调控土壤微生物,改善因连作障碍造成植株养分吸收效率低的问题提供新思路。
1 材料与方法 1.1 供试材料供试土壤采自南京市蔬菜科学研究所(31°43’N, 118°46’E)设施蔬菜大棚。该蔬菜大棚自2013年3月种植番茄,用于开展有机肥、生物有机肥、纯化肥等不同施肥模式对连作番茄青枯病的影响试验。采用对角线取样法采集因不同施肥模式造成的番茄青枯病不同发病率的6个不同处理土壤(表 1),采土当季(2019年6月)青枯病发病率分别为12.5%、21.9%、40.0%、59.4%、83.3% 和91.6%,每种土壤的基本理化性质如表 1所示。每种土壤采集30 kg,采集回实验室自然风干后,磨土过5目筛待用。
|
|
表 1 盆栽试验前青枯病不同发病率土壤的基本理化性状 Table 1 Basic physicochemical properties of soils with different bacterial wilt incidence rates |
供试作物为番茄,品种为上海合作903。
供试肥料为化肥,分别为尿素(含N 46.3%)、重过磷酸钙(含P2O5 43%)和硫酸钾(含K2O 52%)。
1.2 供试土壤样品采集番茄田间试验每个小区面积8 m2,种植世纪红冠品种番茄40株,田间当季试验结束后,分别采集6个不同青枯病发病率的小区土壤,将番茄植株连根带土取出后,采集土体土壤用于DNA提取,每种发病率的处理采集6个重复,共6个处理,累计36个土壤样品,–80 ℃保存备用。
1.3 供试土壤DNA提取提取土壤DNA进行高通量测序。使用PowerSoil DNA(MoBio Laboratories Inc., USA)试剂盒,参照说明书提取土壤样品总DNA,–80 ℃保存备用。
1.4 测序数据的分析根据Caporaso等[20]和Kozich等[21]的试验方法,分别用520F:5’-AYT GGG YDT AAA GNG -3’和802R:5’-TAC NVG GGT ATC TAA TCC -3’引物测定细菌16S rRNA基因的V4区片段。将高通量测序获得的原始下机数据进行一系列处理获得用于后续分析OTU表格和分类信息,具体步骤如下:采用UPARSE标准处理流程[22],对序列质量进行质控,去除低质量序列,拼接正反向序列;运用USEARCH软件,按照UPARSE pipeline将拼接好的序列在97% 序列相似度的条件下生成可操作分类单元(OTU)初始表,提取每个OTU的代表性序列[22];将OTU代表性序列上传至网站http://rdp.cme.msu.edu进行序列比对(RDP naïve Bayesian classifier, cutoff = 80%)。选用RDP 16S rRNA database数据库对细菌群落进行分类注释[23],最终获得每个OTU对应的具体分类信息。
1.5 盆栽试验设计盆栽试验于2019年8—10月在江苏省固体有机废弃物资源化高技术研究重点实验室宜兴基地温室进行,供试作物为番茄,共设置6个处理,分别为采集至青枯病发病率为12.5%、21.9%、40.0%、59.4%、83.3% 和91.6% 的田间6个处理移除番茄植株后的土壤。每个处理设置12个重复,每个盆钵装土1.5 kg,72盆盆栽按番茄全生育期所需养分量(总氮225 kg/hm2,总磷(P2O5)150 kg/hm2和总钾(K2O)225 kg/hm2)的1% 量施肥,每盆施肥量为:尿素0.52 g、重过磷酸钙3.25 g和硫酸钾0.47 g,与土拌匀作为基肥,每盆种植一株番茄,选取长势均一的种苗移栽,常规管理。在番茄移栽后40 d的花期测定番茄植株生物量,此时所有植株均未发病。
1.6 番茄生物量的统计于番茄移栽后第40天植株花期时测定番茄植株鲜物质量和干物质量。鲜物质量:采集各处理完整植株,称取植株鲜质量。干物质量:105 ℃杀青30 min,70 ℃烘干至恒量,称取植株干质量。
1.7 土壤和植株氮素含量的测定对盆栽试验前采集的初始土体土及盆栽种植40 d结束后的植株氮素含量进行测定,测定方法参照《土壤农化分析》[24]。土壤全氮(TN)采用高氯酸-硫酸消煮法结合流动分析仪(BRAN+LUEBBE AutoAnalyzer 3,下同)测定。土壤NH4+-N、NO3–-N:称取2.000 g的风干土壤样品于三角瓶中,加入20 ml 0.01 mol/L氯化钙溶液,170 r/min震荡30 min,过滤后用流动分析仪测定。植株氮素含量采用过氧化氢–硫酸消煮法结合流动分析仪测定。
1.8 植株氮素吸收效率植株氮素吸收效率=植株氮素累积量/(土壤氮素含量+氮素投入量)
1.9 数据统计与分析使用Microsoft Excel 2007对数据进行统计。用SPSS软件(20.0, SPSS Inc. Chicago, IL)进行单因素方差分析(ANOVA),用Duncan检验法来比较处理间的差异,显著性水平设定为P < 0.05。用R语言(version 3.2.0)软件对16S rDNA测序结果进行分析以及对微生物、土壤氮素含量、发病率和植株氮素吸收效率进行斯皮尔曼相关性分析,显著水平设定为P < 0.05。
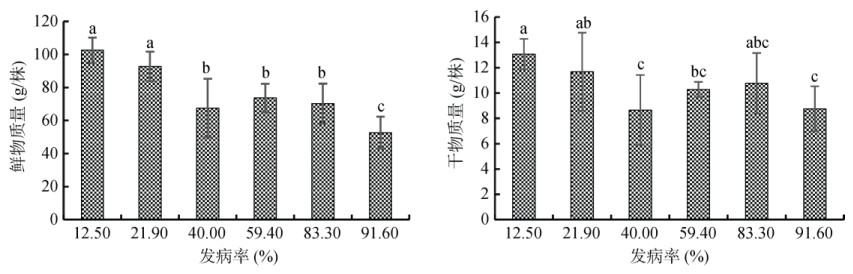
2 结果 2.1 青枯病不同发病率土壤对番茄生物量的影响青枯病不同发病率土壤对番茄植株的影响如图 1所示。不同发病率土壤对植株的鲜物质量和干物质量有显著性影响,整体上为土壤发病率越高,植株的鲜物质量和干物质量值越低,发病率91.6% 的土壤上,植株的鲜物质量和干物质量最低,平均每株干鲜物质量值仅有8.76 g和52.63 g。而发病率12.5% 的土壤上则为最高,分别达到平均每株干鲜物质量值为13.07 g和102.53 g。相比于发病率最低的土壤,发病率越高的土壤与发病率为12.5% 的土壤的植株鲜物质量差异越显著,且发病率为40.0%、59.4%、91.6% 的土壤与发病率为12.5% 的土壤的植株干物质量差异显著。
|
(图中小写字母不同表示不同处理间差异达P < 0.05显著水平,下同) 图 1 青枯病不同发病率土壤对番茄植株鲜物质量和干物质量的影响 Fig. 1 Effects of soils with different bacterial wilt disease incidences on freshand dry weights of tomato plants |
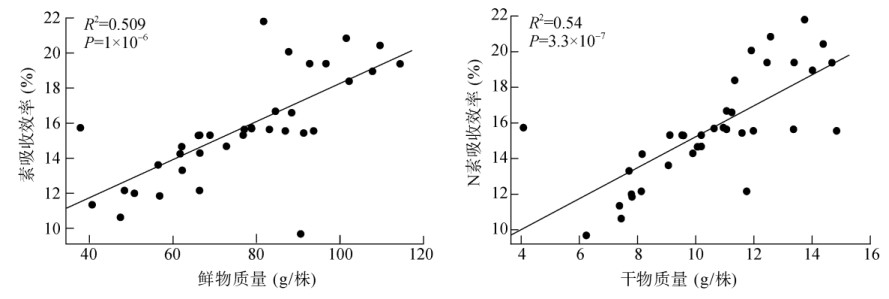
不同发病率土壤种植番茄后植株氮素吸收效率如图 2所示,发病率为12.5% 的土壤种植的番茄植株氮素吸收效率显著高于发病率为91.6% 的土壤,其余处理虽然无显著差异,但整体上体现出随土壤发病率的增加,植株氮素吸收效率下降的趋势(图 2)。氮素吸收效率与植株鲜物质量和干物质量的相关性分析表明,氮素吸收效率与植株的鲜物质量和干物质量均呈显著正相关(图 3),P值均小于0.01。

|
图 2 青枯病不同发病率土壤对植株氮素吸收效率的影响 Fig. 2 Effects of soils with different bacterial wilt disease incidences on plant N absorption efficiency |
|
图 3 植株氮素吸收效率与生物量的相关性 Fig. 3 Correlation of N absorption efficiency with plant biomass |
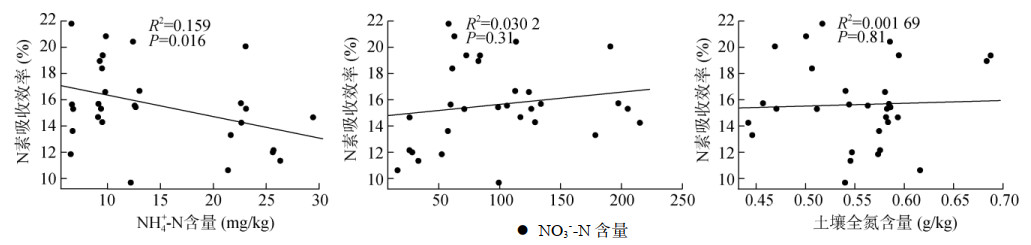
分析不同发病率土壤初始氮素含量与植株氮素吸收效率的相关性,结果表明,不同发病率土壤NH4+-N含量与植株氮素吸收效率显著负相关,P=0.016。NO3–-N和土壤全氮含量与植株氮素吸收效率间无显著相关性(图 4),P值分别为0.31和0.81。
|
图 4 不同发病率初始土壤氮素含量与植株氮素吸收效率的相关性 Fig. 4 Correlations between initial soil nitrogen content and plant nitrogen absorption efficiency of soils with different disease incidence rates |
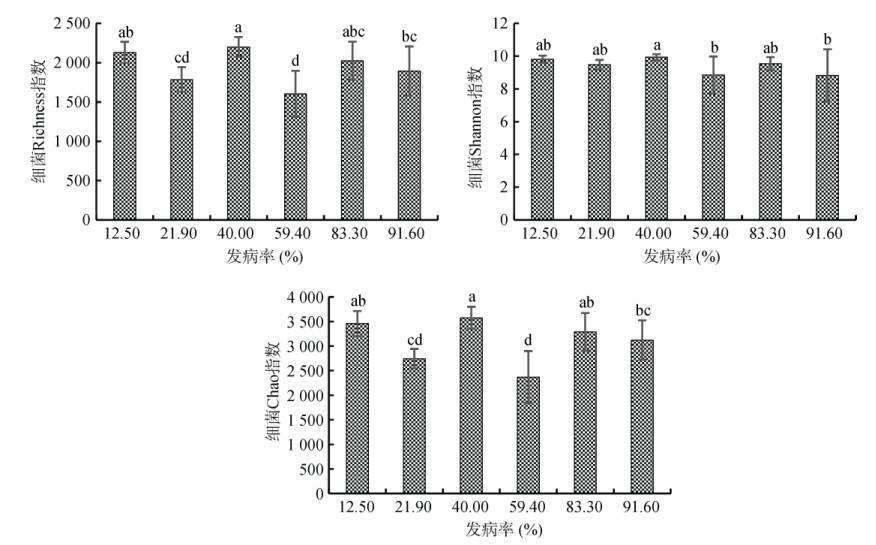
种植番茄前不同发病率土壤微生物Alpha多样性(Richness,Chao和Shannon)不同但无明显规律(图 5),进一步分析发现其与植株氮素吸收效率无显著相关性(图 6)。
|
图 5 不同发病率初始土壤细菌Alpha多样性(Richness,Chao和Shannon) Fig. 5 Initial soil bacterial alpha diversity (Richness, Chao, and Shannon) of soils with different disease incidence rates |

|
图 6 不同发病率初始土壤细菌Alpha多样性(Richness,Chao和Shannon)与植株氮素吸收效率的相关性 Fig. 6 Correlation between initial soil bacterial alpha diversity (Richness, Chao, and Shannon) and plant nitrogen absorption efficiency of soils with different disease incidence rates |
基于Bray-Curtis距离计算出不同发病率土壤初始细菌群落Beta多样性(PCoA)(图 7A)。结果表明,发病率为12.5%、40.0%、83.3%、91.6% 的处理和发病率为21.9% 和59.4% 的处理分别沿着第一轴(PCoA1)有规律地分开,而发病率为12.5%、40.0%、83.3%、91.6% 的处理分别沿着第二轴(PCoA2)有规律地分开。PCoA1轴的差异可以解释全面分析结果的27.1%,PCoA2轴的差异可以解释全面分析结果的6.4%。且第一轴(PCoA1)和第二轴(PCoA2)与植株氮素吸收效率(图 7B)间无显著性相关。

|
图 7 土壤细菌Beta多样性(A)及其与植株氮素吸收效率的相关性(B) Fig. 7 Soil bacterial beta diversity (PCoA) before planting (A) and correlations between beta diversity and plant nitrogen absorption efficiency (B) |
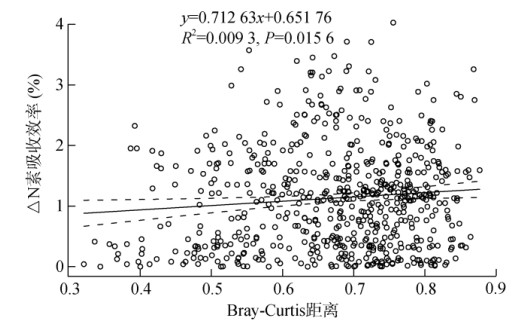
根据种植番茄前不同发病率土壤细菌群落的测序结果,计算基于OTU的群落变化与植株氮素吸收效率间的相关性,结果如图 8所示,Mental检测表明OTU的群落变化与植株氮素吸收效率有显著正相关关系。进一步从所有OTU中挑选与植株氮素吸收效率显著相关的OTU,结果如表 2所示,其中OTU39、OTU142和OTU106与氮素吸收效率呈显著负相关,这些OTU分别在属水平上归类于Gaiella、Parviterribacter和Sulfuritalea属;而OTU236、OTU2920、OTU3160和OTU2203与植株氮素吸收效率呈显著正相关,这些OTU分别属于Lysobacter、Luteimonas、Luteimonas和Lysobacter属(表 2)。
|
图 8 细菌OTU的群落变化与植物氮素吸收效率的相关性 Fig. 8 Correlation between variations of bacterial community based on OTUs and N element absorption efficiency |
|
|
表 2 与氮素吸收效率相关的关键细菌种群 Table 2 Key bacteria associated with N element absorption efficiency |
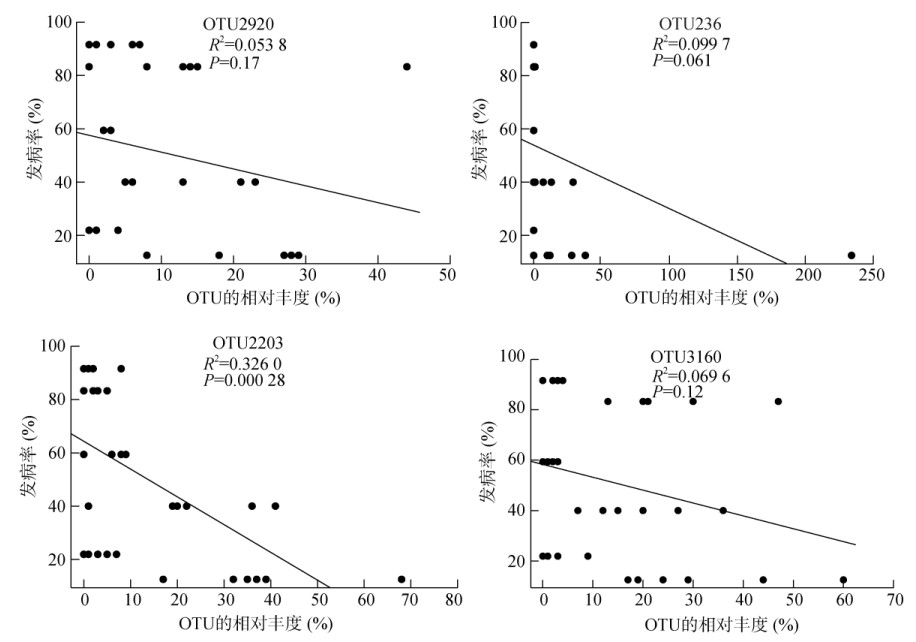
进一步探究与氮素吸收效率具显著正相关性的OTU与发病率的相关关系,结果如图 9所示,与植株氮素吸收效率呈显著正相关的OTU2203 (Lysobacter),同时与发病率呈显著负相关,P值小于0.01。
|
图 9 与氮素吸收效率显著正相关的OTU与初始发病率的相关性 Fig. 9 Correlation between OTU significantly and positively related to nitrogen uptake efficiency and initial disease incidence |
青枯病是由青枯劳尔氏菌(Ralstonia solanacearum)引起的主要发生于茄科作物(如番茄、烟草、辣椒等)的细菌性土传病害[25]。青枯病危害性较大,是严重制约农业可持续生产的主要土传病害之一。本研究利用青枯病发病率分别为12.5%、21.9%、40.0%、59.4%、83.3% 和91.6% 的土壤进行盆栽试验,探究不同发病率土壤是如何影响植株氮素吸收的。已有研究表明,连作障碍是由土壤养分失衡、有害微生物增加、土壤性质恶化、化感物质积累和微生物区系劣变等综合因素作用的结果[26]。长期连作会造成根际周围的土壤营养平衡失调,有益微生物数量降低[27],植物生长受到阻碍,导致作物减产[28-34]。本研究通过在不同发病率土壤中种植番茄后对植株生物量和氮素吸收效率进行测定,结果显示青枯病发病率越高的土壤植株长势越差,且发病率越高的土壤植株干鲜重越低,植株的氮素吸收效率也越低,即高发病率土壤中的植株长势差,生物量低,植株氮素吸收能力差,这和已有的研究一致。阮维斌等[35]研究发现大豆连作障碍导致大豆生物量下降,养分吸收总量显著降低,固氮作用减弱,植株黄化等。本研究也表明了植株氮素吸收效率与植株的干鲜物质量呈显著正相关,植株的氮素吸收效率越高,植株的长势越好。
在探究番茄植株在不同发病率土壤下影响植株氮素吸收效率的因素时,对种植番茄前的初始土壤提取土壤DNA进行高通量测序,同时测定初始土壤氮素含量。结果表明,并非初始土壤氮素含量越高,植株氮素吸收效率越高。影响植株氮素吸收效率的理化因素有多种,土壤氮磷比、碳氮比等都会影响植株的氮素吸收效率[36-37],本研究并没有发现土壤氮素含量与植株的氮素吸收效率间的正相关关系。
进一步在研究土壤初始微生物区系与番茄植株氮素吸收效率的关系时发现,初始土壤细菌群落的Alpha多样性和Beta多样性与植物氮素吸收效率均无显著相关性。土壤微生物在土壤为植物提供养分过程中起着关键作用,它是陆地生态系统植物多样性和生产力的重要驱动者[38],本研究发现细菌群落多样性指标与植株氮素吸收效率无显著相关性。但从PCoA分析发现,不同发病率的供试土壤具有不同的细菌群落组成,这证实了不同健康程度的土壤具有不同的细菌群落多样性[39],且已有研究表明了有益细菌类群在防控青枯病发生和促进植株生长方面的联合效应[40],推测土壤微生物群落中的某些关键细菌类群的差异,造成了植株的氮素吸收效率的差异。从细菌群落中的7 424个OTU中筛选出与植株氮素吸收效率显著相关的OTU,结果显示,OTU236、OTU2920、OTU3160、OTU2203与氮素吸收效率呈显著正相关,他们分别属于溶杆菌属(Lysobacter)、藤黄单胞菌属(Luteimonas)、藤黄单胞菌属(Luteimonas)、溶杆菌属(Lysobacter)。在与氮素吸收效率显著正相关的微生物中,进一步发现OTU2203(溶杆菌属)同时也与发病率呈负相关。研究表明,溶杆菌属细菌对真菌、革兰氏阴性细菌、革兰氏阳性细菌均有明显的拮抗作用,与其他生防菌相比,溶杆菌属细菌能够分泌几丁质酶、β-1, 3-葡聚糖酶等多种胞外酶,该酶通过水解病原菌细胞壁抑制其增殖,从而提高植物的抗真菌能力[41]。同时溶杆菌属也能分泌活性小分子物质、生物表面活性剂、抗生素等来抑制病原菌的生理生化过程,从而达到对病原菌的拮抗效果[42]。溶杆菌属因其高效、广谱的拮抗作用,现已成为植物病害生防微生物的重要组成部分[43]。此外,藤黄单胞菌属也对大肠杆菌、金黄色葡萄球菌、铜绿假单胞菌等均具有一定的抗性,但对真菌没有抗性[44]。目前已有研究表明有复合菌剂在盆栽试验条件下能对番茄青枯病有抑制效果,同时也能促进番茄植株的生长[45],本研究的结果与此一致。而溶杆菌属和藤黄单胞菌属是如何同时影响植株抗病和氮素吸收效率的,以及其在二者之间的作用机制还有待研究。
4 结论本研究表明,随着初始土壤番茄青枯病发病率的逐渐升高,番茄植株长势越来越差,且植株的氮素吸收效率也越来越低,初始土壤的全氮、铵态氮和硝态氮含量与植株的氮素吸收效率无显著正相关。在初始土壤的细菌群落方面,多样性和群落组成与植株的氮素吸收效率无显著性相关性,但基于OTU的细菌群落变化与植物氮素吸收效率呈显著相关性,与番茄植株氮素吸收效率呈显著正相关的OTUs分别归属于溶杆菌属(OTU236和OTU2203)和藤黄单胞菌属(OTU2920和OTU3160),其中溶杆菌属的细菌OTUs同时与初始土壤青枯病发病率呈负相关。
| [1] |
Richard C. Bacterial wilt disease and the Ralstonia solanacearum species complex[J]. Plant Pathology, 2006, 55(2): 308-309 DOI:10.1111/j.1365-3059.2006.01387.x (  0) 0) |
| [2] |
番茄青枯病生物防治研究进展[J]. 江苏农业科学, 2013, 41(8): 131-134 DOI:10.3969/j.issn.1002-1302.2013.08.050 (  0) 0) |
| [3] |
加工番茄连作对土壤理化性状及微生物量的影响[J]. 土壤学报, 2016, 53(2): 533-542 (  0) 0) |
| [4] |
Shen Z Z, Penton C R, Lv N, et al. Banana Fusarium wilt disease incidence is influenced by shifts of soil microbial communities under different monoculture spans[J]. Microbial Ecology, 2018, 75(3): 739-750 DOI:10.1007/s00248-017-1052-5 (  0) 0) |
| [5] |
黄瓜连作对土壤理化性状及生物活性的影响研究[J]. 中国生态农业学报, 2006, 14(2): 119-121 (  0) 0) |
| [6] |
基于三七连作障碍的土壤理化性状及酶活性研究[J]. 生态环境学报, 2015, 24(3): 409-417 (  0) 0) |
| [7] |
刘星. 甘肃中部沿黄灌区马铃薯连作障碍机理及防控技术初探[D]. 兰州: 甘肃农业大学, 2015.
(  0) 0) |
| [8] |
Mendes R, Kruijt M, de Bruijn I, et al. Deciphering the rhizosphere microbiome for disease-suppressive bacteria[J]. Science, 2011, 332(6033): 1097-1100 DOI:10.1126/science.1203980 (  0) 0) |
| [9] |
Adesemoye A O, Torbert H A, Kloepper J W. Enhanced plant nutrient use efficiency with PGPR and AMF in an integrated nutrient management system[J]. Canadian Journal of Microbiology, 2008, 54(10): 876-886 DOI:10.1139/W08-081 (  0) 0) |
| [10] |
Pii Y, Mimmo T, Tomasi N, et al. Microbial interactions in the rhizosphere: Beneficial influences of plant growth-promoting rhizobacteria on nutrient acquisition process. A review[J]. Biology and Fertility of Soils, 2015, 51(4): 403-415 DOI:10.1007/s00374-015-0996-1 (  0) 0) |
| [11] |
植物文化在住宅区园林景观植物配置中的重要性研究[J]. 现代园艺, 2020, 43(23): 66-68 DOI:10.3969/j.issn.1006-4958.2020.23.025 (  0) 0) |
| [12] |
植物营养学[M].
高等教育出版社, 北京, 2006
(  0) 0) |
| [13] |
植物生理学(2版)[M].
科学出版社, 北京, 2011
(  0) 0) |
| [14] |
氮素与植物生长相关研究进展[J]. 东北农业大学学报, 2013, 44(4): 144-148 DOI:10.3969/j.issn.1005-9369.2013.04.026 (  0) 0) |
| [15] |
连作对花生土壤酶活性、养分含量和植株产量的影响[J]. 土壤, 2018, 50(3): 491-497 (  0) 0) |
| [16] |
连作对大蒜土壤养分、微生物结构和酶活的影响[J]. 中国农业科技导报, 2019, 21(1): 141-147 (  0) 0) |
| [17] |
微生物多样性对土壤氮磷钾转化、酶活性及油菜生长的影响[J]. 生态学报, 2016, 36(18): 5856-5864 (  0) 0) |
| [18] |
土壤微生物在植物获得养分中的作用[J]. 生态学报, 2015, 35(20): 6584-6591 (  0) 0) |
| [19] |
中国土壤氮素研究[J]. 土壤学报, 2008, 45(5): 778-783 DOI:10.3321/j.issn:0564-3929.2008.05.003 (  0) 0) |
| [20] |
Caporaso J G, Lauber C L, Walters W A, et al. Global patterns of 16S rRNA diversity at a depth of millions of sequences per sample[J]. Proceedings of the National Academy of Sciences of the United States of America, 2011, 108(Suppl 1): 4516-4522 (  0) 0) |
| [21] |
Kozich J J, Westcott S L, Baxter N T, et al. Development of a dual-index sequencing strategy and curation pipeline for analyzing amplicon sequence data on the MiSeq Illumina sequencing platform[J]. Applied and Environmental Microbiology, 2013, 79(17): 5112-5120 DOI:10.1128/AEM.01043-13 (  0) 0) |
| [22] |
Edgar R C. UPARSE: highly accurate OTU sequences from microbial amplicon reads[J]. Nature Methods, 2013, 10(10): 996-998 DOI:10.1038/nmeth.2604 (  0) 0) |
| [23] |
Wang Q, Garrity G M, Tiedje J M, et al. Naive Bayesian classifier for rapid assignment of rRNA sequences into the new bacterial taxonomy[J]. Applied and Environmental Microbiology, 2007, 73(16): 5261-5267 DOI:10.1128/AEM.00062-07 (  0) 0) |
| [24] |
土壤农化分析[M].
中国农业出版社, 北京, 1999
(  0) 0) |
| [25] |
硅介导番茄青枯病抗性的土壤定量蛋白质组学研究[J]. 土壤学报, 2015, 52(1): 162-173 (  0) 0) |
| [26] |
作物连作障碍的克服——难解的问题[J]. 中国农业科学, 2016, 49(5): 916-918 (  0) 0) |
| [27] |
土壤强还原处理对三七连作障碍因子及再植三七生长的影响[J]. 土壤学报, 2019, 56(3): 703-715 (  0) 0) |
| [28] |
Kelderer M, Manici L M, Caputo F, et al. Planting in the 'inter-row' to overcome replant disease in apple orchards: A study on the effectiveness of the practice based on microbial indicators[J]. Plant and Soil, 2012, 357(1/2): 381-393 (  0) 0) |
| [29] |
Li C G, Li X M, Kong W D, et al. Effect of monoculture soybean on soil microbial community in the Northeast China[J]. Plant and Soil, 2010, 330(1/2): 423-433 (  0) 0) |
| [30] |
Urashima Y, Sonoda T, Fujita Y, et al. Application of PCR-denaturing-gradient gel electrophoresis (DGGE) method to examine microbial community structure in Asparagus fields with growth inhibition due to continuous cropping[J]. Microbes and Environments, 2012, 27(1): 43-48 DOI:10.1264/jsme2.ME11222 (  0) 0) |
| [31] |
Yang J I, Ruegger P M, McKenry M V, et al. Correlations between root-associated microorganisms and peach replant disease symptoms in a California soil[J]. PLoS One, 2012, 7(10): e46420 DOI:10.1371/journal.pone.0046420 (  0) 0) |
| [32] |
Yim B, Smalla K, Winkelmann T. Evaluation of apple replant problems based on different soil disinfection treatments—links to soil microbial community structure?[J]. Plant and Soil, 2013, 366(1/2): 617-631 (  0) 0) |
| [33] |
Zhang Y T. Identification and characterization of a Bacillus subtilis strain TS06 as bio-control agent of strawberry replant disease (Fusarium and Verticilium wilts)[J]. African Journal of Biotechnology, 2012, 11(3): 570-580 DOI:10.5897/ajb11.1131 (  0) 0) |
| [34] |
苹果连作障碍研究进展[J]. 园艺学报, 2017, 44(11): 2215-2230 (  0) 0) |
| [35] |
连作障碍因素对大豆养分吸收和固氮作用的影响[J]. 生态学报, 2003, 23(1): 22-29 DOI:10.3321/j.issn:1000-0933.2003.01.004 (  0) 0) |
| [36] |
氮磷配施对小麦植株氮素利用率的影响[J]. 农业科技通讯, 2020(12): 48-51 DOI:10.3969/j.issn.1000-6400.2020.12.018 (  0) 0) |
| [37] |
土壤C/N对苹果植株生长及氮素利用的影响[J]. 中国生态农业学报, 2013, 21(7): 795-800 (  0) 0) |
| [38] |
van der Heijden M G A, Bardgett R D, van Straalen N M. The unseen majority: Soil microbes as drivers of plant diversity and productivity in terrestrial ecosystems[J]. Ecology Letters, 2008, 11(3): 296-310 DOI:10.1111/j.1461-0248.2007.01139.x (  0) 0) |
| [39] |
Matson P A, Parton W J, Power A G, et al. Agricultural intensification and ecosystem properties[J]. Science, 1997, 277(5325): 504-509 DOI:10.1126/science.277.5325.504 (  0) 0) |
| [40] |
Li S T, He P, Jin J Y. Nitrogen use efficiency in grain production and the estimated nitrogen input/output balance in China agriculture[J]. Journal of the Science of Food and Agriculture, 2013, 93(5): 1191-1197 DOI:10.1002/jsfa.5874 (  0) 0) |
| [41] |
Postma J, Stevens L H, Wiegers G L, et al. Biological control of Pythium aphanidermatum in cucumber with a combined application of Lysobacter enzymogenes strain 3.1T8 and chitosan[J]. Biological Control, 2009, 48(3): 301-309 DOI:10.1016/j.biocontrol.2008.11.006 (  0) 0) |
| [42] |
溶杆菌属细菌鉴定及生防机制概况[J]. 西北农林科技大学学报(自然科学版), 2015, 43(5): 174-182, 191 (  0) 0) |
| [43] |
胶状溶杆菌OH17菌株遗传操作系统的构建[J]. 南京农业大学学报, 2017, 40(4): 649-654 (  0) 0) |
| [44] |
李广宁. 一株产抗藤黄单胞菌的鉴定及其特性研究[D]. 沈阳: 沈阳药科大学, 2009.
(  0) 0) |
| [45] |
复合菌剂对番茄抗病促生的效果研究[J]. 生态环境学报, 2012, 21(11): 1836-1840 DOI:10.3969/j.issn.1674-5906.2012.11.011 (  0) 0) |
 2022, Vol. 54
2022, Vol. 54


