2. 土壤与农业可持续发展国家重点实验室(中国科学院南京土壤研究所), 南京 210008;
3. 中国科学院大学, 北京 100049
随着纳米技术的发展和纳米材料的大量使用,纳米颗粒(NPs)向环境中的排放量也日益增加[1]。土壤作为生产生活的主要场所和连接各圈层的关键生态系统,大量的纳米颗粒会通过多种直接途径(例如农业应用、大气沉降、环境修复)或间接途径(例如污水灌溉、污泥农用、畜禽粪便)进入土壤中,不仅对土壤生态和植物生长造成危害,并通过进一步的迁移进入到深层土壤中,污染作为重要饮用水来源的地下水[2-3]。因此,揭示NPs在土壤环境中的迁移规律及其影响因素,对于全面了解NPs在生态环境中的行为、归趋和风险具有重要意义。
大量研究表明NPs进入土壤环境后,其迁移规律受NPs本身的性质和环境因素共同影响[4-5]。纳米颗粒在多孔介质中的迁移与介质的表面性质密切相关,表面光滑的多孔介质对NPs的持留明显降低,天然有机质的存在也一定程度上可以提高纳米颗粒的迁移性[6]。而在真实的土壤环境中,生物膜和土壤矿物是决定其表面化学性质的主要因素。生物膜在土壤等界面环境中广泛存在[7],是一种复杂并高度结构化的微生物聚集体,并能够分泌大量的含有多糖和蛋白等成分的胞外聚合物(EPS),不仅能够影响土壤等环境介质的表面特性,而且还会改变渗透率和流动模式等水力条件[8]。黏土矿物和金属氧化物等土壤矿物是土壤的重要组成部分[9],其大量的存在和良好的表面性质,决定其与进入土壤的NPs具有强烈的相互作用。而目前对于生物膜和土壤矿物对NPs在土壤中迁移过程的影响及其机制尚不清楚。
由于土壤组成复杂,异质性极强,通过实地土壤难以对物质的迁移进行单因素分析和机制研究,而洁净的石英砂等多孔介质与土壤结构相似,通常用于模拟研究NPs的迁移和传输过程[10]。因此,本研究中,在传统多孔介质填充柱的基础上,通过添加生物膜和土壤矿物,构建更加接近真实土壤环境的模拟研究装置,并选择目前被广泛应用的氧化锌(ZnO NPs)、氧化铈(CeO2 NPs)和氧化铁(Fe2O3 NPs)3种典型金属氧化物纳米颗粒作为主要研究对象,旨在研究不同类型、浓度和粒径的NPs在饱和多孔介质中的传输规律和影响因素,并采用经典的DLVO理论探讨其迁移过程中的能量变化和驱动机制,重点揭示生物膜和土壤矿物对纳米颗粒迁移行为的影响及其机制。本研究有助于进一步认识NPs在多孔介质中的迁移规律和影响机制,对于深入理解和评估NPs在土壤中的环境行为和生态风险具有重要意义。
1 材料与方法 1.1 纳米颗粒和矿物表征为研究纳米颗粒的种类和粒径对其迁移的影响,分别采用报告粒径为20 ~ 50 nm(CeO2 NP20)、< 50 nm(CeO2 NP50)和 < 100 nm(CeO2 NP100)的氧化铈纳米颗粒,以及粒径为50 nm的氧化锌纳米颗粒(ZnO NP50)和粒径为30 nm的氧化铁纳米颗粒(Fe2O3 NP30)。为研究土壤矿物对纳米颗粒迁移的影响,选用针铁矿和蒙脱石这两种土壤中典型的氧化物矿物和黏土矿物。所有的纳米颗粒和土壤矿物均由上海阿拉丁试剂公司提供。通过透射电子显微镜(TEM,JEM 2100F,日本)测定这些材料的形貌和粒径大小,NPs的ζ电位和水动力学直径使用纳米粒度仪(Nano ZS90,马尔文,英国)测定。所有纳米颗粒需配制浓度为100 mg/L的悬浮液备用,具体方法为:准确称量0.1 g的纳米颗粒溶于1 L超纯水中,然后超声处理(100 W,25 kHz,25 ℃)30 min,得到较稳定的纳米颗粒悬浮液。
1.2 含生物膜、EPS和矿物的多孔介质填充材料制备将高纯度的石英砂(16 ~ 30目,阿拉丁)用不同孔径的筛子过筛,从中获取20 ~ 30目的石英砂。将石英砂浸泡在5% 的稀HNO3溶液中30 min,并适当搅拌以去除其中的有机质,然后用去离子水将石英砂清洗干净,放入高压灭菌锅(121 ℃)中灭菌30 min,最后将其放入无菌的电解质溶液(10 mmol/L KCl)中密封备用。
铜绿假单胞菌(CGMCC 1.50)购置于中国科学院微生物研究所,严格参照说明书要求对细菌进行激活处理,然后挑选单个菌落接种至LB液体培养基中并在恒温培养箱中(37 ℃,200 r/min)暗培养24 h。将灭菌的石英砂放入LB培养基中,然后接种1 ml已培养的铜绿假单胞菌悬浮液暗培养24 h,让生物膜均匀附着生长在石英砂表面,待生长完成后,将石英砂紧密填充至迁移柱中。为了让生物膜更多地生长在石英砂表面,将稀释3倍的LB培养基用蠕动泵通入已填充好的柱子中(0.6 ml/min,12 h,37 ℃),并每隔一段时间将蠕动方向调换。当生物膜生长完成后,用10 mmol/L KCl电解质溶液将填充柱内的松散物质洗脱20 min(4 ml/min)。
为了解生物膜中EPS对纳米颗粒运输的影响,制备附着EPS的石英砂进行迁移试验。首先将所培养的细菌在40 kHz条件下超声10 min,再离心(5 000 g,4 ℃)15 min去除细菌,将上清液收集并高速离心(12 000 g,4 ℃)30 min以去除细胞残体。然后收集上清液并与其3倍体积的无水乙醇混合均匀,放入4 ℃冰箱中静置3 d,通过高速离心获取底部沉淀即为EPS粗提取物。将沉淀在截留分子量8 000 D的透析袋中用超纯水透析3 d,获取纯净的EPS。最后将灭菌的石英砂和提取的EPS充分混合24 h,以获取含有EPS涂层的石英砂。
为了让土壤矿物能够更多地附着在石英砂表面,将500 g/L的土壤矿物悬浮液与石英砂在30 ℃的恒温培养箱中混合放置3 d,待附着完成后用去离子水反复冲洗去除石英砂表面松散的土壤矿物,然后进行填充以获取含矿物涂层的石英砂填充柱。
1.3 饱和填充柱迁移试验采用定制的PVC管作为迁移的填充柱,其长度和直径分别为13和1.4 cm。根据填充介质将迁移试验分为4组:①纯石英砂;②含EPS石英砂;③含生物膜石英砂;④含土壤矿物石英砂。在所有迁移试验之前要先进行填充柱孔隙度的测量。将洗净烘干的石英砂紧密填充于填充柱中,通过蠕动泵缓慢由下至上用去离子水饱和填充柱,并通过计算进入填充柱中去离子水的体积获得填充柱的孔隙体积,确定填充柱孔隙度。填充完成的柱子用KCl(10 mmol/L,pH=7)电解质溶液在1 ml/min的条件下平衡15 PV,并将3.6 PV的纳米颗粒悬浮液(50 mg/L,10 mmol/L KCl,pH=7)以1 ml/min的流速注入填充柱中,最后用3.6 PV的KCl(10 mmol/L)电解质溶液洗脱。所有的流出液每2 ml采集一次,使用紫外分光光度计监测流出液的浓度。
为了定量比较不同条件下纳米颗粒在多孔介质中的沉积动力学,使用以下公式确定沉积速率系数(kd)[8]:
| $ {k_d} = - \frac{v}{{\theta L}}\ln \frac{C}{{{C_0}}} $ | (1) |
式中:v为流速(m/s);θ为孔隙度;L为多孔介质长度(m);C为出水样品中纳米颗粒浓度(mg/L);C0为进水纳米颗粒浓度(mg/L);C/C0为归一化穿透浓度,可以从穿透曲线的平台得到。
使用经典的DLVO理论计算了纳米颗粒与石英砂表面的相互作用能曲线,该理论将带电表面之间的相互作用电势描述为双电层(EDL)和范德华(VDW)相互作用的总和。在本次研究中,总的相互作用能,即VDW和EDL相互作用的总和,是通过将纳米颗粒-石英砂系统视为球-板相互作用来确定的。使用纳米颗粒和石英砂的ζ电位代替相应的表面电位。计算公式如下[11]:
| $ {\Phi _{{\text{DLV0}}}}(h) = {\Phi _{{\text{vdw}}}}{\text{(}}h{\text{) + }}\Phi {\text{dl(}}h{\text{)}} $ | (2) |
| $ {\Phi _{{\text{vdw}}}}(h) = - \frac{{{A_{123}}{r_p}}}{{6h}}{\left[ {1 + \frac{{14h}}{{\text{λ }}}} \right]^{ - 1}} $ | (3) |
| $ {\Phi _{{\text{dl}}}}(h) = \pi {\varepsilon _0}{\varepsilon _r}\left\{ {2{\Psi _p}{\Psi _s}\ln \left[ {\frac{{1 + \exp ( - kh)}}{{1 - \exp ( - kh)}}} \right] + \left( {\Psi _p^2 + \Psi _s^2} \right)\ln \left[ {1 - \exp ( - 2kh)} \right]} \right\} $ | (4) |
式中:Φdl和Φvdw分别代表静电和范德华相互作用能(kT);h是NPs和石英砂之间的分离距离(m);ε0是真空的介电常数,8.854 × 10–12 C/(V·m);εr是水的介电常数,78.5(无量纲);k是Debye屏蔽长度;ψp和ψs分别是NPs和石英砂的表面电位(V)。A123是NPs-水-石英砂的Hamaker常数,Debye长度(k)和A123计算如下:
| $ {A_{123}} = \left( {\sqrt {{A_{11}}} - \sqrt {{A_{22}}} } \right)\left( {\sqrt {{A_{33}}} - \sqrt {{A_{22}}} } \right) $ | (5) |
| $ k = {\left( {\frac{{2{I_S}{N_A}1000{e^2}}}{{{\varepsilon _r}{\varepsilon _0}{k_B}T}}} \right)^{\frac{1}{2}}} $ | (6) |
式中:A11是NPs的Hamaker常数(CeO2 NPs 1.84×10−21,ZnO NPs 9.21×10−20,Fe2O3 NPs 10×10−20)[12-13],A33是石英砂的Hamaker常数(6.50×10−20),A22是水的Hamaker常数(4.9×10–20)[14]。IS是背景溶液的离子强度;NA是阿伏加德罗常数(6.02×1023);e是电子电荷(1.602×10–19 C);kB是玻尔兹曼常数(1.38×10–23 J/K);T是绝对温度(298 K)。
1.4 生物膜和土壤矿物对纳米颗粒的吸附聚集为了探究生物膜对ZnO NPs的吸附作用,通过提取铜绿假单胞菌生物膜进行吸附试验。将活化的细菌用LB培养基在恒温培养箱(37 ℃,200 r/min)中培养48 h后,以3 000 r/min的速度离心10 min,去掉上清液,加入超纯水分散后以相同条件离心5次,获取较为纯净的生物膜。将生物膜和ZnO NPs的混合悬浮液在恒温振荡培养箱(25 ℃,200 r/min)中黑暗培养2 h。每隔5 min吸取5 ml样品,并立即用0.45 μm醋酸纤维滤膜将未吸附的ZnO NPs和生物膜分离。用紫外分光光度计(UV 2100,岛津,日本) 在375 nm处测定样品的吸光度值,通过ZnO NPs的标准曲线计算出纳米颗粒的浓度。通过与纳米颗粒添加量相比,计算出生物膜的吸附效率。
为了研究土壤矿物对NPs的吸附作用,进行了ZnO NPs和针铁矿/蒙脱石的共沉降试验。ZnO NPs和土壤矿物的浓度分别为50和100 mg/L,并且以10 mmol/L KCl(pH=7)作为背景溶液。将悬浮液超声(10 min,120 kHz)后迅速将混合液转移至石英皿中,使用紫外分光光度计在375 nm处每5 min监测一次吸光度值,总共监测2 h。累积沉降曲线的吸光度值为纳米颗粒和土壤矿物悬浮液单独沉降的吸光度值之和。通过归一化处理吸光度(At/A0)建立与时间(t)关系的曲线。沉降曲线采用以下指数模型拟合[15]:
| $ y = {\text{O}}{{\text{D}}_{{\text{plateau}}}} + {\text{O}}{{\text{D}}_1}\exp ( - {R_0}t) $ | (7) |
式中:ODplateau和OD1分别代表沉降曲线到达平稳时At/A0的值和At/A0的减少值;R0为沉降速率。累积沉降曲线的吸光度值为ZnO NPs和土壤矿物悬浮液单独沉降的吸光度值之和。△OD1为共沉降OD1减去累积沉降OD1,△OD1为正则表示异质聚集有利于共沉降,为负则不利于共沉降。
2 结果与讨论 2.1 纳米颗粒和填充介质表征通过TEM对NPs的形貌和尺寸进行观测(图 1),结果表明NPs主要为不规则的球形颗粒,分散不均匀,团聚现象较为明显。通过Nano-Measure软件测量大于200个颗粒的平均粒径(表 1),测得的实际粒径均小于报告粒径。通过动态光散射(DLS)分析出NPs在10 mmol/L NaNO3背景溶液中的平均水动力学直径,其远大于对应NPs的实际粒径,从TEM图像可以证实其主要归因于纳米颗粒的聚集。大量研究表明,ζ电位是控制胶体稳定性的重要参数,并且NPs的表面电荷对其在石英砂介质中的传输和沉积起着重要作用[10]。因此,在相同实验传输条件下测定了颗粒的ζ电位,测得纯净石英砂的ζ电位为–28.70 mV;而对于不同纳米颗粒而言,除了Fe2O3 NPs的ζ电位为正,其余NPs的ζ电位均为负(表 1),ZnO NPs的ζ电位其负值相对较大,CeO2 NPs的ζ电位其负值随粒径的增大而增大。

|
图 1 不同纳米颗粒的TEM图像 Fig. 1 TEM images of different nanoparticles |
|
|
表 1 纳米颗粒的表征 Table 1 Characterization of nanoparticles |
通过干净石英砂填充柱试验获得了ZnO、CeO2和Fe2O3纳米颗粒在饱和多孔介质的穿透曲线(图 2A)。发现ZnO NPs的稳定突破平台远远大于Fe2O3 NPs和CeO2 NPs,ZnO NPs其稳定平台C/C0最高达到0.92,Fe2O3 NPs和CeO2 NPs稳定平台C/C0仅为0.07 ~ 0.25。ZnO NPs在2 PV穿透体积时才进入稳定穿透平台,且其平台稳定性较好,而Fe2O3 NPs和CeO2 NPs在1.5 PV时就达到了稳定穿透平台,但其在稳定平台的C/C0变动较大。因此,纳米颗粒的类型是影响其在环境介质中迁移性的重要因素。3种不同粒径的CeO2 NPs在饱和多孔介质中的传输(图 2A)结果发现,粒径较大的CeO2 NPs反而更容易流出,其稳定平台也相对较高。由于纳米颗粒的尺寸很小,因此纳米颗粒在传输过程中会受到布朗运动影响,布朗运动将随着纳米颗粒尺寸的减小而增加,这可能会增加纳米颗粒在传输介质表面碰撞的概率,从而促进较小粒径纳米颗粒在多孔介质中的沉积[16]。
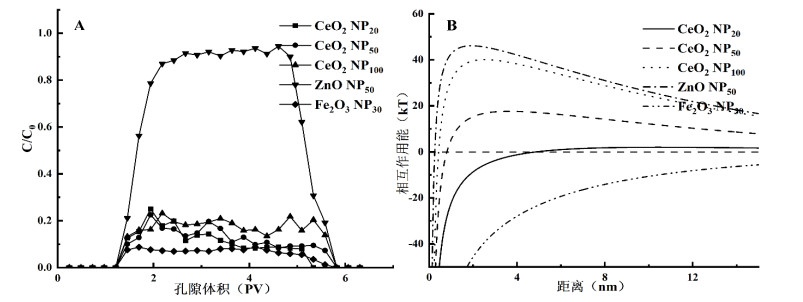
|
图 2 不同纳米颗粒的穿透曲线(A)和DLVO相互作用能曲线(B) Fig. 2 Penetration profiles (A) and DLVO interaction energy profiles (B) of different nanoparticles |
同时计算了不同类型和粒径的纳米颗粒迁移的沉积速率(kd,图 3),其结果与穿透曲线具有很好的一致性。对于不同粒径的CeO2 NPs,其kd随着粒径的增大而显著减小,不同种类NPs的kd差异性显著,CeO2 NPs、ZnO NPs和Fe2O3 NPs分别为15.22、0.62和18.96。进一步对纳米颗粒与石英砂表面进行了DLVO相互作用能分析(图 2B),结果能很好地解释不同纳米颗粒在饱和多孔介质中传输的异质性。ZnO NPs相互作用能最高,其最大势垒(Φmax)为46.10 kT,因此其与介质的排斥力强,克服ZnO NPs被结合在介质中不需要较强的能量,因此ZnO NPs在饱和介质中有较好的迁移潜力。而Fe2O3 NPs表面为正电荷,与填充介质间具有较强的静电吸引,其相互作用能很低,极易被吸附在石英砂介质表面,因此表现出较差的迁移性。对于不同粒径的CeO2 NPs,粒径较大的CeO2 NPs的Φmax相对较高,因此它与石英砂间的相互作用斥力更强,更有利于其在饱和多孔介质中的传输,这一结果恰好也与图 2A中的穿透结果一致。通过表 1可以看出粒径较小的CeO2 NPs有较低的表面电位,其间的静电斥力较小,因此拥有更强的聚集和结合能力,能够形成较大的颗粒,减少其在介质中的传输。
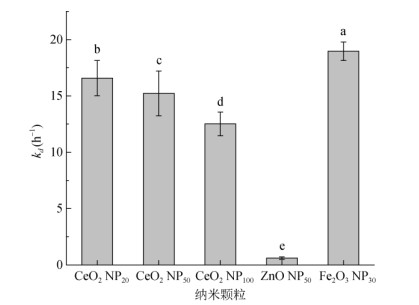
|
(图中小写字母不同表示不同纳米颗粒间差异显著(P < 0.05,n= 3)) 图 3 不同纳米颗粒的沉积速率 Fig. 3 Deposition rates of different nanoparticles |
进一步测定了ZnO NPs在不同浓度和离子强度背景溶液下的穿透曲线(图 4)。当NPs通入石英砂填充柱之前,检查了硝酸钾示踪剂的穿透行为,示踪剂大约在1.3 PV时能够被监测到,在2 PV时达到稳定平台,并且示踪剂的平台曲线非常稳定,表明多孔介质的填充效果和孔隙性较好,示踪剂能在多孔介质中完全穿透[8]。C/C0相对稳定平台能直观反映NPs悬浮液穿透曲线的突破情况,平台越高则传输量越高,反之则低。ZnO NPs在10 mmol/L KCl溶液中以1 ml/min流速下获得了不同浓度ZnO NPs穿透曲线。与示踪剂相比,在2.18 PV时ZnO NPs才基本达到稳定平台,因此,在运输的前期,ZnO NPs在多孔介质中的迁移均受到了较强的阻滞,但最大C/C0为0.99,表明ZnO NPs在多孔介质中具有较好的迁移能力。不同浓度纳米颗粒悬浮液相比,浓度越高其稳定平台越高,当浓度上升为100 mg/L时,其平台C/C0稳定在0.96附近。但是,在初始穿透时,20、50和100 mg/L浓度的纳米颗粒C/C0为0.46、0.21和0.10,浓度越低其C/C0反而越高。这可能是因为高浓度纳米颗粒更容易团聚,因此在开始阶段更容易滞留在介质中,其C/C0较低,但当滞留达到饱和后,滞留的纳米颗粒量在高浓度纳米颗粒溶液中所占比例相比低浓度纳米颗粒溶液较小,因此其稳定平台较高。

|
图 4 ZnO NPs在不同浓度(A)和离子强度(B)下的穿透曲线 Fig. 4 Penetration curves of ZnO NPs at different concentrations (A) and ionic strengths (B) |
进一步研究了离子强度(0.1 ~ 10 mmol/L KCl)对ZnO NPs在饱和多孔介质中迁移行为(图 4B),结果表明ZnO NPs的稳定突破平台随离子强度的增加而降低,这与以前一些研究者的结果一致。例如,在NaCl和CaCl2电解质溶液中,当离子强度值大于0.1 mmol/L时,TiO2 NPs的kd值随离子强度值的增加而增加,而对于NaCl溶液中小于0.1 mmol/L时,kd值基本上与离子强度无关[17]。据报道,胶体表面电荷对纳米颗粒的沉积起着非常重要的作用[18],因此我们测定了不同离子强度下ZnO NPs的ζ电位结果(图 5A),可以发现在KCl浓度高于0.1 mmol/L时,随着离子强度升高,ZnO NPs的ζ电位负值显著降低。根据DLVO理论,增加溶液的离子强度可以压缩双电层,从而减小纳米颗粒和多孔介质之间的静电斥力,同时随着离子强度的增加,纳米颗粒之间的排斥力降低,使其更加易于团聚,从而减少在多孔介质中的迁移。因此,离子强度增加对纳米颗粒表面电荷的影响可能是造成其在多孔介质中滞留增加的主要原因[19]。
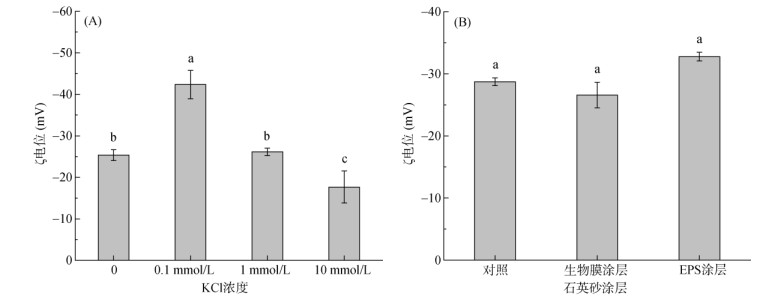
|
(图中小写字母不同表示处理间差异显著(P<0.05)) 图 5 不同离子强度下ZnO NPs(A)和不同表面涂层的石英砂(B)的ζ电位 Fig. 5 ζ potentials of ZnO NPs with different ionic strengths (A) and quartz sand with different surface coatings (B) |
为了探究生物膜和土壤矿物对纳米颗粒传输的影响,通过改变石英砂颗粒的表面涂层进行传输试验,获得了ZnO NPs在不同涂层多孔介质中的穿透曲线(图 6A)。结果表明,在生物膜、EPS和矿物等不同涂层的饱和介质中,ZnO NPs通过色谱柱的突破时间均与示踪剂相似,均在1.5 PV处,表明不同表面涂层对饱和多孔介质的流体动力学性质影响较小。有研究表明,生物膜的形成会引起色谱柱堵塞,从而导致系统流体动力学的改变[20-21]。但在本研究的系统中并没有观察到如此显著的效果,这可能与填充柱制备的方法有关。虽然填充柱中大量生长的生物膜会对NPs传输有影响,但是在相对较高的进水流速和较大孔隙条件下,系统的流体动力学基本不变,不同涂层多孔介质表面性质差异可能是造成纳米颗粒传输不同的重要因素[22]。

|
(蒙脱石-NPs和针铁矿-NPs表示矿物和纳米颗粒的共沉降曲线,蒙脱石+NPs和针铁矿+NPs表示矿物和纳米颗粒的共加沉曲线) 图 6 ZnO NPs在不同表面涂层石英砂中的穿透曲线(A)以及生物膜和矿物对ZnO NPs的吸附和沉降曲线(B) Fig. 6 Penetration curves of ZnO NPs in quartz sand with different surface coatings (A), adsorption and settling curves of ZnO NPs by biofilms and minerals (B) |
生物膜涂层传输试验结果表明生物膜会降低纳米颗粒在填充柱中的传输,这些结果与之前的一些研究结果一致[21]。根据ZnO NPs在10 mmol/L KCl溶液中以1 ml/min流速下获得的穿透曲线,发现含有生物膜涂层介质的穿透平台C/C0在0.41左右,大幅小于在纯石英砂填充柱的穿透平台,而含EPS涂层的石英砂却有较高的稳定平台,其稳定平台C/C0在0.87左右,与纯石英砂填充柱相比只是小幅度降低。结果表明生物膜附着对纳米颗粒在多孔介质的传输具有较强的阻滞作用,而EPS对纳米颗粒传输的抑制作用相对较小。虽然EPS涂层介质中纳米颗粒传输稳定平台较高,但是其在3 PV时才进入稳定平台,与纯石英砂填充柱和生物膜处理相比均较晚。在相同的处理条件下,与干净石英砂的kd(0.62)相比较,生物膜涂层条件下能够获得更大的kd(6.35),而EPS涂层对ZnO NPs的kd(1.03)影响较小。因此,生物膜主要通过提高纳米颗粒的沉积来抑制其在饱和多孔介质的传输。进一步测定了生物膜和EPS涂层对石英砂表面电位的影响,结果表明生物膜和EPS均未能显著影响石英砂的表面电位(图 5B)。EPS含有丰富的表面官能团,其可通过“桥连”作用促进纳米颗粒的同质聚集,在穿透初始阶段降低了纳米颗粒传输,但是其对石英砂表面结合纳米颗粒的能力影响较小,因此并没有大幅度提高多孔介质对纳米颗粒的滞留量[23]。大量研究表明,生物膜作为微生物聚集体,其内部空间高度结构化,并且具有许多微小的孔径,纳米颗粒可以在生物膜中扩散并积聚,从而减少纳米颗粒在介质的传输[22, 24]。因此附着在多孔介质中的生物膜能够大量滞留纳米颗粒,从而极大地抑制纳米颗粒在饱和多孔介质的传输。通过生物膜对ZnO NPs的吸附结果发现(图 6B),生物膜对ZnO NPs的吸附作用很强,在120 min时的吸附效率高达62.93%。生物膜在前40 min的吸附速率较快,之后较为平缓,这归因在吸附前期,生物膜有较为丰富的吸附位点以及较高的纳米颗粒浓度[23]。这也是造成ZnO NPs在穿透过程中较晚达到稳定平台的原因。因此可以确定生物膜对纳米颗粒的吸附作用是其阻滞纳米颗粒在多孔介质中迁移的主要机制。
同时研究了土壤矿物涂层对纳米颗粒在饱和多孔介质中迁移的影响(图 6A),结果表明矿物涂层降低了ZnO NPs在饱和多孔介质中的穿透,蒙脱石和针铁矿的稳定平台C/C0分别为0.72和0.74,但是与生物膜涂层(C/C0=0.41)相比,其C/C0依然保持在较高水平,其对纳米颗粒迁移的影响相对较小。这可能是由于矿物与生物膜阻滞纳米颗粒传输的机制不同。ZnO NPs和蒙脱石/针铁矿的共沉降结果显示(图 6B),ZnO NPs与和蒙脱石/针铁矿的共沉降曲线一直处于对应加沉曲线的下方,说明蒙脱石/针铁矿有利于ZnO NPs的聚集沉降。计算蒙脱石和针铁矿的ΔOD1值分别为0.31和0.30,表明ZnO NPs和蒙脱石/针铁矿发生了明显的异质聚集。大量研究表明,矿物对纳米颗粒直接的吸附作用相对较弱,其主要是通过与纳米颗粒的异质聚集作用影响纳米颗粒的环境行为,其能够通过异质聚集作用,与纳米颗粒团聚形成较大的颗粒,从而促进其沉降和减少其在小孔隙中的传输[25]。因此纳米颗粒与矿物之间的聚集作用对纳米颗粒在多孔介质中的穿透非常重要。从穿透曲线中能够看出,矿物涂层显著降低了纳米颗粒穿透稳定平台,并且在穿透初期对纳米颗粒传输有较大的抑制作用,进一步表明矿物涂层主要通过促进纳米颗粒的聚集来影响其在介质的传输。不同矿物类型的差异也主要表现在穿透的初期,针铁矿对纳米颗粒传输的抑制作用更强,这主要是由于两种矿物表面电荷的差异造成,针铁矿表面带有正电荷,与ZnO NPs异质聚集作用更强[26]。因此,土壤等环境介质中附着的生物膜和大量的矿物颗粒,能有效阻滞纳米颗粒的迁移,对于控制纳米颗粒在环境中的传输和扩散具有重要意义,而在纯石英砂等多孔介质进行的传输试验会高估纳米颗粒在环境中的迁移能力和环境风险。
3 结论通过改变纳米颗粒的性质、环境条件和传输介质表面涂层,探讨了纳米颗粒在饱和多孔介质中的传输规律和影响机制。研究表明,纳米颗粒的种类、浓度、粒径以及悬浮液离子强度均会影响其在饱和多孔介质中的传输,DLVO相互作用能结果能够很好地解释纳米颗粒在纯石英砂介质中的传输机制。传输介质的表面涂层能够影响纳米颗粒的传输,生物膜和土壤矿物均能抑制纳米颗粒在饱和多孔介质的传输,但是传统的DLVO理论并不能很好地解释纳米颗粒在这种涂层介质中的传输机制,非DLVO相互作用以及涂层的表面特性对增强纳米颗粒沉积有很大贡献。生物膜对纳米颗粒有极强的吸附和阻滞能力,从而极大地增加纳米颗粒的沉积速率并抑制其在饱和多孔介质的传输。土壤矿物主要是通过与纳米颗粒的异质聚集作用,促进其与纳米颗粒团聚形成较大的颗粒,从而阻碍其在多孔介质的传输。生物膜和土壤矿物是土壤等环境介质中普遍存在的物质,将极大地影响纳米颗粒在环境中的行为与效应。本研究的结果有助于进一步认识人工纳米颗粒在土壤中的迁移和传输规律,并为全面评估纳米颗粒的环境风险提供一定的理论基础。
| [1] |
水体中金属(氧化物)纳米颗粒的环境行为与污染控制研究进展[J]. 环境化学, 2021, 40(2): 436-449 (  0) 0) |
| [2] |
人工纳米材料对植物–微生物影响的研究进展[J]. 土壤学报, 2016, 53(1): 1-11 (  0) 0) |
| [3] |
Hochella M F, Mogk D W, Ranville J, et al. Natural, incidental, and engineered nanomaterials and their impacts on the Earth system[J]. Science, 2019, 363(6434): 1-10 (  0) 0) |
| [4] |
Goldberg E, McNew C, Scheringer M, et al. What factors determine the retention behavior of engineered nanomaterials in saturated porous media?[J]. Environmental Science & Technology, 2017, 51(5): 2729-2737 (  0) 0) |
| [5] |
蒙脱石纳米颗粒聚集中的离子特异性效应[J]. 土壤学报, 2018, 55(3): 673-682 (  0) 0) |
| [6] |
几种物理因素对四氧化三铁纳米颗粒在有机质存在条件下的饱和多孔介质中迁移持留行为的影响[J]. 农业环境科学学报, 2010, 29(10): 2017-2024 (  0) 0) |
| [7] |
不同金属离子对稻田自然生物膜磷酸酶活性的影响[J]. 土壤, 2020, 52(3): 525-531 (  0) 0) |
| [8] |
Tong M P, Ding J L, Shen Y, et al. Influence of biofilm on the transport of fullerene (C60) nanoparticles in porous media[J]. Water Research, 2010, 44(4): 1094-1103 DOI:10.1016/j.watres.2009.09.040 (  0) 0) |
| [9] |
广西水耕人为土黏粒矿物组成及其空间分布特征[J]. 土壤, 2020, 52(6): 1290-1297 (  0) 0) |
| [10] |
Shen C Y, Jin Y, Zhuang J, et al. Role and importance of surface heterogeneities in transport of particles in saturated porous media[J]. Critical Reviews in Environmental Science and Technology, 2020, 50(3): 244-329 DOI:10.1080/10643389.2019.1629800 (  0) 0) |
| [11] |
Bergendahl J, Grasso D. Prediction of colloid detachment in a model porous media: Thermodynamics[J]. AIChE Journal, 1999, 45(3): 475-484 DOI:10.1002/aic.690450305 (  0) 0) |
| [12] |
Li L, Schuster M. Influence of phosphate and solution pH on the mobility of ZnO nanoparticles in saturated sand[J]. Science of the Total Environment, 2014, 472: 971-978 DOI:10.1016/j.scitotenv.2013.11.057 (  0) 0) |
| [13] |
Liu X Y, Chen G X, Su C M. Influence of collector surface composition and water chemistry on the deposition of cerium dioxide nanoparticles: QCM-D and column experiment approaches[J]. Environmental Science & Technology, 2012, 46(12): 6681-8 (  0) 0) |
| [14] |
Wang D J, Park C M, Masud A, et al. Carboxymethylcellulose mediates the transport of carbon nanotube-magnetite nanohybrid aggregates in water-saturated porous media[J]. Environmental Science & Technology, 2017, 51(21): 12405-12415 (  0) 0) |
| [15] |
Wang Y L, Yang K, Chefetz B, et al. The pH and concentration dependent interfacial interaction and heteroaggregation between nanoparticulate zero-valent iron and clay mineral particles[J]. Environmental Science: Nano, 2019, 6(7): 2129-2140 DOI:10.1039/C9EN00433E (  0) 0) |
| [16] |
Dunphy G K A, Finnegan M P, Banfield J F. Influence of surface potential on aggregation and transport of titania nanoparticles[J]. Environmental Science & Technology, 2006, 40(24): 7688-93 (  0) 0) |
| [17] |
Chen G, Liu X Y, Su C. Transport and retention of TiO2 rutile nanoparticles in saturated porous media under low-ionic-strength conditions: Measurements and mechanisms[J]. Langmuir, 2011, 27(9): 5393-5402 DOI:10.1021/la200251v (  0) 0) |
| [18] |
Tufenkji N, Elimelech M. Breakdown of colloid filtration theory: Role of the secondary energy minimum and surface charge heterogeneities[J]. Langmuir, 2005, 21(3): 841-852 DOI:10.1021/la048102g (  0) 0) |
| [19] |
Wang D J, Bradford S A, Harvey R W, et al. Transport of ARS-labeled hydroxyapatite nanoparticles in saturated granular media is influenced by surface charge variability even in the presence of humic acid[J]. Journal of Hazardous Materials, 2012, 229/230: 170-176 DOI:10.1016/j.jhazmat.2012.05.089 (  0) 0) |
| [20] |
Kim J W, Choi H, Pachepsky Y A. Biofilm morphology as related to the porous media clogging[J]. Water Research, 2009, 44(4): 1193-1201 (  0) 0) |
| [21] |
Tripathi S, Champagne D, Tufenkji N. Transport behavior of selected nanoparticles with different surface coatings in granular porous media coated with Pseudomonas aeruginosa biofilm[J]. Environmental Science & Technology, 2012, 46(13): 6942-6949 (  0) 0) |
| [22] |
Peulen T O, Wilkinson K J. Diffusion of nanoparticles in a biofilm[J]. Environmental Science & Technology, 2011, 45(8): 3367-3373 (  0) 0) |
| [23] |
Fulaz S, Vitale S, Quinn L, et al. Nanoparticle-biofilm interactions: The role of the EPS matrix[J]. Trends in Microbiology, 2019, 27(11): 915-926 DOI:10.1016/j.tim.2019.07.004 (  0) 0) |
| [24] |
Tang J, Wu Y H, Esquivel-Elizondo S, et al. How microbial aggregates protect against nanoparticle toxicity[J]. Trends in Biotechnology, 2018, 36(11): 1171-1182 DOI:10.1016/j.tibtech.2018.06.009 (  0) 0) |
| [25] |
Wang R, Dang F, Liu C, et al. Heteroaggregation and dissolution of silver nanoparticles by iron oxide colloids under environmentally relevant conditions[J]. Environmental Science: Nano, 2019, 6(1): 195-206 DOI:10.1039/C8EN00543E (  0) 0) |
| [26] |
Zhao J, Tang J, Dang T H. Influence of extracellular polymeric substances on the heteroaggregation between CeO2 nanoparticles and soil mineral particles[J]. The Science of the Total Environment, 2022, 806(Pt 2): 150358 (  0) 0) |
2. State Key Laboratory of Soil and Sustainable Agriculture, Institute of Soil Science, Chinese Academy of Sciences, Nanjing 210008, China;
3. University of Chinese Academy of Sciences, Beijing 100049, China
 2022, Vol. 54
2022, Vol. 54


