由于人类的活动,如化石燃料燃烧、农业施肥、工业排放等导致了一系列的全球变化,造成全球氮循环的改变[1-2]。据统计,全球氮沉降量从1860年的15 Tg攀升到2005年的25 ~ 40 Tg,预计在2100年氮沉降量将达60 ~ 100 Tg[3]。氮的输入可直接作用于土壤环境和生物从而对土壤碳循环等重要生态系统功能产生巨大影响[4]。而目前我们对氮输入背景下土壤碳库组成及化学结构变化仍不明确,这限制了我们在未来氮输入增加条件下预测土壤碳库变化的准确性。
土壤碳库作为陆地生态系统储量最大的有机碳库,其微小的变化都将对自然界的物质循环、能量流动以及全球气候产生巨大的影响[5-6]。当前解析气候变化下土壤碳库的响应过程及机制已经成为研究热点。目前研究表明,长期施氮可一定程度增加土壤碳储量,大量研究表明氮输入对土壤碳库的作用在不同生态系统中的表现不同[7],其作用机制主要是氮的输入通过促进地上植被生长从而增强凋落物碳向土壤中的输入过程[8]。氮添加下凋落物化学计量的改变通过改变微生物群落组成影响生态系统功能[9],此外,氮输入增加背景下pH降低可能会通过抑制微生物介导的有机碳分解从而增强有机碳的固存[10]。而有机碳在土壤中并不是以单一成分及状态存在[11],目前研究表明,通过物理分组将有机质在土壤团聚体中的实际位置以及不同颗粒大小和密度视为决定土壤总有机碳(SOC)功能和周转的关键属性,并且利用颗粒有机碳(POC)和矿物结合有机碳(MOC)可以较好预测气候变化下土壤碳的动态[12-13],因此探究氮输入背景下对土壤碳库组成影响及驱动对预测土壤碳动态具有重要意义。
凋落物碳作为土壤碳库主要碳源,是决定和驱动土壤养分循环的主要因子[14]。研究发现凋落物养分分解动态变化对碳、氮组分的损失有很强的调节作用[15],凋落物在分解过程中,碳质量的变化对酸解物质的损失起关键作用,凋落物化学计量特征也可调节易溶性有机碳的释放[16]。氮沉降下凋落物的成分和化学结构均已发生一定程度改变,一方面由于氮的输入加剧了植物种群间的竞争作用从而减少物种丰富度,改变了凋落物来源[17];另一方面,氮的富集可降低土壤碳氮比,增强微生物对凋落物等外源碳的分解作用[18]。而碳源成分变化可直接影响土壤碳库组成及其有机碳化学结构,而目前氮输入条件下对土壤不同成分及存在状态有机碳化学结构影响仍不明确。
贝加尔针茅(Stipa baicalensis)草原是亚欧大陆中部草原地区所特有的草原类型,也是中国北方草甸草原的代表类型之一[15, 19]。受温带气候影响,中国东北草甸草原储存大量土壤碳,但生态系统较为脆弱,极易受氮沉降等气候变化影响[19]。因此我们基于在中国东北草甸草原设置的10a氮沉降野外模拟试验,分析氮输入下土壤碳组分及其化学结构变化,探讨氮输入对草甸草原土壤碳库的驱动途径,为草甸草原土壤碳库对大气氮沉降变化响应机理提供理论补充。试验基于以下假设并进行验证:①长期氮输入通过增加地上生物量来提高土壤碳库储量,且相比土壤MOC,对土壤轻组有机碳(LOC)和POC增加更为明显;②长期氮输入可促进凋落物碳官能团中碳水化合物的损失,提高凋落物碳的稳定性,由于凋落物的积累提高土壤碳官能团中烷基碳和芳香碳的比例。
1 材料与方法 1.1 试验区概况试验地点位于中国内蒙古自治区呼伦贝尔市鄂温克自治旗伊敏河镇境内,地理位置为48°27′~ 48°35′N,119°35′ ~ 119°41′E,试验在贝加尔针茅草甸草原围封样地进行,地势平坦,海拔约765 m。贝加尔针茅(Stipa baicalensis)为建群种,羊草(Leymus chinensis)为优势种。该区气候属于温带大陆性气候,昼夜温差大,年平均气温–2.4 ~ 2.2 ℃,年均降水量350 ~ 400 mm,降水主要集中在6—9月,年均无霜期为100 d左右。土壤类型为暗栗钙土。试验前0 ~ 20 cm土壤基本理化性质如下:土壤pH 7.07,有机碳27.92 g/kg,全氮1.85 g/kg,全磷0.45 g/kg。
1.2 试验设计试验样地于2010年6月份围封,并开展模拟氮沉降试验(仅模拟大气干沉降),采用随机区组设计,设置6个施氮水平:0、30、50、100、150、200 kg/(hm2·a),其中不包括大气氮沉降量,分别用CK(对照)、N30、N50、N100、N150、N200表示,每个处理水平设3个重复。小区面积8 m×8 m,小区间设2 m隔离带,重复间设5 m隔离带。2010年至今,每年6月中旬和7月中旬分两次将氮肥等量施入样地,氮肥为NH4NO3。为了尽量避免氮肥的挥发,在试验中将氮肥溶于适量水中制成溶液,使用洒水壶将该溶液均匀喷洒到小区内,对照小区内喷洒等量水。
1.3 样品采集于2020年8月上旬采集土壤样品,每个小区依“S”形采集10个点的土样混合均匀,采样深度为0 ~ 20 cm。去除植物根系及其他土壤入侵物后,置于阴凉通风处风干,测定混合土壤样品的基本理化性质、碳组分及红外光谱
凋落物和地上生物量分别在每年8月底调查。每个试验小区放置1个1 m×1 m的样方,选择具有代表性的样方同时避免小区的边缘效应,采用收获法进行,将样方内植物分物种齐地面刈割后带回室内,凋落物则采集地上表面枯落的植物残体,最后在65 ℃烘箱烘至恒重后称重。
1.4 指标测定 1.4.1 凋落物及土壤基础理化指标测定凋落物碳氮采用元素分析仪测定;土壤有机碳采用重铬酸钾法测定;土壤全氮采用凯氏定氮法测定;土壤pH在水土比2.5:1(V: m)下搅拌15 min后采用pH计测定;土壤经30 ml 0.5 mol/L的K2SO4溶液浸提,浸提液经振荡、离心、过滤后采用流动分析仪测定土壤硝态氮、铵态氮含量;土壤有效磷采用钼锑抗比色法测定;土壤速效钾经过乙酸铵浸提用火焰光度计测定。
1.4.2 土壤碳组分的测定将土壤碳库分为3个组分,分别为:轻组有机碳、颗粒有机碳、矿物结合有机碳。并根据Haddix[20]有机碳分组方法做出一定改进,具体步骤为:称取5 g过2 mm筛风干土放入50 ml离心管中,加入33 ml 1.85 g/cm3 NaI上下轻轻反复摇动10次,在4 000 r/min转速下离心15 min,静置5 min后,将悬浮液倒入装有0.45 μm滤膜的布氏漏斗中,在真空环境下抽滤,用去离子水洗涤除去残留的NaI溶液后,滤膜上的物质为轻组有机碳,在65 ℃下干燥12 h,然后采用元素分析仪分析碳含量。离心管内为重组有机碳,将重组有机碳进一步分组,首先倒入蒸馏水,离心,直至洗净NaI,再倒入33 ml 5 g/L六偏磷酸钠溶液放置离心管振荡器振荡6 h,振荡完毕过53 μm筛子,> 53 μm为颗粒有机碳,< 53 μm为矿物结合有机碳。收集各组分有机碳烘干,研磨过0.15 mm筛测定有机碳含量。
1.4.3 红外光谱测定使用傅里叶变换红外光谱仪测定土壤红外光谱,具体方法:将每个处理3个重复混合成一个复合样品,土样在玛瑙研钵进行研磨过0.05 mm筛,采用ATR附件进行测定。参数设定:土壤光谱测定范围为500 ~ 4 000 cm–1,分辨率为4,扫描次数为32次。测定数据统一进行平滑和基线校正。
1.5 统计处理利用SPSS对不同指标进行单因素方差分析;利用OMINIC软件计算红外光谱不同官能团特征峰面积;利用Unscrambler X 10.4对红外光谱进行主成分分析及数据导出;利用R语言lavaan包建立结构方程模型,分析氮输入下对土壤碳库的驱动途径;利用Origin 2019进行绘图。
2 结果与分析 2.1 长期氮输入对土壤理化性质的影响由表 1可知,随着氮沉降水平增加,土壤有机碳含量呈增加趋势(增幅0.3% ~ 13.6%),但增加不显著。N50(17.9%)、N100(25.6%)、N150(20.4%)、N200(21.1%)处理均显著提高凋落物碳含量(P < 0.05)。不同水平氮沉降能够提高土壤全氮含量和凋落物氮、C/N,但影响不显著。土壤pH随着施氮水平提高而降低,其中N150(降幅13.9%)、N200(17%) 处理显著降低土壤pH(P < 0.05)。施氮显著提高土壤硝态氮(0.35倍~ 15.1倍)和铵态氮含量(0.26倍~ 0.98倍)(P < 0.05),地上生物量随施氮水平提高呈增加趋势(29.3% ~ 92.9%)。
|
|
表 1 长期氮输入对0 ~ 20 cm土壤理化性质的影响 Table 1 Effects of long-term nitrogen input on 0-20 cm soil physiochemical properties |
由图 1可知,不同有机碳组分对氮沉降水平的响应不同,除N150外,不同水平的氮沉降处理轻组有机碳(LOC)含量均低于CK,其中N30(9.28%)和N50(11.67%)处理达显著水平(P < 0.05)。颗粒有机碳(POC)含量随着施氮水平的增加呈增加趋势(9.22% ~ 16.39%)。矿物结合有机碳(MOC)含量随着施氮水平增加呈先增加后降低的趋势,其中N150和N200处理MOC含量低于CK。

|
(图中小写字母不同表示处理间差异显著(P < 0.05)。LOC:轻组有机碳;POC:颗粒有机碳;MOC:矿物结合有机碳;下同) 图 1 不同组分有机碳含量 Fig. 1 Contents of different organic carbon fractions |
通过对红外谱图不同特征峰所对应的官能团进行解析,发现凋落物和不同组分有机碳红外光谱特征差异主要表现在6种有机官能团特征峰(图 2),分别为3 400 cm–1处的酚醇、羧基有机物-OH,2 950 ~ 2 870 cm–1处的脂肪族甲基(CH3-)和亚甲基(CH2-),1 525和1 630 cm–1处的芳香族C=C,1 420 cm–1处的饱和烷基C-H,1 159 cm–1处的多糖类C-O,1 030 ~ 1 050 cm–1处的单糖类C-O[21-25]。其余特征峰主要为土壤无机矿物成分,3 620 cm-1处的土壤黏粒-OH,1 478和882 cm–1处的无机碳酸盐C=O[21-23];而1 000 cm–1以下吸收区域主要为有机物-矿物混合带,不同物质特征峰相互干扰重叠,分析误差较大,无实际参考价值。
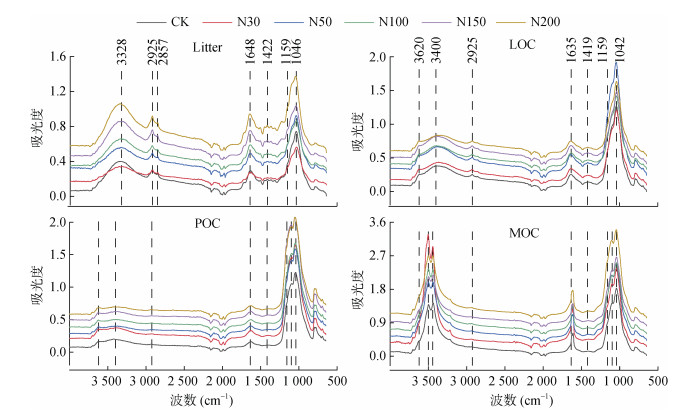
|
图 2 凋落物和不同有机碳组分红外光谱特征 Fig. 2 Infrared spectra of litters and different organic carbon fractions |
不同组分有机碳红外光谱PCA结果显示(图 3A),不同组分有机碳成分差异较大,被明显区分,PCA得分结果显示:PC1正值主要包括MOC和LOC,PC1负值主要包括POC;PC2正值主要包括POC和LOC,PC2负值主要包括MOC。因子载荷结果显示(图 3B),PC1正值主要包括脂肪碳、烷基碳、烷氧碳(单糖+多糖),PC1负值主要包括芳香碳和酚醇化合物;PC2正值主要包括脂肪族碳、芳香碳和酚醇化合物,PC2负值主要包括烷基碳、多糖碳。综上所述,LOC主要来源于脂肪碳、芳香碳、酚醇化合物,POC主要来源于芳香碳和酚醇化合物,MOC主要来源于烷基碳和多糖。
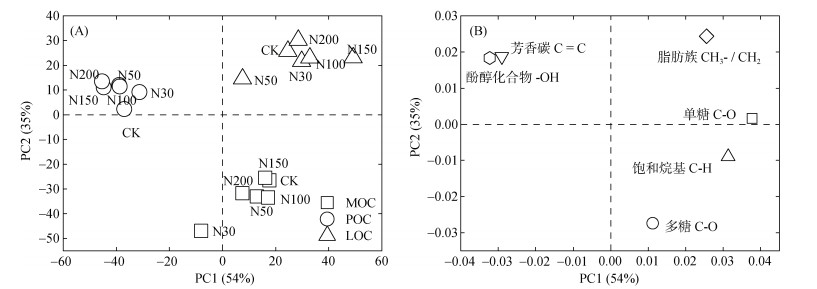
|
(图A为主成分分析图;图B为因子载荷图) 图 3 不同有机碳组分红外光谱主成分分析 Fig. 3 Principal component analysis of infrared spectra of different organic carbon fractions |
通过对不同官能团特征峰面积计算其相对强度,结果表明(表 2),不同组分有机碳中,烷氧碳等碳水化合物成分相对强度最高,烷基碳相对强度最低。相比CK,随着各施氮水平的增加,凋落物和土壤LOC官能团中碳水化合物相对强度降低,脂肪碳、烷基碳、芳香碳相对强度呈增加趋势;而土壤MOC和POC官能团中碳水化合物、烷基碳及芳香碳相对强度增加,其中土壤MOC脂肪碳和酚醇化合物以及POC酚醇化合物相对强度降低。以芳香碳和脂肪碳的相对强度比值来评价有机碳化学结构的稳定性,发现相比CK,施氮增加,凋落物及土壤不同组分有机碳化学结构均趋于稳定。
|
|
表 2 凋落物和土壤不同碳组分红外光谱特征峰相对强度(%) Table 2 Relative intensities of infrared spectral characteristic peaks of different organic carbon fractions in litters and soil |
结构方程模型(SEM)表明(图 4),氮沉降条件下通过增加地上生物量来提高POC和MOC含量;但随着氮沉降引发的酸化效应,导致pH降低,相反地促进了矿物有机碳分解释放。根据SEM标准化总效应来看,氮输入条件下对土壤不同碳库影响程度依次为:POC > MOC > LOC,且pH降低对矿物有机碳的分解效应要大于地上生物量增加对矿物结合有机碳的促进效应。
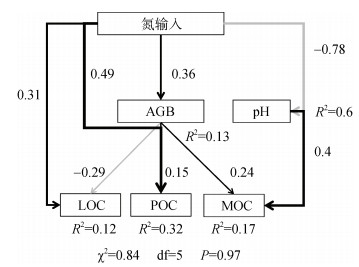
|
(CFI=1,SRMR=0,RMSEA=0.036;灰色线代表变量之间负效应,黑色线代表变量之间正效应,与箭头相邻的数字表示变量之间效应值线条粗细代表变量之间效应大小,变量后面R2代表该模型对不同变量解释程度) 图 4 氮输入对土壤碳组分的作用途径 Fig. 4 Functional pathway of nitrogen input on soil carbon components |
研究结果表明,氮添加对草甸草原土壤碳库组成产生较大影响,施氮提高了土壤总有机碳含量(表 1),其中除N150外,不同施氮处理相比CK降低土壤中LOC含量,提高土壤POC含量(图 1)。这与研究最初的假设不完全一致,即氮添加可以通过提高地上生物量来促进凋落物碳的输入,通过活性有机碳的输入量增加来提高土壤LOC和POC含量[26-27]。Riggs等[28]通过研究氮输入对美国5个草地土壤碳库的影响,结果发现,氮的富集可能通过减缓碳的分解来增强有机碳的固存,但可能受土壤性质影响导致氮输入对土壤碳促进的现象并不普遍。LOC是植物碳向土壤碳转化过程“初级”分解产物,其成分中含有更大比例的植物源有机碳,因此易受外界环境干扰和微生物利用[26, 29]。而POC作为植物碳在土壤中的进一步分解产物[30],可以通过与土壤颗粒结合受到一定程度的物理保护[31]。LOC含量取决于植物碳输入和微生物分解之间的平衡,本研究结果显示,不同施氮水平LOC呈现先降低后增加趋势的变化。Chen等[32]研究表明,连续5a施氮条件下轻组有机碳表现出降低趋势,本研究结果与此相似,这应该主要是与微生物作用有关,微生物对氮添加的响应极为复杂。研究表明,长期氮输入可能使得土壤由氮限制变为碳限制,由于凋落物复杂和难分解性,这可能会促进微生物对不稳定碳组分的挖掘和利用[18]。对于不同施氮水平下LOC的变化,可能由于在低氮条件下,微生物活性较高,会加速对LOC含量的分解,但随着施氮水平增加,pH降低引发的酸化效应会抑制微生物活动,降低微生物多样性,因此对LOC分解能力减弱[32]。POC含量的升高则与最初的假设一致,凋落物碳输入会促进POC有机碳在土壤中的固持。
虽然相比CK,氮添加各处理对MOC无显著影响(图 1),但随着施氮水平增加,土壤MOC含量表现为先增加后降低,当达到N150后土壤MOC含量低于CK,表明土壤矿物和有机碳结合稳定能力下降,目前关于氮输入对土壤MOC影响研究结果存在较大争议。Cusack等人[33]研究表明,热带森林土壤MOC含量随着施氮量增加呈现增加趋势;而Chen等[34]研究结果则相反,研究发现氮添加后热带森林土壤POC含量显著增加,而MOC含量显著减少,体现了氮输入下矿物结合碳的脆弱性,这可能与土壤的生物因子和非生物因子的驱动作用有关。本研究结果发现氮添加条件下,可通过增加植物碳输入来提高土壤POC和MOC含量,但随着施氮水平提高,土壤pH显著降低,相反会促进矿物有机碳分解释放(图 4)。目前研究表明矿物结合碳在形成过程中,吸附结合的有机碳主要来源于微生物分解过程产生的代谢产物[35],主要可能有两方面原因:一方面由于过量氮输入,可能会抑制微生物生长,从而减少微生物代谢产物来降低矿物结合碳的来源;另一方面,氮富集引发的土壤酸化效应,降低交换性金属离子(如钙、镁等),尤其是钙离子对矿物结合碳的形成和稳定具有重要作用,通过降低矿物结合碳的稳定性造成损失[14, 36]。因此未来在预测氮沉降背景下土壤碳的动态应该重视生物和非生物因子耦合作用。
3.2 长期氮输入对草甸草原凋落物及土壤有机碳化学结构的影响分析碳的化学结构能够从分子角度理解土壤碳的稳定性,本研究结果表明,随施氮水平增加,凋落物及土壤不同组分碳结构的稳定性均呈增加趋势,其中凋落物碳中的碳水化合物官能团相对强度降低,脂肪碳、烷基碳、芳香碳相对强度增加(表 2)。这主要是由于土壤氮的富集,会促进地上凋落物的分解,从凋落物化学成分上来看,主要是分子结构较简单易溶性糖类的首先损失,较难分解的纤维素和木质素等成分固存在土壤中。土壤LOC官能团变化趋势与凋落物碳一致,随着氮素添加水平提高,碳水化合物官能团相对强度降低。轻组有机碳作为凋落物的初级分解产物,与凋落物的成分及其性质具有更大的相似性[26, 37],但相比凋落物,LOC成分仍然较为复杂,在土壤中所提取的轻组有机物质主要为动植物残体分解和半分解产物,化学性质不稳定[38],因此随着氮的利用性增加会促进真菌等生物加速对凋落物和LOC的分解和转化。而本研究结果表明轻组有机碳对氮输入的响应与凋落物一致,但与地上凋落物相比,LOC与土壤微生物作用更为强烈,氮输入条件下微生物活动增强可能加速对LOC的分解作用。
土壤有机质是由不同分解阶段动植物残体组成的复杂连续体,在土壤中不同存在位置可能存在不同的有机质周转过程[11]。本研究结果表明,LOC主要来源于脂肪碳、芳香碳、酚醇化合物,POC主要来源于芳香碳和酚醇化合物,MOC主要来源于烷基碳和多糖(图 3)。有研究表明颗粒有机碳以及轻组有机碳含有更多植物源木质素物质,而矿物结合有机碳则富含碳水化合物以及蛋白质等[35]。不同组分有机碳来源物质的分解程度、化学性质以及植物和微生物来源的碳的相对贡献均有所差异[39],因此土壤有机质存在位置及受保护程度影响着有机碳化学结构[11, 35]。关于氮沉降对SOC结构组成和转化过程的影响,本研究结果表明,随施氮水平升高,土壤MOC和POC官能团中碳水化合物、烷基碳及芳香碳相对强度增加,其中土壤MOC脂肪碳和酚醇化合物以及POC酚醇化合物相对强度降低(表 2),这与Hasegawa等[40]研究结果一致,施氮可以改变温带地区森林土壤有机碳化学组成,且主要体现在木质素衍生物的积累。而Zak等[41]研究结果显示,施氮增加了森林土壤有机碳的积累,但不改变土壤有机碳化学组成,这可能是由于生态系统类型、气候条件和施氮量导致结果差异。本研究结果中随着施氮量增加地上生物量和凋落物积累量较大(表 1),由于植物源有机碳输入增强导致大量碳水化合物进入土壤,氮输入下随着未受保护的LOC的分解,首先导致碳水化合物的损失,其中一部分会被土壤颗粒固定[35, 40]。木质素则由于其自身化学稳定性可以在土壤中得到保存,土壤不同组分芳香碳占比的提高可能是由于凋落物长期积累导致木质素在土壤中的大量保存[37],进而提高土壤有机碳结构稳定性。分析土壤碳库的化学结构变化可以从分子角度解释土壤有机碳周转及存在状态,揭示在不同水平氮输入背景下对土壤碳化学结构的驱动因素和可能存在过程,但未来仍需进一步解析和量化氮沉降对不同碳库的影响作用。
4 结论氮输入能够促进土壤碳的固存,但土壤不同碳组分对氮输入水平响应不一致,随着施氮水平增加,地上生物量增加促进凋落物积累,提高土壤中颗粒有机碳含量,降低轻组有机碳含量,同时由于pH的降低反过来促进矿物结合有机碳的释放。氮输入促进地上生物量增加的同时也改变了凋落物的化学质量,从化学结构角度来看,氮输入下提高土壤中木质素等芳香碳的积累从而提高土壤碳的稳定性。因此,凋落物中木质素衍生物的积累可能是促进草甸草原土壤有机碳固存的关键因素。
| [1] |
Liu X J, Duan L, Mo J M, et al. Nitrogen deposition and its ecological impact in China: An overview[J]. Environmental Pollution, 2011, 159(10): 2251-2264 DOI:10.1016/j.envpol.2010.08.002 (  0) 0) |
| [2] |
Zhang Q, Li Y N, Wang M R, et al. Atmospheric nitrogen deposition: A review of quantification methods and its spatial pattern derived from the global monitoring networks[J]. Ecotoxicology and Environmental Safety, 2021, 216: 112180 DOI:10.1016/j.ecoenv.2021.112180 (  0) 0) |
| [3] |
Galloway J N, Townsend A R, Erisman J W, et al. Transformation of the nitrogen cycle: Recent trends, questions, and potential solutions[J]. Science, 2008, 320(5878): 889-892 DOI:10.1126/science.1136674 (  0) 0) |
| [4] |
deVries W. Impacts of nitrogen emissions on ecosystems and human health: A mini review[J]. Current Opinion in Environmental Science & Health, 2021, 21: 100249 (  0) 0) |
| [5] |
Stockmann U, Adams M A, Crawford J W, et al. The knowns, known unknowns and unknowns of sequestration of soil organic carbon[J]. Agriculture, Ecosystems & Environment, 2013, 164: 80-99 (  0) 0) |
| [6] |
潘根兴, 周萍, 李恋卿, 等. 固碳土壤学的核心科学问题与研究进展[J]. 土壤学报, 2007, 44(2): 327-337 DOI:10.3321/j.issn:0564-3929.2007.02.020 (  0) 0) |
| [7] |
Lu X F, Hou E Q, Guo J Y, et al. Nitrogen addition stimulates soil aggregation and enhances carbon storage in terrestrial ecosystems of China: A meta-analysis[J]. Global Change Biology, 2021, 27(12): 2780-2792 DOI:10.1111/gcb.15604 (  0) 0) |
| [8] |
Xu C H, Xu X, Ju C H, et al. Long-term, amplified responses of soil organic carbon to nitrogen addition worldwide[J]. Global Change Biology, 2021, 27(6): 1170-1180 DOI:10.1111/gcb.15489 (  0) 0) |
| [9] |
Li Y B, Bezemer T M, Yang J J, et al. Changes in litter quality induced by N deposition alter soil microbial communities[J]. Soil Biology and Biochemistry, 2019, 130: 33-42 DOI:10.1016/j.soilbio.2018.11.025 (  0) 0) |
| [10] |
Geisseler D, Scow K M. Long-term effects of mineral fertilizers on soil microorganisms-A review[J]. Soil Biology and Biochemistry, 2014, 75: 54-63 DOI:10.1016/j.soilbio.2014.03.023 (  0) 0) |
| [11] |
Lehmann J, Kleber M. The contentious nature of soil organic matter[J]. Nature, 2015, 528(7580): 60-68 DOI:10.1038/nature16069 (  0) 0) |
| [12] |
Cotrufo M F, Ranalli M G, Haddix M L, et al. Soil carbon storage informed by particulate and mineral-associated organic matter[J]. Nature Geoscience, 2019, 12(12): 989-994 DOI:10.1038/s41561-019-0484-6 (  0) 0) |
| [13] |
Lugato E, Lavallee J M, Haddix M L, et al. Different climate sensitivity of particulate and mineral-associated soil organic matter[J]. Nature Geoscience, 2021, 14(5): 295-300 DOI:10.1038/s41561-021-00744-x (  0) 0) |
| [14] |
Keiluweit M, Bougoure J J, Nico P S, et al. Mineral protection of soil carbon counteracted by root exudates[J]. Nature Climate Change, 2015, 5(6): 588-595 DOI:10.1038/nclimate2580 (  0) 0) |
| [15] |
Gong J R, Zhu C C, Yang L L, et al. Effects of nitrogen addition on above-and belowground litter decomposition and nutrient dynamics in the litter-soil continuum in the temperate steppe of Inner Mongolia, China[J]. Journal of Arid Environments, 2020, 172: 104036 DOI:10.1016/j.jaridenv.2019.104036 (  0) 0) |
| [16] |
Wang L F, Chen Y M, Zhou Y, et al. Litter chemical traits strongly drove the carbon fractions loss during decomposition across an alpine treeline ecotone[J]. Science of the Total Environment, 2021, 753: 142287 DOI:10.1016/j.scitotenv.2020.142287 (  0) 0) |
| [17] |
He K J, Huang Y M, Qi Y, et al. Effects of nitrogen addition on vegetation and soil and its linkages to plant diversity and productivity in a semi-arid steppe[J]. Science of the Total Environment, 2021, 778: 146299 DOI:10.1016/j.scitotenv.2021.146299 (  0) 0) |
| [18] |
Chen R R, Senbayram M, Blagodatsky S, et al. Soil C and N availability determine the priming effect: Microbial N mining and stoichiometric decomposition theories[J]. Global Change Biology, 2014, 20(7): 2356-2367 DOI:10.1111/gcb.12475 (  0) 0) |
| [19] |
Li W H, Li X, Zhao Y J, et al. Ecosystem structure, functioning and stability under climate change and grazing in grasslands: Current status and future prospects[J]. Current Opinion in Environmental Sustainability, 2018, 33: 124-135 DOI:10.1016/j.cosust.2018.05.008 (  0) 0) |
| [20] |
Haddix M L, Gregorich E G, Helgason B L, et al. Climate, carbon content, and soil texture control the independent formation and persistence of particulate and mineral-associated organic matter in soil[J]. Geoderma, 2020, 363(11): 114160 (  0) 0) |
| [21] |
Calderón F J, Mikha M M, Vigil M F, et al. Diffuse-reflectance mid-infrared spectral properties of soils under alternative crop rotations in a semi-arid climate[J]. Communications in Soil Science and Plant Analysis, 2011, 42(17): 2143-2159 DOI:10.1080/00103624.2011.596243 (  0) 0) |
| [22] |
Calderón F J, Reeves J B, Collins H P, et al. Chemical differences in soil organic matter fractions determined by diffuse-reflectance mid-infrared spectroscopy[J]. Soil Science Society of America Journal, 2011, 75(2): 568-579 DOI:10.2136/sssaj2009.0375 (  0) 0) |
| [23] |
Demyan M S, Rasche F, Schulz E, et al. Use of specific peaks obtained by diffuse reflectance Fourier transform mid-infrared spectroscopy to study the composition of organic matter in a Haplic Chernozem[J]. European Journal of Soil Science, 2012, 63(2): 189-199 DOI:10.1111/j.1365-2389.2011.01420.x (  0) 0) |
| [24] |
Matamala R, Jastrow J D, Calderón F J, et al. Predicting the decomposability of Arctic tundra soil organic matter with mid infrared spectroscopy[J]. Soil Biology and Biochemistry, 2019, 129: 1-12 DOI:10.1016/j.soilbio.2018.10.014 (  0) 0) |
| [25] |
Peltre C, Bruun S, Du C W, et al. Assessing soil constituents and labile soil organic carbon by mid-infrared photoacoustic spectroscopy[J]. Soil Biology and Biochemistry, 2014, 77: 41-50 DOI:10.1016/j.soilbio.2014.06.022 (  0) 0) |
| [26] |
Gosling P, Parsons N, Bending G D. What are the primary factors controlling the light fraction and particulate soil organic matter content of agricultural soils?[J]. Biology and Fertility of Soils, 2013, 49(8): 1001-1014 DOI:10.1007/s00374-013-0791-9 (  0) 0) |
| [27] |
Plaza-Bonilla D, Álvaro-Fuentes J, Cantero-Martínez C. Identifying soil organic carbon fractions sensitive to agricultural management practices[J]. Soil and Tillage Research, 2014, 139: 19-22 DOI:10.1016/j.still.2014.01.006 (  0) 0) |
| [28] |
Riggs C E, Hobbie S E, Bach E M, et al. Nitrogen addition changes grassland soil organic matter decomposition[J]. Biogeochemistry, 2015, 125(2): 203-219 DOI:10.1007/s10533-015-0123-2 (  0) 0) |
| [29] |
Helfrich M, Ludwig B, Buurman P, et al. Effect of land use on the composition of soil organic matter in density and aggregate fractions as revealed by solid-state 13C NMR spectroscopy[J]. Geoderma, 2006, 136(1/2): 331-341 (  0) 0) |
| [30] |
Semenov V M, Lebedeva T N, Pautova N B, et al. Relationships between the size of aggregates, particulate organic matter content, and decomposition of plant residues in soil[J]. Eurasian Soil Science, 2020, 53(4): 454-466 DOI:10.1134/S1064229320040134 (  0) 0) |
| [31] |
窦森, 李凯, 关松. 土壤团聚体中有机质研究进展[J]. 土壤学报, 2011, 48(2): 412-418 (  0) 0) |
| [32] |
Chen Q Y, Hu Y L, Hu A, et al. Shifts in the dynamic mechanisms of soil organic matter transformation with nitrogen addition: From a soil carbon/nitrogen-driven mechanism to a microbe-driven mechanism[J]. Soil Biology and Biochemistry, 2021, 160: 108355 DOI:10.1016/j.soilbio.2021.108355 (  0) 0) |
| [33] |
Cusack D F, Silver W L, Torn M S, et al. Effects of nitrogen additions on above-and belowground carbon dynamics in two tropical forests[J]. Biogeochemistry, 2011, 104(1/2/3): 203-225 (  0) 0) |
| [34] |
Chen J G, Xiao W, Zheng C Y, et al. Nitrogen addition has contrasting effects on particulate and mineral-associated soil organic carbon in a subtropical forest[J]. Soil Biology and Biochemistry, 2020, 142: 107708 DOI:10.1016/j.soilbio.2020.107708 (  0) 0) |
| [35] |
Grandy A S, Neff J C. Molecular C dynamics downstream: The biochemical decomposition sequence and its impact on soil organic matter structure and function[J]. Science of the Total Environment, 2008, 404(2/3): 297-307 (  0) 0) |
| [36] |
Jilling A, Keiluweit M, Gutknecht J L M, et al. Priming mechanisms providing plants and microbes access to mineral-associated organic matter[J]. Soil Biology and Biochemistry, 2021, 158: 108265 DOI:10.1016/j.soilbio.2021.108265 (  0) 0) |
| [37] |
李娜, 盛明, 尤孟阳, 等. 应用13C核磁共振技术研究土壤有机质化学结构进展[J]. 土壤学报, 2019, 56(4): 796-812 (  0) 0) |
| [38] |
尚秋彤, 黄瑞林, 倪浩为, 等. 黑土真菌群落互作及其与梯度有机质碳分子结构的关系[J]. 环境科学, 2020, 41(9): 4305-4313 (  0) 0) |
| [39] |
Angst G, Mueller K E, Nierop K G J, et al. Plant-or microbial-derived? A review on the molecular composition of stabilized soil organic matter[J]. Soil Biology and Biochemistry, 2021, 156: 108189 DOI:10.1016/j.soilbio.2021.108189 (  0) 0) |
| [40] |
Hasegawa S, Marshall J, Sparrman T, et al. Decadal nitrogen addition alters chemical composition of soil organic matter in a boreal forest[J]. Geoderma, 2021, 386: 114906 DOI:10.1016/j.geoderma.2020.114906 (  0) 0) |
| [41] |
Zak D R, Freedman Z B, Upchurch R A, et al. Anthropogenic N deposition increases soil organic matter accumulation without altering its biochemical composition[J]. Global Change Biology, 2017, 23(2): 933-944 DOI:10.1111/gcb.13480 (  0) 0) |
 2022, Vol. 54
2022, Vol. 54


