2. 永清环保股份有限公司, 长沙 410128
钨是一种战略金属资源,被广泛应用于光源、军事、电子、冶金和化工领域。金属钨及其合金通过多种途径释放到土壤中,在适当的pH和氧化还原条件下转化成钨氧阴离子(WO42–)[1-2]。与金属钨(W0)相比,这些氧化态阴离子的迁移性高,存在较高的环境风险。研究发现,钨可以引起白血病、甲状腺功能紊乱和糖尿病等人体疾病[3]。但作为一种新近较为被关注的污染物,对其环境行为和生态风险等方面的认识还十分不足。
钨在土壤微界面可以发生吸附络合反应,进一步影响钨在土壤中的迁移、转化和归趋[4-5]。土壤活性组分包括矿物、有机物和微生物等,其中矿物占固相组分的比例最大。层状硅酸盐是土壤中最常见、占比最大且活性较高的黏土矿物,在很大程度上决定着土壤对污染物的吸附承载能力[6]。近年来,少数学者利用批吸附试验探究了层状硅酸盐对钨的吸附行为,有学者发现高岭石对钨的吸附量大于蒙脱石和伊利石[7],且高离子强度显著抑制钨吸附。当溶液中存在磷酸根时,钨的吸附量显著下降[8]。以上研究从宏观吸附量角度初步评估了钨在硅酸盐矿物上的吸附行为,但钨的微观吸附机理,如表面络合物种类、钨的聚合程度等还未明晰。
氧化铁虽然在土壤中的丰度不及层状硅酸盐,但它们往往具有较大的比表面积和丰富的表面位点,且在一般条件下携带正电荷,对负电性污染物有较高的亲和力[9]。已有的关于铁氧化物对钨的吸附研究表明,水铁矿和针铁矿的吸附能力远大于蒙脱石,尤其在酸性条件下[10]。在赤铁矿表面,钨与铁氧氢键发生内圈络合反应,在酸性pH时形成钨的多聚物[11]。此外,磷酸根和腐殖酸的存在抑制钨在氧化铁表面的吸附[12-13]。由此可见,氧化铁对钨在土壤中的固存发挥重要作用。
在土壤中,层状硅铝酸盐矿物与氧化铁往往通过多种作用力胶结在一起形成复合物[14]。硅酸盐矿物-氧化铁复合体是土壤团粒结构的基本单元,控制着众多土壤微界面过程,如营养元素、污染物和有机碳的固持[15-18]。厘清钨在硅酸盐矿物-氧化铁复合体上的吸附络合行为,更能真实评价其在土壤中的固持、迁移转化和归趋。基于此,本研究选取代表性层状硅酸盐矿物蒙脱石,制备蒙脱石-水铁矿和蒙脱石-针铁矿两种不同复合体,通过批吸附试验,结合扫描电子显微镜(SEM)、X射线光电子能谱(XPS)和傅里叶变换红外光谱(ATR-FTIR),探究的宏观吸附现象和微观结合机制,为准确评价钨在土壤微界面的化学行为提供参考。
1 材料与方法 1.1 供试材料蒙脱石购置于美国Sigma-Aldrich公司。钨溶液用钨酸钠(Na2WO4·2H2O,Aladdin)配置。
1.2 蒙脱石-氧化铁复合体制备复合体制备方法是在有蒙脱石存在时添加Fe(Ⅲ),再经过碱沉淀和一定条件处理。
蒙脱石-水铁矿复合体:①取3份(各2 g)蒙脱石悬浮在0.1 g/L KNO3溶液中,充分搅拌使蒙脱石均匀分散,并水化18 h以上;②在搅拌条件下向蒙脱石悬液中加入不同量的Fe(NO3)3·9H2O溶液,控制初始复合体中Fe质量分数分别为5%、20% 和50%,将混合液充分反应2 h;③向悬液中缓慢滴加1 mol/L NaOH,直至pH为7.5并稳定2 h;④将悬液离心,沉淀反复冲洗3次后冷冻干燥,研磨过100目筛备用。复合体中水铁矿的最终质量占比分别约为8%、30% 和63%。低、中、高Fe含量复合体分别记为蒙脱石-水铁矿_5%Fe、蒙脱石-水铁矿_20%Fe和蒙脱石-水铁矿_50%Fe。
蒙脱石-针铁矿复合体:制备方法与蒙脱石-水铁矿复合体类似,只是在进行第4步之前,将混合悬液放置于60 ℃恒温水浴中老化3 d,其他步骤同上。复合体中针铁矿的最终质量占比分别约为7.7%、28% 和61%。低、中、高Fe含量复合体分别记为蒙脱石-针铁矿_5%Fe、蒙脱石-针铁矿_20%Fe和蒙脱石-针铁矿_50%Fe。
1.3 批吸附试验将一定量吸附剂悬液置于50 ml离心管底部,加入0.9 ml钨母液,并用0.1 mol/L KNO3溶液定容到30 ml,随后将混合液调至pH 3 ~ 9。吸附体系中钨初始浓度为30 mg/L,吸附剂浓度为0.05 g/L。将离心管置于水平摇床中反应24 h后取出,离心15 min,上清液过0.22 μm尼龙滤膜,利用电感耦合等离子体发射光谱(ICP-OES)测定钨浓度,离心后的沉淀物用于X-射线光电子能谱(XPS)测定。
1.4 SEM和XPS检测利用扫描电子显微镜(SEM)观察蒙脱石、蒙脱石-水铁矿和蒙脱石-针铁矿二元复合体的形貌。
利用KRATOS Axis Ultra X(Thermo Fisher Scientific,USA)能谱仪测定样品吸附钨前后的XPS图谱。在测量前,将样品保持在N2气氛下的密封塑料袋中,测定过程中步长设为0.05 eV,平均每个样品扫描10次。结合能(BE)利用C1s峰(284.8 eV)校正,XPS图谱拟合在XPS PEAK41软件中进行,特定光谱的半峰全宽(FWHM)保持不变。
1.5 原位ATR-FTIR试验原位ATR-FTIR试验在配置有ATR系统(ZnSe晶体,45°角)的PerkinElmer红外光谱仪上进行,流动池由矩形支架组成。将1 ml吸附剂悬液均匀地散布在ZnSe晶体表面,待一夜干燥后将晶体放在流动池的支架上。背景电解液(0.1 g/L KNO3)以1 ml/min速度泵入反应容器,直到红外信号稳定后引入新制备的钨母液,每隔40 min记录一次光谱,钨的特征红外吸收光谱主要集中在1 400 ~ 700 cm–1范围[11]。ATR-FTIR试验考虑pH 4和7两个条件。
2 结果与讨论 2.1 蒙脱石-氧化铁二元复合体形貌特征图 1为蒙脱石、蒙脱石-水铁矿和蒙脱石-针铁矿复合体的SEM图谱。蒙脱石为层状或片状结构,颗粒团聚在一起,但结合相对松散。与纯蒙脱石相比,蒙脱石-水铁矿复合体表面存在大量细小的无定形水铁矿颗粒;蒙脱石-针铁矿复合体表面含有针状或短棒状的针铁矿结构。蒙脱石-水铁矿/针铁矿的结合比较紧密,主要因为蒙脱石表面携带负电荷,而铁氧化物带正电,两者之间有较强的静电引力。氧化铁覆盖在蒙脱石表面可能形成一层“氧化铁”膜,进一步可能改变污染物的界面吸附行为。

|
图 1 蒙脱石、蒙脱石-水铁矿和蒙脱石-针铁矿复合体扫描电镜图 Fig. 1 SEM images of Mont, Mont-Fh and Mont-Goe complexes |
蒙脱石、蒙脱石-水铁矿/针铁矿复合体对钨的pH吸附结果见图 2。在较宽的pH范围(3 ~ 9)中,蒙脱石对钨的吸附量介于70 ~ 100 mg/g。蒙脱石晶体结构中的Si4+和Al3+均能和低价金属离子置换,这种同等置换现象导致蒙脱石晶体负电荷过剩[19]。而钨在溶液中以WO42–形式存在,二者能产生较大的静电斥力,所以单一蒙脱石对钨的吸附量并不高。随pH升高钨吸附量降低,这与前人结果[10]类似,归因于随pH升高,吸附体系负电性增加,WO42–与蒙脱石的排斥力增加,从而降低了钨的吸附。
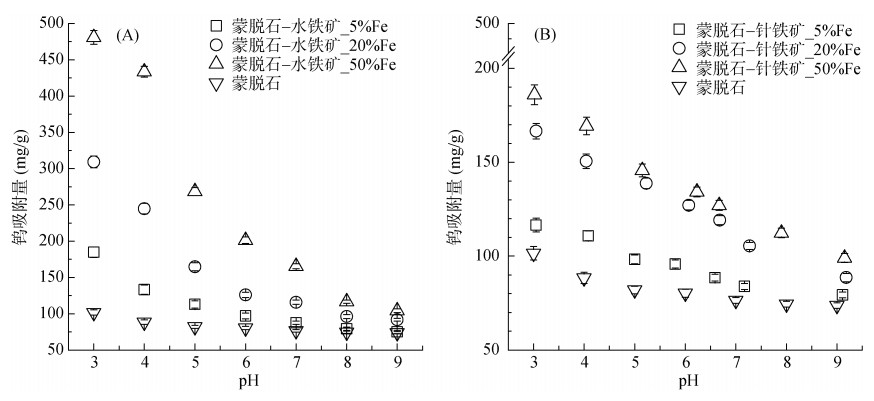
|
图 2 蒙脱石、蒙脱石-水铁矿/针铁矿复合体在pH 3 ~ 9条件下对钨的吸附 Fig. 2 Tungsten adsorption edges on Mont, Mont-Fh and Mont-Goe complexes under pH 3–9 |
蒙脱石-水铁矿/针铁矿复合体对钨的吸附显著大于蒙脱石,且随复合体中Fe含量增加而增加。氧化铁表面多携带较多的正电荷,使蒙脱石表面负电性减少,从而促进钨与吸附剂的结合;此外,钨可能在氧化铁表面形成更加稳定的内圈络合物。
对比两种不同复合体发现,蒙脱石-水铁矿对钨的吸附量显著高于蒙脱石-针铁矿。水铁矿是不稳定态铁氧化物,是针铁矿形成的中间过渡态。水铁矿核心是八面体结构但其表面存在四面体结构,这种未饱和状态使其具有较大的比表面和表面位点;而针铁矿则是由八面体联成的链状晶体结构,吸附性能较水铁矿差[20-21]。此外,针铁矿的零点电荷pH(pHPZC)要小于水铁矿[10, 22-23],pHPZC越低则矿物表面所带负电荷越多,增大了矿物与带负电荷的WO42–间的静电斥力。
2.3 钨的表面络合形态利用原位ATR-FTIR技术研究了吸附态钨的络合形态。图 3A和3B分别为蒙脱石在pH 4和7时,表面吸附态钨的红外光谱。随反应时间的增加,钨的红外光谱峰强增加,在120 min时基本达到吸附平衡。Na2WO4在吸收峰位948 cm–1和896 cm–1处有两个明显的峰,可能归属于W-O的对称伸缩振动[24]。在pH 4和pH 7时,钨在蒙脱石上的吸附光谱都与Na2WO4光谱有较高的一致性,暗示蒙脱石表面吸附态钨结构与WO42–结构相同,意味着钨没有发生内圈络合反应,而主要以外圈络合物形式结合在蒙脱石表面。
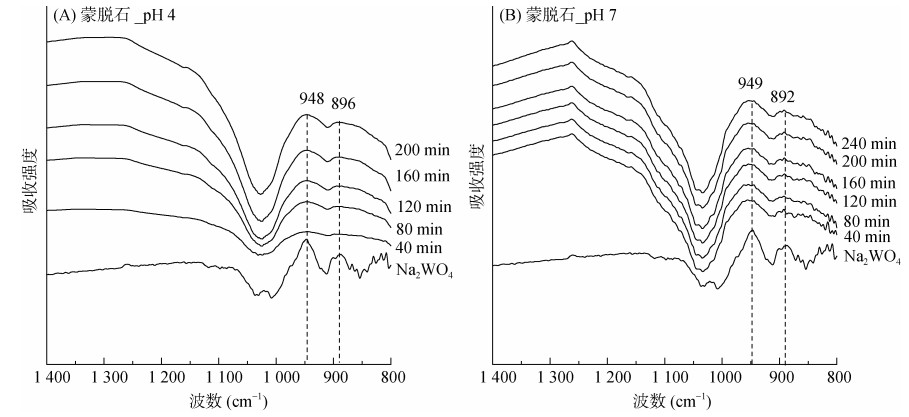
|
图 3 蒙脱石表面吸附态钨的原位红外光谱以及Na2WO4标准图谱 Fig. 3 ATR-FTIR spectra of absorbed tungsten on Mont surface and standarded Na2WO4 |
图 4为蒙脱石-水铁矿/针铁矿复合体表面吸附态钨的红外光谱,可以明显看出钨在蒙脱石-氧化铁表面的吸附形态与在蒙脱石表面的显著不同。在pH 7时,钨在蒙脱石-水铁矿上的吸附光谱出现两个宽峰,分别位于吸收峰位924 cm–1和826 cm–1。与蒙脱石体系对比,826 cm–1新峰可能归因于钨在水铁矿表面的内圈络合反应[11],进一步生成Fe-O-W络合物。与之相似,在pH 7时,钨在蒙脱石-针铁矿上的吸附光谱也在吸收峰位938 cm–1和827 cm–1处出现峰位,表明钨在针铁矿表面也有内圈络合物生成。但对比峰强度可知,钨在蒙脱石-针铁矿上的内圈络合强度要小于蒙脱石-水铁矿,可能由于其较低的吸附量。
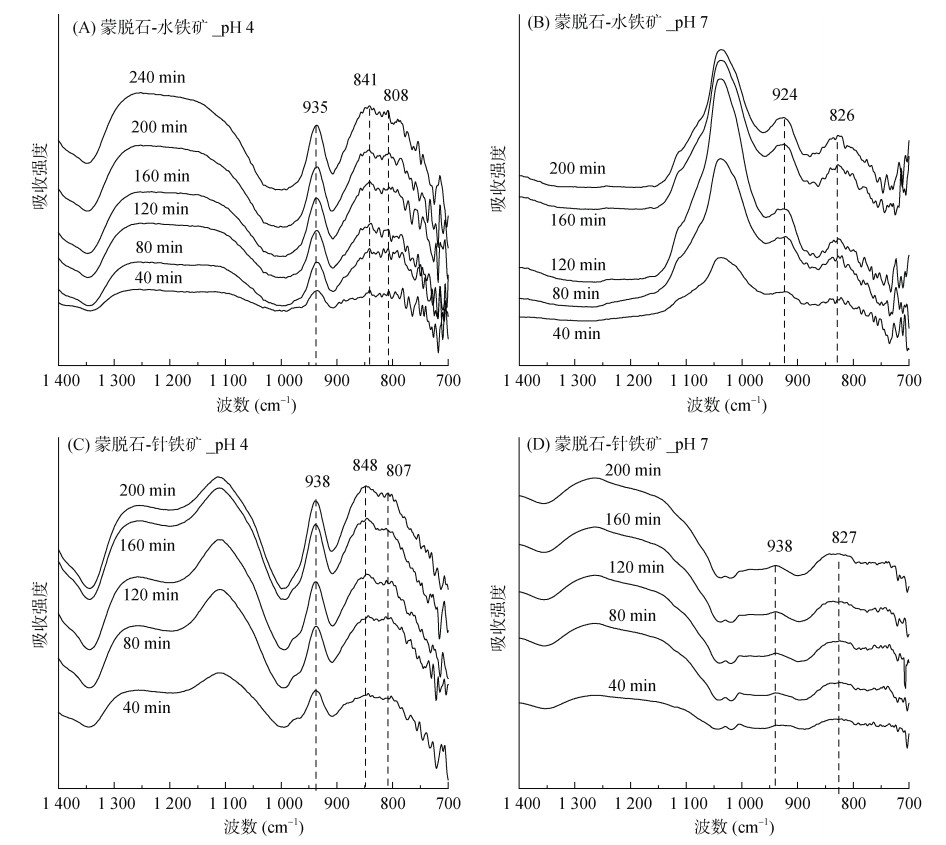
|
图 4 蒙脱石-水铁矿和蒙脱石-针铁矿复合体表面吸附态钨的原位红外光谱 Fig. 4 ATR-FTIR spectra of absorbed tungsten on Mont–Fh and Mont–Goe complex surfaces |
当pH 4时,钨在蒙脱石-水铁矿上吸附光谱出现3个峰值,分别为吸收峰位935、841和808 cm–1,推测在酸性条件下,表面吸附态钨可能存在新的赋存形式。一些学者的研究表明[11-12, 24-25],聚钨酸根(W-O-W)的伸缩振动主要位于吸收峰位835 ~ 877 cm–1,因此我们推测在pH 4时,钨在蒙脱石-水铁矿和蒙脱石-针铁矿上不仅有内圈络合,还能形成聚合态钨。前人报道也发现,当pH为4时,溶液中的聚钨酸盐主要以伪钨酸盐[HW6O20]3–和偏钨酸盐[H2W12O40]6–存在[26]。
为了进一步证明蒙脱石-氧化铁表面Fe-OH参与了络合反应,我们将蒙脱石-水铁矿和蒙脱石-针铁矿吸附钨前后的样品进行XPS分析,结果见图 5。Fe 2p图谱可分为两个组分,分别为表面FeOOH(713.5 eV)和内部Fe-O-Fe(711.5 eV)。对蒙脱石-水铁矿,吸附钨前两组分占比分别为44.3% 和55.7%;当吸附钨后,713.5 eV组分上升到49.1%,表明水铁矿表面铁羟基参与了钨的络合,形成内圈Fe-O-W,贡献了~713.5 eV组分。与之相似,蒙脱石-针铁矿吸附钨后FeOOH组分由44.4% 上升到49.7%,进一步表明针铁矿表面铁羟基参与了内圈络合反应。
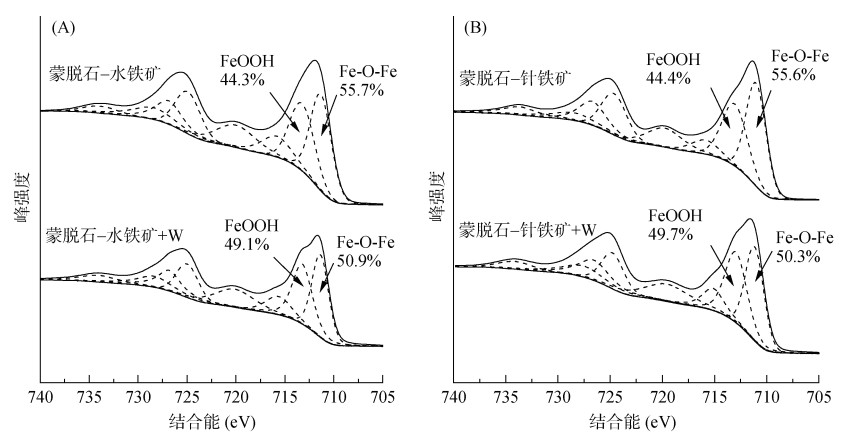
|
图 5 蒙脱石-水铁矿和蒙脱石-针铁矿复合体吸附钨前后Fe 2p XPS光谱 Fig. 5 Fe 2p XPS spectra of Mont-Fh and Mont-Goe complexes before and after binding of tungsten |
以上结果表明,钨在蒙脱石表面主要以外圈络合物形式存在,而在蒙脱石-氧化铁复合体上主要以内圈络合物形式存在,且在较低pH时形成聚合态钨。
2.4 环境意义与展望本研究结果证实,当硅酸盐矿物表面覆盖氧化铁,会显著改变钨的吸附量、吸附方式和聚合状态。因此,在评估土壤对钨的吸附缓冲能力,土壤铁含量和氧化铁形态将是一个重要指标。由于钨在蒙脱石表面主要以外圈络合物形式存在,因此稳定性差,在环境条件改变下有较高的解吸风险。而当蒙脱石表面覆盖氧化铁,形成亲和力较高的内圈络合物,稳定性要高于外圈络合物。但在特殊条件下,表面氧化铁也发生由生物和非生物介导的还原溶解,进一步造成结合态钨的释放。
前人研究发现,钨酸盐单体在碱性土壤中较为常见,而聚钨酸盐在酸性土壤中占主导[3, 5]。结合本文结果,聚合态钨可能主要形成在土壤氧化铁表面。聚合态钨的溶解度低于钨酸盐单体,因此钨在碱性土壤中的移动性更高。有研究发现,钨酸盐单体和低聚态钨更容易被植物体吸收[2, 27]。这也更加证实,碱性土壤中钨的生态环境风险更高。这对于指导农业生产活动提供了一定理论基础,如人为添加碱性物质(石灰、碱性肥料等)至土壤中,可能使钨的溶解性和活性增强,增大钨在土壤中的流动性,从而加大受钨污染土壤修复的难度。
土壤组分十分复杂,还存在大量的有机组分如微生物、腐殖酸等[28-29],它们如何吸附络合钨,以及进一步影响土壤钨的迁移转化值得后续研究关注。土壤中的水铁矿处于亚稳定态,在一定pH、温度以及其他化学条件下能发生结晶转化[30-32],也可能发生还原溶解。未来的研究也需关注矿物转化、溶解、重结晶过程中钨的动态行为。
3 结论蒙脱石表面覆盖氧化铁显著促进对钨的吸附,且水铁矿比针铁矿的促进作用更显著。蒙脱石表面吸附态钨主要以外圈络合物形式存在,与溶液中Na2WO4形态相似。蒙脱石-氧化铁复合体表面钨主要与FeOOH反应生成内圈络合物(Fe-O-W),且在低pH时形成聚合态钨。pH显著影响钨在土壤界面的吸附和形态,进一步造成偏碱性土壤中钨的移动性和生态风险更高。本研究证实,在预测土壤钨的迁移转化、生物有效性和归宿时必须考虑矿物复合体系。
| [1] |
Clausen J L, Korte N. Environmental fate of tungsten from military use[J]. Science of the Total Environment, 2009, 407(8): 2887-2893 DOI:10.1016/j.scitotenv.2009.01.029 (  0) 0) |
| [2] |
Oburger E, Vergara Cid C, Schwertberger D, et al. Response of tungsten (W) solubility and chemical fractionation to changes in soil pH and soil aging[J]. Science of the Total Environment, 2020, 731: 139224 DOI:10.1016/j.scitotenv.2020.139224 (  0) 0) |
| [3] |
Datta S, Vero S E, Hettiarachchi G M, et al. Tungsten contamination of soils and sediments: Current state of science[J]. Current Pollution Reports, 2017, 3(1): 55-64 DOI:10.1007/s40726-016-0046-0 (  0) 0) |
| [4] |
杜辉辉, 刘新, 李杨, 等. 土壤中钨的环境行为与潜在风险: 研究进展与展望[J/OL]. 土壤学报, 2022, 59(2). DOI: 10.11766/trxb202011100503.
(  0) 0) |
| [5] |
Bednar A J, Jones W T, Boyd R E, et al. Geochemical parameters influencing tungsten mobility in soils[J]. Journal of Environmental Quality, 2008, 37(1): 229-233 DOI:10.2134/jeq2007.0305 (  0) 0) |
| [6] |
Bradl H B. Adsorption of heavy metal ions on soils and soils constituents[J]. Journal of Colloid and Interface Science, 2004, 277(1): 1-18 DOI:10.1016/j.jcis.2004.04.005 (  0) 0) |
| [7] |
Sen Tuna G, Braida W. Evaluation of the adsorption of mono- and polytungstates onto different types of clay minerals and pahokee peat[J]. Soil and Sediment Contamination: an International Journal, 2014, 23(8): 838-849 DOI:10.1080/15320383.2014.809049 (  0) 0) |
| [8] |
Li R P, Lin C Y, Liu X T. Adsorption of tungstate on kaolinite: Adsorption models and kinetics[J]. RSC Advances, 2016, 6(24): 19872-19877 DOI:10.1039/C5RA24201K (  0) 0) |
| [9] |
Garcı́a-Sánchez A, Alastuey A, Querol X. Heavy metal adsorption by different minerals: Application to the remediation of polluted soils[J]. Science of the Total Environment, 1999, 242(1/2/3): 179-188 (  0) 0) |
| [10] |
Iwai T, Hashimoto Y. Adsorption of tungstate (WO4) on birnessite, ferrihydrite, gibbsite, goethite and montmorillonite as affected by pH and competitive phosphate (PO4) and molybdate (MoO4) oxyanions[J]. Applied Clay Science, 2017, 143: 372-377 DOI:10.1016/j.clay.2017.04.009 (  0) 0) |
| [11] |
Rakshit S, Sallman B, Davantés A, et al. Tungstate (Ⅵ) sorption on hematite: An in situ ATR-FTIR probe on the mechanism[J]. Chemosphere, 2017, 168: 685-691 DOI:10.1016/j.chemosphere.2016.11.007 (  0) 0) |
| [12] |
Sallman B, Rakshit S, Lefèvre G. Influence of phosphate on tungstate sorption on hematite: A macroscopic and spectroscopic evaluation of the mechanism[J]. Chemosphere, 2018, 213: 596-601 DOI:10.1016/j.chemosphere.2018.09.157 (  0) 0) |
| [13] |
Du H H, Xu Z L, Hu M, et al. Natural organic matter decreases uptake of W(Ⅵ), and reduces W(Ⅵ) to W(Ⅴ), during adsorption to ferrihydrite[J]. Chemical Geology, 2020, 540: 119567 DOI:10.1016/j.chemgeo.2020.119567 (  0) 0) |
| [14] |
魏世勇. 氧化铁—层状硅酸盐矿物二元体的形成、微观结构和表面性质[D]. 武汉: 华中农业大学, 2010.
(  0) 0) |
| [15] |
Bronick C J, Lal R. Soil structure and management: A review[J]. Geoderma, 2005, 124(1/2): 3-22 (  0) 0) |
| [16] |
Kleber M, Eusterhues K, Keiluweit M, et al. Mineral-organic associations: Formation, properties, and relevance in soil environments[J]. Advances in Agronomy, 2015, 130: 1-140 (  0) 0) |
| [17] |
Gomez-Gonzalez M A, Villalobos M, Marco J F, et al. Iron oxide - clay composite vectors on long-distance transport of arsenic and toxic metals in mining-affected areas[J]. Chemosphere, 2018, 197: 759-767 DOI:10.1016/j.chemosphere.2018.01.100 (  0) 0) |
| [18] |
许海娟, 王锐, 魏世勇, 等. 蒙脱石-氧化铁复合体的表征及其对不同形态磷的吸附特性[J]. 土壤学报, 2019, 56(6): 1381-1389 (  0) 0) |
| [19] |
王阿龙. 改性蒙脱石对废水中铅的吸附性能研究[D]. 南京: 南京理工大学, 2018.
(  0) 0) |
| [20] |
彭昌军. 铁氧化物及铁锰复合氧化物对砷的吸附及其应用研究[D]. 厦门: 厦门大学, 2014.
(  0) 0) |
| [21] |
Liu J, Zhu R L, Ma L Y, et al. Adsorption of phosphate and cadmium on iron (oxyhydr)oxides: A comparative study on ferrihydrite, goethite, and hematite[J]. Geoderma, 2021, 383: 114799 DOI:10.1016/j.geoderma.2020.114799 (  0) 0) |
| [22] |
Sparks D L. Environmental soil chemistry[M].
Academic Press, United States, 2003
(  0) 0) |
| [23] |
Kingston F J, Posner A M, Quirk J P. Anion adsorption by goethite and gibbsite[J]. Journal of Soil Science, 1972, 23(2): 177-192 DOI:10.1111/j.1365-2389.1972.tb01652.x (  0) 0) |
| [24] |
Davantès A, Costa D, Lefèvre G. Infrared study of (poly)tungstate ions in solution and sorbed into layered double hydroxides: Vibrational calculations and in situ analysis[J]. The Journal of Physical Chemistry C, 2015, 119(22): 12356-12364 DOI:10.1021/acs.jpcc.5b01578 (  0) 0) |
| [25] |
Sun J, Bostick B C. Effects of tungstate polymerization on tungsten(Ⅵ) adsorption on ferrihydrite[J]. Chemical Geology, 2015, 417: 21-31 DOI:10.1016/j.chemgeo.2015.09.015 (  0) 0) |
| [26] |
Ogata F, Nakamura T, Ueta E, et al. Adsorption of tungsten ion with a novel Fe-Mg type hydrotalcite prepared at different Mg2+/Fe3+ ratios[J]. Journal of Environmental Chemical Engineering, 2017, 5(4): 3083-3090 DOI:10.1016/j.jece.2017.06.017 (  0) 0) |
| [27] |
Oburger E, Vergara Cid C, Preiner J, et al. pH-dependent bioavailability, speciation, and phytotoxicity of tungsten (W) in soil affect growth and molybdoenzyme activity of nodulated soybeans[J]. Environmental Science & Technology, 2018, 52(11): 6146-6156 (  0) 0) |
| [28] |
李杨, 周丽, 杜辉辉, 等. Cd(Ⅱ)与As(Ⅴ)在一株土壤细菌Delftia sp. 上的共吸附研究[J]. 土壤, 2020, 52(5): 935-940 (  0) 0) |
| [29] |
杜辉辉, 陶洁, 聂宁, 等. α-氧化铝–细菌二元复合胶体对锑的吸附研究[J]. 土壤学报, 2021, 58(3): 704-711 (  0) 0) |
| [30] |
Hu S W, Lu Y, Peng L F, et al. Coupled kinetics of ferrihydrite transformation and as(Ⅴ) sequestration under the effect of humic acids: A mechanistic and quantitative study[J]. Environmental Science & Technology, 2018, 52(20): 11632-11641 (  0) 0) |
| [31] |
胡世文, 刘同旭, 李芳柏, 等. 土壤铁矿物的生物-非生物转化过程及其界面重金属反应机制的研究进展[J]. 土壤学报, 2022, 59(1): 54-65 (  0) 0) |
| [32] |
刘晶. 金属离子在典型铁氧化物表面的吸附、氧化/还原及结晶生长研究[D]. 北京: 中国科学院大学(中国科学院广州地球化学研究所), 2019.
(  0) 0) |
2. Yonker Environmental Protection Co., Ltd., Changsha 410128, China
 2022, Vol. 54
2022, Vol. 54


