2. 中国科学院大学, 北京 100049
我国酸性土壤(pH<5.5)面积约2亿hm2,主要分布在南方红壤区[1]。在酸性红壤上植物面临的逆境环境中,低的土壤磷素有效性是主要养分限制因子[2]。丛枝菌根真菌(arbuscular mycorrhizal fungi, AMF)普遍存在于土壤环境中,与植物形成互利共生关系,对提高植物磷素吸收具有重要作用[3]。AMF具有丰富的物种多样性,其生理生态功能与群落结构密切相关,不同的AMF群落通常对植物磷素吸收贡献不同[4]。因此,了解酸性红壤AMF群落多样性和组成以及与土壤环境的关系,是充分挖掘酸性红壤AMF生态功能潜力的必要条件,对提高植物磷素吸收有重要意义。
土壤AMF群落多样性和组成结构受到农业管理措施的强烈影响[5]。特别是,土地利用方式的改变严重影响了土壤理化性质、养分循环、生物多样性和组成结构[6]。在不同土地利用方式下,土壤理化性质是影响土壤AMF多样性和群落结构的重要因素[7]。长期相同利用方式的土壤AMF群落形成了特有的组成结构[8]。此外,在土壤–植物系统中,根际作用也显著影响了AMF群落[9],不同根系分泌物组分调控不同AMF种类在根际的定植及生长[10]。研究发现,同一生境下共存的不同植物类型,其共生的AMF种类明显不同[11]。由此可见,各种因素对AMF群落的影响并不是独立的,而是一个有机的整体。在研究土地利用方式对根际AMF群落的影响时,也应该考虑植物根际效应对AMF的作用强度。
近60年来,我国南方酸性红壤地区遭遇严重的土地利用方式改变,特别是自然植被用地向农业用地的转变。这种土地利用方式改变对土壤AMF群落的影响还鲜有报道。在前期研究中,本课题组调查了酸性红壤土地利用方式对土壤固氮微生物群落的影响[12]。在此基础上,本研究拟进一步分析不同土地利用方式下非根际和根际土壤AMF群落多样性和组成结构,明确土地利用方式、根际作用二者谁是影响酸性红壤AMF群落的主要因素,并阐明其机制,以为了解酸性红壤AMF群落组成、深入挖掘AMF资源提供理论基础和科学支撑。
1 材料与方法 1.1 研究地点和土样采集研究区位于中国科学院鹰潭国家农业生态系统观测研究站(28°15′ N,116°55′ E)。该地区土壤为酸性红黏土,由第四纪红黏土发育而成。于2018年6月13日作物(玉米、花生和大豆)开花期,选取5个不同农田利用方式的地点(均由草地转化而来),在每个地点选择4种典型的土地利用方式(草地、玉米、花生和大豆),且4种土地利用类型按照当地的田间管理制度已经连续种植同一作物超过15年,采用5点采样法采集根际和非根际两种点位土壤。根际土壤采用抖根法收集,其中绿狐尾是草地的优势物种,其根际土壤主要来自绿狐尾。本研究共采集40份土壤样品,每份土壤样品分成3份:一份新鲜土样储存在4℃下,用于测定铵态氮和硝态氮含量;一份风干过2 mm筛后测量其他土壤理化性质;一份存放在–80 ℃冰箱以提取土壤DNA。
1.2 土壤理化性质测定土壤pH采用pH计(Mettler Toledo FE20,上海,中国)测定;有机质和全氮含量分别采用硫酸–重铬酸盐氧化法[13]和凯氏定氮法测定[14];铵态氮和硝态氮含量采用氯化钾溶液浸提,连续流动分析仪(San++,Skalar,Holland)测定;有效磷含量采用盐酸–氟化铵溶液浸提,钼蓝比色法测定[13];速效钾含量采用醋酸铵溶液浸提,火焰光度法测定(FP640,Shanghai,China)。土壤理化因子结果已在前期研究结果中展示[12]。
1.3 土壤DNA提取和高通量测序使用DNA试剂盒(FastDNA SPIN Kit for soil)提取土壤DNA。以提取的DNA为模板,进行PCR扩增。AMF的特异性引物AMV4.5NF序列为5′-AAGC TCGTAGTTGAATTTCG-3′和AMDGR(5′-CCCAACT ATCCCTATTAATCAT-3′) [15]。在每个样品的上游引物5'端添加一段长度为7 bp的特异性多肽以区分样品。PCR反应体系和程序参照Lee等[16]。将纯化的扩增子合并为等摩尔体积,使用Illumina MiSeq250测序平台进行高通量测序(上海派森诺生物技术有限公司)。
使用QIIME v1.9.1软件包处理测序数据。序列经过质量过滤,去除嵌合序列、小于220 bp的短序列以及引文序列,将剩余的高质量序列聚类为操作分类单元(OTU),阈值设置为97%,并选取每个OTU中丰度最高的序列作为代表序列,基于NCBI GenBank库对代表序列进行分类学注释。基于最小序列数,每个样品的序列被稀释到44 535个序列,用于α和β多样性分析。使用QIIME软件计算α多样性指数(香农指数和物种丰富度)。
1.4 数据分析使用软件SPSS 20.0进行统计学分析。采用双向方差分析(ANOVA)检验土地利用方式和采样点位(根际和非根际)对AMF群落优势属相对丰度和α多样性的影响。如果差异具有统计学意义(P<0.05),再使用单因素方差分析或T检验进行差异比较。采用Pearson法进行相关性分析。
基于Bray-Curtis距离,采用非度量多维标度(NMDS)展示AMF群落的组成结构。置换多元方差分析(PERMANOVA)用于检验土地利用方式和采样点位(根际和非根际)对AMF群落结构影响差异的显著性。运用相似度分析(similarity percentage,SIMPER)找出造成不同土地利用方式AMF群落差异的关键属。使用Mantel检验土壤理化因子对AMF群落结构的影响。以上分析均使用R软件vegan包完成。
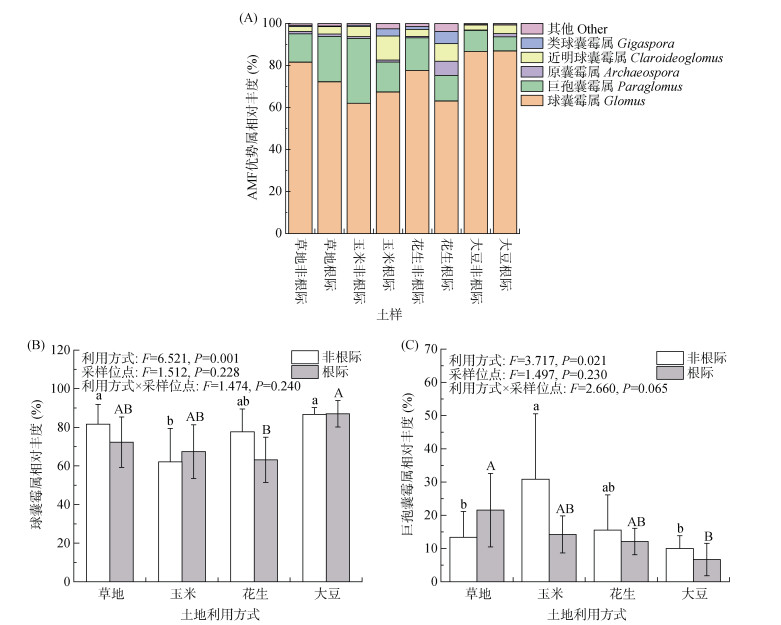
2 结果与分析 2.1 酸性红壤AMF群落优势属如图1A所示,所调查的酸性红壤样品中AMF群落优势属(相对丰度>1%)包括:球囊霉属(Glomus,62.1% ~ 86.7%)、巨孢囊霉属(Paraglomus,6.0% ~ 30.1%)、原囊霉属(Archaeospora,0.2% ~ 6.7%)、近明球囊霉属(Claroideoglomus,2.2% ~ 11.4%)和类球囊霉属(Gigaspora,0.1% ~ 3.4%)。本文重点分析了土地利用方式和根际作用(采样点位)对球囊霉属和巨孢囊霉属的影响,发现土地利用方式显著影响其相对丰度(P<0.05),但是根际作用影响并不显著(图1B和1C)。草地和大豆地非根际土壤球囊霉属的相对丰度明显高于玉米地(P<0.05),而大豆地根际球囊霉属的相对丰度明显高于花生地根际(P<0.05) (图1B)。玉米地非根际土壤巨孢囊霉属的相对丰度显著高于草地和大豆地(P<0.05),而大豆地根际土壤巨孢囊霉属的相对丰度显著低于草地(P<0.05) (图1C)。
|
(柱图上方不同小写和大写字母分别表示非根际和根际样品在不同土地利用方式间显著差异(P<0.05);下同) 图 1 不同土地利用方式下非根际和根际土壤AMF优势属(相对丰度>1%) Fig. 1 Relative abundances of dominant AMFs under different land-use patterns (relative abundance>1%) |
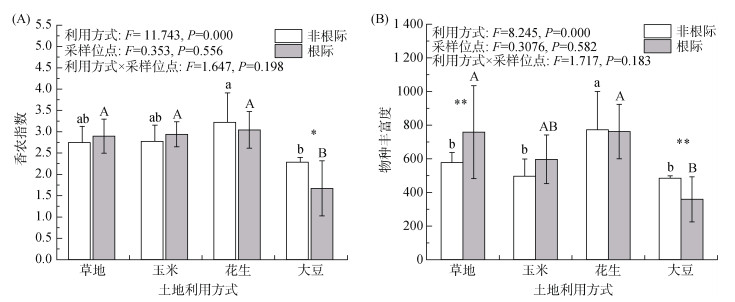
研究区不同土地利用方式土壤AMF群落的α多样性如图2所示。双因素方差分析表明,土地利用方式显著影响了AMF群落的香农指数和物种丰富度(P<0.05),而根际作用(采样点位)影响并不显著。相比其他3种土地利用方式,大豆地的香农指数最低(图2A),而且大豆地AMF群落物种丰富度明显低于花生地,并且大豆地根际土壤AMF群落物种丰富度显著低于草地根际(P<0.05) (图2B)。
|
图 2 不同土地利用方式下非根际和根际土壤AMF群落多样性指数 Fig. 2 Community diversity indexes of AMFs under different land-use patterns |
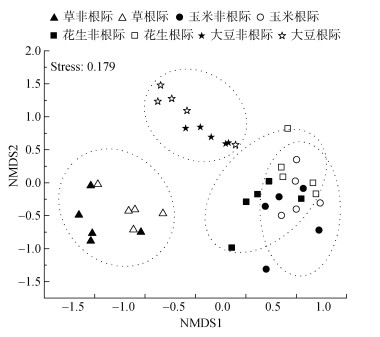
NMDS分析结果(图3)显示,AMF群落组成结构在不同土地利用方式间明显分开,而同一土地利用方式下的根际和非根际样品相似度更高(图3)。PERMANOVA检验显示,土地利用方式和根际作用均显著影响了AMF群落组成结构(表1),但是土地利用方式的作用强度(F=14.164,P=0.001)明显高于根际作用(F=2.339,P=0.044)。土地利用方式两两之间AMF群落组成差异显著(P<0.05),其中草地与大豆地之间的差异最大(F=30.407,P=0.001)。对于根际作用,只有大豆地非根际和根际之间AMF群落组成的差异显著(P<0.05)。
|
图 3 不同土地利用方式下土壤AMF群落结构的NMDS分析 Fig. 3 NMDS analysis of AMF community compositions under different land-use patterns |
|
|
表 1 不同土地利用方式下AMF群落组成的PERMANOVA分析 Table 1 PERMANOVA analysis (global test and pairwise comparison) of AMF community compositions under different land-use patterns |
SIMPER分析表明,球囊霉属解释了草地和每种土地利用方式之间的大部分差异,其相对贡献在草地和大豆地之间最高(表2)。
|
|
表 2 不同土地利用方式间AMF群落组成差异的优势属贡献率(%) Table 2 Contributions of dominant species to AMF community compositions under different land-use patterns |
相关性分析表明(表3),AMF群落α多样性指数与土壤理化因子无显著性相关。Mantel检验表明,土壤pH、铵态氮、硝态氮、有效磷、速效钾和有机质均与AMF群落组成结构显著相关(P<0.05),其中与土壤pH的相关系数最大。
|
|
表 3 土壤理化因子与AMF群落多样性和组成结构的相关性 Table 3 Correlation between soil physicochemical characteristics and AMF diversity and community structure |
土地利用变化是影响土壤生物群落和陆地生态系统功能变化的最重要人为活动之一。已有研究报道了土地利用方式对土壤AMF群落的影响[5,15]。此外,植物根际作用对AMF的影响也已有明确定论[17],但是,AMF群落对土地利用变化过程中根际作用的响应还缺乏充足认识。本研究发现,与植物根际效应相比,酸性红壤中土地利用方式对土壤AMF群落优势属、多样性指数和群落组成结构的影响更大 (图1、图2和表1),这支撑了以前的研究结果,即土地利用方式对土壤AMF群落有着重要影响[18]。
本研究中,土地利用方式对AMF群落影响比根际效应更强,这归因于多种因素。首先,所研究的土地利用变化已持续15年以上,表现出对土壤环境的长期影响,而根际效应是短期影响,对土壤的作用仅几个月。多数土壤微生物物种需要时间适应环境变化[19],因此,相对短时间的根际效应对土壤AMF群落的影响程度应该较小。其次,酸性土壤本身的特点决定了土地利用变化对土壤环境的干扰强度要比根际效应更强,这一点可在测定的土壤理化性质中观察到,即土地利用方式对土壤理化因子的影响程度大于根际作用[12]。类似的,有研究报道,玉米和大豆的间作系统对土壤AMF群落多样性影响显著高于根际效应[20]。再者,根际富集的微生物物种主要来自周围的非根际土壤,与其他土地利用方式相比,同一土地利用方式下非根际和根际土壤之间的微生物群落组成应该更为相似。因此,不同土地利用方式间土壤本身AMF群落组成的差异可能削弱了整体根际效应的作用强度。
土地利用变化可通过多种方式影响土壤微生物,包括土壤理化性质、植物种类以及田间管理等(化肥、农药和灌溉)[21]。本研究中,所有研究地点的土壤类型相同、地理位置相近,因此,土地利用方式是引起土壤理化性质改变的主要原因。与自然草地相比,农业用地的土壤养分有效性,包括铵态氮、硝态氮、速效钾、有效磷和有机质含量更高[12],而且这些理化因子均与土壤AMF群落组成结构密切相关(表3)。本研究中,土壤pH是影响土壤AMF群落结构的最关键因子。土壤pH对土壤AMF群落结构的影响多有报道[22]。一方面,土壤pH直接或间接通过调节土壤养分状况来影响土壤AMF群落组成[20,22];另一方面,在酸性土壤中,低的土壤pH破坏宿主植物叶绿体超微结构,导致分配到土壤AMF的养分减少,最终影响AMF群落组成结构[23]。
值得注意的是,所调查的土地利用方式中,与草地相比,大豆地明显降低了土壤AMF群落物种丰富度和香农指数,并强烈改变了AMF群落组成结构(图2和表1),表明土地利用方式对土壤AMF群落的影响也依赖于植物类型。豆科作物是根瘤菌的天然寄主,能与根瘤菌共生形成根瘤,向根瘤提供更多的养分反而降低了对AMF的分配,进而可能降低AMF物种丰富度[24]。此外,高氮土壤条件会抑制菌根定殖[25],当大豆根际中的共生固氮菌参与固氮时,土壤AMF物种可能会受到影响,但是,具体机制还需进一步深入研究。
本研究发现,球囊霉属(Glomus)是酸性红壤AMF群落丰度最大的属(图1A),而且主要解释了自然植被向农田土地利用方式转变过程中AMF群落组成结构的变化(表2),说明球囊霉属中的物种对酸性土壤环境干扰的耐受性较强,其偏好性地适应不同土地利用方式。球囊霉属作为球囊菌门的一类土壤真菌,其菌丝能渗入根皮层,从而扩大根系吸收面积,为植物生长提供充分的营养条件[26]。以往研究发现,在未扰动的自然草地转为耕地过程中,球囊霉属的菌丝更容易定殖[26-27],而且耕作机械破坏后,土壤结构发生改变,球囊霉属有能力重新建立相互连接的微生物网络[27]。由于球囊霉属在不同植物类型间的共生能力不同,导致球囊霉属在孢子萌发、菌根侵染和丛枝形成过程中植物种类间有所差异,进而影响土壤AMF群落组成结构[28]。
4 结论酸性红壤生态系统中,土地利用方式对土壤AMF群落的影响远大于根际效应。相比玉米和花生地,草地转变为大豆地对土壤AMF群落的影响最大,降低了AMF群落多样性。作为酸性红壤AMF群落中最丰度的属,球囊霉属(Glomus)主要贡献了土地利用方式中土壤AMF群落结构的改变。
| [1] |
易杰祥, 吕亮雪, 刘国道. 土壤酸化和酸性土壤改良研究[J]. 华南热带农业大学学报, 2006(1): 23-28 DOI:10.3969/j.issn.1674-7054.2006.01.005 (  0) 0) |
| [2] |
陈利军, 蒋瑀霁, 王浩田, 等. 长期施用有机物料对旱地红壤磷组分及磷素有效性的影响[J]. 土壤, 2020, 52(3): 451-457 (  0) 0) |
| [3] |
黄艳飞, 吴庆丽, 万群, 等. 丛枝菌根真菌的研究进展[J]. 现代农业, 2019(12): 9-12 DOI:10.3969/j.issn.1007-5739.2019.12.007 (  0) 0) |
| [4] |
苗原, 吴会芳, 马承恩, 等. 菌根真菌与吸收根功能性状的关系: 研究进展与评述[J]. 植物生态学报, 2013, 37(11): 1035-1042 (  0) 0) |
| [5] |
宋福强, 刘宇飞, 范晓旭. 耕种措施对农田生态系统AM真菌群落结构的影响[J]. 菌物学报, 2018, 37(8): 988-998 (  0) 0) |
| [6] |
Goss-Souza D, Mendes L W, Borges C D, et al. Soil microbial community dynamics and assembly under long-term land use change[J]. FEMS Microbiology Ecology, 2017, 93(10): fix109 (  0) 0) |
| [7] |
杨文莹, 孙露莹, 宋凤斌, 等. 陆地农业生态系统丛枝菌根真菌物种多样性研究进展[J]. 应用生态学报, 2019, 30(11): 3971-3979 (  0) 0) |
| [8] |
马少兰, 马彩霞, 徐鹏鑫, 等. 再植枸杞根际真菌群落对长期连作的响应研究[J]. 土壤学报, 2019, 56(6): 1493-1503 (  0) 0) |
| [9] |
王丽艳, 周晨, 刘光正, 等. 基于高通量测序的闽楠幼林根际土壤丛枝菌根真菌群落变化[J]. 微生物学通报, 2021, 48(5): 1461-1472 (  0) 0) |
| [10] |
葛伟, 董醇波, 张芝元, 等. 外生菌根真菌与内生细菌共生互作的研究进展[J]. 微生物学通报, 2021, 48(10): 3810-3822 (  0) 0) |
| [11] |
李荣波, 景跃波, 卯吉华, 等. 云南核桃不同套种模式根际丛枝菌根真菌多样性[J]. 北方园艺, 2021(5): 84-93 (  0) 0) |
| [12] |
Wang C, Zheng M M, Chen J, et al. Land-use change has a greater effect on soil diazotrophic community structure than the plant rhizosphere in acidic ferralsols in Southern China[J]. Plant and Soil, 2021, 462(1/2): 445-458 (  0) 0) |
| [13] |
Sims J R, Haby V A. Simplified colorimetric determination of soil organic matter[J]. Soil Science, 1971, 112(2): 137-141 DOI:10.1097/00010694-197108000-00007 (  0) 0) |
| [14] |
鲁如坤. 土壤农业化学分析方法[M]. 中国农业科技出版社, 2000.
(  0) 0) |
| [15] |
Lumini E, Orgiazzi A, Borriello R, et al. Disclosing arbuscular mycorrhizal fungal biodiversity in soil through a land-use gradient using a pyrosequencing approach[J]. Environmental Microbiology, 2010, 12(8): 2165-2179 (  0) 0) |
| [16] |
Lee J, Lee S S, Young J P W. Improved PCR primers for the detection and identification of arbuscular mycorrhizal fungi[J]. FEMS Microbiology Ecology, 2008, 65(2): 339-349 DOI:10.1111/j.1574-6941.2008.00531.x (  0) 0) |
| [17] |
李雪静, 徐天乐, 陈保冬, 等. 荒漠和草原生态系统丛枝菌根真菌多样性和群落结构[J]. 生态学杂志, 2017, 36(10): 2734-2743 (  0) 0) |
| [18] |
邱江梅, 曹建华, 李强. 云南岩溶断陷盆地土地利用方式对丛枝菌根真菌群落结构的影响[J]. 微生物学通报, 2020, 47(9): 2771-2788 (  0) 0) |
| [19] |
Reardon C L, Gollany H T, Wuest S B. Diazotroph community structure and abundance in wheat-fallow and wheat-pea crop rotations[J]. Soil Biology and Biochemistry, 2014, 69: 406-412 DOI:10.1016/j.soilbio.2013.10.038 (  0) 0) |
| [20] |
Bainard L D, Klironomos J N, Gordon A M. Arbuscular mycorrhizal fungi in tree-based intercropping systems: A review of their abundance and diversity[J]. Pedobiologia, 2011, 54(2): 57-61 DOI:10.1016/j.pedobi.2010.11.001 (  0) 0) |
| [21] |
王庆峰, 姜昕, 马鸣超, 等. 长期施用氮肥和磷肥对东北黑土丛枝菌根真菌群落组成的影响[J]. 中国农业科学, 2018, 51(17): 3315-3324 DOI:10.3864/j.issn.0578-1752.2018.17.007 (  0) 0) |
| [22] |
Xu X H, Chen C, Zhang Z, et al. The influence of environmental factors on communities of arbuscular mycorrhizal fungi associated with Chenopodium ambrosioides revealed by MiSeq sequencing investigation[J]. Scientific Reports, 2017, 7: 45134 DOI:10.1038/srep45134 (  0) 0) |
| [23] |
邓杰, 李芳, 古丽君, 等. 不同土壤pH下AM真菌对苜蓿苗期生长的影响[J]. 草业科学, 2019, 36(11): 2854-2862 (  0) 0) |
| [24] |
Zeng H L, Yu L L, Liu P, et al. Nitrogen fertilization has a stronger influence than cropping pattern on AMF community in maize/soybean strip intercropping systems[J]. Applied Soil Ecology, 2021, 167: 104034 DOI:10.1016/j.apsoil.2021.104034 (  0) 0) |
| [25] |
Zhang R Z, Mu Y, Li X R, et al. Response of the arbuscular mycorrhizal fungi diversity and community in maize and soybean rhizosphere soil and roots to intercropping systems with different nitrogen application rates[J]. Science of the Total Environment, 2020, 740: 139810 DOI:10.1016/j.scitotenv.2020.139810 (  0) 0) |
| [26] |
Munkvold L, Kjøller R, Vestberg M, et al. High functional diversity within species of arbuscular mycorrhizal fungi[J]. The New Phytologist, 2004, 164(2): 357-364 DOI:10.1111/j.1469-8137.2004.01169.x (  0) 0) |
| [27] |
Daniell T J, Husband R, Fitter A H, et al. Molecular diversity of arbuscular mycorrhizal fungi colonising arable crops[J]. FEMS Microbiology Ecology, 2001, 36(2/3): 203-209 (  0) 0) |
| [28] |
刘蕾, 徐梦, 张国印, 等. 不同轮作模式下设施土壤丛枝菌根真菌群落结构的季相变化[J]. 应用生态学报, 2021, 32(11): 4095-4106 (  0) 0) |
2. University of Chinese Academy of Sciences, Beijing 100049, China
 2022, Vol. 54
2022, Vol. 54


