2. 南京信息工程大学长望学院, 南京 210044;
3. 山东省德州市陵城区农业技术推广中心, 山东德州 253500;
4. 江苏省农业科学院农业资源与环境研究所, 农业农村部长江下游平原农业环境重点实验室, 南京 210014
地球大气中温室气体浓度呈现长期持续增长的趋势,对气候变化造成严重危害。自20世纪中期以来,全球平均表面温度上升源于3种主要温室气体(CO2、CH4和N2O)浓度的增加[1]。N2O在大气中含量虽少,但在100年尺度上其相对增温潜势是CO2的298倍[2]。2019年,全球N2O的平均浓度已达到0.332 μmol/mol,是1750年工业化前水平(0.27 μmol/mol) 的123%[3]。人类在过去40年内向农田施氮,使得人为N2O排放量增加30%,是造成N2O负担增长的主要原因[4]。我国稻田排放产生的N2O约占农田N2O排放总量的7% ~ 11%[5]。因此,控制稻田N2O排放是减缓温室效应的主要措施之一。
我国稻田的水分管理模式主要是以前期淹水、烤田、干湿交替和排水落干为特征的间隙灌溉[6]。土壤微生物好氧的硝化作用过程和厌氧的反硝化作用过程是稻田土壤N2O排放的重要来源[7]。一般认为烤田期和排水落干期水分条件适宜,土壤硝化菌和反硝化菌的活性增强,是产生N2O的主要阶段[8]。硝化作用由氨氧化过程和亚硝酸氧化过程组成,其中氨氧化过程是反应的限速步骤,而氨氧化古菌(AOA)和氨氧化细菌(AOB)是催化氨氧化过程的重要菌种[9]。反硝化作用是指在厌氧条件下,微生物将硝酸盐及亚硝酸盐还原为NO、N2O和N2的过程,其中由亚硝酸盐转变为NO的过程是反硝化作用的关键步骤[10],亚硝酸盐还原酶是调控该过程的关键酶,其功能基因由nirK和nirS编码[11]。N2O还原酶是调控N2O转变为N2的关键酶,其功能基因由nosZ编码[12]。通过研究与N2O排放相关的土壤微生物功能基因可从分子生物学角度探寻N2O的排放规律[13]。
秸秆还田作为一项保护地耕作措施,具有培肥地力、固碳增产的作用[14]。当前有关秸秆还田对稻田N2O排放影响的报道尚未达成一致结论。有研究表明,相比秸秆不还田处理,秸秆还田处理显著增加稻田N2O排放[15];施氮促进稻田N2O排放,而配施小麦秸秆则会抑制稻田N2O排放[16];添加水稻秸秆促进稻田N2O排放[17]。以上研究多从土壤理化性质角度分析秸秆还田对稻田N2O排放的影响,但与其微生物学机制相关联的研究较少。一方面,秸秆还田使微生物可利用碳源增加,增强微生物活性,加快氧气消耗从而形成厌氧环境,有利于进行反硝化作用,增加N2O排放[18];另一方面,由于秸秆碳氮比较高,加入土壤后会促进微生物对氮的固定,减少N2O排放[19]。因此,不同种类秸秆的施用对稻田N2O排放的影响具有不确定性,对硝化反硝化微生物的影响有待进一步研究。
基于此,本研究以典型单季稻田的原状土柱为研究对象,设置土柱试验,同步监测3种秸秆施用(水稻秸秆RS、小麦秸秆WS、玉米秸秆MS)下水稻各生长期N2O排放通量、水稻产量、土壤理化因子,同时利用分子生物学技术,将上述因子与N2O产生的微生物过程相耦合,定量化研究5个N2O排放相关菌群及功能基因(氨氧化古菌AOA、氨氧化细菌AOB、反硝化菌功能基因nirS、nirK、nosZ)的丰度,以阐明N2O排放对不同种类秸秆施用引发的微生物响应机制,筛选单季稻田N2O减排效果最佳的秸秆还田模式,为稻田温室气体排放估算与减排措施的研究提供科学依据。
1 材料与方法 1.1 盆栽试验设计与土样采集供试原状土样,采自江苏省宜兴市周铁镇(31.4765 °N,119.9861 °E)典型单季稻田,土柱试验在江苏省农业科学院现代化温室进行,供试验水稻品种南粳46,于2020年6月29日移栽,同年11月9日收获。供试土壤由0 ~ 20、20 ~ 40和40 ~ 60 cm三个深度的土壤各自混合均匀后得到,称取35 kg依次装入半径为15 cm、有效高度为50 cm的土柱内。土壤的基本理化性质为:pH 6.38(m土壤∶ V水=1∶2.5),有机质含量29.2 g/kg,全氮含量1.72 g/kg,有效磷含量23.09 mg/kg,速效钾含量159.28 mg/kg,CEC 22.61 cmol/kg。选用水稻、小麦和玉米3种作物秸秆作为供试秸秆,其基本性质如表 1所示。试验采用完全随机区组设计,共设置4个处理:空白对照(CK)、水稻秸秆还田(RS)、小麦秸秆还田(WS)、玉米秸秆还田(MS),每个处理3个重复,共12个盆栽。本试验中水稻秸秆由江苏省农业科学院提供,小麦和玉米秸秆由山东省德州市陵城区农业技术推广中心提供。还田秸秆采用尼龙网袋法处理,即将秸秆粉碎至1 ~ 2 cm大小后装入尺寸为15 cm×20 cm的350目尼龙网袋中密封,按照每盆280 g的施用量(0.8% 每克干土,相当于田间施入量约8 t/hm2)施用至盆栽内部5 ~ 10 cm处。
|
|
表 1 供试秸秆基本性质 Table 1 Basic properties of tested straw types |
综合当地施肥管理方式,氮肥(尿素)施用量为N 240 kg/hm2,基肥、分蘖肥和穗肥分别在2020年6月30日、7月15日和8月13日按50%、25% 和25% 比例施用;磷肥P2O5 96 kg/hm2和钾肥K2O 192 kg/hm2,作基肥一次性施用。水分管理采用间隙灌溉模式,并将水稻生长期分为前期淹水(2020年6月30日—7月29日)、烤田(7月30日—8月12日,通常土壤水分含量达到50% ~ 60% 田间最大持水量时结束烤田)、干湿交替(8月13日—10月14日)和排水落干(10月15日—11月9日)4个时期。
在水稻生长的4个典型生育期(分蘖期、拔节期、抽穗期和成熟期)原位采集0 ~ 10 cm深度土壤样品。一部分烘干磨碎过筛后用于基本理化性质分析,剩余部分在–20 ℃条件下保存用于土壤微生物分析。4个典型生育期采样时间分别对应前期淹水、排水烤田、干湿交替和排水落干时期。分别于施用基肥、分蘖肥和穗肥后7 d内每天下午17:00—19:00用50 ml塑料瓶采集田面水水样,过滤后测定NH4+-N和NO3–-N含量。土壤和田面水无机氮含量由荷兰SKALAR SAN++ SYSTEM流动分析仪测定(Skalar, the Netherlands)测定。水稻收获时计算水稻产量。
1.2 气样采集与测定本研究采用密闭静态暗箱法[20]采集气体,用气相色谱仪测定N2O浓度。采样箱(长25 cm×宽21 cm×高80 cm)由PVC材料制成,外覆铝膜,具有不透光性。采样箱内置小型风扇以使采集气体更均匀、更准确,同时配备温度计以记录采样时温度变化。采样前先倒置采样箱,使其边缘与盆栽盆凹槽密闭连接,然后向盆栽盆凹槽注水,密封采样箱,隔绝外界气体。选择上午08:00—10:00采集样品,一组采样设置4个采集时段,在45 min内完成,即用20 ml注射器每15 min向采样箱抽集气体。水稻生长季内水分变化剧烈的烤田及复水期每2 ~ 3 d采样1次,其他时间每隔4 ~ 5 d采样1次,水稻收获前1个月间隔7 d采样1次。
将采集的气样注入气相色谱仪(Shimadzu, GC14B),N2O浓度由放射源为63Ni的电子捕获(ECD)检测器以恒电流方式测量。对每组气样检测后的4个浓度值进行线性回归分析得到N2O排放通量,再通过积分求出水稻各生育期N2O的累积排放量。
根据N2O浓度与时间关系曲线计算排放通量:
| $F=\rho \times V / A \times \mathrm{d} c / \mathrm{d} t \times 273 /(273+T)$ | (1) |
式中:F代表N2O排放通量(N, μg/(m2·h));ρ为标准状态下N2O密度(1.25 kg/m3);V为采气箱内有效空间体积(m3);A为采气箱覆盖的土壤面积(m2);dc为气体浓度差(nl/L);dt为时间间隔(h);T为采样时箱温(℃)。
N2O排放通量用每次观测的3个重复的平均值及标准偏差表示。N2O平均排放量是将3个重复的每次观测值按时间间隔加权平均后再平均。N2O总排放量按下式计算:
| $ T=\sum\left[\left(F_{i+1}+F_{i}\right) / 2\right] \times\left(D_{i+1}-D_{i}\right) \times 24 / 1000 $ | (2) |
式中:T代表N2O排放总量(N,g/m2或mg/m2);Fi和Fi+1分别为第i和i+1次采样时N2O平均排放通量(N,μg/(m2·h));Di和Di+1分别为第i和i+1次采样时间(d)。
1.3 土壤微生物丰度分析称取水稻各典型生育期土样0.5 g,用Fast DNA SPIN KIT试剂盒(MP Biomedicals, Eschwege, Germany)提取总DNA[21]。DNA纯度和浓度检测方法均为NanoDrop2000,DNA完整性检测方法为琼脂糖凝胶电泳。操作按照说明书的提取步骤进行,将样品在冰上融化后,充分混匀并离心,取适量样品进行检测。将提取得到的微生物总DNA在电压5 V/cm条件下通过1% 琼脂糖凝胶电泳检测,检测时间为20 min,稀释10倍后进行下游实验。
使用Lighe Cycler ST300(Roche Diagnostics,Germany)定量PCR仪分别对成功提取的AOA、AOB及反硝化菌功能基因nirS、nirK、nosZ的特定DNA片段进行扩增。AOA和AOB的扩增引物分别为Arch-amoAF/Arch-amoAR和amoA1F/amoA2R[22],nirS、nirK和nosZ的扩增引物分别为Cd3aF/R3cdR[23]、COPPER583F/COPPER909R[24]和nosLb/nosRb[25],按照定量试剂盒说明书设置程序。
使用CFX96C100™热循环器(Bio-Rad, Hercules, CA)进行扩增。AOA和AOB的扩增程序为:95 ℃变性3 min;然后35个循环为95 ℃变性45 s,53 ℃(AOA)或55 ℃(AOB)退火1 min,72 ℃延伸1 min;最后72 ℃处理7 min[26]。nirS的扩增程序为:95 ℃变性10 min;先进行6个循环:95 ℃变性15 s,63 ~ 58 ℃(–1℃/循环)处理30 s,72 ℃和80 ℃分别延伸30 s;再进行40个循环:95 ℃变性15 s,58 ℃退火30 s,72 ℃和80 ℃分别延伸30 s[27]。nirK的扩增程序为:94 ℃变性5 min;先进行5个循环:94 ℃变性30 s,72 ~ 67 ℃(–1℃/循环)处理1 min,72 ℃延伸1 min;再进行25个循环:94 ℃变性30 s,67 ℃退火1 min,72 ℃延伸1 min;最后72 ℃处理7 min[28]。nosZ的扩增程序为:95 ℃变性5 min;然后35个循环为94 ℃变性1 min,64 ℃退火1 min,72 ℃延伸1 min;最后72 ℃处理5 min[29]。
1.4 数据处理与分析采用Excel 2019进行数据处理,采用SPSS 25.0进行单因素方差分析(one-way ANOVA)、LSD法进行多重比较、Pearson法进行相关性分析,采用R-4.0.4和Amos 24.0进行结构方程模型(Structral Equation Modeling)构建与分析,采用Origin 2021绘制图形。
2 结果与分析 2.1 N2O排放通量变化图 1表示不同处理下水稻生长期N2O排放通量随水稻移栽天数的变化。各处理N2O排放通量变化趋势基本相同,在水稻移栽后20 d内基本没有N2O的产生,即尽管前期淹水时大量施用含氮的基肥和分蘖肥,但各个处理排放量较为稳定,秸秆还田处理与CK基本没有差异。施用分蘖肥后6 d至烤田开始期间,N2O排放通量逐渐稳步增长。烤田期间各处理N2O排放急剧增加,与CK相比,3个施用秸秆的处理N2O排放通量增加显著,且施用秸秆处理于移栽后33 d时达到峰值,之后急剧下降。其中,RS处理N2O排放通量峰值高达N 2 387.92 μg/(m2·h),是整个水稻生长期所有处理的最大值。随着烤田期的结束进入穗肥期,N2O的排放再次进入较低水平。施用穗肥后N2O排放通量有小幅波动,在水稻移栽后81 d时RS与WS处理的排放峰值分别为N 215.58 μg/(m2·h)和187.14 μg/(m2·h),但远小于烤田期峰值,此次波动处于穗肥期结束后的常规时期(不施肥)。
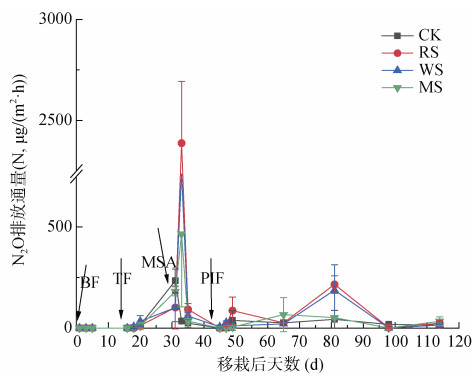
|
(BF:基肥,TF:分蘖肥,PIF:穗肥,MSA:烤田期;下同) 图 1 水稻生长期N2O排放通量的变化 Fig. 1 Variation in N2O emission flux during rice growing season |
由表 2可知,各处理N2O排放主要集中在烤田期,烤田期N2O排放量占水稻生育期总排放量的51.52% ~ 57.21%,其次是排水落干时期,占排放量的31.52% ~ 38.67%。与CK相比,RS、WS和MS处理分别增加N2O排放总量6.85、4.52和0.40 mg/m2,增幅分别为162.32%、107.11% 和9.48%,其中仅RS处理与CK处理N2O排放总量有显著性差异(P < 0.05)。施用秸秆均能显著增加水稻产量,与CK相比增产0.24 ~ 0.41 kg/m2,增幅16.78% ~ 28.67%(P < 0.05)。相比CK,RS处理显著增加了水稻单位产量N2O排放量的111.34%(P < 0.05),而其他处理的增加效果不显著。
|
|
表 2 2020年各处理不同水分管理时期N2O排放量、N2O排放总量、水稻产量和单位产量N2O排放量 Table 2 N2O emissions in different water managements periods, total N2O emissions, rice grain yields and N2O emissions per unit output during rice growing season in 2020 |
荧光定量PCR的检测结果表明(图 2),稻田土壤AOA和AOB数量分别介于1.91×105 ~ 1.41×107 copies/g和3.36×103 ~ 1.81×105 copies/g,AOA拷贝数比AOB多出2 ~ 3个数量级,可知本试验中水稻土壤环境更利于AOA生长。nirS、nirK和nosZ三种反硝化菌功能基因数量分别介于2.50×105 ~ 1.43× 107、7.86×104 ~ 1.74×106 copies/g和6.56×104 ~ 4.60× 106 copies/g,nirS拷贝数比nirK和nosZ多1个数量级,是反硝化过程中的优势功能基因。在水稻生育期内,除WS处理下nirK丰度一直降低外,其他各处理氨氧化菌和反硝化菌群落丰度随水稻生育期变化趋势大致相同,均为先上升后下降。在拔节期,相比CK,RS处理下AOA、AOB、nirS、nosZ丰度分别显著增加了6.14倍、8.26倍、4.82倍和16.96倍(P < 0.05),MS和WS处理对上述功能基因丰度均无显著影响;不同处理均对nirK丰度没有显著影响。同一生育期不同处理(nirK+nirS)/nosZ比值基本无显著性差异;CK和RS处理不同生育期该比值没有显著性差异;WS和MS处理分蘖期该比值显著高于其他3个时期(P < 0.05),而其他3个时期之间没有显著性差异。
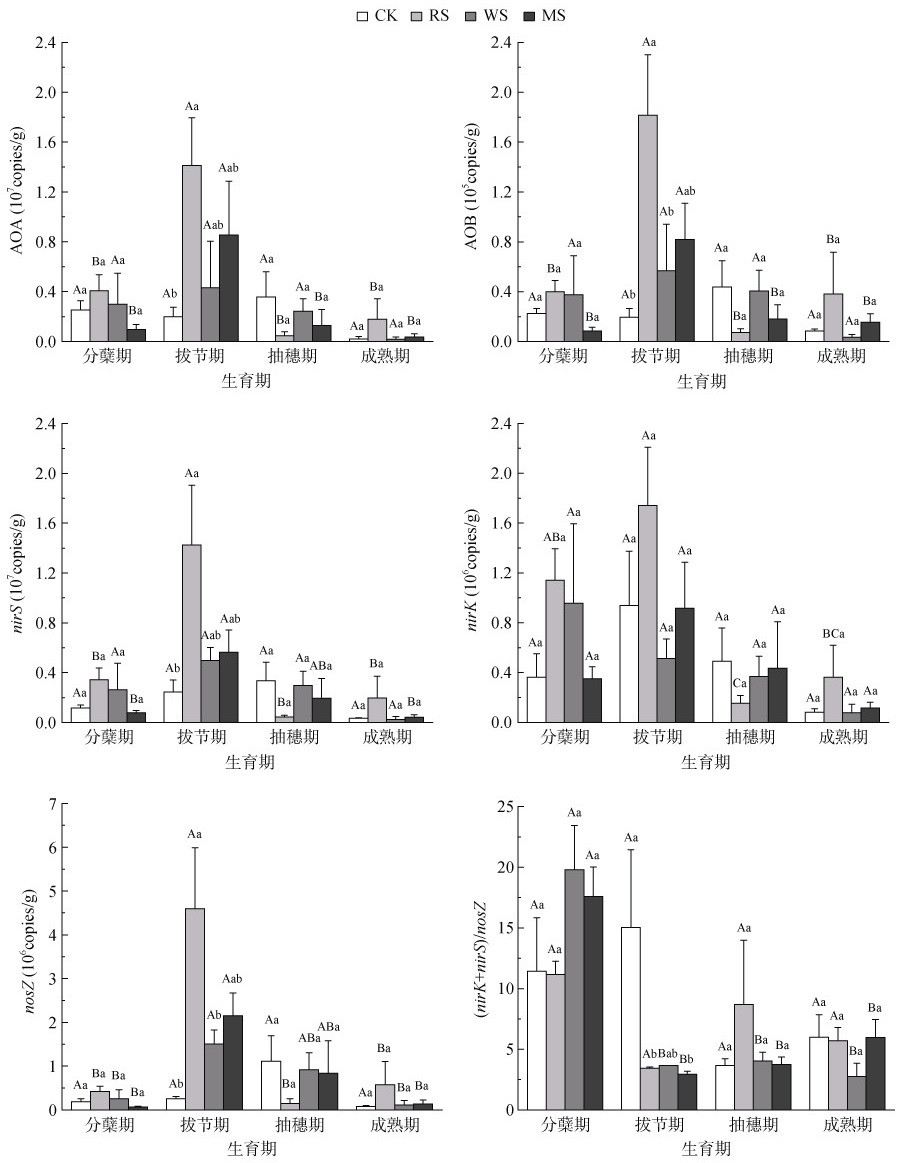
|
(图中不同大写字母表示同一处理不同时期间差异显著(P < 0.05),不同小写字母表示同一时期不同处理间差异显著(P < 0.05),下同) 图 2 水稻生长期土壤氨氧化菌(AOA和AOB)和反硝化菌(nirS/nirK/nosZ)的群落丰度 Fig. 2 Abundances of ammonia-oxidizing bacteria and ammonia oxidizing archaea (AOA and AOB) and denitrifiers (nirS/nirK/nosZ) during rice growing season |
图 3表明,本研究中土壤NH4+-N和NO3–-N含量均随水稻生长呈下降趋势,且NH4+-N含量整体高于NO3–-N含量。CK、RS、WS、MS处理下,土壤NH4+-N含量随生育期变化的极差分别为27.26、21.11、40.75、42.60 mg/kg;土壤NO3–-N含量的极差分别为19.32、12.41、11.00、6.43 mg/kg。不同生育期间比较,各处理下土壤NH4+-N和NO3–-N含量均在分蘖期达到峰值,其中CK处理分蘖期土壤NH4+-N含量显著高于其他3个生育期;RS处理各生育期之间土壤NH4+-N含量没有显著性差异;而WS和MS处理下,分蘖期土壤NH4+-N含量仅显著高于成熟期;除MS处理外,其余处理分蘖期土壤NO3–-N含量均显著高于其他3个生育期(P < 0.05)。不同处理间比较,抽穗期CK处理的土壤NH4+-N含量显著高于RS和MS处理(P < 0.05),抽穗期MS处理的土壤硝态氮含量显著高于CK和WS处理(P < 0.05),其他生育期内各处理之间均无显著性差异。
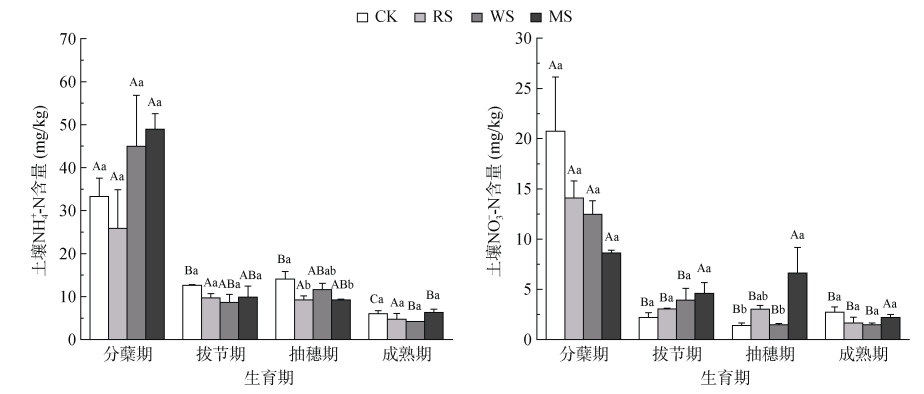
|
图 3 水稻生长期土壤NH4+-N、NO3–-N含量变化 Fig. 3 Variation in soil NH4+-N and NO3–-N contents during rice growing season |
如图 4所示,田面水NH4+-N浓度整体明显高于NO3–-N浓度。各个处理3个肥期田面水NH4+-N浓度变化趋势基本一致。水稻基肥期,1 ~ 4 d田面水NH4+-N浓度先大幅升高后迅速下降,且各个处理间峰值出现的时间存在差异,4 ~ 7 d内呈现先下降后升高趋势,变化幅度较上个时期小。水稻蘖肥期,田面水NH4+-N浓度每日以不同速率急剧下降。水稻穗肥期,NH4+-N浓度总体呈现下降趋势,变化速率先急后缓,其中1 ~ 4 d下降速率较快,4 ~ 7 d基本保持稳定。各个处理3个肥期田面水NO3–-N浓度变化趋势亦较为一致。水稻基肥期,1 ~ 2 d内各处理田面水NO3–-N浓度几乎没有增长,在2 ~ 4 d逐渐升高到达峰值,4 ~ 6 d缓慢下降,6 ~ 7 d内CK处理浓度下降而其余处理浓度升高。水稻蘖肥期,1 ~ 7 d内田面水NO3–-N浓度逐渐增长,其中CK处理在2 ~ 3 d和5 ~ 6 d出现小幅下降。水稻穗肥期,各处理在1 ~ 3 d内浓度升高后又下降,且在3 ~ 6 d内呈现同样趋势,其中WS处理变化幅度较大,6 ~ 7 d内除RS处理浓度缓慢升高其余处理均缓慢下降。
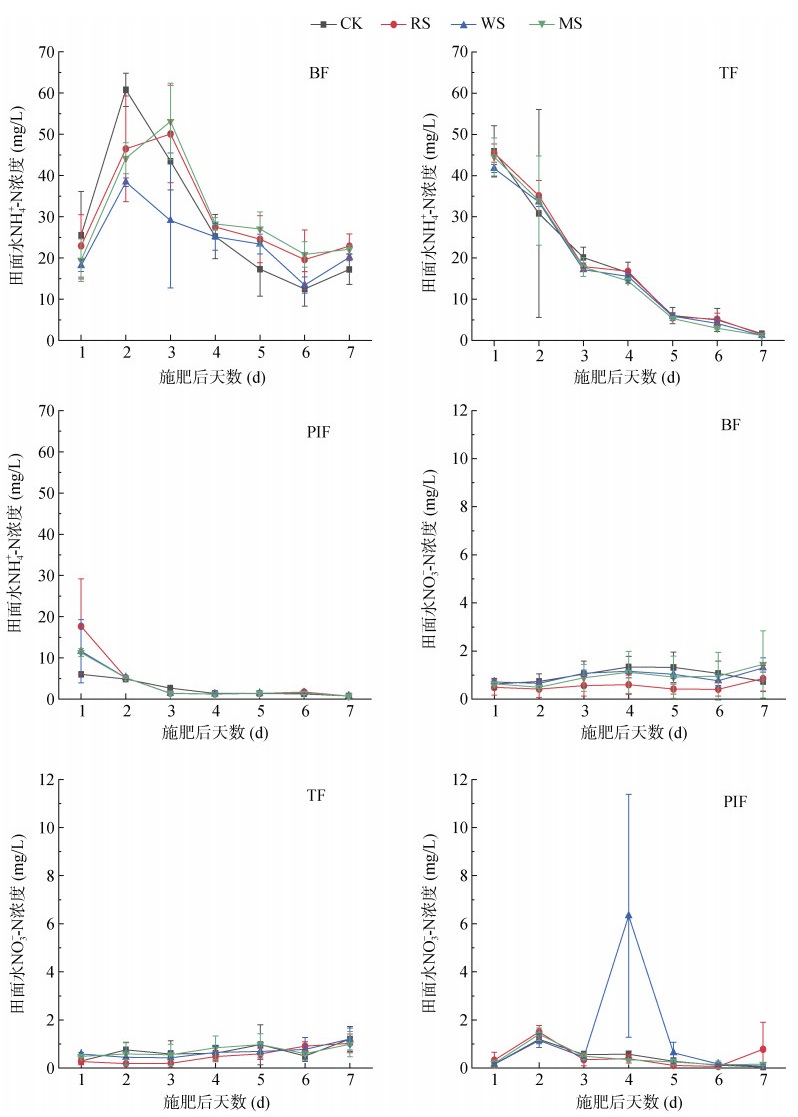
|
图 4 水稻生长期田面水NH4+-N、NO3–-N浓度季节变化 Fig. 4 Seasonal variations in NH4+-N and NO3–-N concentrations in floodwater during rice growing season |
经过验证,N2O排放量与田面水NH4+-N和NO3–-N浓度相关性不显著,因此对除此以外的其他因素进行相关性分析,结果如表 3所示。N2O排放量与nirS、AOB、nosZ、AOA、nirK拷贝数分别在P < 0.01水平显著正相关(按相关性由大到小排序);与土壤NH4+-N含量在P < 0.01水平显著负相关;与土壤NO3–-N含量在P < 0.05水平显著负相关。
|
|
表 3 气体排放与土壤微生物种群数量和土壤理化因子的相关性 Table 3 Correlation between N2O emission, abundance of soil microbial communities and soil physiochemical properties |
以N2O排放量为中心,建立路径分析模型研究各因子对N2O排放量的影响,本研究中整个生育期土壤理化和微生物定量数据为影响因素的结构方程模型如图 5所示,可见,AOB拷贝数和土壤NH4+-N含量对N2O排放量的影响起主导作用,显著性P < 0.05,标准化路径系数分别为0.64和–0.35,即AOB拷贝数增加一个标准差时N2O排放量增加0.64个标准差,土壤NH4+-N含量增加一个标准差时N2O排放量减少0.35个标准差。nosZ和AOB、nosZ和nirK、AOB和nirK拷贝数之间的相关系数分别为0.92、0.83和0.81;土壤NH4+-N和NO3–-N含量的相关系数为0.63。由此可见,AOB丰度和土壤NH4+-N含量是直接影响太湖地区单季稻田N2O排放的主要因素。
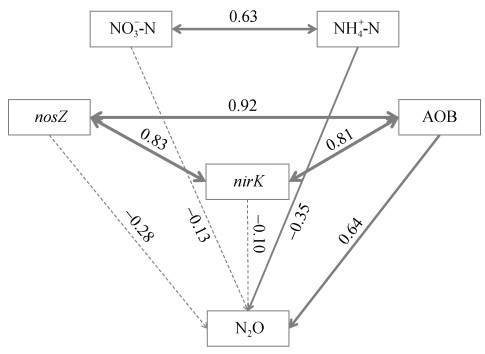
|
(路径旁边显示标准化的路径系数;实箭头和虚箭头分别表示P < 0.05和P > 0.05;箭头的宽度与路径系数的程度成正比;箭头上数值的正负分别表示正相关关系和负相关关系) 图 5 土壤理化因子和微生物丰度对N2O排放影响的结构方程模型 Fig. 5 Structural Equation Model for effects of soil physiochemical properties and microbial abundance on N2O emissions |
研究表明,N2O主要由土壤微生物参与的硝化和反硝化过程产生,其调控过程与土壤含水量和通气性密切相关[30]。稻田长期淹水时,O2供应不足,N2O主要通过反硝化作用产生,产生的N2O在强还原条件下进一步被还原为N2;而烤田和排水落干期稻田处于非淹水状态,良好的通气环境有利于硝化和反硝化作用同时进行,N2O排放通量大幅增加[31]。由表 2可知,在前期淹水、烤田、干湿交替、排水落干4个阶段各处理N2O平均排放通量分别为N 1.02、3.37、0.59、2.29 mg/(m2·h),即N2O主要集中在烤田期排放,与前人研究结论一致[32]。
本研究中,施用秸秆显著促进了单季稻整个生育期N2O的排放(图 1),且增排效果RS > WS > MS,与单位产量N2O排放量从大到小排序一致。这可能是由于秸秆施入土壤,提供的易分解有机质可以促进硝化和反硝化微生物活动,有利于N2O产生。秸秆在土壤中的降解速率受其化学组成的影响,适宜微生物分解的秸秆C/N比为28左右[33]。本研究供试水稻、小麦和玉米秸秆的C/N比分别为26.35、30.06和34.59。秸秆C/N比较高时微生物所需氮源受限,参与硝化和反硝化作用的底物供应不足,减缓了N2O的排放[34]。尽管秸秆在水稻生长前期腐解时固持土壤氮素导致作物缺氮,影响早期分蘖,但在水稻生长后期,秸秆进一步腐解,释放其中储存的养分,在水稻灌浆期提高根系活力,促进光合物质的转化,增加水稻产量[35]。有研究表明,后续作物吸收利用是秸秆还田的去向之一[36];秸秆分解过程中的残留物有助于维持农业土壤中微生物的多样性,并影响碳的相关转化过程[37]。因此,秸秆分解不仅会发生在当季,还会延续到后续作物及土壤微生物,因此N2O周年排放亟待进一步研究。
本研究中,施用秸秆处理时各菌群基因丰度均在水稻拔节期达到最大(图 2)。结合以往研究分析可得,在水稻生长前期,氮肥分解为硝化和反硝化作用提供底物,氨氧化菌和反硝化菌数量增多,至拔节期水稻生长旺盛,菌群数量达到峰值,随着氮素的消耗,水稻生长后期氨氧化菌和反硝化菌数量减少[38]。施用秸秆可以培肥地力,为相关功能微生物提供充足的营养物质、能源和底物,促进拔节期氨氧化菌和反硝化菌的生长和繁殖,大幅增加N2O排放通量,从而增加整个水稻生长期的N2O排放总量。研究表明,高NH4+-N的中性土壤中AOB主导N2O产生,而低NH4+-N的酸性土壤中AOA对硝化作用贡献较大[39],这是由于酸性条件下AOA对氨的亲和性较高[40]。本试验中,稻田土壤pH为6.38,相关性分析得到AOB拷贝数与N2O排放量相关性显著,表明AOB主导氨氧化过程,且烤田期土壤通气性好,AOB数量增多促进硝化作用进行,从而产生大量N2O。尽管nirK和nirS执行的功能相同,但由于nirK的丰度与磷或钾的供应量有关,而nirS的丰度由氮的供应量决定[41],因此施用秸秆提供氮底物显著增加nirS的丰度而对nirK的丰度没有显著影响。(nirK+nirS)/nosZ比值反映了反硝化产物N2O和N2的比例。本试验中拔节期各处理nosZ拷贝数增加,N2O排放通量却并未减少,且秸秆处理下N2O排放通量均高于CK处理,而该比值则反之,进一步说明烤田期N2O主要通过硝化作用产生。本研究中N2O排放量与nirS丰度和nosZ丰度呈显著正相关,与以往研究一致[42-43]。
水稻生育期内不同处理土壤NH4+-N和NO3–-N含量的变化趋势表明,前期淹水期由于基肥和分蘖肥的施用,在适宜的条件下,尿素水解为NH4+-N,NH4+-N被氧化为NO3–-N。各处理分蘖期土壤NH4+-N和NO3–-N含量分别在25.87 ~ 48.92 mg/kg和8.62 ~ 20.73 mg/kg,为各生育期最大值。进入拔节期之后,水稻由营养生长转为生殖生长,对氮素的需求量增加,随着硝化作用和反硝化作用的进行,土壤NH4+-N和NO3–-N含量均呈减少趋势。分蘖期秸秆中的养分分解释放较快,小麦和玉米秸秆处理下的土壤NH4+-N含量高于CK处理,拔节期之后CK处理下的土壤NH4+-N含量整体稍高于秸秆处理,与秸秆所含纤维素、半纤维素、木质素等成分较难矿化、水稻生育后期分解缓慢有关[44]。分蘖期CK处理下的土壤NO3–-N含量高于秸秆处理,可能受秸秆腐解产生的有机酸抑制NO3–-N形成的影响[45],也可能是秸秆还田初期稻田淹水条件下NO3–-N易流失所致[46]。相关性分析和SEM表明,N2O排放量与土壤NH4+-N和NO3–-N含量均呈负相关,而各生育期不同处理间反硝化作用底物NO3–-N和硝化作用底物NH4+-N含量基本没有显著性差异,这表明底物含量差异对N2O排放量的影响较小,与N2O排放相关的土壤微生物功能基因拷贝数的差异可能在N2O排放过程中产生更为重要的作用。因此,不同种类秸秆还田下与N2O排放相关的土壤微生物群落多样性仍需进一步研究,以明晰秸秆种类影响水稻生育期N2O排放的微生物机理。
4 结论水稻拔节期(对应烤田期),与CK相比,RS处理显著增加AOA、AOB、nirS、nosZ丰度(P < 0.05),从而增加水稻生长期N2O排放量,WS和MS处理对上述功能基因丰度均无显著影响,不同处理对nirK丰度均没有显著影响。相关性分析表明,本试验条件下稻田N2O排放量与土壤中AOA、AOB、nirS、nirK和nosZ拷贝数呈极显著正相关关系(P < 0.01),与土壤NH4+-N含量呈极显著负相关关系(P < 0.01),与土壤NO3–-N含量呈显著负相关关系(P < 0.05)。利用结构方程模型(SEM)进一步探究变量间的直接和间接作用发现,AOB丰度直接促进N2O的排放,土壤NH4+-N含量则对其产生直接抑制作用。由此可见,本试验条件下AOB丰度和土壤NH4+-N含量对稻田土壤N2O排放起直接主导作用。综合考虑单季稻田秸秆还田后水稻产量、土壤理化因子和微生物变化,本试验条件下玉米秸秆还田为减少N2O排放量、提高水稻产量的最优处理。
| [1] |
IPCC. Climate Change 2013: the physical science basis. contribution of working group I to the Fifth assessment report of the Intergovernmental Panel on Climate Change[C]. UK: Cambridge University Press, 2014.
(  0) 0) |
| [2] |
IPCC. Climate change 2007: The physical science basis. Contribution of working group I to the fourth assessment report of the intergovernmental panel on climate change[C]. UK: Cambridge University Press, 2007.
(  0) 0) |
| [3] |
WMO. WMO Greenhouse Gas Bulletin: The State of Greenhouse Gases in the Atmosphere Based on Global Observations through 2019[R]. Geneva: WMO, 2020.
(  0) 0) |
| [4] |
Tian H, Xu R, Canadell J G, et al. A comprehensive quantification of global nitrous oxide sources and sinks[J]. Nature, 2020, 586(7828): 248-256 DOI:10.1038/s41586-020-2780-0 (  0) 0) |
| [5] |
Zou J W, Huang Y, Zheng X H, et al. Quantifying direct N2O emissions in paddy fields during rice growing season in mainland China: Dependence on water regime[J]. Atmospheric Environment, 2007, 41(37): 8030-8042 DOI:10.1016/j.atmosenv.2007.06.049 (  0) 0) |
| [6] |
Yan X Y, Yagi K, Akiyama H, et al. Statistical analysis of the major variables controlling methane emission from rice fields[J]. Global Change Biology, 2005, 11(7): 1131-1141 DOI:10.1111/j.1365-2486.2005.00976.x (  0) 0) |
| [7] |
朱永官, 王晓辉, 杨小茹, 等. 农田土壤N2O产生的关键微生物过程及减排措施[J]. 环境科学, 2014, 35(2): 792-800 (  0) 0) |
| [8] |
徐华, 邢光熹, 蔡祖聪, 等. 土壤水分状况和氮肥施用及品种对稻田N2O排放的影响[J]. 应用生态学报, 1999, 10(2): 186-188 DOI:10.3321/j.issn:1001-9332.1999.02.015 (  0) 0) |
| [9] |
秦红灵, 陈安磊, 盛荣, 等. 稻田生态系统氧化亚氮(N2O)排放微生物调控机制研究进展及展望[J]. 农业现代化研究, 2018, 39(6): 922-929 (  0) 0) |
| [10] |
郭丽芸, 时飞, 杨柳燕. 反硝化菌功能基因及其分子生态学研究进展[J]. 微生物学通报, 2011, 38(4): 583-590 (  0) 0) |
| [11] |
Liu B R, Jia G M, Chen J, et al. A review of methods for studying microbial diversity in soils[J]. Pedosphere, 2006, 16(1): 18-24 DOI:10.1016/S1002-0160(06)60021-0 (  0) 0) |
| [12] |
王培欣, 杨亚东, 王占海, 等. 施肥制度对水稻土壤nosZ型反硝化细菌群落的影响[J]. 生态学杂志, 2019, 38(7): 2072-2079 (  0) 0) |
| [13] |
梁丽华, 左剑恶. 反硝化功能基因——检测反硝化菌种群结构的分子标记[J]. 微生物学通报, 2009, 36(4): 627-633 (  0) 0) |
| [14] |
杨帆, 李荣, 崔勇, 等. 我国南方秸秆还田的培肥增产效应[J]. 中国土壤与肥料, 2011(1): 10-14 DOI:10.3969/j.issn.1673-6257.2011.01.003 (  0) 0) |
| [15] |
冯珺珩, 黄金凤, 刘天奇, 等. 耕作与秸秆还田方式对稻田N2O排放、水稻氮吸收及产量的影响[J]. 作物学报, 2019, 45(8): 1250-1259 (  0) 0) |
| [16] |
Ma J, Li X L, Xu H, et al. Effects of nitrogen fertiliser and wheat straw application on CH4 and N2O emissions from a paddy rice field[J]. Soil Research, 2007, 45(5): 359 DOI:10.1071/SR07039 (  0) 0) |
| [17] |
Lou Y S, Ren L X, Li Z P, et al. Effect of rice residues on carbon dioxide and nitrous oxide emissions from a paddy soil of subtropical China[J]. Water, Air, and Soil Pollution, 2007, 178(1/2/3/4): 157-168 (  0) 0) |
| [18] |
Miller M N, Zebarth B J, Dandie C E, et al. Crop residue influence on denitrification, N2O emissions and denitrifier community abundance in soil[J]. Soil Biology and Biochemistry, 2008, 40(10): 2553-2562 DOI:10.1016/j.soilbio.2008.06.024 (  0) 0) |
| [19] |
王改玲, 郝明德, 陈德立. 秸秆还田对灌溉玉米田土壤反硝化及N2O排放的影响[J]. 植物营养与肥料学报, 2006, 12(6): 840-844 DOI:10.3321/j.issn:1008-505X.2006.06.014 (  0) 0) |
| [20] |
张振超, 王金牛, 孙建, 等. 土壤温室气体测定方法研究进展[J]. 应用与环境生物学报, 2019, 25(5): 1228-1243 (  0) 0) |
| [21] |
Kolb S, Knief C, Dunfield P F, et al. Abundance and activity of uncultured methanotrophic bacteria involved in the consumption of atmospheric methane in two forest soils[J]. Environmental Microbiology, 2005, 7(8): 1150-1161 DOI:10.1111/j.1462-2920.2005.00791.x (  0) 0) |
| [22] |
Long X E, Chen C R, Xu Z H, et al. Abundance and community structure of ammonia-oxidizing bacteria and Archaea in a temperate forest ecosystem under ten-years elevated CO2[J]. Soil Biology and Biochemistry, 2012, 46: 163-171 DOI:10.1016/j.soilbio.2011.12.013 (  0) 0) |
| [23] |
Dandie C E, Wertz S, Leclair C L, et al. Abundance, diversity and functional gene expression of denitrifier communities in adjacent riparian and agricultural zones[J]. FEMS Microbiology Ecology, 2011, 77(1): 69-82 DOI:10.1111/j.1574-6941.2011.01084.x (  0) 0) |
| [24] |
Wertz S, Dandie C E, Goyer C, et al. Diversity of nirK denitrifying genes and transcripts in an agricultural soil[J]. Applied and Environmental Microbiology, 2009, 75(23): 7365-7377 DOI:10.1128/AEM.01588-09 (  0) 0) |
| [25] |
Wang C, Lu H H, Dong D, et al. Insight into the effects of biochar on manure composting: Evidence supporting the relationship between N2O emission and denitrifying community[J]. Environmental Science & Technology, 2013, 47(13): 7341-7349 (  0) 0) |
| [26] |
Li M, Cao H L, Hong Y G, et al. Spatial distribution and abundances of ammonia-oxidizing Archaea (AOA) and ammonia-oxidizing bacteria (AOB) in mangrove sediments[J]. Applied Microbiology and Biotechnology, 2011, 89(4): 1243-1254 DOI:10.1007/s00253-010-2929-0 (  0) 0) |
| [27] |
Kandeler E, Deiglmayr K, Tscherko D, et al. Abundance of narG, nirS, nirK, and nosZ genes of denitrifying bacteria during primary successions of a glacier foreland[J]. Applied and Environmental Microbiology, 2006, 72(9): 5957-5962 DOI:10.1128/AEM.00439-06 (  0) 0) |
| [28] |
Wertz S, Degrange V, Prosser J I, et al. Maintenance of soil functioning following erosion of microbial diversity[J]. Environmental Microbiology, 2006, 8(12): 2162-2169 DOI:10.1111/j.1462-2920.2006.01098.x (  0) 0) |
| [29] |
Chèneby D, Hartmann A, Hénault C, et al. Diversity of denitrifying microflora and ability to reduce N2O in two soils[J]. Biology and Fertility of Soils, 1998, 28(1): 19-26 DOI:10.1007/s003740050458 (  0) 0) |
| [30] |
Oertel C, Matschullat J, Zurba K, et al. Greenhouse gas emissions from soils—A review[J]. Geochemistry, 2016, 76(3): 327-352 DOI:10.1016/j.chemer.2016.04.002 (  0) 0) |
| [31] |
Liu J B, Hou H J, Sheng R, et al. Denitrifying communities differentially respond to flooding drying cycles in paddy soils[J]. Applied Soil Ecology, 2012, 62: 155-162 DOI:10.1016/j.apsoil.2012.06.010 (  0) 0) |
| [32] |
李彬波, 曾科, 李瑞, 等. 作物生长对土壤N2O排放影响的研究进展[J]. 土壤通报, 2015, 46(4): 1003-1010 (  0) 0) |
| [33] |
王德建, 常志州, 王灿, 等. 稻麦秸秆全量还田的产量与环境效应及其调控[J]. 中国生态农业学报, 2015, 23(9): 1073-1082 (  0) 0) |
| [34] |
高焕平, 刘世亮, 赵颖, 等. 秸秆与氮肥调节C/N比对潮土CH4, CO2和N2O排放/吸收的影响[J]. 土壤通报, 2019, 50(1): 157-164 (  0) 0) |
| [35] |
徐国伟, 吴长付, 刘辉, 等. 麦秸还田及氮肥管理技术对水稻产量的影响[J]. 作物学报, 2007, 33(2): 284-291 DOI:10.3321/j.issn:0496-3490.2007.02.017 (  0) 0) |
| [36] |
Hubbard V C, Jordan D. Nitrogen recovery by corn from nitrogen-15 labeled wheat residues and intact roots and soil[J]. Soil Science Society of America Journal, 1996, 60(5): 1405-1410 DOI:10.2136/sssaj1996.03615995006000050016x (  0) 0) |
| [37] |
Ge Z, Li S Y, Bol R, et al. Differential long-term fertilization alters residue-derived labile organic carbon fractions and microbial community during straw residue decomposition[J]. Soil and Tillage Research, 2021, 213: 105120 DOI:10.1016/j.still.2021.105120 (  0) 0) |
| [38] |
纪洋, 于海洋, 徐华. 控释肥与尿素配合施用对稻季土壤CH4和N2O排放的影响[J]. 生态环境学报, 2017, 26(9): 1494-1500 (  0) 0) |
| [39] |
Hink L, Nicol G W, Prosser J I. Archaea produce lower yields of N2O than bacteria during aerobic ammonia oxidation in soil[J]. Environmental Microbiology, 2017, 19(12): 4829-4837 DOI:10.1111/1462-2920.13282 (  0) 0) |
| [40] |
He J Z, Hu H W, Zhang L M. Current insights into the autotrophic thaumarchaeal ammonia oxidation in acidic soils[J]. Soil Biology and Biochemistry, 2012, 55: 146-154 DOI:10.1016/j.soilbio.2012.06.006 (  0) 0) |
| [41] |
陈哲. 长期施肥对水稻土反硝化作用和反硝化功能微生物的影响机理[D]. 北京: 中国科学院研究生院, 2010.
(  0) 0) |
| [42] |
Huang R, Wang Y Y, Gao X S, et al. Nitrous oxide emission and the related denitrifier community: A short-term response to organic manure substituting chemical fertilizer[J]. Ecotoxicology and Environmental Safety, 2020, 192: 110291 DOI:10.1016/j.ecoenv.2020.110291 (  0) 0) |
| [43] |
韩冰, 叶旭红, 张西超, 等. 不同灌溉方式设施土壤N2O排放特征及其影响因素[J]. 水土保持学报, 2016, 30(5): 310–315, 321 (  0) 0) |
| [44] |
龚振平, 邓乃榛, 宋秋来, 等. 基于长期定位试验的松嫩平原还田玉米秸秆腐解特征研究[J]. 农业工程学报, 2018, 34(8): 139-145 (  0) 0) |
| [45] |
Zhu J G, Liu G, Han Y, et al. Nitrate distribution and denitrification in the saturated zone of paddy field under rice/wheat rotation[J]. Chemosphere, 2003, 50(6): 725-732 DOI:10.1016/S0045-6535(02)00212-6 (  0) 0) |
| [46] |
崔思远, 尹小刚, 陈阜, 等. 耕作措施和秸秆还田对双季稻田土壤氮渗漏的影响[J]. 农业工程学报, 2011, 27(10): 174-179 DOI:10.3969/j.issn.1002-6819.2011.10.031 (  0) 0) |
2. College of Changwang, Nanjing University of Information Technology, Nanjing 210044, China;
3. Extension Center of Agricultural Technology in Lingcheng District, Dezhou, Shandong 253500, China;
4. Key Laboratory of Argo-Environment in Downstream of Yangtze Plain, Ministry of Agriculture and Rural Affairs, Institute of Agricultural Resources and Environment, Jiangsu Academy of Agricultural Sciences, Nanjing 210014, China
 2022, Vol. 54
2022, Vol. 54


