2. 福建师范大学福建省植物生理生态重点实验室, 福州 350007
马铃薯(Solanum tuberosum L.)是世界四大粮食作物之一,而中国是马铃薯生产第一大国[1]。据统计,我国马铃薯年种植面积达500多万hm2,年产量约为9 193.8万t[2]。由于土地面积有限,马铃薯连作栽培现象普遍。长期连作导致作物根际微生物群落结构发生变化,罗尔斯通菌属(Ralstonia)和镰刀菌属(Fusarium)等致病菌增多,芽孢杆菌属(Bacillus)和生赤壳属(Bionectria)等有益菌减少,土壤从“细菌型”转变为“真菌型”,土壤微生物群落结构失衡严重,阻碍了马铃薯产业的健康发展[3]。土壤微生物群落和数量变化不仅能反映能量代谢的程度,还能反映土壤肥力状况[4]。因此,有益微生物减少、病原微生物富集及其所引起的微生物群落失衡被认为是连作障碍的主要因素之一[5-6],亟需一种能够快速高效杀灭病原菌改善连作土壤微生物区系的方法。化学消毒剂已在世界范围内广泛应用于防治作物连作障碍[7],如棉隆、氯化苦、威百亩、石灰氮等常用作熏蒸剂来杀灭土壤病原菌[8]。胡洪涛等[2]研究表明,棉隆与青霉菌联合施用使假单胞菌属(Pseudomonas)等有益菌属的丰度显著提升,而致病菌链霉菌属(Streptomyces)丰度显著降低,土壤微生物群落组成发生变化,对马铃薯疮痂病有较好的防控效果。贾喜霞等[9]施用石灰氮进行土壤熏蒸,发现土壤中真菌数量显著降低,而细菌数量没有显著变化,使土壤维持着较高的细菌和真菌比例,可有效缓解连作障碍。
连作土壤熏蒸(消毒或灭菌)后尽管能在短期内大量抑制或杀死土壤中的致病微生物,但由于熏蒸剂施用量和作用强度大,土壤中的有害微生物或线虫等被杀死的同时,一些对于作物生长有益的微生物类群同样也被杀死,微生物群落结构改变程度较大,间接导致了土壤微生物区系的不均衡,以及有益菌和致病菌在种群和个体数量上的相对变化[10-11]。例如,Li等[12]研究发现,连续两年使用氯化苦熏蒸显著降低了细菌和真菌群落的多样性和丰度,放线菌、芽孢杆菌等优势菌群和土传病原菌数量均显著减少。此外,长期使用一种熏蒸剂,还存在药物残留和生态安全风险[13]。三氯异氰尿酸(Trichloroisocyanuric acid,TCCA) 作为一种强氧化剂和氯化剂,具有高效、广谱、较为安全的消毒特点,对细菌、病毒、真菌等都有杀灭作用[14]。作为消毒剂,TCCA已在水稻、棉花、辣椒、烟草等作物上用于多种病害的防治,但在马铃薯连作障碍土壤修复上较为少见,施用TCCA后土壤微生物群落如何变化尚未可知。为此,本研究以马铃薯连作障碍土壤为研究对象,通过盆栽试验,结合高通量测序技术,探讨不同施用量TCCA消毒剂对连作障碍土壤微生物群落组成的影响,以期为退化土壤恢复和农业可持续发展提供科学依据。
1 材料与方法 1.1 试验材料供试土壤于2020年11月中旬采自黑龙江省大庆市马铃薯连作地块。采集后的鲜土挑出石块、根系等杂物,过5 mm筛备用。土壤基本性质为:pH 5.56,速效钾(AK) 130.2 mg/kg,碱解氮(AN) 44.23 mg/kg,速效磷(AP) 86.81 mg/kg,全碳(TC) 10.52 g/kg,全氮(TN) 1.28 g/kg。供试药剂为有效氯含量为42% 的三氯异氰尿酸(TCCA)可湿性粉剂,供试种薯由黑龙江马铃薯生产基地提供。
1.2 试验设计采用盆栽试验,地点位于福建师范大学长安山(26°02′11″N, 119°18′03″E)。试验设置4个处理,分别为:①CK:不施TCCA;②S30:TCCA 30 kg/hm2;③S60:TCCA 60 kg/hm2;④S120:TCCA 120 kg/hm2,每个处理3次重复。将5.7 kg鲜土(含水量140.9 g/kg)混合均匀装入花盆(直径25 cm,高25 cm),于2020年11月28日进行一次消毒处理。TCCA以溶液形式均匀喷洒在土壤表面,直到下渗到土层底部,CK处理喷洒等量水。消毒后于2021年1月21日栽入发芽程度一致的种薯,定期检查马铃薯幼苗生长状况,去除杂草,补充水分,更换花盆位置,减少环境因素的干扰。2021年4月22日进行第二次土壤消毒处理,2021年5月17日进行破坏性土壤取样,挑去植物残体和根系后用网格法取样并装入自封袋内。鲜土过2 mm尼龙网筛后一部分置于4 ℃冰箱保存,一部分进行风干处理,一部分置于–80 ℃冰箱保存用于DNA提取及微生物测定。
1.3 测定方法 1.3.1 土壤基本性质测定土壤pH采用便携式pH计(Mettler FE28,上海)测定,水土比(V/m)为2.5∶1;可溶性有机碳(DOC)用总有机碳分析仪(TOC-VCPH/CPN,Shimadzu,日本)测定,水土比(V/m)为2∶1;铵态氮(NH4+-N)和硝态氮(NO3–-N)用2 mol/L的KCl溶液浸提,水土比(V/m)为4∶1,用连续流动分析仪(Skalar san++,荷兰)测定;全碳(TC)和全氮(TN)采用元素分析仪(Elementar Vario EL III,德国)测定;碱解氮(AN)采用碱解–扩散法测定;速效磷(AP)采用钼锑抗比色法,用HCl-NH4F浸提,分光光度计(WFJ721,上海光谱)测定;速效钾(AK)采用CH3COONH4浸提,火焰光度计(FP6410,上海欣益)测定。
1.3.2 DNA提取及高通量测序使用OMEGA M5635-02 Soil DNA Kit试剂盒提取土壤DNA,使用NanoDrop NC-2000分光光度计(Thermo Scientific,Wilmington,DE,美国)测定DNA的质量,利用1.2%琼脂糖凝胶电泳检测DNA提取质量,使用引物338F(5′-ACTCCTACGGGAGGCAGCA-3′)和806R (5′GGACTACHVGGGTWTCTAAT-3′)对细菌V3 ~ V4高变域进行PCR扩增。利用引物ITS5(5′-GGAA GTAAAAGTCGTAACAAGG-3′)和ITS2(5′-GCTGCG TTCTTCATCGATGC-3′)对真菌ITS1区进行PCR扩增。PCR反应体系为25 μl;反应条件为:98 ℃预变性2 min;98 ℃变性15 s,55 ℃复性30 s,72 ℃延伸30 s,共25个循环;72 ℃延伸5 min,反应结束,产物混匀后通过2.0% 的琼脂糖凝胶电泳检测[15]。扩增完毕后采用Illumina公司的TruSeq Nano DNA LT Library Prep Kit制备测序文库,采用Illumina NovaSeq平台对DNA片段进行双端(Paired-end)测序。土壤微生物总DNA提取和测序委托上海派森诺生物科技有限公司完成。
1.4 数据分析下机数据经QIIME2(Ver 1.8.0)软件进行去引物、过滤、去噪、拼接和去嵌合体等步骤,最终得到有效序列。使用DADA2质控后产生的每个去重的序列为ASV(Amplicon Sequence Variants, ASV),采用QIIME2的classify-sklearn算法对于每个ASV的特征序使用预先训练好的Naive Bayes分类器进行物种注释,得出物种分类水平[16]。细菌16S rRNA基因对比数据库为Greenge-nes,真菌ITS序列选用UNITE,最后对采用QIIME2的qiime feature-table rarefy功能进行抽平,抽平深度设为最低样本序列量的95%。通过对抽平后的ASV进行统计,细菌16S rRNA共得到333 156条序列,真菌ITS共得到713 424条序列。
采用Excel 2019和SPSS 19.0进行数据处理和统计分析,采用单因素方差分析比较处理间的差异显著性(LSD检验,P < 0.05)。采用Origin 2019绘制群落结构组成图,用R 4.1版本中vegan包和ggplot 2包绘制主坐标分析图,用Canoco 5.0绘制冗余分析图。
2 结果与分析 2.1 土壤基本性质由表 1可知,相较CK处理,S30处理对土壤pH和DOC含量均无显著影响,而S60和S120处理显著提高了土壤pH(P < 0.05),分别升高了0.15个和0.26个单位;DOC含量亦显著增加,分别增加了30.4%和83.5%。与CK相比,S30、S60和S120处理未显著影响土壤TC、TN、AK、AN和AP的含量,但S60和S120处理显著增加了土壤NH4+-N含量(P < 0.05),分别提高了3.3倍和9.7倍,S120处理显著降低了土壤NO3–-N含量(P < 0.05),降低了56.4%。
|
|
表 1 不同处理的土壤基本性质 Table 1 Basic properties of tested soils under different treatments |
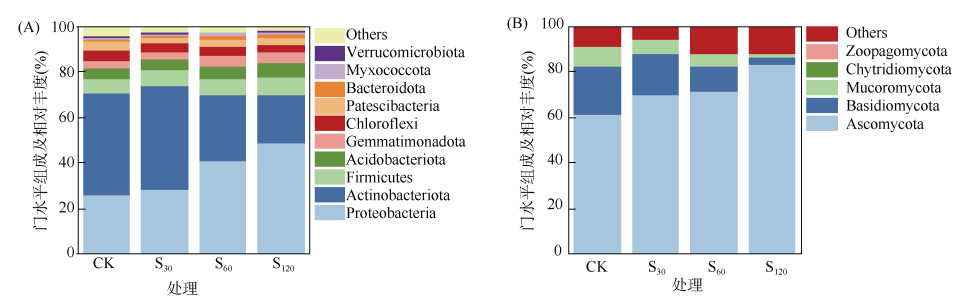
在细菌门水平上(图 1A),土壤中丰度较高的细菌群落为变形菌门(Proteobacteria)、放线菌门(Actinobacteriota)、厚壁菌门(Firmicutes)、嗜酸菌门(Acidobacteriota)、芽单胞菌门(Gemmatimonadota)和绿弯菌门(Chloroflexi)。与CK处理相比,S60和S120处理显著增加了变形菌门的相对丰度(P < 0.05),分别提高了55.3% 和85.9%,同时还增加了厚壁菌门、嗜酸菌门和芽单胞菌门的相对丰度,但差异未达显著水平;显著降低了放线菌门的相对丰度(P < 0.05),分别降低了35.2% 和52.3%(P < 0.05)。在真菌门水平上(图 1B),子囊菌门(Ascomycota)、担子菌门(Basidiomycota)、毛霉菌门(Mucoromycota)、壶菌门(Chytridiomycota)和Zoopagomycota是土壤中丰度较高的真菌群落,相对丰度为71.8%、13.5%、5.3%、0.1% 和0.1%。相较于CK处理,S30、S60和S120处理均显著增加了子囊菌门的相对丰度,分别提高了14.3%、16.7% 和35.1%,且S120处理与S30和S60处理的差异达显著水平(P < 0.05)。
|
(图中相对丰度在每个处理中均小于1% 的物种,合并为“Others”,下同) 图 1 土壤细菌(A)和真菌(B)门水平相对丰度 Fig. 1 Relative abundances of bacteria (A) and fungi (B) at phyla level in soils under different treatments |
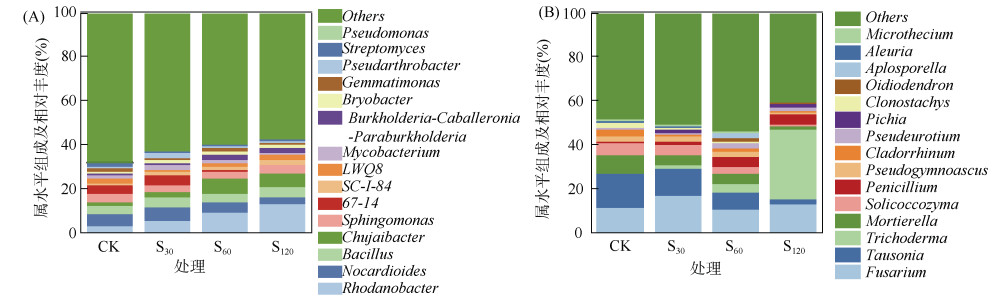
在细菌属水平上(图 2A),与CK处理相比,S60和S120处理显著增加了罗丹杆菌属(Rhodanobacter)的相对丰度(P < 0.05),分别提高了2.2倍和3.4倍;显著增加了竹杆菌属(Chujaibacter)的相对丰度(P < 0.05),分别提高了2.4倍和2.3倍;显著降低了链霉菌属(Streptomyces)的相对丰度(P < 0.05),分别降低了35.7% 和57.1%;均增加了芽孢杆菌属(Bacillus)和假单胞菌属(Pseudomonas)的相对丰度,但差异未达显著水平。在真菌属水平上(图 2B),相较于CK处理,S60和S120处理显著降低了Tausonia、被孢霉菌属(Mortierella)和Solicocozyma菌属的相对丰度(P < 0.05),但S120处理显著提高了木霉菌属(Trichoderma)的相对丰度(P < 0.05)。
|
图 2 土壤细菌(A)和真菌(B)属水平相对丰度 Fig. 2 Relative abundances of bacteria (A) and fungi (B) at genera level in soils under different treatments |
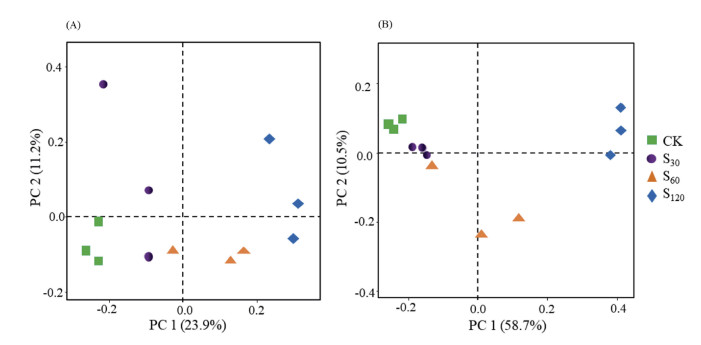
细菌群落主坐标分析(PCoA)结果表明,提取两个主成分的方差累积贡献率为35.1%(图 3A)。在PC1轴上,S30与CK处理聚在一起,而S60和S120处理与CK处理明显分离,说明S30与CK处理细菌群落结构相似,而S60和S120处理与CK处理的细菌群落结构差异较大。真菌群落PcoA分析显示,PC1和PC2的累积贡献率为69.2%(图 3B),在PC1轴上,S30与CK处理聚集在一起,而S60和S120处理与CK明显分离,亦说明S30与CK处理真菌群落结构相似,而S60和S120处理与CK处理的真菌群落结构差异较大。
|
图 3 基于ASV水平土壤细菌(A)与真菌(B)的主坐标分析 Fig. 3 Principal coordinate analysis (PCoA) of bacteria (A) and fungi (B) in soils under different treatments at ASV level |
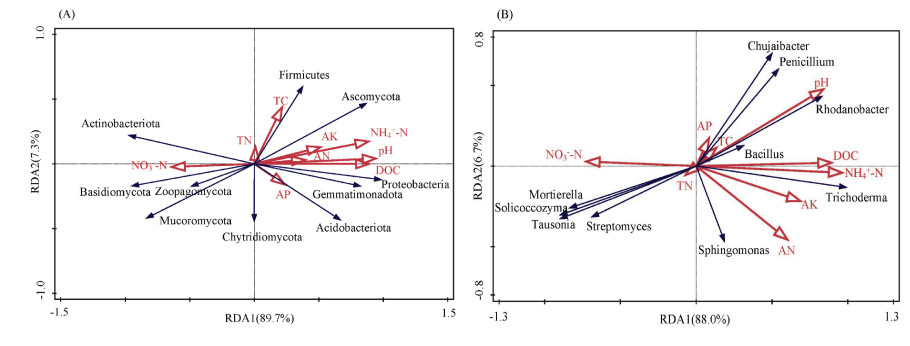
以土壤基本性质指标为解释变量,以优势菌门和属的相对丰度为响应变量进行冗余分析(RDA)。结果表明,在门水平上,两个主轴的特征值分别为89.7% 和7.3%(图 4A)。各优势菌门对环境因子的敏感性不同,主要受土壤pH和NH4+-N含量的影响,土壤pH与变形菌门(Proteobacteria)、厚壁菌门(Firmicutes)、嗜酸菌门(Acidobacteriota)、芽单胞菌门(Gemmatimonadota)和子囊菌门(Ascomycota)相对丰度呈正相关关系,与放线菌门(Actinobacteriota)相对丰度呈负相关关系。此外,变形菌门、厚壁菌门、嗜酸菌门、芽单胞菌门和子囊菌门相对丰度与DOC、AK、AN和NH4+-N含量均呈正相关关系,与NO3–-N含量呈负相关关系;放线菌门相对丰度与DOC、AK、AN和NH4+-N含量呈负相关关系,与NO3–-N含量呈正相关关系。在属水平上,两个主轴的特征值分别为88.0% 和6.7%(图 4B),土壤NH4+-N含量和pH是影响其群落结构变化的关键因子。罗丹杆菌属(Rhodanobacter)和木霉菌属(Trichoderma)相对丰度与pH、DOC和NH4+-N含量呈正相关,与NO3–-N含量呈负相关;链霉菌属(Streptomyces)相对丰度与pH、DOC和NH4+-N含量呈负相关,与NO3–-N含量呈正相关。
|
图 4 优势菌门(A)和属(B)与土壤基本性质的冗余分析 Fig. 4 Redundancy analysis (RDA) of dominant phyla (A) and genera (B) with soil basic properties |
本研究中,土壤细菌群落以放线菌门、变形菌门、厚壁菌门、嗜酸菌门、芽单胞菌门和绿弯菌门为主。S60和S120处理降低了放线菌门的相对丰度,但显著提高了变形菌门的相对丰度使其成为优势菌门,同时还提高了厚壁菌门、嗜酸菌门和芽单胞菌门的相对丰度,表明施用TCCA可以增加某些有益菌门的相对丰度。研究表明,放线菌门不仅是有机物的分解者,还可以抑制土传病害的病原体[17]。变形菌门能参与土壤养分、循环促进土壤肥力发展和作物养分的转化[18]。厚壁菌门细胞壁中肽聚糖含量高,大多可产生芽孢,借以抵抗脱水和极端环境,同时还能降解蛋白质、纤维素等大分子化合物[19]。嗜酸菌门被认为具有广泛的代谢和遗传功能,能表达多种活性转运蛋白,降解结冷胶并产生胞外多糖[20]。芽单胞菌门是有效的生物防治剂,可以产生抗生素,减少土传病害[21]。本研究中,真菌群落以子囊菌门、担子菌门和毛霉菌门为主,且3个TCCA处理均显著增加了子囊菌门的相对丰度。子囊菌门是土壤中的主要分解者[22],它可以通过对作物残体的分解释放无机养分[23]。在细菌属水平上,S60和S120处理显著降低了链霉菌属的相对丰度,增加了假单胞菌属和芽孢杆菌属的相对丰度。链霉菌属为马铃薯连作障碍常见致病菌,可引起马铃薯疮痂病[24];假单胞菌属能分泌多种类型的抗生素,可抑制病原菌的生长,促进植物生长[25];而芽孢杆菌属可作为生物控制剂,抑制土传微生物,减少土传病害[26]。在真菌属水平上,S120处理中木霉菌属的相对丰度显著增加。张亚玲等[27]研究发现,木霉菌与杀菌剂联用对水稻纹枯病的防治有一定效果,木霉菌属也是对水稻纹枯病防治应用研究较多的真菌,它通过产生小分子抗生素和大分子抗菌蛋白或胞壁降解酶来抑制病原菌的生长、繁殖和侵染。
3.2 土壤微生物群落组成变化的影响因素土壤微生物群落是评估土壤质量和指示土壤环境变化的重要指标[28]。本研究中,S30处理对土壤微生物群落组成的影响并不明显,但S60和S120处理显著改变了微生物群落组成,其原因在于高量TCCA施用后在土壤溶液中分解形成次氯酸可直接毒杀某些微生物,从而影响了微生物的群落组成。此外,微生物群落组成亦受土壤pH、有机质和养分含量、质地、温度、水分条件等土壤理化性质的影响[29]。本研究中,S60和S120处理的土壤pH、DOC和NH4+-N含量显著升高。在门水平上,土壤pH和NH4+-N含量是微生物群落组成变化的关键因子。Liu等[30]研究发现,土壤pH是影响嗜酸菌门的关键因子之一,嗜酸菌的丰度随土壤pH增加而降低。本研究结果与之不同,可能是因为微生物分泌胞外酶的最适合pH存在差异所致。pH影响着土壤中多种微生物的活动过程,而DOC可为微生物提供碳源参与土壤碳循环[31],因此土壤pH、DOC含量与细菌丰度有一定的关联。本研究也证实了细菌中的变形菌门、厚壁菌门、嗜酸菌门和芽单胞菌门与土壤pH、DOC含量呈正相关关系。已有研究表明,土壤消毒(熏蒸)处理后NH4+-N含量会增加[32],这是因为土壤中的NH4+-N会在氨氧化细菌和硝化细菌的作用下转化为NO3–-N[33],但是消毒处理会抑制土壤硝化过程,而消毒处理后的大量微生物残体也很容易被分解从而增加土壤NH4+-N含量[34]。在土壤中,除自氧硝化细菌外,还有一些异氧微生物亦能参与硝化过程,而放线菌作为腐生异氧菌也参与其中。在本研究中,S60和S120处理均显著降低了放线菌门的相对丰度,显著增加了NH4+-N含量,这表明TCCA消毒后会抑制土壤硝化作用,而RDA分析也证实了这一点,即放线菌与NH4+-N含量呈负相关关系。研究表明,子囊菌门能在多种类型土壤中作为优势菌门存在,且在偏酸性土壤中大量存在[35],而土壤中反硝化真菌90% 属于子囊菌门[36],它们可将NO3–-N还原为N2O,从而降低土壤NO3–-N含量。本研究结果也证实,在不同处理中子囊菌门均为优势菌门,且与NO3–-N含量呈负相关关系。在属水平上,土壤NH4+-N含量和pH亦是影响群落组成的关键因子,并且土壤pH、NH4+-N和DOC含量与链霉菌属相对丰度呈负相关,与木霉菌属相对丰度呈正相关。本研究中链霉菌属的相对丰度显著降低,很可能是土壤pH和NH4+-N含量升高所致。木霉菌作为一种反硝化菌属广泛存在于有机质丰富的土壤中[37],它对消毒剂敏感性低,甚至可以降解消毒剂。研究表明,土壤消毒后木霉菌属通常为主导菌属,这是因为消毒剂对其繁殖具有一定的刺激作用,它可以产生很强的化学毒素来杀灭病原菌[38]。本研究亦发现,随着TCCA施用量的增加,木霉菌属相对丰度呈明显的上升趋势。
4 结论施用TCCA可作为马铃薯连作障碍土壤的防控措施之一,60 kg/hm2或120 kg/hm2施用的效果较为明显,不仅增加了土壤变形菌门、厚壁菌门和嗜酸菌门等有益菌的相对丰度,亦显著降低了致病菌链霉菌属的相对丰度,显著改变了微生物群落结构;同时,土壤pH、DOC和NH4+-N含量亦有显著变化。除了TCCA直接杀菌作用,土壤pH和NH4+-N含量亦是影响微生物群落组成改变的关键因素。当然,TCCA施用对马铃薯连作障碍土壤的修复效果还需要田间试验的进一步验证。
| [1] |
刘羽, 刘富强, 李文刚, 等. 微肥对马铃薯产量、品质、薯皮超微结构及块茎耐贮性的影响[J]. 中国马铃薯, 2018, 32(6): 351-357 DOI:10.3969/j.issn.1672-3635.2018.06.005 (  0) 0) |
| [2] |
胡洪涛, 朱志刚, 周荣华, 等. 不同处理对蛭石栽培的微型薯疮痂病防控效果及其微生态效应分析[J]. 华中农业大学学报, 2021, 40(4): 72-79 (  0) 0) |
| [3] |
刘星, 张书乐, 刘国锋, 等. 土壤生物消毒对甘肃省中部沿黄灌区马铃薯连作障碍的防控效果[J]. 应用生态学报, 2015, 26(4): 1205-1214 (  0) 0) |
| [4] |
侯乾, 王万兴, 李广存, 等. 马铃薯连作障碍研究进展[J]. 作物杂志, 2019, 35(6): 1-7 (  0) 0) |
| [5] |
侯慧, 董坤, 杨智仙, 等. 连作障碍发生机理研究进展[J]. 土壤, 2016, 48(6): 1068-1076 (  0) 0) |
| [6] |
卢维宏, 张乃明, 包立, 等. 我国设施栽培连作障碍特征与成因及防治措施的研究进展[J]. 土壤, 2020, 52(4): 651-658 (  0) 0) |
| [7] |
Rokunuzzaman M, Hayakawa A, Yamane S, et al. Effect of soil disinfection with chemical and biological methods on bacterial communities[J]. Egyptian Journal of Basic and Applied Sciences, 2016, 3(2): 141-148 DOI:10.1016/j.ejbas.2016.01.003 (  0) 0) |
| [8] |
程鸿燕, 张大琪, 黄斌, 等. 微生物菌肥对熏蒸剂处理后土壤微生态的影响研究进展[J]. 农药学学报, 2020, 22(5): 734-741 (  0) 0) |
| [9] |
贾喜霞, 师桂英, 吕海龙, 等. 土壤熏蒸-微生物有机肥联用缓解设施茄子连作障碍的土壤生物化学效应研究[J]. 甘肃农业大学学报, 2019, 54(3): 84-92 (  0) 0) |
| [10] |
Klose S, Acosta-Martínez V, Ajwa H A. Microbial community composition and enzyme activities in a sandy loam soil after fumigation with methyl bromide or alternative biocides[J]. Soil Biology and Biochemistry, 2006, 38(6): 1243-1254 DOI:10.1016/j.soilbio.2005.09.025 (  0) 0) |
| [11] |
Mowlick S, Inoue T, Takehara T, et al. Changes and recovery of soil bacterial communities influenced by biological soil disinfestation as compared with chloropicrin-treatment[J]. AMB Express, 2013, 3(1): 46 DOI:10.1186/2191-0855-3-46 (  0) 0) |
| [12] |
Li Q J, Zhang D Q, Cheng H Y, et al. Chloropicrin alternated with dazomet improved the soil's physicochemical properties, changed microbial communities and increased strawberry yield[J]. Ecotoxicology and Environmental Safety, 2021, 220: 112362 DOI:10.1016/j.ecoenv.2021.112362 (  0) 0) |
| [13] |
王方艳, 王秋霞, 颜冬冬, 等. 二甲基二硫熏蒸对保护地连作土壤微生物群落的影响[J]. 中国生态农业学报, 2011, 19(4): 890-896 (  0) 0) |
| [14] |
王翔, 聂湘平, 李凯彬. 三氯异氰尿酸和环丙沙星对水生生物的急性毒性[J]. 生态科学, 2006, 25(2): 155–157+ 161 DOI:10.3969/j.issn.1008-8873.2006.02.016 (  0) 0) |
| [15] |
孙倩, 吴宏亮, 陈阜, 等. 宁夏中部干旱带不同作物根际土壤真菌群落多样性及群落结构[J]. 微生物学通报, 2019, 46(11): 2963-2972 (  0) 0) |
| [16] |
Bokulich N A, Kaehler B D, Rideout J R, et al. Optimizing taxonomic classification of marker-gene amplicon sequences with QIIME 2's q2-feature-classifier plugin[J]. Microbiome, 2018, 6(1): 90-106 DOI:10.1186/s40168-018-0470-z (  0) 0) |
| [17] |
Janvier C, Villeneuve F, Alabouvette C, et al. Soil health through soil disease suppression: Which strategy from descriptors to indicators?[J]. Soil Biology and Biochemistry, 2007, 39(1): 1-23 DOI:10.1016/j.soilbio.2006.07.001 (  0) 0) |
| [18] |
Huang X, Dong W Y, Wang H J, et al. Biological nutrient removal and molecular biological characteristics in an anaerobic-multistage anaerobic/oxic (A-MAO) process to treat municipal wastewater[J]. Bioresource Technology, 2017, 241: 969-978 DOI:10.1016/j.biortech.2017.05.161 (  0) 0) |
| [19] |
尹萌, 孙寓姣, 李洁, 等. 生物质废弃物发酵过程中菌群多样性及秸秆降解菌的筛选[J]. 江苏农业学报, 2020, 36(3): 591-598 DOI:10.3969/j.issn.1000-4440.2020.03.009 (  0) 0) |
| [20] |
Kielak A M, Barreto C C, Kowalchuk G A, et al. The ecology of acidobacteria: Moving beyond genes and genomes[J]. Frontiers in Microbiology, 2016, 7: 744 (  0) 0) |
| [21] |
Hollister E B, Hu P, Wang A S, et al. Differential impacts of brassicaceous and nonbrassicaceous oilseed meals on soil bacterial and fungal communities[J]. FEMS Microbiology Ecology, 2013, 83(3): 632-641 DOI:10.1111/1574-6941.12020 (  0) 0) |
| [22] |
Bastian F, Bouziri L, Nicolardot B, et al. Impact of wheat straw decomposition on successional patterns of soil microbial community structure[J]. Soil Biology and Biochemistry, 2009, 41(2): 262-275 DOI:10.1016/j.soilbio.2008.10.024 (  0) 0) |
| [23] |
Ma A Z, Zhuang X L, Wu J M, et al. Ascomycota members dominate fungal communities during straw residue decomposition in arable soil[J]. PLoS One, 2013, 8(6): e66146 DOI:10.1371/journal.pone.0066146 (  0) 0) |
| [24] |
郝智勇. 马铃薯种薯生产中常见致病菌及杀菌剂的类型[J]. 黑龙江农业科学, 2017(5): 154-158 (  0) 0) |
| [25] |
Ligon J M, Hill D S, Hammer P E, et al. Natural products with antifungal activity from Pseudomonas biocontrol bacteria[J]. Pest Management Science, 2000, 56(8): 688-695 DOI:10.1002/1526-4998(200008)56:8<688::AID-PS186>3.0.CO;2-V (  0) 0) |
| [26] |
Shafi J, Tian H, Ji M S. Bacillus species as versatile weapons for plant pathogens: A review[J]. Biotechnology & Biotechnological Equipment, 2017, 31(3): 446-459 (  0) 0) |
| [27] |
张亚玲, 唐雪婷, 王兵, 等. 木霉菌与杀菌剂联合使用对水稻纹枯病菌的抑制效果[J]. 河南农业科学, 2021, 50(9): 96-104 (  0) 0) |
| [28] |
张逸飞, 徐婷婷, 韩成, 等. 不同施肥模式和地下水位条件下红壤水稻土PLFA指纹特征[J]. 生态与农村环境学报, 2017, 33(6): 533-538 (  0) 0) |
| [29] |
Zheng Q, Hu Y T, Zhang S S, et al. Soil multifunctionality is affected by the soil environment and by microbial community composition and diversity[J]. Soil Biology and Biochemistry, 2019, 136: 107521 DOI:10.1016/j.soilbio.2019.107521 (  0) 0) |
| [30] |
Liu S, Wang Z Y, Niu J F, et al. Changes in physicochemical properties, enzymatic activities, and the microbial community of soil significantly influence the continuous cropping of Panax quinquefolius L. (American ginseng)[J]. Plant and Soil, 2021, 463(1/2): 427-446 (  0) 0) |
| [31] |
李玲, 仇少君, 刘京涛, 等. 土壤溶解性有机碳在陆地生态系统碳循环中的作用[J]. 应用生态学报, 2012, 23(5): 1407-1414 (  0) 0) |
| [32] |
De Neve S, Csitári G, Salomez J, et al. Quantification of the effect of fumigation on short- and long-term nitrogen mineralization and nitrification in different soils[J]. Journal of Environmental Quality, 2004, 33(5): 1647-1652 DOI:10.2134/jeq2004.1647 (  0) 0) |
| [33] |
燕平梅, 高贵喜, 曹坳程, 等. 土壤熏蒸剂对土壤硝化、反硝化作用的影响[J]. 中国生态农业学报, 2014, 22(4): 401-407 (  0) 0) |
| [34] |
Yamamoto T, Ultra V U, Tanaka S, et al. Effects of methyl bromide fumigation, chloropicrin fumigation and steam sterilization on soil nitrogen dynamics and microbial properties in a pot culture experiment[J]. Soil Science and Plant Nutrition, 2008, 54(6): 886-894 DOI:10.1111/j.1747-0765.2008.00319.x (  0) 0) |
| [35] |
张树萌, 黄懿梅, 倪银霞, 等. 宁南山区人工林草对土壤真菌群落的影响[J]. 中国环境科学, 2018, 38(4): 1449-1458 (  0) 0) |
| [36] |
邓文芳, 吴佳鹏, 洪义国, 等. 真菌反硝化过程及其驱动的N2O产生机制研究进展[J]. 微生物学报, 2021, 61(6): 1551-1566 (  0) 0) |
| [37] |
廉华, 马光恕, 李梅, 等. 棘孢木霉菌剂对黄瓜生理特性及产质量的影响[J]. 中国农业大学学报, 2021, 26(6): 42-52 (  0) 0) |
| [38] |
王宁, 郭建明, 宋兆欣, 等. 土壤消毒对土壤微生物的影响[J]. 北京农业, 2015(12): 129-130 DOI:10.3969/j.issn.1000-6966.2015.12.114 (  0) 0) |
2. Fujian Provincial Key Laboratory for Plant Eco-physiology, Fujian Normal University, Fuzhou 350007 China
 2022, Vol. 54
2022, Vol. 54


