2. 中国科学院大学, 北京 100049
随着我国城镇化进程的推动和工业布局调整,许多化工、农药、钢铁、金属冶炼、电镀等大量排放危险废弃物的企业从市区迁到开发区及工业集中区,导致城市中涌现了大量的重污染场地[1-2]。2014年《全国土壤污染状况调查公报》指出,我国重污染企业用地的点位超标率为36.3%。据不完全统计,全国目前有污染场地约30 ~ 50万个,其中60% 以上存在有机污染问题[2-3]。因此,为了完成2016年“土十条”中所要求的2030年我国污染地块安全利用率要达到95% 以上的战略目标,亟需发展高效、低成本和环境友好的有机污染场地土壤修复技术,这不仅是土壤修复领域的研究热点和难点,更是我国目前的重大科技需求。
作为典型的有机污染物,羟基联苯(hydroxybipheny)不仅被广泛应用于涂料、染料、印染助剂、皮革、木材和纸张的杀菌防腐中,同时还是农药生产的重要中间体和副产品[4-5]。由于羟基联苯的广泛使用,导致其最终进入环境介质,对土壤和水体造成污染,从而严重威胁人体健康。羟基联苯是脱氧核糖核酸酶Ⅰ的抑制剂,具有高毒性和致癌性,可以引发肿瘤、白血病等疾病。我国在2011年4月发布的《食品添加剂使用卫生标准》中规定了对羟基联苯的使用量[6],随后,在2012年4月发布了《卫生部办公厅关于征求拟撤销2, 4-二氯苯氧乙酸等38种食品添加剂意见的函》,其中包括了对羟基联苯[7]。因此,针对对羟基联苯大量使用所造成的环境污染问题,亟需发展快速有效的修复技术。
过硫酸盐化学氧化技术的发展为羟基联苯类污染物的降解和修复提供了契机,其基本原理是过硫酸盐在活化剂的作用下分解为高活性的自由基来降解有机污染物,从而实现污染的去除[8-12]。根据前人研究发现,过硫酸盐可以被金属(离子、氧化物)[8-12]、碱[13-14]、超声[15]、光照[16-18]、热[19-21]、电[22-23]等方式活化产生硫酸根自由基(SO4·–)与污染物反应使其降解。但是由于超声、光等活化手段在土壤中受到了限制,导致过硫酸盐化学氧化技术在土壤中应用不多;而纳米材料[24-27]在环境领域的应用,给过硫酸盐的活化带来了新方法,其独特的机械、催化、光化学、导电性质,能够高效活化过硫酸盐降解有机污染物,但因其成本较高,市场现有的纳米材料无法进行大规模生产应用。另外,目前纳米材料活化过硫酸盐大多用于废水处理,很少用于土壤修复。所以亟需研发高效、低成本和环境友好,且适合土壤修复的纳米功能材料。
基于以上研究背景,本研究以对羟基联苯为研究对象,以生物质炭和工业铁粉为原料,采用工业球磨技术制备铁碳纳米材料,并利用该纳米材料活化过硫酸钠降解对羟基联苯,以评价该体系降解对羟基联苯的效率,揭示此过程中对羟基联苯的降解机制,为羟基联苯类及其他有机污染土壤提供新的修复技术。
1 材料与方法 1.1 试剂和仪器主要试剂:过硫酸钠(PS)、无水硫酸钠、硝酸钠购自国药化学试剂有限公司,氯化钠、碳酸氢钠、磷酸二氢钠购自南京化学试剂有限公司,叔丁醇、对羟基联苯购自上海阿拉丁生化科技股份有限公司,5, 5-二甲基-1-吡咯啉-N-氧化物(DMPO,97%)、2, 2, 6, 6-四甲基哌啶酮(TEMP,99%)购自美国Sigma-Aldrich公司,色谱级甲醇购自德国默克股份两合公司。实验所有溶液均由超纯水配制。
主要仪器:高效液相色谱(LC-2030,岛津(上海)实验器材有限公司)、气相质谱联用仪(GC-MS- QP2020,岛津(上海)实验器材有限公司)、振荡培养箱(ZQTY-70,上海知楚仪器)、往复振荡器(HZ- 2611KA,太仓市华利达实验设备有限公司)、电子太平(BSA124S,塞多利斯科学仪器(北京)有限公司)、pH计(B39964,Thermo)、数控超声波清洗器(KQ- 500DV,昆山市超声仪器有限公司)、电子顺磁共振波谱仪(EPR,Bruker E500)。
1.2 铁碳复合纳米材料的制备向装有直径为8、10、12、16 mm钢珠的球磨罐(7 kg)中加入比例为1∶1的生物质炭和铁粉,盖上盖子,确保密封性完好,放入指定的位置,确保固定完成,拧上安全扣,关闭舱门,设定球磨程序:转速120 r/min,正转5 min停2 min,反转5 min停2 min,运行120 h,每隔24 h取样进行相关参数的测定,共取5次样,最后将上述所得固体过筛以分离所制备的材料和钢珠,筛下物为纳米铁碳材料(Fe-C),将其储存备用。
1.3 试验方法 1.3.1 水溶液中对羟基联苯的降解试验1) PS浓度的影响。在含有25.0 ml对羟基联苯溶液(20 mg/L)的100 ml锥形瓶中加入0.1 g/L的铁碳纳米材料(Fe-C),超声30 s和振荡15 min(25℃,200 r/min)使材料分散均匀后,加入PS母液开始反应,最终反应体系体积为50 ml,PS浓度为0.21 ~ 1.68 mmol/L,对羟基联苯的浓度为10 mg/L,反应0、10、30、60、120 min取0.40 ml反应液和0.40 ml甲醇溶液一起过0.22 μm有机相滤头于2.0 ml液相小瓶,HPLC待测。
2) Fe-C添加量的影响。在含有25.0 ml对羟基联苯溶液(20 mg/L)的100 ml锥形瓶中分别加入一定量(0.05 ~ 1.0 g/L)的Fe-C,超声30 s和振荡15 min (25 ℃,200 r/min)使材料分散均匀后,加入PS母液开始反应,最终反应体系体积为50 ml,PS浓度为0.50 mmol/L,对羟基联苯的浓度为10 mg/L,反应0、10、30、60、120 min取0.40 ml反应液和0.40 ml甲醇溶液一起过0.22 μm有机相滤头于2.0 ml液相小瓶,HPLC待测。
3) 不同活化剂材料的影响。在含有25.0 ml对羟基联苯溶液(20 mg/L)的100 ml锥形瓶中分别加入0.10 g/L的Fe-C、0.05 g/L纳米铁粉(Fe)、0.10 g/L碳材料(C),超声30 s和振荡15 min(25℃,200 r/min)使材料分散均匀后,加入PS母液开始反应,最终反应体系体积为50 ml,PS浓度为0.50 mmol/L,对羟基联苯的浓度为10 mg/L,反应0、10、30、60、90、120 min取0.40 ml反应液和0.40 ml甲醇溶液一起过0.22 μm有机相滤头于2.0 ml液相小瓶,HPLC待测。
4) 初始pH的影响。材料的投加过程等实验步骤、Fe-C浓度(0.10 g/L)、对羟基联苯浓度(10 mg/L)、PS浓度(0.5 mmol/L)同PS浓度试验,提前将Fe-C悬液、对羟基联苯溶液和PS溶液的初始pH调到3.0、5.0、7.0、9.0和11.0,其他降解、提取和分析过程同上。
5) 阴离子的影响。材料的投加过程等实验步骤、Fe-C浓度(0.10 g/L)、对羟基联苯浓度(10 mg/L)、PS浓度(0.5 mmol/L)同PS浓度试验,阴离子的类型为Cl–(10、20、50 mmol/L)、NO3–(10、20、50 mmol/L)、H2PO4–(1、10、20 mmol/L)和HCO3–(1、10、20 mmol/L),以未加阴离子处理为对照,阴离子在PS之前添加,其他降解、提取和分析过程同上。
6) 自由基猝灭试验。材料的投加过程等实验步骤、Fe-C浓度(0.10 g/L)、对羟基联苯浓度(10 mg/L)、PS浓度(0.5 mmol/L)同PS浓度试验,淬灭剂叔丁醇(t-BuOH)和甲醇(MeOH)的浓度均为0.2和1.0 mmol/L,在PS之前添加,同时以未加淬灭剂处理为对照,其他降解、提取和分析过程同上。
7) 自由基捕获试验。反应在2 ml样品瓶中进行,加入Fe-C(0.1 g/L)、PS(0.5 mmol/L)溶液,再分别加入50 µl的5, 5-二甲基-1-吡咯啉-N-氧化物(DMPO)和2, 2, 6, 6-四甲基哌啶酮(TEMP),最终反应体系体积为1.0 ml,Fe-C的浓度为0.10 g/L,PS的浓度为0.50 mmol/L,DMPO和TEMP浓度分别为0.10 mol/L和0.01 mol/L。将毛细管插入反应液中,待反应液吸到指定高度拿出封口,EPR待测。
1.3.2 土壤中对羟基联苯的降解试验反应在20 ml样品瓶中进行,加入0.5 g对羟基联苯含量为20 mg/kg的污染土壤(土壤pH为4.91,有机质含量为10.11 g/kg,总Fe为37.4 g/kg,无定型Fe为3.45 g/kg,游离Fe为23.04 g/kg),加入一定量的超纯水,再加入一定量的(0 ~ 0.2 g/L)Fe-C和PS(0.05 ~ 0.1 g/L)溶液,最终反应体系体积为5.0 ml,常温常压下进行振荡,转速为200 r/min,不同反应时间(0、10、30、60、120和240 min)取样,加入0.50 ml甲醇溶液,再加5.0 ml二氯甲烷振荡30 min,取下层溶液1.0 ml,过装有无水硫酸钠的0.22 μm有机相滤头于2.0 ml液相小瓶,GC-MS待测。
1.4 检测方法水溶液中对羟基联苯的浓度通过HPLC进行测定,色谱柱为C18色谱柱(5 μm,4.6 mm×250 mm),配备自动进样器,检测器为紫外可见吸收检测器。色谱流动相由70% 的甲醇和30% 的超纯水组成,流速为1.0 ml/min,检测波长为258 nm,柱温为30℃,进样量为20 μl。
土壤中对羟基联苯的含量通过GC-MS进行测定,色谱柱为SH-Rxi-5Sil MS(L 30 m,ID 0.25,DF 0.25),配备自动进样器。柱温箱初始温度为60℃,离子源温度为200℃,进样口温度为280℃,接口温度为280℃,线速度为36.5 cm/s,升温程序为:60℃保持0 min,以15℃/min升至150℃保持1 min,以20℃/min升至180℃保持1 min,以20℃/min升至300℃保持1 min。
通过EPR鉴定体系中的自由基种类,检测波段为X-波段,微波功率为6.33 MW,谐振频率为9.42 GHz,调制幅度为1.0 G,调制频率为100 kHz。
通过GC-MS检测对羟基联苯的产物,色谱柱为SH-Rxi-5Sil MS(L 30 m,ID 0.25,DF 0.25),配备自动进样器。色谱条件如下:柱箱初始温度为60℃,离子源温度为200℃,进样口温度为280℃,接口温度为280℃,压力57.5 kPa,柱流量1.0 ml/min,线速度为36.5 cm/s,不分流高压(压力250.0 kPa,时间1.0 min)进样,升温程序为60℃保持0 min,再以10℃/min升至310 ℃保持1 min。
1.5 数据处理对羟基联苯降解率与残留率的计算公式如下:
| $ \text { 对羟基联苯降解率 }(\%)=\left(C_0-C_t\right) / C_0 \times 100 \% $ | (1) |
| $ \text { 对羟基联苯残留率 }(\%)=C_t / C_0 \times 100 \% $ | (2) |
式中:C0为对羟基联苯的初始浓度,mg/L;Ct为反应开始后t时刻对羟基联苯的浓度,mg/L。
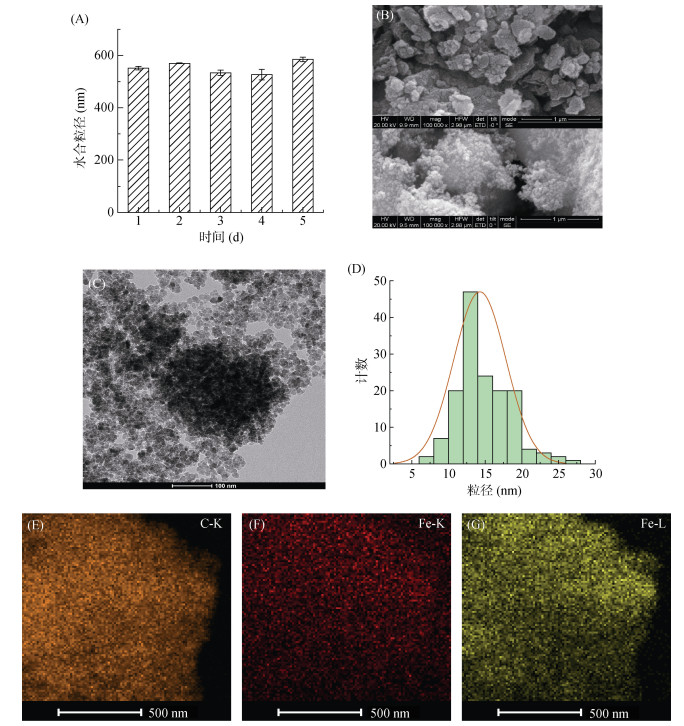
2 结果与讨论 2.1 铁碳纳米材料的制备与表征采用球磨法制备铁碳纳米材料(Fe-C),根据预试验优化了球磨的参数,试验中球磨转速120 r/min,正转5 min停2 min,反转5 min停2 min,运行120 h,每隔24 h取样进行检测,球料比为2.3,对不同时间制备的材料进行表征,结果如图 1所示。图 1A为不同球磨时间材料颗粒的水合粒径变化,可以看出,球磨1 d后材料的水合粒径可达550 nm,随着球磨时间的延长,水合粒径变化不显著,水合粒径较大的原因主要是颗粒的团聚导致的。图 1B和图 1C是球磨所得材料的扫描电镜(SEM)和透射电镜(TEM)图片,可以看出,材料呈片状或球状,在大颗粒表面附着大量细小纳米颗粒,利用TEM的粒径分布分析发现(图 1D),碳材料表面分布粒径为15 nm左右的纳米颗粒,结合图 1E元素分布图中C元素的K线、Fe元素的K线和Fe元素的L线可以看出,所制备的材料中铁(Fe)、碳(C)分布均匀。以上结果表明,通过球磨法成功制备了Fe-C。
|
(A:不同球磨时间的水合粒径;B:SEM图;C:TEM图;D:粒径分布;E:元素分布) 图 1 铁碳纳米材料的表征 Fig. 1 Material characterizations |
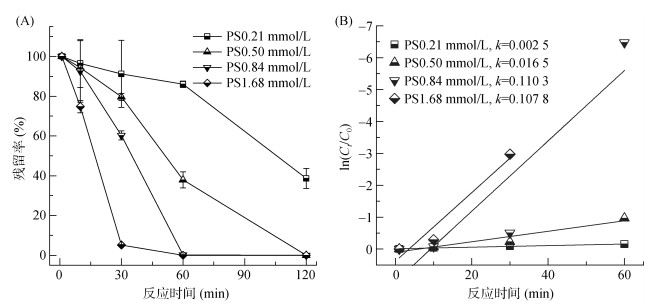
Fe-C活化PS降解对羟基联苯的效果如图 2所示。从图 2可以看出,对羟基联苯的降解效率随着PS的浓度增大而逐渐增加,当PS的浓度为0.21 mmol/L时,对羟基联苯在120 min内降解率可达60%,继续增加PS的浓度至0.50 mmol/L时,污染物在120 min内基本能够被完全降解。对羟基联苯的降解动力学能够很好地用准一级动力学方程拟合(图 3B),随着PS的浓度从0.21 mmol/L增加至1.68 mmol/L,其降解的准一级动力学常数(k)也由0.002 5增加到0.016 5。以上结果说明,增加PS的浓度显著促进了对羟基联苯的降解速率,主要原因是随着氧化剂浓度的增加,反应体系中被Fe-C活化产生参与反应自由基的速率增加,所得到的活性物质越来越多,增加了各活性物质与污染物的接触,从而使得污染物降解的速率加快。
|
图 2 PS浓度对对羟基联苯降解的影响(Fe-C=0.10 g/L) Fig. 2 Effect of PS concentrations on degradation of p-hydroxybiphenyl |

|
图 3 Fe-C添加量对对羟基联苯降解的影响(PS0.50 mmol/L) Fig. 3 Effect of Fe-C concentrations on degradation of p-hydroxybiphenyl |
进一步研究Fe-C添加量对对羟基联苯降解的影响,结果如图 3所示。从图 3可以看出,当Fe-C投加量为0.05 g/L时,污染物在120 min内降解达76.5%,将Fe-C投加量增加到0.10 g/L时,污染物在120 min内基本降解,其k值由0.003 8增加到0.016 5;当Fe-C投加量增加到0.2 g/L和0.50 g/L时,污染物在60 min内降解达91.8% 和93.1%,其k值也分别增加至0.042 6和0.046 9。这是因为增加Fe-C的投加量,反应体系中能被用来活化氧化剂的活性位点随之增加,从而使得产生活性物质的速率增加,导致污染物的降解速率加快。但进一步增加Fe-C的投加量到1.00 g/L时,污染物在120 min内的降解率只有88%,其k也降低到了0.018 7,这是因为过量的Fe-C会跟体系中产生的自由基反应,竞争消耗了一部分参与污染物降解的自由基,从而导致污染物降解效率下降。
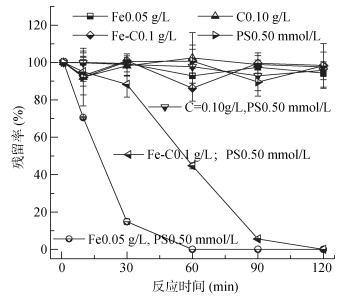
2.3 铁碳纳米材料活化过硫酸盐活性与纳米铁粉的对比通过上述试验对Fe-C和PS剂量的优化,发现在对羟基联苯初始浓度10 mg/L条件下,Fe-C的投加量为0.10 g/L、PS浓度为0.50 mmol/L时,Fe-C和PS使用量最少且降解效果良好。水溶液中作为对照,在相同试验条件下,对比了单独碳材料(C)、纳米铁粉(Fe)活化PS降解对羟基联苯的效果,结果如图 4所示。按照Fe-C中Fe含量为50.23% 的比例,单独纳米铁粉的用量为0.05 g/L时,可以看出,纳米铁粉同样具有高效活化过PS降解对羟基联苯的能力,120 min能将对羟基联苯彻底降解,说明纳米铁粉也能够高效活化过PS降解对羟基联苯。但在实际的土壤修复应用中,商业纳米铁粉的价格(1 000元/kg)要远高于本研究的Fe-C(10元/kg),而碳材料的引入会增加纳米铁材料在土壤中的迁移和增加其在土壤复杂体系中的活性。
|
图 4 对羟基联苯的降解动力学 Fig. 4 Kinetics of p-hydroxybiphenyl degradation |
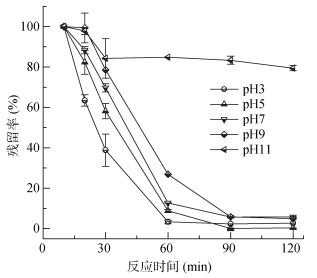
在活化过硫酸盐降解有机污染物的过程中,反应体系的pH对污染物的降解影响较大,因此本研究考察了不同pH下Fe-C活化PS降解对羟基联苯的效果,结果如图 5所示。由图 5可以看出,初始pH在3 ~ 9范围内,对羟基联苯都能够被很好地降解,降解率都在94.1% 以上。总体来说,随着pH下降,对羟基联苯的降解速率逐渐增大,主要原因是在低pH时,Fe-C中的铁会被逐渐溶解,溶出的二价铁离子能够促进PS的活化,从而增加了污染物的降解效率;当pH为11时,对羟基联苯仅降解了20.5%,这是因为在pH升至11时,溶液呈絮凝状,溶液中的铁离子被沉淀,导致反应被抑制。
|
图 5 初始pH对对羟基联苯降解的影响(Fe-C0.10 g/L、PS0.50 mmol/L) Fig. 5 Effect of initial pH on degradation of p-hydroxybiphenyl |
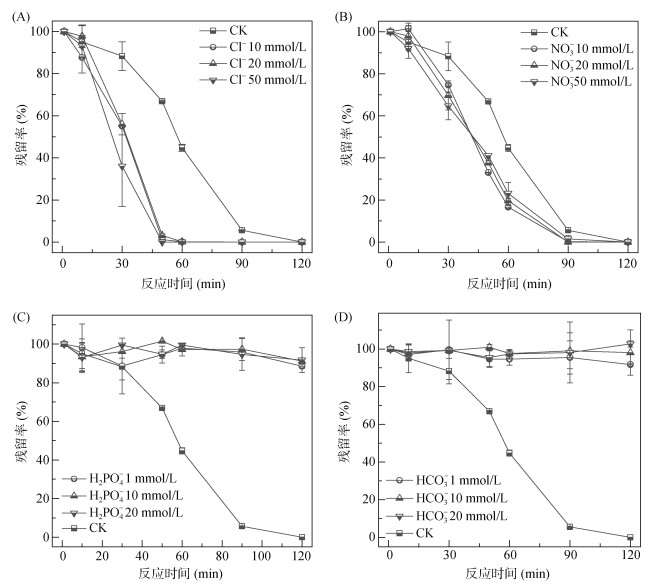
本研究发现,环境中存在的阴离子(Cl–、NO3–、H2PO4–、HCO3–等)会对活化PS中的自由基有着猝灭作用,从而抑制污染物的降解,结果如图 6所示。Cl–的加入显著促进了对羟基联苯的降解(图 6A),主要原因可能是加入的Cl–可以与体系中的·OH和SO4·–反应生成含氯的活性自由基。虽然所生成的含氯自由基的氧化还原电位比·OH和SO4·–低,却能够与对羟基联苯发生反应,从而促进其降解,相关反应式如下[28-30]:
| $ \cdot \mathrm{OH}+\mathrm{Cl}^{-} \to {\text{HOC}}{{\text{I}}^{ \cdot - }} $ | (3) |
| $ {\text{HOC}}{{\text{l}}^{ \cdot - }} + {{\text{H}}^{\text{ + }}} \to {\text{C}}{{\text{l}}^ \cdot } + {{\text{H}}_2}{\text{O}} $ | (4) |
| $ {\text{SO}}_{\text{4}}^{ \cdot - } + {\text{C}}{{\text{l}}^ - } \to {\text{C}}{{\text{l}}^ \cdot }{\text{ + SO}}_4^{2 - } $ | (5) |
| $ {\text{C}}{{\text{l}}^ \cdot } + {\text{C}}{{\text{l}}^ - } \to {\text{Cl}}_2^{ \cdot - } $ | (6) |
| $ {\text{Cl}}_2^{ \cdot - } + \cdot {\text{OH}} \to {\text{HOCl + C}}{{\text{l}}^ - } $ | (7) |
|
图 6 环境阴离子对对羟基联苯降解的影响(Fe-C 0.10g/L,PS 0.50mmd/L) Fig. 6 Effect of environmental anions on degradation of p-hydroxybiphenyl |
而NO3–的加入与Cl–有着类似的结果,其也显著促进了对羟基联苯的降解(图 6B),主要原因可能是·OH和SO4·–转化为硝酸根自由基促进了对羟基联苯的硝基化降解过程[31-32],相关反应式(式(8) ~ 式(10))如下。除此之外,Cl–、NO3–的存在转化了一部分·OH和SO4·–,避免了·OH和SO4·–的自猝灭和相互反应,kSO4·–, SO4·– =4.0×108 mol/(L·s),k·OH, ·OH =5.5×109 mol/(L·s),kSO4·–, ·OH =1.0×1010 mol/(L·s),从而表现出对反应的促进作用。
| $ \cdot {\text{OH + NO}}_{\text{3}}^ - \to {\text{O}}{{\text{H}}^ - }{\text{ + NO}}_{\text{3}}^ \cdot $ | (8) |
| $ {\text{SO}}_4^{ \cdot - } + {\text{NO}}_{\text{3}}^ - \to {\text{SO}}_4^{2 - } + {\text{NO}}_{\text{3}}^ \cdot $ | (9) |
| $ {\rm{NO}}_3^ \cdot + {{\rm{H}}_2}{\rm{O}} + {{\rm{e}}_{{\rm{\bar aq}}}} \to {\rm{NO}}_2^ \cdot + 2{\rm{O}}{{\rm{H}}^ - } $ | (10) |
如图 6C和6D所示,H2PO4–和HCO3–的加入抑制了反应的进行,这是因为H2PO4–和HCO3–的加入,猝灭了体系中
| $ \cdot {\text{OH + HCO}}_{\text{3}}^ - \to {{\text{H}}_2}{\text{O + CO}}_{\text{3}}^{ \cdot - } $ | (11) |
| $ {\text{SO}}_{\text{4}}^{ \cdot - } + {\text{HCO}}_{\text{3}}^ - \to {\text{HSO}}_{\text{4}}^ - {\text{ + CO}}_{\text{3}}^{ \cdot - } $ | (12) |
| $ \cdot {\text{OH + }}{{\text{H}}_2}{\text{PO}}_{\text{4}}^ - \to {\text{O}}{{\text{H}}^ - } + {{\text{H}}_2}{\text{PO}}_{\text{4}}^ \cdot $ | (13) |
| $ {\text{SO}}_{\text{4}}^{ \cdot - } + {{\text{H}}_2}{\text{PO}}_{\text{4}}^ - \to {\text{SO}}_{\text{4}}^{2 - } + {{\text{H}}_2}{\text{PO}}_{\text{4}}^ \cdot $ | (14) |
通过自由基猝灭试验和电子顺磁共振光谱鉴定Fe-C活化PS的体系中的自由基类型以研究此过程的活化机制。甲醇(MeOH)可以用来猝灭·OH和SO4·–,其二级反应动力学常数分别为k·OH, MeOH =(1.2~2.8)× 109 mol/(L·s);
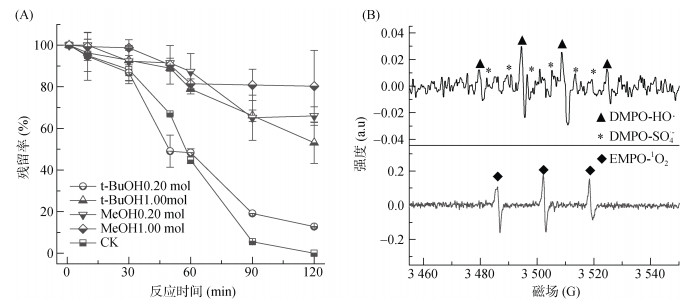
|
图 7 自由基猝灭剂对对羟基联苯降解的影响(A)及Fe-C活化PS体系中EPR图谱(B) Fig. 7 Effect of free radical quencher on degradation of p-hydroxybiphenyl(A)and EPR spectrum of activated PS system with iron-carbon nanomaterials(B) |
综上所述,Fe-C活化过硫酸盐的主要机制包括了自由基和非自由基机制,Fe-C中铁通过电子传递给过硫酸盐导致其分解为
| $ {\text{F}}{{\text{e}}^0} + 2{{\text{S}}_2}{\text{O}}_8^{2 - } \to {\text{F}}{{\text{e}}^{2 + }} + 2{\text{SO}}_4^{ \cdot - } + 2{\text{SO}}_4^{2 - } $ | (15) |
| $ {\text{F}}{{\text{e}}^{2 + }} + {{\text{S}}_2}{\text{O}}_8^{2 - } \to {\text{F}}{{\text{e}}^{3 + }} + {\text{SO}}_4^{ \cdot - } + {\text{SO}}_4^{2 - } $ | (16) |
| $ {\text{F}}{{\text{e}}^0} + {\text{F}}{{\text{e}}^{3 + }} \to {\text{F}}{{\text{e}}^{2 + }} $ | (17) |
| $ {\text{SO}}_4^{ \cdot - } + {\text{O}}{{\text{H}}^ - } \to \cdot {\text{OH + SO}}_4^{2 - } $ | (18) |
| $ {\text{SO}}_4^{ \cdot - } + {{\text{H}}_{\text{2}}}{\text{O}} \to \cdot {\text{OH + SO}}_4^{2 - } + {{\text{H}}^{\text{ + }}} $ | (19) |
| $ {\text{SO}}_4^{ \cdot - } + {\text{F}}{{\text{e}}^{2 + }} \to {\text{F}}{{\text{e}}^{3 + }} + {\text{SO}}_4^{2 - } $ | (20) |
| $ {{\text{S}}_{\text{2}}}{\text{O}}_8^{2 - } + 2{{\text{H}}_{\text{2}}}{\text{O}} \to {\text{HO}}_2^ - + 2{\text{SO}}_4^{2 - } + 3{{\text{H}}^{\text{ + }}} $ | (21) |
| $ {{\text{S}}_{\text{2}}}{\text{O}}_8^{2 - } + {\text{HO}}_2^ - \to {\text{SO}}_4^{ \cdot - } + {\text{SO}}_4^{2 - } + {\text{O}}_{\text{2}}^{ \cdot - } + {{\text{H}}^{\text{ + }}} $ | (22) |
| $ 2{O} _{\text{2}}^{ \cdot - } + 2{{\text{H}}_{\text{2}}}{\text{O}}{ \to ^1}{{\text{O}}_{\text{2}}} + {{\text{H}}_{\text{2}}}{{\text{O}}_{\text{2}}} + 2{\text{O}}{{\text{H}}^ - } $ | (23) |
通过GC-MS对降解产物进行检测,筛选出7种产物,如图 8所示,分别编号为α、β、χ、δ、ε、

|
图 8 对羟基联苯降解产物及可能途径 Fig. 8 Products and possible pathways of p-hydroxybiphenyl degradation |
为了进一步验证Fe-C活化PS降解对羟基联苯的效果,研究了其在土壤中对对羟基联苯的降解过程,如图 9A所示。PS的投入量为0.05 g/L,在不加Fe-C时,对羟基联苯在240 min内降解了26.3%,这是因为供试土壤为红壤,含铁量较高,土壤背景中的铁含量能够活化PS降解对羟基联苯;当加入0.05 ~ 0.20 g/L Fe-C时,污染物在240 min内的降解率可提高至60% 左右,说明Fe-C的加入能够活化PS促进污染物的降解。由图 9B可以看出,当只加Fe-C时,污染物几乎不发生降解;当只加入0.10 g/L的PS时,对羟基联苯在8 h内降解了60%;当同时加入0.10 g/LFe-C和0.10 g/L PS时,在480 min内对羟基联苯降解了85% 以上,说明Fe-C活化PS反应体系能够用于实际的对羟基联苯污染的土壤修复。
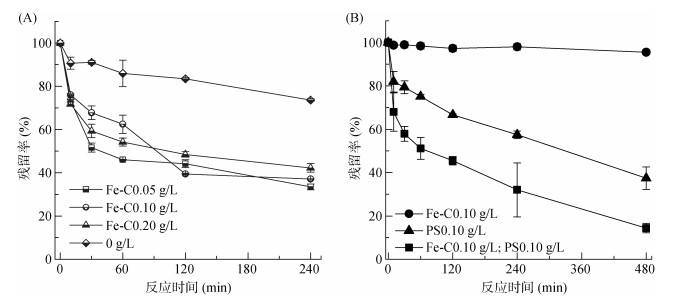
|
图 9 土壤中对羟基联苯的降解效果 Fig. 9 Degradation of p-hydroxybiphenyl in soil |
1) 采用工业球磨技术,以生物质炭和工业铁粉作为原料,成功制备出了铁碳纳米复合材料,为用于环境修复领域纳米材料的批量生产提供了新方法。
2) 在水体系中,铁碳复合纳米材料的投加量为0.10 g/L、过硫酸钠的投加浓度为0.50 mmol/L即可获得良好的降解效果,同时研究发现体系中·OH和SO4·–是主要反应活性物质,另外还存在少量的1O2参与了反应。该反应体系作用pH范围广、不受氯离子和硝酸盐干扰,对不同的有机污染物都有良好的去除能力。
3) 铁碳复合纳米材料和过硫酸钠的反应体系对土壤中的污染物同样具有很好的去除效果,该反应体系在有机污染废水的处理和有机污染土壤的修复中都具有一定的应用前景。
| [1] |
纪晨琛, 马云鹏, 李晓光, 等. 化工与农药污染场地的热脱附修复技术[C]//2015年中国环境科学学会学术年会论文集. 深圳, 2015: 441–446.
(  0) 0) |
| [2] |
廖晓勇, 崇忠义, 阎秀兰, 等. 城市工业污染场地: 中国环境修复领域的新课题[J]. 环境科学, 2011, 32(3): 784-794 (  0) 0) |
| [3] |
李珊珊, 张文毓, 孙长虹, 等. 基于文献计量分析土壤修复的研究现状与趋势[J]. 环境工程, 2015, 33(5): 160-165 (  0) 0) |
| [4] |
Budavari S, The Merck Index-An Encyclopedia of Chemicals, Drugs, and Biologicals[M]. Whitehouse Station, NJ: Merck & Co., Inc., 1996: 1160.
(  0) 0) |
| [5] |
吕咏梅. 苯基苯酚合成与发展[J]. 化工中间体网刊, 2002(Z3): 21-22 (  0) 0) |
| [6] |
中华人民共和国国家卫生健康委员会. 食品添加剂使用标准[S/OL]. (2011-06-07)[2021-2-20]. http://www.nhc.gov.cn/wjw/aqbz/201106/a2cedb1c45894acdba5790ca164883aa.shtml.
(  0) 0) |
| [7] |
中华人民共和国卫生部. 卫生部拟撤销2, 4-二氯苯氧乙酸等食品添加剂的函[EB/OL]. (2012-04-06)[2021-2-20]. http://www.gov.cn/gzdt/2012-04/06/content_2108073.htm.
(  0) 0) |
| [8] |
Qiu Y, Zhang Q, Wang Z H, et al. Degradation of anthraquinone dye reactive blue 19 using persulfate activated with Fe/Mn modified biochar: Radical/non- radical mechanisms and fixed-bed reactor study[J]. Science of the Total Environment, 2021, 758: 143584 DOI:10.1016/j.scitotenv.2020.143584 (  0) 0) |
| [9] |
Zhao X D, Yeung C S, Dong V M. Palladium-catalyzed ortho-arylation of O-phenylcarbamates with simple arenes and sodium persulfate[J]. Journal of the American Chemical Society, 2010, 132(16): 5837-5844 DOI:10.1021/ja100783c (  0) 0) |
| [10] |
Shang W T, Dong Z J, Li M, et al. Degradation of diatrizoate in water by Fe(II)-activated persulfate oxidation[J]. Chemical Engineering Journal, 2019, 361: 1333-1344 DOI:10.1016/j.cej.2018.12.139 (  0) 0) |
| [11] |
Yang G, Dong J W, Xing B, et al. Ni, Fe, and N-tridoped activated carbon as a highly active heterogeneous persulfate catalyst toward the degradation of organic pollutant in water[J]. Separation and Purification Technology, 2020, 252: 117440 DOI:10.1016/j.seppur.2020.117440 (  0) 0) |
| [12] |
Zong Y, Guan X H, Xu J, et al. Unraveling the overlooked involvement of high-valent cobalt-oxo species generated from the cobalt(II)-activated peroxymonosulfate process[J]. Environmental Science & Technology, 2020, 54(24): 16231-16239 (  0) 0) |
| [13] |
Li W, Orozco R, Camargos N, et al. Mechanisms on the impacts of alkalinity, pH, and chloride on persulfate-based groundwater remediation[J]. Environmental Science & Technology, 2017, 51(7): 3948-3959 (  0) 0) |
| [14] |
Furman O S, Teel A L, Watts R J. Mechanism of base activation of persulfate[J]. Environmental Science & Technology, 2010, 44(16): 6423-6428 (  0) 0) |
| [15] |
Wei Z S, Villamena F A, Weavers L K. Kinetics and mechanism of ultrasonic activation of persulfate: An in situ EPR spin trapping study[J]. Environmental Science & Technology, 2017, 51(6): 3410-3417 (  0) 0) |
| [16] |
Dhaka S, Kumar R, Khan M A, et al. Aqueous phase degradation of methyl paraben using UV-activated persulfate method[J]. Chemical Engineering Journal, 2017, 321: 11-19 DOI:10.1016/j.cej.2017.03.085 (  0) 0) |
| [17] |
Liu G S, You S J, Tan Y, et al. In situ photochemical activation of sulfate for enhanced degradation of organic pollutants in water[J]. Environmental Science & Technology, 2017, 51(4): 2339-2346 (  0) 0) |
| [18] |
Choi J, Chung J. Evaluation of urea removal by persulfate with UV irradiation in an ultrapure water production system[J]. Water Research, 2019, 158: 411-416 DOI:10.1016/j.watres.2019.02.017 (  0) 0) |
| [19] |
Johnson R L, Tratnyek P G, Johnson R O. Persulfate persistence under thermal activation conditions[J]. Environmental Science & Technology, 2008, 42(24): 9350-9356 (  0) 0) |
| [20] |
Bruton T A, Sedlak D L. Treatment of aqueous film-forming foam by heat-activated persulfate under conditions representative of in situ chemical oxidation[J]. Environmental Science & Technology, 2017, 51(23): 13878-13885 (  0) 0) |
| [21] |
Zrinyi N, Pham A L T. Oxidation of benzoic acid by heat-activated persulfate: Effect of temperature on transformation pathway and product distribution[J]. Water Research, 2017, 120: 43-51 DOI:10.1016/j.watres.2017.04.066 (  0) 0) |
| [22] |
Farhat A, Keller J, Tait S, et al. Removal of persistent organic contaminants by electrochemically activated sulfate[J]. Environmental Science & Technology, 2015, 49(24): 14326-14333 (  0) 0) |
| [23] |
Matzek L W, Tipton M J, Farmer A T, et al. Understanding electrochemically activated persulfate and its application to ciprofloxacin abatement[J]. Environmental Science & Technology, 2018, 52(10): 5875-5883 (  0) 0) |
| [24] |
Duan X G, Sun H Q, Kang J, et al. Insights into heterogeneous catalysis of persulfate activation on dimensional-structured nanocarbons[J]. ACS Catalysis, 2015, 5(8): 4629-4636 DOI:10.1021/acscatal.5b00774 (  0) 0) |
| [25] |
Lee H, Kim H I, Weon S, et al. Activation of persulfates by graphitized nanodiamonds for removal of organic compounds[J]. Environmental Science & Technology, 2016, 50(18): 10134-10142 (  0) 0) |
| [26] |
Kim C, Ahn J Y, Kim T Y, et al. Activation of persulfate by nanosized zero-valent iron (NZVI): Mechanisms and transformation products of NZVI[J]. Environmental Science & Technology, 2018, 52(6): 3625-3633 (  0) 0) |
| [27] |
Liu Y N, Luo J, Tang L, et al. Origin of the enhanced reusability and electron transfer of the carbon-coated Mn3O4 nanocube for persulfate activation[J]. ACS Catalysis, 2020, 10(24): 14857-14870 DOI:10.1021/acscatal.0c04049 (  0) 0) |
| [28] |
Fu H C, Zhao P, Xu S J, et al. Fabrication of Fe3O4 and graphitized porous biochar composites for activating peroxymonosulfate to degrade p-hydroxybenzoic acid: Insights on the mechanism[J]. Chemical Engineering Journal, 2019, 375: 121980 (  0) 0) |
| [29] |
Luo R, Li M Q, Wang C H, et al. Singlet oxygen-dominated non-radical oxidation process for efficient degradation of bisphenol A under high salinity condition[J]. Water Research, 2019, 148: 416-424 (  0) 0) |
| [30] |
Gligorovski S, Strekowski R, Barbati S, et al. Environmental implications of hydroxyl radicals (•OH)[J]. Chemical Reviews, 2015, 115(24): 13051-13092 (  0) 0) |
| [31] |
Kermani M, Farzadkia M, Morovati M, et al. Degradation of furfural in aqueous solution using activated persulfate and peroxymonosulfate by ultrasound irradiation[J]. Journal of Environmental Management, 2020, 266: 110616 (  0) 0) |
| [32] |
Ghauch A, Tuqan A M, Kibbi N. Naproxen abatement by thermally activated persulfate in aqueous systems[J]. Chemical Engineering Journal, 2015, 279: 861-873 (  0) 0) |
| [33] |
Ma J, Yang Y Q, Jiang X, et al. Impacts of inorganic anions and natural organic matter on thermally activated persulfate oxidation of BTEX in water[J]. Chemosphere, 2018, 190: 296-306 (  0) 0) |
| [34] |
Wang Z, Qiu W, Pang S Y, et al. Relative contribution of ferryl ion species (Fe(IV)) and sulfate radical formed in nanoscale zero valent iron activated peroxydisulfate and peroxymonosulfate processes[J]. Water Research, 2020, 172: 115504 (  0) 0) |
| [35] |
Cheng X, Guo H G, Zhang Y L, et al. Non-photochemical production of singlet oxygen via activation of persulfate by carbon nanotubes[J]. Water Research, 2017, 113: 80-88 (  0) 0) |
2. University of Chinese Academy of Sciences, Beijing 100049, China
 2022, Vol. 54
2022, Vol. 54


