2. 黄土高原特色作物优质高效生产省部共建协同创新中心, 山西太谷 030801;
3. 陕西博秦生物工程有限公司, 陕西咸阳 713899
谷子(Setaria italica)最早起源于中国,是我国北方重要的杂粮作物。与小麦、玉米和水稻等谷物粮食相比,谷子的营养成分种类多、含量丰富,尤其以非必需氨基酸、维生素B、膳食纤维和不饱和脂肪酸等含量较高[1-2]。近年来,随着人们对健康饮食结构的关注逐渐增加,对谷子的需求量也日益扩大。由于低产仍是目前谷子生产中面临的主要问题,因此,寻找适宜增产方式对于维持谷子在农业生产中的地位具有重要意义。增施化肥和选育高产品种是谷子增产的两种主要措施。然而,过量施用化肥易对土壤和环境造成污染,而高产品种的培育往往需要较长时间,因此,有必要寻找新的促生增产方式来增加谷子产量。
外源添加有益微生物促进植物生长是一种高效便捷、环保无害、符合可持续发展要求的措施。目前,利用外源微生物促进小麦[3-4]、水稻[5]和玉米[6-7]等粮食作物生长已有不少报道。谷子促生微生物的研究目前多集中在细菌和真菌上:方瑞琳等[8]的田间试验表明施加细菌和真菌菌剂增加了谷子的根系生物量和产量;张笛等[9]试验发现利用枯草芽孢杆菌(Bacillu subtilis)进行种子包衣促进了谷子种子的萌发;杨永青等[10]研究表明,枯草芽孢杆菌(B. subtilis)和地衣芽孢杆菌(B. licheniformis)微生物菌剂与肥料配施促进了谷子植株的生长;Ahmadvand和Hajinia[11]田间试验接种印度梨形孢(Piriformospora indica)的菌丝体提高了谷子产量。放线菌尤其是链霉菌属在促进植物生长、减轻作物病害和增强植物抗逆性等方面发挥着重要的作用[12-14]。然而,目前关于放线菌对谷子促生作用的了解仍不足。
根际微生物与植物生长关系密切,被视为植物的第二基因组[15]。根际微生物可通过活化土壤养分、分解土壤有机质、产生代谢物质、调控植物的系统抗性、基因表达等途径影响植物的生长发育[16-17]。因此,根际微生物群落结构变化会影响植物的生长状况。外源放线菌对根际微生物群落的调控作用已被证实[17-19]。然而,尚无外源放线菌对谷子根际微生物的影响及其与谷子生长之间联系的报道。此外,由于外源微生物施入土壤后的效果存在因试验条件不同出现差异的现象,因此从不同试验规模和条件出发展开研究,能够更准确地反映外源微生物的实际作用效果。可培养微生物是土壤微生物中的一类特殊菌群,尽管在总微生物中所占比例较小,但由于都是由活体微生物组成,更能反映某一时间点土壤微生物群落与植物之间的关系。不少研究表明,土壤可培养微生物的数量及结构组成与植物的生长密切相关[18, 20-21]。因此,本研究通过培养箱盆栽、室外盆栽结合田间试验的方法,研究包衣施加2种多功能的放线菌剂微白黄链霉菌(Streptomyces albidoflavus,T4)和密旋链霉菌(Streptomyces pactum,Act12)对成熟期谷子根际三大类可培养微生物数量及结构组成的影响,及其与谷子生长之间的联系,旨在为谷子促生增产提供新的有效途径及有应用前景的放线菌株。
1 材料与方法 1.1 试验材料供试放线菌剂:微白黄链霉菌(Streptomyces albidoflavus,T4)和密旋链霉菌(Streptomyces pactum,Act12)均由西北农林科技大学微生物资源研究室分离筛选自青藏高原极端生境土壤中。2株供试放线菌对多种作物病原菌具有拮抗作用且对多种作物具有促生功能。供试放线菌以粉状孢子制剂(经固态发酵制得)的形式施加,其中放线菌的活孢子含量均为109 CFU/g。
供试谷子品种:本研究共设置培养箱盆栽试验、室外盆栽试验和田间试验3个不同条件下的试验。由于培养箱内空间有限,因此选择了超早熟谷子品种“小米”(由山西农业大学农学院农业生物工程研究所提供),室外盆栽试验选用的是山西主栽品种晋谷21,田间试验由于播种时间较晚,选用了适合夏季种植的品种晋谷29。
1.2 试验设计各试验分别设置无菌剂接种的对照(CK)、T4菌剂包衣和Act12菌剂包衣共3个处理。菌剂包衣方法:将已知粒数的谷子种子用6.0 g/L的羧甲基纤维钠溶液浸湿后放入T4或Act12菌剂中至种子表面均匀沾附菌剂后将种子取出,播种。通过称量放入种子前后菌剂质量变化,计算得出种子平均沾附的活孢子数为107 CFU/粒。
培养箱小盆栽试验:取田间耕层土壤,过2 mm筛后加入100 g/kg的有机质和3.0 g/kg的复合肥(N︰P2O5︰K2O = 15︰15︰15),混匀后装入直径11.0 cm、高10.0 cm的小花盆,每盆装土0.5 kg。播种谷子种子(7粒/盆)后将各花盆放置于光照培养箱中培养。设置培养条件为:白天和夜间时间分别为16 h和8 h;温度分别为25 ℃和22 ℃;白天光照强度为30 000 lx,夜间光照为0 lx。播后正常管理,按需浇水。各处理10盆重复。
室外大盆栽试验:取田间耕层土壤,过2 mm筛后加入3.0 g/kg的复合肥(N︰P2O5︰K2O = 15︰15︰15),混匀后装入直径21.0 cm、高20.0 cm的大花盆,每盆装土5.0 kg。播种包衣后谷子种子(14粒/盆)后将各花盆放置于山西农业大学农作站(37°25′21″ N,112°34′45″ E)内培养,正常管理,按需浇水。各处理7盆重复。
田间小区试验:试验于2020年6月20日至10月10日于山西农业大学农作站内进行。各处理设置3个2 m × 4 m的小区重复,各小区完全随机排列。播前充分灌水后按1 000 kg/hm2基施复合肥(N︰P2O5︰K2O = 18︰18︰18),旋耕后按行距40 cm、播量11.3 kg/hm2播种谷子,待出苗后按株距10 ~ 15 cm定苗,播种密度约25 000株/hm2,之后正常管理。
1.3 测定指标生长指标:于各试验谷子的成熟期(培养箱小盆栽、室外大盆栽和田间试验分别为播种后80、130和110 d),采集谷子根系和茎叶样品,测定根系干物质量、茎叶干物质量、单株籽粒干物质量和千粒重。田间试验中,各小区随机选取5株,测定其根系干物质量、茎叶干物质量和单株籽粒干物质量。同时各小区随机选取2行,分别收获籽粒,进行产量计算。
根际微生物:用抖土法采集根际土壤,即取出各盆谷子完整根系后,先将与根际结合不紧密的土壤抖掉,再用软毛刷将根系表面约0.5 mm区域土壤转移至自封袋中,这部分土壤被视为根际土。培养箱小盆栽和室外大盆栽试验中,分别随机选取其中的9盆和6盆,将每3盆和2盆土壤混匀后作为1个测定重复。田间试验中,将各小区随机选取的5株谷子的根际土壤混匀,作为一个测定重复。采用稀释涂布平板法[22]对根际土壤中细菌(B)、真菌(F)和放线菌(A)三大类可培养微生物进行分离计数,并计算微生物总数(细菌、真菌和放线菌的数量之和)及各类微生物的数量比值(B/F、A/F和A/B)。
1.4 数据分析采用Excel 2016对数据进行处理,SPSS 18.0软件进行方差分析;采用LSD方法在P < 0.05或P < 0.01水平进行统计检验,计算微生物与谷子生长指标之间的Pearson相关系数;采用Origin 2021软件进行作图。
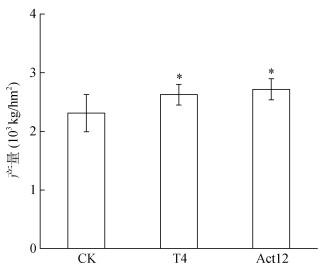
2 结果与分析 2.1 外源放线菌对成熟期谷子生物量和产量的影响在培养箱盆栽和室外盆栽试验中,与对照相比,T4处理使成熟期谷子根系干物质量分别显著增加了41.3% 和15.3%,茎叶干物质量分别显著增加了112.6% 和37.1%(P < 0.05),而Act12处理使室外盆栽中谷子根系干物质量有所降低(图 1A、1B)。此外,在培养箱盆栽试验中,T4还使单株谷子籽粒干物质量比对照提高了133.8%(P < 0.05);田间小区试验中,施加T4和Act12的处理中,单株谷子籽粒干物质量分别为17.3 g和17.0 g,与对照相比分别增加了22.6% 和20.7%(P < 0.05,图 1C)。培养箱盆栽试验中,T4菌剂处理使谷子千粒重增加了10.4%,而在室外盆栽和田间试验中,施加两种放线菌剂对谷子千粒重均无显著影响(图 1D)。田间小区试验中,种子包衣施加T4和Act12菌剂后,谷子产量分别提高了13.7% 和17.7%,且与无菌剂对照之间差异显著(P < 0.05,图 2)。

|
(图中* 表示与对照相比差异显著(P < 0.05),下图同) 图 1 放线菌对成熟期谷子生物量及籽粒干物质量的影响 Fig. 1 Effects of tested actinobacteria on millet biomass and grain dry weight at mature stage |
|
图 2 放线菌对田间试验成熟期谷子产量的影响 Fig. 2 Effects of tested actinobacteria on millet yield at mature stage |
在培养箱盆栽试验中,T4处理使成熟期根际可培养细菌与对照相比显著增加了56.9%(P < 0.05);在室外盆栽和田间试验中,外源施加T4和Act12菌剂对根际可培养细菌数量影响均不显著(图 3A)。对于成熟期根际可培养真菌,T4处理使培养箱盆栽和室外盆栽中其数量与对照相比显著增加了35.5% 和73.3%(P < 0.05),也使田间试验中其数量增加了21.8%;Act12菌剂使室外盆栽中可培养真菌数量显著增加了2.22倍,但使田间试验中可培养真菌数量减少了22.7%(P < 0.05,图 3B)。对于成熟期可培养放线菌数量和微生物总数,培养箱盆栽试验中,施加T4菌剂,与无菌剂对照相比分别显著增加了29.5% 和44.1% (P < 0.05);而在室外盆栽和田间试验中,包衣施加2种供试菌剂对成熟期谷子根际可培养放线菌数量和微生物总数影响均不显著(图 3C、3D)。

|
图 3 放线菌对成熟期谷子根际可培养微生物数量的影响 Fig. 3 Effects of tested actinobacteria on population of culturable microorganisms in rhizosphere soils at millet mature stage |
对于A/B,在室外盆栽试验中,T4处理使其增加了15.7%,而Act12处理使其降低了17.2%,且与对照间差异均显著(P < 0.05);施加2种菌剂对培养箱试验和田间试验中成熟期根际土壤中A/B影响均不大(图 4A)。对于A/F,T4和Act12菌剂使室外盆栽谷子根际土壤中其数值与对照相比分别降低了34.7% 和72.4%(P < 0.05,图 4B)。与A/F结果相似,T4和Act12菌剂处理使室外盆栽试验中成熟期谷子根际土壤中B/F与对照相比分别减少了43.9% 和67.1%(P < 0.05,图 4C)。

|
(A/B、A/F、B/F分别表示放线菌与细菌、放线菌与真菌及细菌与真菌的数量之比) 图 4 放线菌对成熟期谷子根际微生物数量比例的影响 Fig. 4 Effects of tested actinobacteria on population ratios of microorganisms in rhizosphere soils at millet mature stage |
相关分析结果(图 5)显示,成熟期根际细菌数量与真菌和放线菌数量均呈极显著正相关关系,相关系数分别为0.871和0.971(P < 0.01)。成熟期茎叶干物质量和单株籽粒干物质量与根际细菌、真菌、放线菌和微生物总数及A/B正相关,相关系数r= 0.748 ~ 0.971(P < 0.01);而与B/F呈负相关关系(r= 0.764 ~ 0.948,P < 0.01)。根系干物质量与A/F和B/F呈正相关关系(r= 0.638和0.791,P < 0.01),千粒重与细菌、放线菌、微生物总数及A/B均呈负相关关系(r= –0.419 ~ –0.441,P < 0.05)。

|
(B、F、A、TM分别表示可培养细菌、真菌、放线菌、微生物总数,A/B、A/F、B/F分别表示放线菌与细菌、放线菌与真菌、细菌与真菌的数量比值,RDW、SFDW、SDW、TSW表示根系干物质量、茎叶干物质量、单株籽粒干物质量和千粒重。*、**分别表示在P < 0.05和P < 0.01水平相关性显著) 图 5 放线菌作用下谷子生长指标与根际微生物之间的相关性 Fig. 5 Correlation between millet growth indexes and microorganisms in rhizosphere soil。 |
外源施加有益微生物能够促进植物生长,增加作物产量。张笛等[9]试验结果表明,用枯草芽孢杆菌(B. subtilis)种子包衣促进了谷子种子的萌发;Pal和Sonali[23]的研究表明,接种丛枝菌根真菌(Glomus mosseae, G. fasciculatum, G. decipiens)能够促进谷子的生长,并改变谷子植株的生物化学和组织化学结构;Ahmadvand和Hajinia[11]通过田间试验发现接种印度梨形孢(P. indica)的菌丝体促进了谷子生长,并增加了谷子产量。本研究结果表明,种子包衣施加供试放线菌剂T4和Act12均促进了谷子地上部和根系生物量的累积,同时提高了谷子的产量。表明T4和Act12均具有促进谷子生长、增加谷子产量的能力,证实了放线菌作为谷子促生微生物的可能性。值得注意的是,在田间试验中,添加放线菌增加了谷子单株籽粒干物质量和产量,但对千粒重无显著影响(图 1和2),表明供试放线菌是通过增加单株籽粒数,而不是增加单粒种子质量来使谷子增产。
根际微生物在维持土壤环境健康、调控植物生长等方面发挥重要作用。外源施加多种有益微生物能够调整植物根际微生物群落结构[24-26]。外源有益微生物通过优化作物根际微生物群落结构进而促进作物生长、增强植物抗病和抗逆性的功能也已被证实[17-18, 27]。然而,外源微生物对谷子根际微生物影响的报道仍较少。与高通量测序手段中对土壤中所有微生物进行分析不同,从土壤中分离出的微生物均为活体微生物,是土壤微生物中的一个特殊群体,直接参与土壤环境调节及根系生长的调控作用。因此,尽管高通量测序手段已经被广泛应用,不少学者仍致力于土壤可培养微生物与植物生长互作关系的研究。细菌、真菌和放线菌是可培养微生物中最主要的三大类群,其数量及比例能够反映可培养微生物群体的状况。不少研究表明,通过调节上述三大类微生物的数量和比例能够影响植物的生长和抗胁迫能力[18, 21, 28]。本研究发现外源添加放线菌剂T4和Act12均增加了成熟期谷子根际可培养微生物的数量,调整了细菌、真菌和放线菌三大类微生物的数量比例,同时促进了谷子生长,增加了谷子产量。相关分析结果表明,三大类微生物数量和比例与谷子生物量和产量显著相关(图 5)。表明通过刺激根际微生物的生长、优化根际可培养微生物结构,使土壤微生物环境维持在有利于谷子生长的健康状态是供试放线菌使谷子促生增产的重要机制。此外,放线菌施加于土壤中,还可能通过产生抗生素类物质,抑制病原菌等有害微生物的生长繁殖或促进有益微生物数量的增长来使土壤微生物环境维持健康状态。本试验所用2株放线菌均为对多种作物病原菌有拮抗作用的生防放线菌[29-30],因此,T4或Act12进入土壤后也可能通过减少土壤中有害微生物的数量、增加有益微生物的数量来影响谷子生长。
本研究中,尽管在不同试验条件下成熟期根际三大类可培养微生物的数量和比值存在差异,但供试菌剂对微生物群落的调整作用总体来看趋势一致。本试验设置了光照培养箱小盆栽试验、室外大盆栽试验及田间小区试验3个不同规模的试验来研究T4和Act12菌剂包衣处理对谷子成熟期根际微生物的影响。同一种作物不同品种之间根际微生物会存在差异,且土壤微生物也会受土壤环境和外界气候条件等多种因素的影响。本研究对不同试验规模及不同试验品种的数据进行分析,得出了基本一致的试验结果,更能说明供试菌剂具有调整谷子根际微生物的能力,并能够通过这种调控作用间接影响谷子植株的生长。
此外,根际微生物与植物的互作是一个动态变化的过程。本研究选择了成熟期这一关键生育时期来探究外源放线菌作用下根际微生物与谷子生长之间的关系,获得了一定有意义的结果。在今后的研究中,应从时间序列出发,研究外源放线菌干扰下根际微生物的动态变化规律及其作用方式,进而更深入地揭示外源放线菌对谷子生长的调控机理。
4 结论包衣施加T4和Act12菌剂均能够促进谷子植株生长,增加谷子产量;外源放线菌通过优化谷子根际可培养微生物群落结构,即增加细菌、真菌、放线菌三大类可培养微生物总数,降低放线菌/真菌和细菌/真菌比值,从而间接影响谷子生长,使谷子增产;调控根际可培养微生物群落结构是促进作物增产的有效途径之一。
| [1] |
刘俊英, 谢国莉, 危晴, 等. 小米中脂肪酸的GC-MS法测定及营养价值分析[J]. 食品研究与开发, 2012, 33(2): 165-168 DOI:10.3969/j.issn.1005-6521.2012.02.049 (  0) 0) |
| [2] |
张超, 张晖, 李冀新. 小米的营养以及应用研究进展[J]. 中国粮油学报, 2007, 22(1): 51–55, 78 DOI:10.3321/j.issn:1003-0174.2007.01.014 (  0) 0) |
| [3] |
刘玉涛, 杨斌, 张凯, 等. 链霉菌剂种子包衣对小麦幼穗分化及生物学特性的影响[J]. 麦类作物学报, 2020, 40(8): 990-1001 (  0) 0) |
| [4] |
高雁, 张永强, 张志东, 等. 功能性微生物菌剂对小麦生长和根际土壤生态的影响[J]. 新疆农业科学, 2021, 58(1): 115-124 (  0) 0) |
| [5] |
Gopalakrishnan S, Srinivas V, Vidya M S, et al. Plant growth-promoting activities of Streptomyces spp. in sorghum and rice[J]. SpringerPlus, 2013, 2: 574 DOI:10.1186/2193-1801-2-574 (  0) 0) |
| [6] |
方成, 岳明灿, 王东升, 等. 化肥减施配施微生物菌剂对鲜食玉米生长和土壤肥力的影响[J]. 土壤, 2020, 52(4): 743-749 (  0) 0) |
| [7] |
肖让, 张永玲, 赵芸晨, 等. 不同抗旱措施配施菌肥对河西绿洲土壤改良和制种玉米产量的影响[J]. 水土保持学报, 2021, 35(3): 341-349 (  0) 0) |
| [8] |
方瑞琳, 王帝, 王雨婷, 等. 不同微生物菌剂对谷子主要农艺性状及产量的影响[J]. 黑龙江八一农垦大学学报, 2021, 33(2): 1–6, 39 DOI:10.3969/j.issn.1002-2090.2021.02.001 (  0) 0) |
| [9] |
张笛, 辛秋宇, 苗兴芬. 微生物种衣剂拌种及水引发对谷子种子萌发的影响[J]. 黑龙江八一农垦大学学报, 2019, 31(5): 15–21, 72 DOI:10.3969/j.issn.1002-2090.2019.05.003 (  0) 0) |
| [10] |
杨永青, 高芳芳, 马亚君, 等. 山西省旱作农业区不同施肥处理对谷子产量、品质及经济效益的影响[J]. 作物杂志, 2020(4): 195-201 (  0) 0) |
| [11] |
Ahmadvand G, Hajinia S. Effect of endophytic fungus Piriformospora indica on yield and some physiological traits of millet (Panicum miliaceum) under water stress[J]. Crop and Pasture Science, 2018, 69(6): 594 DOI:10.1071/CP17364 (  0) 0) |
| [12] |
Palazzini J, Roncallo P, Cantoro R, et al. Biocontrol of Fusarium graminearum sensu stricto, reduction of deoxynivalenol accumulation and phytohormone induction by two selected antagonists[J]. Toxins, 2018, 10(2): 88 DOI:10.3390/toxins10020088 (  0) 0) |
| [13] |
Vurukonda S S K P, Giovanardi D, Stefani E. Plant growth promoting and biocontrol activity of Streptomyces spp. as endophytes[J]. International Journal of Molecular Sciences, 2018, 19(4): 952 (  0) 0) |
| [14] |
Li Y L, Guo Q, He F, et al. Biocontrol of root diseases and growth promotion of the tuberous plant Aconitum carmichaelii induced by actinomycetes are related to shifts in the rhizosphere microbiota[J]. Microbial Ecology, 2020, 79(1): 134-147 (  0) 0) |
| [15] |
Berendsen R L, Pieterse C M J, Bakker P A H M. The rhizosphere microbiome and plant health[J]. Trends in Plant Science, 2012, 17(8): 478-486 (  0) 0) |
| [16] |
Li H Y, Guo Q, Jing Y X, et al. Application of Streptomyces pactum Act12 enhances drought resistance in wheat[J]. Journal of Plant Growth Regulation, 2020, 39(1): 122-132 (  0) 0) |
| [17] |
Li Y L, Guo Q, Li Y Z, et al. Streptomyces pactum Act12 controls tomato yellow leaf curl virus disease and alters rhizosphere microbial communities[J]. Biology and Fertility of Soils, 2019, 55(2): 149-169 (  0) 0) |
| [18] |
Ma Y Y, Li Y L, Lai H X, et al. Effects of two strains of Streptomyces on root-zone microbes and Nematodes for biocontrol of root-knot nematode disease in tomato[J]. Applied Soil Ecology, 2017, 112: 34-41 (  0) 0) |
| [19] |
李堆淑, 何念武, 冀玉良. 干旱胁迫下灰色链霉菌对桔梗幼苗根际土壤酶活性、养分及微生物的影响[J]. 干旱地区农业研究, 2017, 35(6): 173-180 (  0) 0) |
| [20] |
魏蔚, 吴昊, 宋时丽, 等. 复合菌剂对小麦秸秆降解速率、土壤酶和土壤微生物类群的影响[J]. 土壤, 2019, 51(5): 955-963 (  0) 0) |
| [21] |
Chen J, Xue Q H, Ma Y Q, et al. Streptomyces pactum may control Phelipanche aegyptiaca in tomato[J]. Applied Soil Ecology, 2020, 146: 103369 (  0) 0) |
| [22] |
程丽娟, 薛泉宏. 微生物学实验技术第2版[M].
科学出版社, 北京, 2012
(  0) 0) |
| [23] |
Pal A, Sonali-Pandey. A study on pearl millet (Pennisetum glaucum L.) plant Biochemical and histochemical changes inoculated with indigenous AM fungi under Barren soil[J]. Journal of Plant Biotechnology, 2017, 44(2): 203-206 (  0) 0) |
| [24] |
宋以玲, 于建, 陈士更, 等. 复合微生物菌剂对棉花生理特性及根际土壤微生物和化学性质的影响[J]. 土壤, 2019, 51(3): 477-487 (  0) 0) |
| [25] |
罗佳煜, 宋瑞清, 邓勋, 等. PGPR与外生菌根菌互作对樟子松促生作用及根际微生态环境的影响[J]. 中南林业科技大学学报, 2021, 41(9): 22-34 (  0) 0) |
| [26] |
姚有华, 王玉林, 姚晓华, 等. 促生菌接种对青稞根际土壤微生物群落结构的影响[J]. 西南农业学报, 2021, 34(6): 1277-1285 (  0) 0) |
| [27] |
胡振兴, 刘灵, 陈丽萍, 等. 干旱胁迫下丛枝菌根对大豆抗氧化代谢及根围微生物的影响[J]. 中国生态农业学报, 2018, 26(4): 526-537 (  0) 0) |
| [28] |
隋宗明, 殷洁, 李轩, 等. 紫茎泽兰堆肥的质量及对土壤有机质、养分和微生物的影响[J]. 土壤, 2017, 49(3): 527-533 (  0) 0) |
| [29] |
赵娟, 薛泉宏, 王玲娜, 等. 多功能放线菌Act12对土传病原真菌的拮抗性及其鉴定[J]. 中国生态农业学报, 2011, 19(2): 394-398 (  0) 0) |
| [30] |
陈杰, 汤琳, 郭天文, 等. 马铃薯土传病原真菌拮抗放线菌的抗病促生作用[J]. 西北农林科技大学学报(自然科学版), 2014, 42(1): 111-119 (  0) 0) |
2. Ministerial and Provincial Co-Innovation Centre for Endemic Crops Production with High-quality and Efficiency in Loess Plateau, Taigu, Shanxi 030801, China;
3. Shaanxi Boqin Biological Engineering limited Company, Xianyang, Shaanxi 713899, China
 2022, Vol. 54
2022, Vol. 54


