2. 中国科学院南京土壤研究所, 南京 210008;
3. 中国科学院沈阳应用生态研究所, 沈阳 110016
氧化亚氮(N2O)作为主要温室气体之一[1],其在百年尺度上的增温潜势为CO2的265倍[2]。农田土壤是N2O重要的排放源[3],农业系统的N2O排放量占陆地生态系统总N2O排放量的65%[4]。黑土作为“耕地中的大熊猫”,其在保障区域生态环境安全、国家粮食安全和农业可持续发展中发挥着重要作用。然而,农业生产中为了追求作物高产而长期过量施用氮肥,进而引发了一系列环境问题,如温室气体N2O大量排放等。在全球碳中和的背景下,实现温室气体减排对生态环境保护和农业可持续发展具有重要意义。
水分是调控土壤N2O排放的重要因子。土壤水分通过影响土壤透气性和微生物活性,进而影响土壤N2O产排[5]。前期的研究表明,土壤水分含量的增加显著刺激了酸性土壤N2O的排放[6]。Szukics等[7]也发现,反硝化细菌受土壤水分影响显著,在湿润的土壤环境中反硝化细菌响应剧烈,其丰度快速上升。反硝化微生物同时受土壤碳底物调控,而生物质炭作为典型的高碳氮比有机物料,可以为微生物提供充足的碳底物,促进微生物对土壤氮的固定,从而直接或间接地影响硝化反硝化作用和土壤N2O产排。例如,Taghizadeh-Toosi等[8]将生物质炭(30 t/hm2)施入牧场中,土壤N2O排放量减少了近70%。生物质炭具有多孔、强阳离子交换能力、高化学稳定性等特点[9],施用高孔隙度、高比表面积的生物质炭,可以吸附土壤无机氮(NH4+和NO3–),从而影响土壤N2O产排过程[10-11]。然而,目前生物质炭对土壤N2O产排的影响尚未得到一致性结论,生物质炭添加表现出促进[12-13]、抑制[14]或不显著[15]作用,这种差异可能是水分、碳底物等环境因子与微生物共同作用的结果。例如,向原位棕壤撒施玉米秸秆生物质炭显著降低了土壤N2O排放[16],但是水分因素并未被考虑。向菜地施加生物质炭显著提高了amoA-AOB基因丰度[17],但是其对N2O产排的影响效应并不清楚。因此,迫切需要开展不同水分状况下生物质炭对黑土N2O产排的影响效应研究。
生物质炭对土壤N2O排放影响研究大多为单独添加生物质炭或者单独研究不同水分调控,很少涉及不同水分状况下生物质炭对N2O排放影响的综合效应。本文以东北黑土为研究对象,通过设置不同类型和不同量生物质炭添加,并调控两种土壤水分含量(40%和100% 田间持水量(WHC)),采用室内培养和实时荧光定量PCR(real-time quantitative PCR,qPCR)技术,研究黑土N2O排放及相关功能基因丰度的变化,探讨不同水分模式下生物质炭对黑土N2O产排及相关功能基因丰度的影响效应。
1 材料与方法 1.1 供试土壤和生物质炭供试土壤采自吉林省四平市梨树县高家村中国科学院沈阳应用生态研究所保护性耕作研发基地(43°18′ N,124°19′ E)。该地属北温带半湿润大陆季风性气候,四季分明,雨热同季,作物生长期日照、降水较充足,年平均气温6.9 ℃,年平均降雨量614 mm,年均日照时数2 644.2 h,其中作物生长季节4—9月日照时数1 435.5 h,占全年日照总时数59%,无霜期150 d左右。试验土壤采自深度为0 ~ 20 cm的耕层土壤,置于阴凉干燥通风的环境下风干至土壤基本保持恒重,取出一部分土样过2 mm筛后用于试验。该土样基本理化性质如下:pH 7.37、有机质14.3 g/kg、全氮1.42 g/kg、全磷0.64 g/kg和容重1.35 g/cm3。试验所用生物质炭分别以玉米秸秆、稻壳为原料,经机械研磨后过1 mm筛,并于500 ℃管式炉高温热解制得,生物质炭所含基本元素占比见表 1。
|
|
表 1 生物质炭基本元素含量占比(%) Table 1 Proportion of basic elements in biochars |
试验设置5个处理,包括:①未施生物质炭+100%WHC(W2);②1%(m/m)玉米秸秆生物质炭+100%WHC(1%MB+W2);③4%(m/m)玉米秸秆生物质炭+100%WHC(4%MB+W2);④4%(m/m)稻壳生物质炭+100%WHC(4%RB+W2);⑤4%(m/m)玉米秸秆生物质炭+40%WHC(4%MB+W1)。其中,生物质炭的添加比例表示培养瓶中生物质炭质量与土壤和生物质炭混合后总质量(25 g)之比。例如,1% 和4% 生物质炭添加量分别为10.10 mg/g和41.67 mg/g。将生物质炭和土壤按照设定比例添加到120 ml已灭菌的玻璃血清瓶中,添加碳酸氢铵和硝酸钾混合溶液使土壤中NH4+-N、NO3–-N初始含量为50 mg/kg(干土),并调节含水量至设定值。用瓶塞、铝箔外加封口膜压实密封,防止瓶内气体扩散,并于25℃恒温箱中培养4周,每周进行破坏性取样。取样后,一部分土壤样品用2 mol/L KCl浸提,立即测定NH4+-N和NO3–-N含量,另一部分样品保存于–80 ℃冰箱,用于DNA提取。培养过程中动态测定N2O排放,表征土壤硝化和反硝化活性,气体采集测定时间为培养开始后1、2、3、5、8、10、13、15、17、19和22 d。取一支针筒注射器,采气前抽吸空气3次,然后插入瓶内,上下抽吸3次混匀培养瓶内气体,再抽取5 ml气体缓缓注入气相色谱进样口(进样口安装带橡胶垫封口的螺丝帽)。在培养期间每天固定时间打开培养瓶换气30 min刷新气体条件,并每隔2 d用称重法及时补充去离子水,以保持土壤含水量恒定。
1.3 土壤理化和生物指标测定土壤含水量的测定采用烘干法,田间持水量(WHC)的测定采用环刀法[18],NH4+-N含量测定采用KCl浸提–纳氏试剂分光光度法,NO3–-N含量测定采用KCl浸提–紫外分光光度法;采用安捷伦气相色谱仪(Agilent 7890A)测定N2O样品浓度,电子捕获检测器(ECD)温度为300 ℃,柱箱温度60 ℃,载气为高纯氮气[19],流速为25 ml/min。利用实时荧光定量PCR技术依次检测amoA-AOA、amoA-AOB、nirS和nosZ基因拷贝数,之后用SYBR Premix Ex TaqTM试剂盒,在CFX Connect Real-time PCR Detection System上进行定量PCR的分析,PCR扩增的引物和反应条件如表 2所示。标准曲线采用含有目标基因的克隆进行制备,将含有目标基因的克隆在液体培养基中过夜培养,使用Mini BEST Plas mid Purification Kit(Takara)试剂盒提取质粒并纯化,通过测定DNA浓度结合其分子质量计算得出原始基因拷贝数,将质粒连续稀释8 ~ 10个数量级,得到相应目标基因的标准曲线[20]。
|
|
表 2 荧光实时定量PCR扩增的引物和反应条件 Table 2 Amplification primers and reaction conditions of quantitative PCR |
N2O排放通量(F)按下式计算:
| $ F = \rho\times \frac{V}{m} \times \frac{{\Delta c}}{{\Delta t}} \times \frac{{273}}{{273 + T}} $ | (1) |
式中:F为N2O排放通量(μg/(kg·h));ρ为标准状态下N2O的密度,为1.25 kg/m3;V为培养瓶中气体的有效空间(m3);m为培养瓶内烘干土的质量(kg);∆c/∆t为在一特定时间内N2O浓度变化速率;T为测定气体时的温度(℃)。
N2O累积排放量(M)按下式计算:
| $ M=Σ(F_{i+1}+F_{i})/2×(t_{i+1}-t_{i})×24 $ | (2) |
式中:M为N2O累积排放量(μg/kg);F为气体排放通量(μg/(kg·h));i为采样次数,t为采样时间(d)。
文中试验数据均为3个重复的平均值以及标准偏差。数据处理分析采用Microsoft Excel 2019和SPSS 21软件进行,利用Origin 2019b软件作图。
2 结果与分析 2.1 土壤N2O排放的动态变化特征土壤水分增加在一定程度上促进了土壤N2O的排放。然而随着秸秆生物质炭添加量的增加,土壤N2O排放量呈现下降趋势,但不同类型生物质炭添加展现出不同的N2O排放特征。培养期内,4%MB+W1处理的N2O排放通量与累积排放量均显著低于其他4种处理(P < 0.01),其N2O累积排放量仅为4%MB+ W2处理的1.2%(图 1B)。与W2处理相比,4%RB+W2处理的N2O排放通量较低并呈现下降趋势(图 1A),且其N2O累积排放量显著降低,达到68.1%。1%MB+W2和4%MB+W2处理均在培养2 d时出现N2O排放峰并明显高于W2处理,分别为2 354.5和827.7 μg/(kg·h),之后迅速降低。这两组处理的N2O累积排放量也均高于W2处理,但4%MB+W2处理N2O累积排放量显著低于1%MB+W2处理(P < 0.05)。在培养5 d以后,各处理N2O排放通量均维持在极低水平(< 5 μg/(kg·h))。方差分析进一步表明,土壤含水量、生物质炭种类、施加量及其交互作用均显著影响N2O排放通量与累积排放量(P < 0.01)。
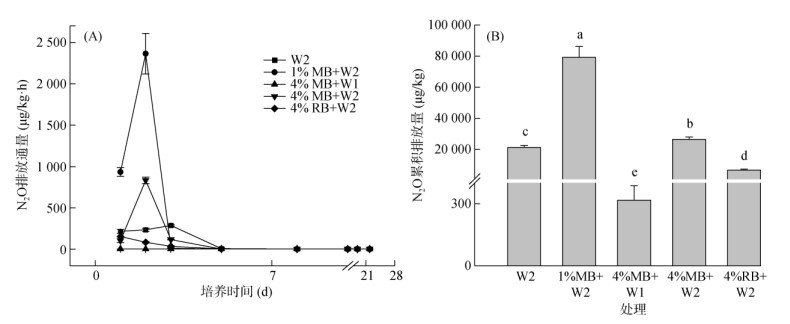
|
(柱图上方不同小写字母表示处理间差异显著(P < 0.05)) 图 1 不同处理N2O排放通量的动态变化及累积排放量 Fig. 1 Dynamics of N2O fluxes and cumulative N2O emissions during 22 d incubation |
高水分状况下(100%WHC)土壤NO3–-N含量较低,且添加秸秆生物质炭处理NO3–-N含量在开始培养一周内迅速下降至极低水平(< 15 mg/kg)。本试验中,土壤NO3–-N含量在培养第1周显著下降(P < 0.05),培养前期土壤反硝化作用强烈(图 2A)。与W2和4%MB+W2处理相比,4%RB+W2处理的土壤NO3–-N含量更高。4%MB+W1处理的土壤NO3–-N含量在培养一周后逐渐增加并明显高于4%MB+W2处理。添加玉米秸秆生物质炭增加了土壤NH4+-N含量,而添加稻壳生物质炭却一定程度上降低了土壤NH4+-N含量,除4%MB+W2处理外,不同处理土壤样品的NH4+-N含量在培养第1周内均呈现下降趋势(图 2B),且整个培养期间4%MB+W2与4%MB+W1处理土壤的NH4+-N含量均显著高于其他3种处理(P < 0.05),均在第2周达到峰值,分别为177.6 mg/kg和157.0 mg/kg。W2与4%RB+W2处理的NH4+-N含量在培养第1周内显著下降后呈现缓慢上升的趋势。方差分析也表明,不同处理、培养时间以及其交互作用均显著影响土壤NO3–-N、NH4+-N含量(图 2,P < 0.05)。
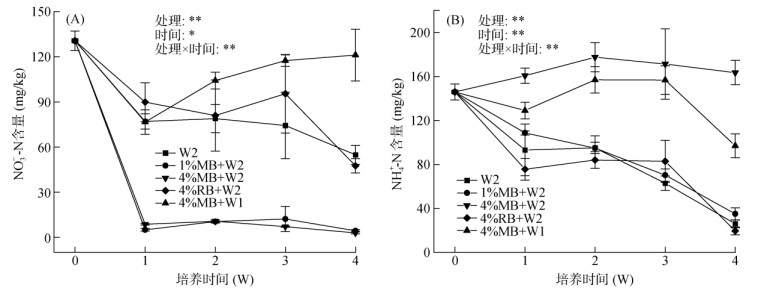
|
(*和**表示各因素在P < 0.05和P < 0.01水平上影响显著;下同) 图 2 不同处理土壤NH4+-N、NO3–-N含量变化趋势 Fig. 2 Dynamics of soil NH4+-N and NO3–-N contents during incubation of five different treatments |
硝化与反硝化功能基因的qPCR分析结果表明,土壤水分增加在一定程度上提高了nirS基因丰度,且随着秸秆生物质炭添加量的增加,土壤nirS基因丰度有所降低。培养期间各处理的土壤nirS基因丰度在第1周显著增加(P < 0.05),与N2O排放通量变化特征相似,除W2处理外,nirS丰度均达到对应峰值(图 3A)。4%MB+W2处理的nirS基因丰度显著高于4%MB+W1处理(P < 0.05)。与W2处理相比,1%MB+W2和4%MB+W2处理的土壤nirS基因丰度均有所增加,但后者nirS丰度增量较前者低。4%RB+W2处理的nirS基因丰度在培养初期大幅增加而后大幅下降,与土壤NO3–-N含量的变化特征一致。此外,研究结果表明,高水分状况下添加两种含量的秸秆生物质炭都在一定程度上降低了nosZ基因丰度;4%RB+W2与4%MB+W1处理的土壤nosZ基因丰度显著高于其他处理(P < 0.05,图 3B),表现出极强的N2O还原潜力,培养期间各处理土壤的nosZ基因丰度均呈先上升后下降的趋势。相关分析表明,nosZ基因丰度与NO3–-N含量呈显著负相关关系(r= –0.5,P < 0.05,表 3)。
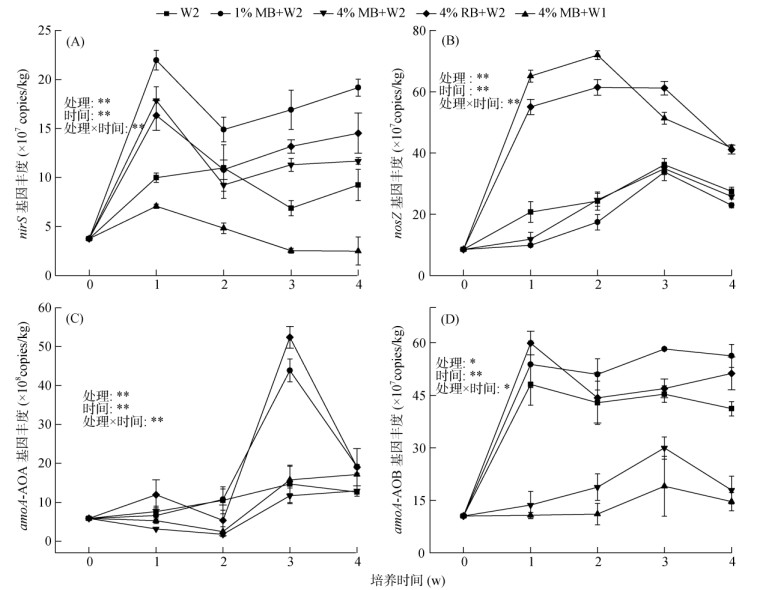
|
图 3 不同处理nirS、nosZ、amoA-AOA和amoA-AOB基因丰度变化趋势 Fig. 3 Dynamics of abundances of nirS, nosZ, amoA-AOA and amoA-AOB genes during incubation under five treatments based on qPCR analysis |
|
|
表 3 N2O排放通量与土壤无机氮含量、amoA-AOA、amoA-AOB、nirS以及nosZ功能基因丰度间的相关关系(r) Table 3 Correlation among N2O emission flux, soil NH4+-N and NO3–-N contents and amoA-AOA, amoA-AOB, nirS and nosZ functional gene abundances during incubation |
添加高量(4%)玉米秸秆生物质炭显著降低了AOB丰度。开始培养后,4%RB+W2、1%MB+W2和W2处理的土壤amoA-AOB功能基因丰度迅速上升,显著高于4%MB+W2和4%MB+W1处理(P < 0.05),与土壤NH4+-N含量变化规律吻合。相关分析表明,N2O排放通量与amoA-AOB基因丰度呈显著正相关关系(r = 0.48,P < 0.05,表 3)。除1%MB+W2处理外,4%RB+W2和W2处理的土壤amoA-AOB基因丰度均在第1周达到峰值,分别为59.9×107和48.1×107 copies/kg,之后呈缓慢降低趋势。土壤amoA-AOA功能基因丰度在第3周迅速上升,且4%RB+W2和1%MB+W2处理amoA-AOA丰度在第3周达到峰值并显著高于其他处理(P < 0.05),其amoA-AOA基因丰度分别为52.4×108和4.39×107 copies/kg(图 3C、3D)。方差分析进一步表明,不同处理、培养时间及其交互作用显著影响了nirS、nosZ、amoA-AOA、amoA-AOB功能基因丰度(P < 0.05)。
3 讨论 3.1 生物质炭和土壤水分对土壤N2O排放的影响硝化反硝化作用作为土壤N2O产生的主要途径[25],受水分、无机氮底物含量等多种因素影响。培养期间,4%MB+W1处理土壤N2O累积排放量显著低于其他处理(P < 0.05),NO3–-N含量在培养结束后达到峰值(图 2),说明硝化作用可能是该黑土N2O产排的主要来源。各处理土壤N2O排放通量的峰值均出现在培养前期,这是由于前期大量输入氮源和硝化反硝化作用底物,以及生物质炭的施加促使微生物活性显著增加[26],而随着反应底物的消耗及微生物活性的降低,使得N2O通量大幅下降,这与Shi等[27]研究结果一致。
生物质炭添加对土壤N2O具有一定的减排潜力[28]。本研究结果也发现,随着秸秆生物质炭添加量的增加,土壤N2O排放呈下降趋势。施加生物质炭为反硝化微生物提供了作用底物,促使微生物活性加强,从而促进N2O排放[29]。但是生物质炭本身呈碱性,随着生物质炭施加量的增大,土壤微区碱性可能有所增强,由于反硝化细菌最适宜的pH为7.0 ~ 7.5,进而不利于土壤反硝化反应的进行,最终降低了N2O排放。同时,施加高量生物质炭也会提高土壤C/N比,促使NH4+-N更多地被微生物同化固定从而弱化硝化作用产生的N2O[30-31]。不同原料类型生物质炭对土壤性质的影响也不相同,在100%WHC土壤水分状况下,玉米秸秆生物质炭显著增加了土壤N2O排放,而稻壳生物质炭则显著降低了土壤N2O排放。这种差异一方面由于4% 高量稻壳生物质炭添加极大地促进了nosZ基因丰度增加而表现出更强的N2O还原潜力,进而大量的N2O被还原为N2;另一方面也可能由于稻壳生物质炭具有高比表面积和多孔隙结构,其对土壤NO3–具有较强的吸附固定作用[32-33],从而减少了反硝化过程的作用底物,进而降低了土壤N2O排放。
3.2 不同水分模式下生物质炭对硝化反硝化功能基因丰度的影响硝化反硝化微生物作为土壤氮循环的主要驱动者,其相关功能基因丰度的变化与土壤N2O排放规律有密切联系[34]。本研究结果表明,不论是生物质炭施加量多少,还是生物质炭类型的不同,施加生物质炭处理土壤的nirS和nosZ功能基因丰度均在培养前期显著增加(P < 0.05,图 3),这是由于生物质炭中含有的溶解性有机碳刺激反硝化微生物。一方面生物质炭使nirS丰度增加促进了土壤反硝化进程产生N2O,另一方面由于厌氧所带来的强还原环境,进一步加速了N2O还原为N2释放到大气中,推动了土壤反硝化作用完全进行[35]。有研究表明,当土壤中溶解性有机碳的含量增加时,N2O排放随之增多,这可能是由于溶解性有机碳为反硝化菌的活动提供了物质条件[36]。本研究结果也发现,4%MB+W1处理nirS丰度显著低于4%MB+W2处理,主要是由于厌氧环境促进反硝化作用;而添加高量生物质炭处理nosZ丰度均高于添加低量处理,推测高量生物质炭添加极可能促进了更完全的反硝化作用。Cayuela等[37]研究了15种农业土壤后也指出,生物质炭作为反硝化微生物的电子受体实现“电子穿梭”,把电子转化到土壤反硝化微生物基团中,促进N2O还原为N2,降低N2O/(N2O+N2)的比例,进一步证明了此观点。4%RB+ W2处理土壤nosZ丰度在整个培养阶段显著高于4%MB+W2处理土壤,可能是由于稻壳生物质炭碳氮元素组分和内部结构更有利于N2O还原微生物的生长繁殖。
生物质炭添加可以通过影响NH4+-N、NO3–-N含量,进而影响硝化作用功能基因amoA-AOA、amoA-AOB[38]以及反硝化作用功能基因nirS、nosZ丰度(图 3)。在培养前期,5种处理土壤的amoA-AOA功能基因丰度均处于较低水平,表明添加生物质炭对amoA-AOA丰度有抑制作用,但在培养阶段后期,除W2处理amoA-AOA丰度在整个培养阶段稳定变化外,其他4种施加生物质炭的处理土壤amoA-AOA丰度均发生较大幅度增加,这是由于生物质炭的老化可以刺激土壤中氨氧化古菌和氨氧化细菌种群增长[39]。在培养初期,4%RB+W2、1%MB+W2和W2处理的土壤amoA-AOB丰度迅速增加,这种情况与amoA-AOA相反。相关分析进一步表明,N2O排放通量与amoA-AOB丰度呈正相关(r = 0.48,P < 0.05,表 3),说明AOB在该土壤硝化过程中可能起重要作用。培养过程中,4MB%+W2处理土壤硝化作用功能基因丰度与4%MB+W1处理总体变化趋势一致,说明土壤含水量对氨氧化作用,尤其是AOA的影响并不显著。而在相同土壤含水量条件下,添加少量(1%)生物质炭显著提高了amoA-AOA和amoA-AOB丰度,添加较高量(4%)生物质炭则相反,说明生物质炭用量对土壤硝化作用的影响更加敏感[40]。也有可能是因为生物质炭施加量的增大一定程度上提高了土壤系统碱性,与此同时,生物质炭带入的营养物质和致密的多孔结构为微生物创造良好栖息环境,进而对硝化过程产生影响。高水分状况下添加生物质炭处理nirS基因丰度显著提高,但随着生物质炭添加量的提高nirS丰度有所降低,添加高量稻壳生物质炭处理nosZ基因丰度显著提高,促进反硝化作用最后一步而减少N2O排放;秸秆生物质炭添加量对amoA-AOB基因丰度有显著影响。
4 小结高土壤水分显著促进了土壤N2O排放。然而随着秸秆生物质炭的增加,土壤N2O排放呈下降趋势,但不同类型生物质炭添加下黑土展现出不同的N2O排放特征。在100%WHC土壤水分状况下,玉米秸秆生物质炭显著增加了土壤N2O排放,而稻壳生物质炭则显著降低了土壤N2O排放。4% 高量稻壳生物质炭添加下nosZ基因丰度显著高于玉米秸秆生物质炭添加,表现出更强的N2O还原潜力。
| [1] |
Oertel C, Matschullat J, Zurba K, et al. Greenhouse gas emissions from soils—A review[J]. Geochemistry, 2016, 76(3): 327-352 DOI:10.1016/j.chemer.2016.04.002 (  0) 0) |
| [2] |
IPCC. 2021. Climate Change 2021: The physical science basis [M]. Cambridge, United Kingdom and New York, USA: Cambridge University Press.
(  0) 0) |
| [3] |
Trost B, Prochnow A, Baumecker M, et al. Effects of nitrogen fertilization and irrigation on N2O emissions from a sandy soil in Germany[J]. Archives of Agronomy and Soil Science, 2015, 61(5): 569-580 DOI:10.1080/03650340.2014.946912 (  0) 0) |
| [4] |
Garrido F, Hénault C, Gaillard H, et al. N2O and NO emissions by agricultural soils with low hydraulic potentials[J]. Soil Biology and Biochemistry, 2002, 34(5): 559-575 DOI:10.1016/S0038-0717(01)00172-9 (  0) 0) |
| [5] |
Oswald R, Behrendt T, Ermel M, et al. HONO emissions from soil bacteria as a major source of atmospheric reactive nitrogen[J]. Science, 2013, 341(6151): 1233-1235 DOI:10.1126/science.1242266 (  0) 0) |
| [6] |
王连峰, 蔡祖聪. 淹水与湿润水分前处理对旱地酸性土壤氧化亚氮和二氧化碳排放的影响[J]. 环境科学学报, 2011, 31(8): 1736-1744 DOI:10.13671/j.hjkxxb.2011.08.008 (  0) 0) |
| [7] |
Szukics U, Abell G C J, Hödl V, et al. Nitrifiers and denitrifiers respond rapidly to changed moisture and increasing temperature in a pristine forest soil[J]. FEMS Microbiology Ecology, 2010, 72(3): 395-406 DOI:10.1111/j.1574-6941.2010.00853.x (  0) 0) |
| [8] |
Taghizadeh-Toosi A, Clough T J, Sherlock R R, et al. Biochar adsorbed ammonia is bioavailable[J]. Plant and Soil, 2012, 350(1/2): 57-69 (  0) 0) |
| [9] |
潘逸凡, 杨敏, 董达, 等. 生物质炭对土壤氮素循环的影响及其机理研究进展[J]. 应用生态学报, 2013, 24(9): 2666-2673 DOI:10.13287/j.1001-9332.2013.0518 (  0) 0) |
| [10] |
Li Y F, Hu S D, Chen J H, et al. Effects of biochar application in forest ecosystems on soil properties and greenhouse gas emissions: A review[J]. Journal of Soils and Sediments, 2018, 18(2): 546-563 DOI:10.1007/s11368-017-1906-y (  0) 0) |
| [11] |
Bakken L R, Bergaust L, Liu B B, et al. Regulation of denitrification at the cellular level: A clue to the understanding of N2O emissions from soils[J]. Philosophical Transactions of the Royal Society B: Biological Sciences, 2012, 367(1593): 1226-1234 DOI:10.1098/rstb.2011.0321 (  0) 0) |
| [12] |
Lin Y X, Ding W X, Liu D Y, et al. Wheat straw-derived biochar amendment stimulated N2O emissions from rice paddy soils by regulating the AmoA genes of ammonia-oxidizing bacteria[J]. Soil Biology and Biochemistry, 2017, 113: 89-98 DOI:10.1016/j.soilbio.2017.06.001 (  0) 0) |
| [13] |
Saarnio S, Heimonen K, Kettunen R. Biochar addition indirectly affects N2O emissions via soil moisture and plant N uptake[J]. Soil Biology and Biochemistry, 2013, 58: 99-106 DOI:10.1016/j.soilbio.2012.10.035 (  0) 0) |
| [14] |
Li B, Bi Z C, Xiong Z Q. Dynamic responses of nitrous oxide emission and nitrogen use efficiency to nitrogen and biochar amendment in an intensified vegetable field in southeastern China[J]. GCB Bioenergy, 2017, 9(2): 400-413 DOI:10.1111/gcbb.12356 (  0) 0) |
| [15] |
Wang J, Chen Z, Xiong Z, et al. Effects of biochar amendment on greenhouse gas emissions, net ecosystem carbon budget and properties of an acidic soil under intensive vegetable production[J]. Soil Use and Management, 2015, 31(3): 375-383 DOI:10.1111/sum.12202 (  0) 0) |
| [16] |
程效义, 刘晓琳, 孟军, 等. 生物炭对棕壤NH3挥发、N2O排放及氮肥利用效率的影响[J]. 农业环境科学学报, 2016, 35(4): 801-807 (  0) 0) |
| [17] |
王先芳, 任天志, 智燕彩, 等. 添加生物炭改善菜地土壤氨氧化细菌群落并提高净硝化率[J]. 植物营养与肥料学报, 2020, 26(3): 502-510 (  0) 0) |
| [18] |
鲍士旦. 土壤农化分析(3版)[M].
中国农业出版社, 北京, 2000
(  0) 0) |
| [19] |
Wang L F, Cai Z C, Yan H. Nitrous oxide emission and reduction in a laboratory-incubated paddy soil response to pretreatment of water regime[J]. Journal of Environmental Sciences (China), 2004, 16(3): 353-357 (  0) 0) |
| [20] |
郭赟, 吴宇澄, 林先贵, 等. 3次连续重复提取DNA能较好反映土壤微生物丰度[J]. 微生物学报, 2012, 52(7): 894-901 (  0) 0) |
| [21] |
Francis C A, Roberts K J, Beman J M, et al. Ubiquity and diversity of ammonia-oxidizing Archaea in water columns and sediments of the ocean[J]. Proceedings of the National Academy of Sciences of the United States of America, 2005, 102(41): 14683-14688 DOI:10.1073/pnas.0506625102 (  0) 0) |
| [22] |
Rotthauwe J H, Witzel K P, Liesack W. The ammonia monooxygenase structural gene AmoA as a functional marker: Molecular fine-scale analysis of natural ammonia-oxidizing populations[J]. Applied and Environmental Microbiology, 1997, 63(12): 4704-4712 DOI:10.1128/aem.63.12.4704-4712.1997 (  0) 0) |
| [23] |
Kloos K, Mergel A, Rösch C, et al. Denitrification within the genus Azospirillum and other associative bacteria[J]. Functional Plant Biology, 2001, 28(9): 991 DOI:10.1071/PP01071 (  0) 0) |
| [24] |
Guo G X, Deng H, Qiao M, et al. Effect of Pyrene on denitrification activity and abundance and composition of denitrifying community in an agricultural soil[J]. Environmental Pollution, 2011, 159(7): 1886-1895 DOI:10.1016/j.envpol.2011.03.035 (  0) 0) |
| [25] |
Song X T, Ju X T, Topp C F E, et al. Oxygen regulates nitrous oxide production directly in agricultural soils[J]. Environmental Science & Technology, 2019, 53(21): 12539-12547 (  0) 0) |
| [26] |
章骁劼. 生物炭、水分和氮源对农田土壤N2O排放和相关微生物的影响[D]. 杭州: 浙江大学, 2017.
(  0) 0) |
| [27] |
Shi Y L, Liu X R, Zhang Q W. Effects of combined biochar and organic fertilizer on nitrous oxide fluxes and the related nitrifier and denitrifier communities in a saline-alkali soil[J]. Science of the Total Environment, 2019, 686: 199-211 DOI:10.1016/j.scitotenv.2019.05.394 (  0) 0) |
| [28] |
赵光昕, 刘杏认, 张晴雯, 等. 施用生物炭对农田土壤N2O的减排效应[J]. 农业环境科学学报, 2018, 37(12): 2872-2880 DOI:10.11654/jaes.2018-0699 (  0) 0) |
| [29] |
Ambus P, Skiba U, Butterbach-Bahl K, et al. Reactive nitrogen and greenhouse gas flux interactions in terrestrial ecosystems[J]. Plant and Soil, 2011, 343(1/2): 1-3 (  0) 0) |
| [30] |
冯政君. 不同环境条件下生物炭对土壤N2O排放的影响及机制[D]. 杭州: 浙江大学, 2017.
(  0) 0) |
| [31] |
Nelson N O, Agudelo S C, Yuan W Q, et al. Nitrogen and phosphorus availability in biochar-amended soils[J]. Soil Science, 2011, 176(5): 218-226 DOI:10.1097/SS.0b013e3182171eac (  0) 0) |
| [32] |
高德才, 张蕾, 刘强, 等. 旱地土壤施用生物炭减少土壤氮损失及提高氮素利用率[J]. 农业工程学报, 2014, 30(6): 54-61 (  0) 0) |
| [33] |
盖霞普, 刘宏斌, 翟丽梅, 等. 玉米秸秆生物炭对土壤无机氮素淋失风险的影响研究[J]. 农业环境科学学报, 2015, 34(2): 310-318 (  0) 0) |
| [34] |
董成, 陈智勇, 谢迎新, 等. 生物炭连续施用对农田土壤氮转化微生物及N2O排放的影响[J]. 中国农业科学, 2020, 53(19): 4024-4034 (  0) 0) |
| [35] |
Troy S M, Lawlor P G, O' Flynn C J, et al. Impact of biochar addition to soil on greenhouse gas emissions following pig manure application[J]. Soil Biology and Biochemistry, 2013, 60: 173-181 (  0) 0) |
| [36] |
Liao X, Liu D Y, Niu Y H, et al. Effect of field-aged biochar on fertilizer N retention and N2O emissions: A field microplot experiment with 15N-labeled urea[J]. Science of the Total Environment, 2021, 773: 145645 (  0) 0) |
| [37] |
Cayuela M L, Sánchez-Monedero M A, Roig A, et al. Biochar and denitrification in soils: When, how much and why does biochar reduce N2O emissions?[J]. Scientific Reports, 2013, 3: 1732 (  0) 0) |
| [38] |
侯海军, 秦红灵, 陈春兰, 等. 土壤氮循环微生物过程的分子生态学研究进展[J]. 农业现代化研究, 2014, 35(5): 588-594 (  0) 0) |
| [39] |
Zhang X, Duan P P, Wu Z, et al. Aged biochar stimulated ammonia-oxidizing Archaea and bacteria-derived N2O and NO production in an acidic vegetable soil[J]. Science of the Total Environment, 2019, 687: 433-440 (  0) 0) |
| [40] |
李双双, 陈晨, 段鹏鹏, 等. 生物质炭对酸性菜地土壤N2O排放及相关功能基因丰度的影响[J]. 植物营养与肥料学报, 2018, 24(2): 414-423 (  0) 0) |
2. Institute of Soil Science, Chinese Academy of Sciences, Nanjing 210008, China;
3. Institute of Applied Ecology, Chinese Academy of Sciences, Shenyang 110016, China
 2022, Vol. 54
2022, Vol. 54


