2. 中国科学院南京土壤研究所, 南京 210008
多环芳烃(polycyclic aromatic hydrocarbons,PAHs)是一类由天然来源和人为活动产生的具有两个或两个以上苯环结构的持久性有机污染物[1]。其中,石油泄露是一种常见的石油源性PAHs的来源[2]。研究表明,石油工业污染土壤占总污染源比例的7%,而加油站也是最常见的服务行业污染源(15%)[3]。PAHs及其衍生物具有生物富集性、迁移性以及遗传毒性[4],对人体健康可产生严重危害。因此,PAHs污染土壤的风险管控与修复技术研究至关重要。
污染物的生物有效性是指其被生物体吸收的能力和可能的毒性[5]。随着人们对污染物生物有效性及污染物老化过程的深入认知,意识到传统总量表征方法并不能准确表征污染物的环境风险[6],逐步建立了基于温和溶剂提取等方法来表征土壤中有机污染物的生物有效性[7]。环糊精大分子是一种具有环状结构,腔内疏水、腔外亲水的分子。有机污染物与环糊精大分子结合形成络合物,增强了有机污染物的水溶性[8]。羟丙基-β-环糊精(HPCD)是一种环糊精外部增加了羟基官能团的改性β-环糊精[9]。研究报道,采用HPCD提取方法可以很好地评价土壤中PAHs的生物有效性[7]。张亚楠等[10]研究表明,HPCD提取的PAHs浓度与蚯蚓体内富集的PAHs浓度显著相关。Yu等[6]将索氏提取法、正丁醇法、HPCD法提取的多氯联苯(PCBs)生物有效性与蚯蚓体内PCBs的生物累积量进行比较,发现HPCD法是预测土壤中实际PCBs生物累积的最佳方法。
近年来,基于生物有效性调控的土壤污染阻控技术受到广泛关注。通过向土壤中添加高效吸附材料,可降低土壤中污染物的生物有效性进而降低其环境风险[11]。活性炭价格低廉、比表面积大、孔隙结构发达,可高效吸附有机污染物,降低其在土壤中的生物有效性[12]。已有研究表明,活性炭吸附的PCBs在蛤蜊肠道内的生物吸收率仅1% ~ 2%[13],活性炭也可大大降低滴滴涕、二噁英和呋喃的平衡孔隙水浓度,阻控持久性有机污染物进入生物体[14]。但是在针对土壤污染应急管理过程中,如石油泄露等突发事件产生的环境PAHs污染[15],活性炭对污染物的阻控效果能持续多久还不明确;且大部分研究工作关注表层土壤,对不同深度和性质土壤中活性炭的阻控效果也还有待进一步研究。
由此,本研究以菲、芘、苯并[b]荧蒽、苯并[g, h, i]芘为不同环数PAHs模式污染物,模拟场地突发事件造成的PAHs污染土壤,采用加速溶剂萃取技术和HPCD提取方法,探究活性炭对不同类型土壤中PAHs生物有效性的动态影响,以期为活性炭在污染土壤修复与环境应急管理中的应用提供理论依据与技术支撑。
1 材料与方法 1.1 供试材料供试土壤采自某污染场地。采样时,根据场地情况,随机选取3处样点利用钻探设备进行采样,分别采集6、9、13.5 m土柱共计16个土壤样品,即S1~S16。采集的土壤经自然风干,剔除砂石后粉碎,过10目筛备用。土壤基本理化性质如表 1所示,测定参考《土壤农业化学分析方法》[16]。
|
|
表 1 供试土壤基本理化性质 Table 1 Basic physical and chemical properties of tested soil |
供试粉状活性炭购自上海九亿化学试剂有限公司,其基本理化性质见表 2。
|
|
表 2 供试活性炭基本理化性质 Table 2 Physico-chemical properties of activated carbon |
16份土壤样品,每份取样400 g,然后从中再分别取20 g过100目筛后与20 ml 40 mg/L PAHs丙酮溶液混合,在通风橱中搅拌均匀,待丙酮挥发后,将其与原剩余380 g土样充分混匀,制备得到每份400 g含PAHs 2 mg/kg的污染土壤。污染土壤老化7 d后,将各土样均分为两份,每份200 g,用于培养试验,一份不加活性炭作为对照处理,另一份添加10 g活性炭并充分混匀作为5%(m/m)活性炭处理。所有待培养的土样置于500 ml棕色磨口玻璃瓶中,去离子水调节土壤含水率为25%,放置于25 ℃避光条件下培养,在1、2、4、8个月时分别取样测定土壤中PAHs的残留量和生物有效态含量。
1.3 样品采集取样时用小土钻取出5 ~ 6 g土样,用铝箔包好并将其置于–80 ℃的冰箱中冷冻24 h以上,之后取出冷冻后的土壤样品,放置于冷冻干燥箱中,在–60 ℃条件下,抽真空干燥24 h,将抽真空后的样品研磨成粉末状保存待测。
1.4 PAHs提取与测定 1.4.1 PAHs残留量提取取1.0 g土样与硅藻土充分混匀后装入ASE萃取柱中进行萃取,萃取温度为100 ℃,萃取压力为10 MPa,萃取溶剂为正己烷∶丙酮(4∶1,V/V);萃取结束,将萃取液倒入梨形瓶中,加入5 ml正己烷∶丙酮(1∶1,V/V)润洗两次,利用旋转蒸发仪进行浓缩,水浴温度为50 ℃,泵气压为350 mbar;萃取液浓缩至2 ml以下,过已用10 ml正己烷∶二氯甲烷(9∶1,V/V)活化的SPE柱(依次填入0.5 g无水硫酸钠、0.5 g硅胶、0.5 g弗罗里硅土、1.0 g无水硫酸钠)进行净化,再用5 ml正己烷∶二氯甲烷(9∶1,V/V)润洗梨形瓶两次,润洗液同样过SPE柱;将净化过的萃取液再次进行浓缩至1 ml以下,再用正己烷(色谱纯)定容至1 ml,转移至棕色进样瓶中待测。
1.4.2 PAHs有效态含量提取参照Reid等[7]和张亚楠等[10]的方法,土壤中生物有效态PAHs采用温和溶剂HPCD进行提取。具体为:取1.0 g土样于50 ml玻璃离心管中,加入20 ml 50 mmol/L的HPCD溶液;放置在振荡条件为25 ℃、振速为200 r/min的恒温空气摇床中振荡提取20 h;取出静置30 min,再放置在转速为2 000 r/min的离心机中离心10 min;倒出上清液,再向底部土壤中加入20 ml去离子水进行涡旋,使离心后的土壤与去离子水充分混合,静置30 min后,再次进行2 000 r/min离心10 min;倒出上清液,加入硅藻土与离心瓶底部土壤搅拌均匀,装入ASE萃取柱中;再使用与1.4.1中残留量提取相同的步骤将样品进行净化、浓缩和测定。最终利用差减法计算HPCD提取的PAHs有效态含量。
1.4.3 测定条件PAHs采用安捷伦7890B- 5977B气相色谱质谱联用仪(GC-MS)测定。色谱条件:进样口温度300 ℃,进样体积1 µl,柱流量1 ml/min。升温程序:45 ℃保持2 min,以20 ℃/min升温至265 ℃,以5 ℃/min升温至285 ℃,以10 ℃/min升温至320 ℃,保持4 min。质谱条件:全扫描SCAN,扫描范围35 ~ 450 u,离子源温度230 ℃,四级杆温度150 ℃,离子化能量70 eV,传输线温度280 ℃,溶剂延迟3.9 min。色谱柱(DB-5MS):30 m×0.25 mm×0.25 µm,固定相为5% 苯基–甲基聚硅氧烷。
1.5 数据处理本文数据采用Excel 2019、SPSS 19.0、Origin 2022软件进行处理和绘图,采用Duncan法进行显著性检验(P < 0.05),采用多元线性回归分析进行相关分析。
2 结果与讨论 2.1 土壤中PAHs残留量动态变化土壤中菲(3环)、芘(4环)、苯并[b]荧蒽(5环)、苯并[g, h, i]芘(6环)的残留量随培养时间变化如图 1所示。培养开始时各处理土壤中PAHs含量为2 mg/kg,培养1个月后,各处理土壤中PAHs残留量降低较快,对照处理土壤中菲、芘、苯并[b]荧蒽、苯并[g, h, i]芘分别降低了77.90%、81.32%、44.29%、82.04%,5% 活性炭处理土壤中分别降低了38.92%、45.89、79.31%、85.33%。此后,除对照处理土壤中苯并[g, h, i]芘残留量未降低外,其他处理中菲、芘、苯并[b]荧蒽、苯并[g, h, i]芘残留量均呈降低趋势。由图 1可见,培养到第8个月结束时,对照处理土壤中菲、芘、苯并[b]荧蒽残留量均值分别降低了58.07%、24.82%、18.08%,5% 活性炭处理土壤中菲、芘、苯并[b]荧蒽、苯并[g, h, i]芘残留量均值分别降低了39.30%、28.71%、36.43%、61.30%。整体而言,各处理土壤中PAHs含量在培养4个月后不再有明显变化,土壤中PAHs残留量逐渐稳定。
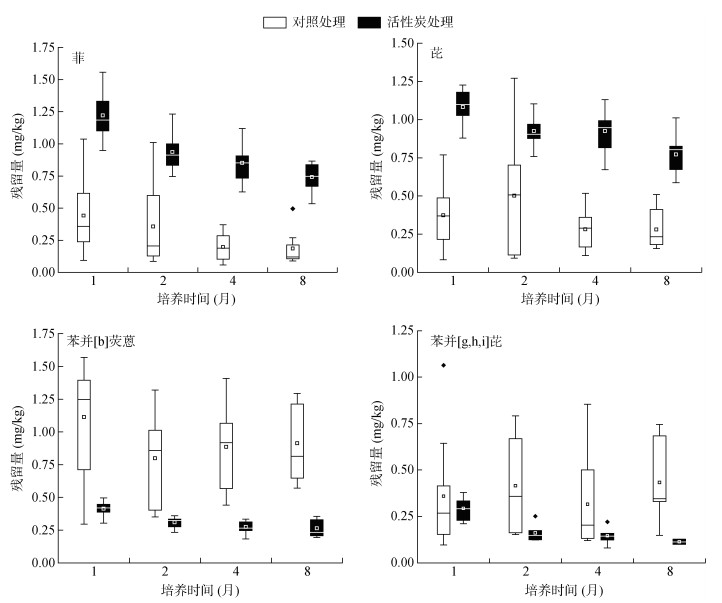
|
图 1 土壤中PAHs残留量随时间的变化 Fig. 1 Residues of PAHs in soils during different time |
在同一取样时间下,5% 活性炭处理与对照处理土壤中PAHs的残留量具有显著差异,表现为5% 活性炭处理菲、芘等低环PAHs残留量显著高于对照处理(P < 0.05),而5环PAHs苯并[b]荧蒽的残留量则显著低于对照处理(P < 0.05),6环PAHs苯并[g, h, i]芘残留量在两处理组之间无显著差异。该结果说明添加5% 活性炭对土壤中低环PAHs具有固定作用,增加了低环PAHs在土壤中的固持。这可能是由于低环PAHs具有较高的蒸汽压和挥发性,容易从土壤中挥发[1],活性炭可有效吸附低环PAHs,减少其挥发损失[17]。而高环PAHs具有较低的蒸气压和水溶性,本身不易挥发[18],在添加活性炭的处理中其残留量更低,这可能是因为活性炭的添加刺激了土壤微生物活性,增加了高环PAHs的微生物降解[19]。Meynet等[20]研究发现,活性炭添加至土壤中可保留微生物降解PAHs的潜力。Beesley等[21]研究表明,土壤与生物炭混合培养60 d后能够降低土壤中超过50% 高环PAHs的残留量。Li等[22]研究结果显示,向污染土壤中添加1% 的玉米秸秆生物炭可抑制2、3环PAHs降解,促进4 ~ 6环PAHs降解,与本研究结果基本一致。
2.2 土壤中PAHs生物有效性动态变化土壤中PAHs生物有效性随时间动态变化如图 2所示。培养1个月后,在对照和5% 活性炭处理之间菲、芘、苯并[b]荧蒽生物有效性具有显著差异(P < 0.05),而苯并[g, h, i]芘生物有效性无显著变化。此时,对照处理菲、芘、苯并[b]荧蒽生物有效性均值分别为54.06%、54.13%、70.70%,显著高于5% 活性炭处理(菲19.00%、芘16.40%、苯并[b]荧蒽31.10%),尽管在1个月后两个处理组中苯并[g, h, i]芘生物有效性无著差异,但在培养至2个月后,5% 活性炭处理土壤中苯并[g, h, i]芘生物有效性均值较对照处理降低了21.29%。该结果说明向土壤中加入5% 活性炭可降低PAHs的生物有效性,在1个月内对3、4、5环PAHs生物有效性即具有显著降低效果(P < 0.05),2个月后对6环PAHs生物有效性具有明显降低效果。本研究将PAHs生物有效性和土壤理化性质进行多元线性回归分析,结果表明,PAHs生物有效性与有机碳含量呈显著负相关关系(P < 0.05),说明增加碳含量能够降低PAHs生物有效性。Brändli等[12]发现,向城市土壤中添加活性炭能够降低64% 自由溶解的PAHs。Oleszczuk等[23]指出,添加5% 活性炭到污泥中能够降低95% 以上溶解态PAHs。也有研究证实,土壤中添加生物炭56 d后显著降低蚯蚓体内PAHs浓度[24]。
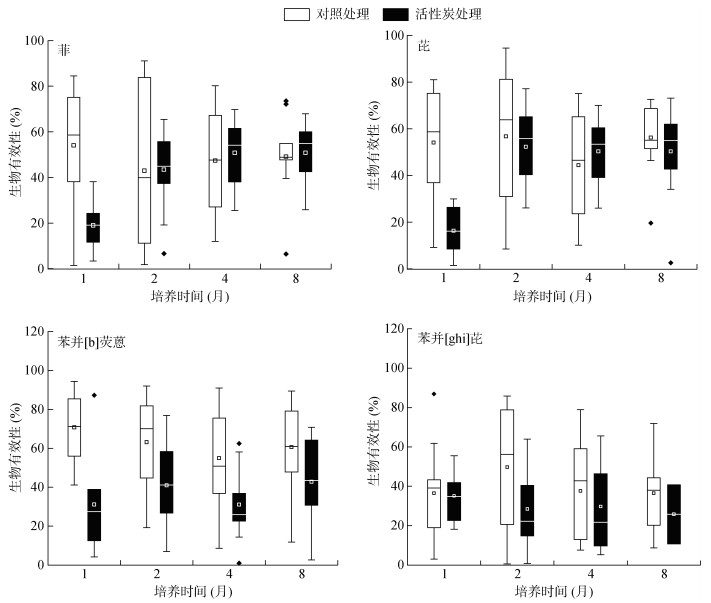
|
图 2 土壤中PAHs生物有效性随时间变化 Fig. 2 Bioavailability of PAHs in soils during different time |
随着培养时间的延长,在对照处理土壤中PAHs有效性在培养开始前4个月内呈降低趋势,培养至第8个月时,土壤中菲、苯并[g, h, i]芘生物有效性逐渐趋于稳定,这主要归因于PAHs在土壤中的老化过程。研究表明,随着老化时间延长,土壤中PAHs与土壤有机质等组分结合更加密切,导致生物有效性降低[25]。而芘、苯并[b]荧蒽生物有效性略有升高,这也可能是由于随着老化时间的延长有部分PAHs解吸出来。在活性炭处理土壤中菲、芘、苯并[b]荧蒽随培养时间的延长生物有效性呈上升趋势,苯并[g, h, i]芘生物有效性随培养时间延长则趋于稳定。这是因为在培养开始阶段,活性炭可高效吸附PAHs,大幅度降低其生物有效性,但随时间延长这种吸附效果减弱,PAHs可进一步解吸出来进入土壤溶液,导致其生物有效性升高。该结果说明向土壤中添加活性炭来阻控PAHs降低其生物有效性并不是一劳永逸的。活性炭对PAHs的阻控效果会逐渐降低,在实际场地应用过程中应注意跟踪。图 3进一步证实了在1个月内活性炭对土壤中PAHs生物有效性的降低率是最高的,随着时间延长活性炭阻控效果减弱。
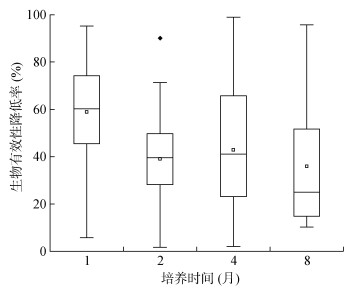
|
图 3 添加5% 活性炭土壤中PAHs生物有效性降低率随时间变化 Fig. 3 Bioavailability reduction rate of PAHs in soils added with 5% activated carbon during different time |
土壤中PAHs残留量和生物有效性随不同质地土壤变化见图 4。从图 4中可以看出,在对照处理土壤中PAHs残留量表现为砂土 > 粉砂壤土 > 砂质壤土。研究表明,PAHs含量与土壤中砂粒含量呈显著正相关,倾向于在粗砂含量高的土壤中积累[26],这与本研究结果基本一致(表 1)。添加5% 活性炭的粉砂壤土、砂质壤土中PAHs的残留量显著高于对照处理(P < 0.05),砂土中添加5% 活性炭对PAHs残留量无显著影响。

|
图 4 不同质地土壤中PAHs残留量和生物有效性 Fig. 4 Residue and bioavailability of PAHs in soils of different textures |
在砂土、粉砂壤土中添加5% 活性炭可显著降低PAHs的生物有效性(P < 0.05),但在砂质壤土中PAHs的生物有效性在对照和5% 活性炭处理之间无显著差异。可见,添加活性炭对砂土中PAHs生物有效性降低效果最好。可能由于砂土有机碳含量低,对PAHs吸附作用较弱[27],因此砂土本身PAHs生物有效性较高,添加活性炭在该类型土壤中阻控PAHs效果最好。如图 4所示,在砂土中添加活性炭后生物有效性降低了45%。同时亦证明,土壤中有机碳含量是调控PAHs生物有效性的重要因子。
3 结论土壤中添加5% 活性炭处理能够有效降低不同类型PAHs生物有效性和高环PAHs残留量;对3、4、5环PAHs,在添加活性炭后的1个月内PAHs生物有效性降低效果最好,随着时间的延长,活性炭对PAHs的阻控效果呈减弱趋势;添加5% 活性炭可显著降低砂土、粉砂壤土中PAHs的生物有效性,而对砂质壤土中PAHs的生物有效性影响较小。
| [1] |
Haritash A K, Kaushik C P. Biodegradation aspects of polycyclic aromatic hydrocarbons (PAHs): A review[J]. Journal of Hazardous Materials, 2009, 169(1/2/3): 1-15 (  0) 0) |
| [2] |
Gao P, Li H B, Wilson C P, et al. Source identification of PAHs in soils based on stable carbon isotopic signatures[J]. Critical Reviews in Environmental Science and Technology, 2018, 48(13/14/15): 923-948 (  0) 0) |
| [3] |
Panagos P, van Liedekerke M, Yigini Y, et al. Contaminated sites in Europe: Review of the current situation based on data collected through a European network[J]. Journal of Environmental and Public Health, 2013, 2013: 158764 (  0) 0) |
| [4] |
袁静, 王青玲, 侯金玉, 等. 亚油酸钠刺激多环芳烃污染土壤微生物修复的机理研究[J]. 土壤, 2020, 52(5): 948-955 DOI:10.13758/j.cnki.tr.2020.05.011 (  0) 0) |
| [5] |
Alexander M. Aging, bioavailability, and overestimation of risk from environmental pollutants[J]. Environmental Science & Technology, 2000, 34(20): 4259-4265 (  0) 0) |
| [6] |
Yu C G, Zhang C K, Ye Z, et al. Alternative evaluation to earthworm toxicity test in polychlorinated biphenyls spiked and remediated soils[J]. Bulletin of Environmental Contamination and Toxicology, 2020, 105(2): 250-254 DOI:10.1007/s00128-020-02939-1 (  0) 0) |
| [7] |
Reid B J, Stokes J D, Jones K C, et al. Nonexhaustive cyclodextrin-based extraction technique for the evaluation of PAH bioavailability[J]. Environmental Science & Technology, 2000, 34(15): 3174-3179 (  0) 0) |
| [8] |
Wang X J, Brusseau M L. Solubilization of some low-polarity organic compounds by hydroxypropyl-. beta.- cyclodextrin[J]. Environmental Science & Technology, 1993, 27(13): 2821-2825 (  0) 0) |
| [9] |
Gao H P, Xu L, Cao Y M, et al. Effects of hydroxypropyl-β-cyclodextrin and β-cyclodextrin on the distribution and biodegradation of phenanthrene in NAPL-water system[J]. International Biodeterioration & Biodegradation, 2013, 83: 105-111 (  0) 0) |
| [10] |
张亚楠, 杨兴伦, 卞永荣, 等. 化学提取法表征污染土壤中PAHs老化规律和蚯蚓富集特征[J]. 环境科学, 2015, 36(12): 4582-4590 DOI:10.13227/j.hjkx.2015.12.034 (  0) 0) |
| [11] |
Lamichhane S, Bal Krishna K C, Sarukkalige R. Polycyclic aromatic hydrocarbons (PAHs) removal by sorption: A review[J]. Chemosphere, 2016, 148: 336-353 DOI:10.1016/j.chemosphere.2016.01.036 (  0) 0) |
| [12] |
Brändli R C, Hartnik T, Henriksen T, et al. Sorption of native polyaromatic hydrocarbons (PAH) to black carbon and amended activated carbon in soil[J]. Chemosphere, 2008, 73(11): 1805-1810 DOI:10.1016/j.chemosphere.2008.08.034 (  0) 0) |
| [13] |
McLeod P B, van den Heuvel-Greve M J, Allen-King R M, et al. Effects of particulate carbonaceous matter on the bioavailability of benzo[a]Pyrene and 2, 2', 5, 5'-tetrachlorobiphenyl to the clam, Macoma balthica[J]. Environmental Science & Technology, 2004, 38(17): 4549-4556 (  0) 0) |
| [14] |
Ghosh U, Luthy R G, Cornelissen G, et al. In-situ sorbent amendments: A new direction in contaminated sediment management[J]. Environmental Science & Technology, 2011, 45(4): 1163-1168 (  0) 0) |
| [15] |
Hazaimeh M D, Ahmed E S. Bioremediation perspectives and progress in petroleum pollution in the marine environment: A review[J]. Environmental Science and Pollution Research International, 2021, 28(39): 54238-54259 DOI:10.1007/s11356-021-15598-4 (  0) 0) |
| [16] |
鲁如坤. 土壤农业化学分析方法[M].
中国农业科技出版社, 北京, 2000
(  0) 0) |
| [17] |
Yakout S M, Daifullah A A M, El-Reefy S A. Equilibrium and kinetic studies of sorption of polycyclic aromatic hydrocarbons from water using rice husk activated carbon[J]. Asian Journal of Chemistry, 2013, 25(18): 10037-10042 DOI:10.14233/ajchem.2013.14783 (  0) 0) |
| [18] |
Plaza-Bolaños P, Frenich A G, Vidal J L M. Polycyclic aromatic hydrocarbons in food and beverages. Analytical methods and trends[J]. Journal of Chromatography A, 2010, 1217(41): 6303-6326 DOI:10.1016/j.chroma.2010.07.079 (  0) 0) |
| [19] |
Dutta T, Kwon E, Bhattacharya S S, et al. Polycyclic aromatic hydrocarbons and volatile organic compounds in biochar and biochar-amended soil: A review[J]. GCB Bioenergy, 2017, 9(6): 990-1004 DOI:10.1111/gcbb.12363 (  0) 0) |
| [20] |
Meynet P, Hale S E, Davenport R J, et al. Effect of activated carbon amendment on bacterial community structure and functions in a PAH impacted urban soil[J]. Environmental Science & Technology, 2012, 46(9): 5057-5066 (  0) 0) |
| [21] |
Beesley L, Moreno-Jiménez E, Gomez-Eyles J L. Effects of biochar and greenwaste compost amendments on mobility, bioavailability and toxicity of inorganic and organic contaminants in a multi-element polluted soil[J]. Environmental Pollution, 2010, 158(6): 2282-2287 DOI:10.1016/j.envpol.2010.02.003 (  0) 0) |
| [22] |
Li X N, Song Y, Wang F, et al. Combined effects of maize straw biochar and oxalic acid on the dissipation of polycyclic aromatic hydrocarbons and microbial community structures in soil: A mechanistic study[J]. Journal of Hazardous Materials, 2019, 364: 325-331 DOI:10.1016/j.jhazmat.2018.10.041 (  0) 0) |
| [23] |
Oleszczuk P, Hale S E, Lehmann J, et al. Activated carbon and biochar amendments decrease pore-water concentrations of polycyclic aromatic hydrocarbons (PAHs) in sewage sludge[J]. Bioresource Technology, 2012, 111: 84-91 DOI:10.1016/j.biortech.2012.02.030 (  0) 0) |
| [24] |
Gomez-Eyles J L, Sizmur T, Collins C D, et al. Effects of biochar and the earthworm Eisenia fetida on the bioavailability of polycyclic aromatic hydrocarbons and potentially toxic elements[J]. Environmental Pollution, 2011, 159(2): 616-622 DOI:10.1016/j.envpol.2010.09.037 (  0) 0) |
| [25] |
Ma L L, Zhang J, Han L S, et al. The effects of aging time on the fraction distribution and bioavailability of PAH[J]. Chemosphere, 2012, 86(10): 1072-1078 (  0) 0) |
| [26] |
Wang L J, Zhang P Q, Wang L, et al. Polycyclic aromatic hydrocarbons in urban soil in the semi-arid city of Xi'an, Northwest China: Composition, Distribution, Sources, and Relationships with soil properties[J]. Archives of Environmental Contamination and Toxicology, 2018, 75(3): 351-366 (  0) 0) |
| [27] |
Ukalska-Jaruga A, Debaene G, Smreczak B. Dissipation and sorption processes of polycyclic aromatic hydrocarbons (PAHs) to organic matter in soils amended by exogenous rich-carbon material[J]. Journal of Soils and Sediments, 2020, 20(2): 836-849 (  0) 0) |
2. Institute of Soil Science, Chinese Academy of Sciences, Nanjing 210008, China
 2022, Vol. 54
2022, Vol. 54


