2. 桂林理工大学岩溶地区水污染控制与利用安全保障协同创新中心, 桂林 541004;
3. 广西环境污染控制理论与技术重点实验室科教结合科技创新基地, 桂林 541004
植物修复技术(phytoremediation)是一种环境友好、成本低廉的重金属污染土壤原位修复技术,极具应用潜力[1]。超富集植物(hyperaccumulator)能从土壤中超量吸收重金属并将其富集在体内,通过收割植物地上部分可起到去除土壤中过量重金属的目的[2]。李氏禾(Leersia hexandra Swartz)是我国境内首次发现的铬超富集植物,其生长迅速、繁殖能力强,对铬具有很强的富集和耐受能力,并能将高毒性的Cr(VI)转化成低毒性的Cr(III)积累在植物的茎和叶片中,是铬污染土壤修复的优质植物材料[3]。近年来,本课题组围绕李氏禾在植物–微生物联合修复[4]、超富集植物耐性机制[5]、农艺调控[6-7]等方面开展了一系列研究。为了能更好地将李氏禾应用于生产实践,还需要对李氏禾生理生化机制进行深入研究。
研究表明,植物根系泌氧能通过改变土壤氧化还原电位、促进根部铁膜形成等方式调控根际土壤重金属形态及生物有效性,从而影响植物对重金属的吸收[8]。此外,根系泌氧能使植物根际土壤形成好氧区、兼性好氧区和厌氧区,这有利于不同功能的微生物在根际发挥作用,从而促进植物对重金属的富集[9]。然而,李氏禾根系泌氧水平是否与其对土壤铬的超富集有关尚不清楚。因此,研究重金属处理下超富集植物根系泌氧的变化规律对阐明超富集机制具有重要意义。
土壤中的根–土界面、土–水界面存在大量的物质交换和能量流动,使土壤性质在微小区域内也存在显著的差异[10]。使用传统的非原位取样方法研究土壤异质性时,通常只能在不同剖面单点取样,取样时极易破坏土壤结构,无法获得物质真实的时空分布特征[11]。原位高分辨技术为揭示植物修复的根际效应和作用机理提供了原位和直观的表征手段,但其在根际微界面的应用才刚刚起步[12]。平面光极技术(planar optode,PO)是基于荧光淬灭原理开发的新兴高分辨成像技术,能原位监测具有高度异质性的根际溶解氧时空变化规律,为研究植物根系泌氧机理提供了新的视角[13-15]。例如,Han等[16]发现苦草(Vallisneria spiralis)整个根系都在释放溶解氧,但80% 左右的氧释放都在主根附近。目前,利用平面光极技术研究重金属处理下超富集植物根际溶解氧时空变化规律的研究很少,在Web of Science和知网数据库中以“超富集植物”和“平面光极”作为关键词进行检索,均未发现相关文献报道。因此,本研究基于平面光极原位高分辨技术,对0、50、100 mg/kg 3个铬含量水平下超富集植物李氏禾根际和非根际土中溶解氧进行二维连续实时监测,以为揭示李氏禾铬超富集机制提供科学依据。
1 材料与方法 1.1 试验植物准备从广西桂林市雁山区的农田附近采集未受重金属污染的李氏禾,用自来水反复冲洗后,选择生长状况较好且大小一致的植物样本在塑料圆桶中预培养7 d,圆桶直径为15 cm,桶中加入1/2浓度的Hoagland营养液,每个桶中装20株左右。控制温室中的生长环境,保持14 h光照(光照强度为250 μmol/(m2·s),昼夜温度为25℃/18℃,相对湿度为70% ~ 75%,每3 d更换1次营养液。
1.2 供试土壤准备供试土壤采自桂林理工大学雁山校区校园土(0 ~ 20 cm),自然风干后过2 mm孔径的网筛,土壤基本理化性质见表 1。准备9个长宽高分别为10、8、20 cm的有机玻璃根箱,该根箱有一面可拆卸,可拆卸面和后部分是由14个螺丝连接,且二者之间有一个3 mm宽的硅胶垫,这保证了前板和后板之间的密封性。分别称取1 kg过筛后的土壤放于每个塑料桶中,加入去离子水使土壤含水量保持在田间持水量的80% 左右。
|
|
表 1 供试土壤理化性质 Table 1 Physicochemical properties of tested soil |
以重铬酸钾(K2Cr2O7)溶液的形式向装有供试土壤的塑料桶中分别加入50 mg/kg和100 mg/kg的铬,搅拌均匀后装入对应的根箱,每个处理3个重复。同时以土壤中不添加铬的根箱作为对照,其他条件与铬处理相同。将所有根箱放入温室平衡2周,平衡期间每天给土壤浇去离子水,使土壤含水量保持在田间持水量的80% 左右。土壤平衡后测得铬处理土壤实际铬含量平均分别为59.2 mg/kg和113.8 mg/kg。土壤平衡结束后,每个根箱移栽入3株大小一致的李氏禾,种植间距为2 cm。移栽时注意使李氏禾根部尽量靠近可拆卸后板,移栽后将根箱倾斜45°使根部沿着后板生长。
植物移栽后置于温室培养一周,然后打开根箱可拆卸后板,将4 cm×4 cm的平面光极传感膜的敏感面朝向根系生长区域贴至可拆卸后板上,贴好传感膜后将膜与植物根系接触,同时确保膜与土壤颗粒紧密接触且无气泡产生。培养期间在根箱外部贴锡箔纸避光,贴膜位置见图 1。将膜–根系稳定24 h后,架设平面光极实验装置,开始用高分辨率数码相机拍摄根系泌氧荧光图像,每天下午16:00进行拍摄,连续拍摄8 d,装置示意图见图 2。将根箱放置于摄像头正前方,曝光时间为3 000 ms,使用可调节波长的氙灯光源采光,光源波长415 nm,同时在相机镜头前放置与中心波长相对应的滤光片。拍摄过程中,镜头距离平面光极传感膜30 cm,并且保证每天的观测距离相同,整个成像过程在暗室中完成。试验期间每日定时给每个根箱浇入适量去离子水以保证根箱内土壤含水量不变。拍摄完成后收获李氏禾,测量根长和株高。

|
图 1 根箱贴膜示意图 Fig. 1 Schematic diagram of the rhizobox |
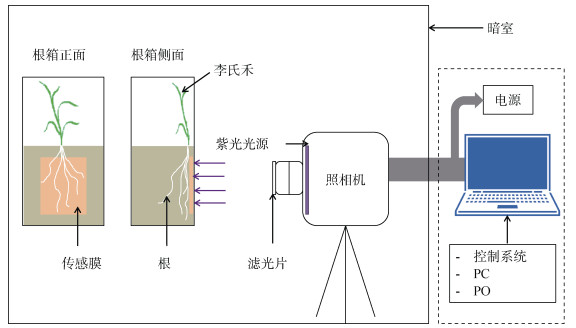
|
图 2 平面光极实验装置示意图 Fig. 2 Schematic diagram of planar optode(PO)setup |
首先,对平面光极传感膜进行校准,随后根据校准值得到O2浓度。O2的校准曲线符合修正的Stern-Volmer方程[17-18]:
| $ \frac{F}{{{F_0}}} = \frac{R}{{{R_0}}} = \alpha + (1 - \alpha )(\frac{1}{{1 + {K_{{\text{sv}}}}[{{\text{O}}_{\text{2}}}]}}) $ | (1) |
| $ R = \frac{{{\text{Red}}}}{{{\text{Blue}}}} $ | (2) |
式中:F为有氧的荧光强度;F0为无氧的荧光强度;α为荧光不可淬灭的部分;Ksv为Stern-Volmer方程淬灭常数;[O2] 为O2的浓度;R和R0分别表示有O2和无O2时不同颜色通道的像素强度比。变量R为O2指示剂的红色通道(Red)和参比点的蓝色通道(Blue)的强度比,以此来测量O2分布。同时该值取决于O2敏感指示剂和参比指示剂的特性[19]。
在本实验中,O2传感膜是通过两点法进行校准,控制校准时环境温度与试验环境温度相同。在准备好的石英比色皿内壁贴上O2传感膜,将准备的饱和无水亚硫酸钠溶液和氧饱和水分别装入比色皿中,利用平面光极设备依次采集图像,再利用软件进行图像分析,饱和无水亚硫酸钠组为0% O2,氧饱和水组为100% O2,测量值为标定时的百分数(%)。处理后的图像中的颜色分布表示了根际O2的分布情况,其中不同的颜色代表了不同O2浓度。
利用MATLAB(R2019a)软件提取彩色图像中的数据,将图片先转换为16位灰度图片,校正相机噪声并减去背景值后再将灰度图像转换为彩色网状图片,并根据标准系列的荧光图像绘制溶解氧(0% 和100%)平面分布等值线图。数据采用Origin 2019和Excel 2010软件分析,用软件SPSS 24.0中的最小显著差法(LSD)进行处理间显著性分析。
2 结果分析 2.1 李氏禾的生长状态拍摄结束时,李氏禾的根长和株高如表 2所示。结果表明,与对照处理相比,50和100 mg/kg铬处理都显著提高了李氏禾的根长和株高(P < 0.05),其中100 mg/kg铬处理李氏禾的根长和株高分别达到了14.57 cm和28.54 cm,是对照处理的1.64倍和1.31倍。
|
|
表 2 不同铬处理下李氏禾的根长和株高 Table 2 Root lengths and heights of L. hexandra under different Cr treatments |
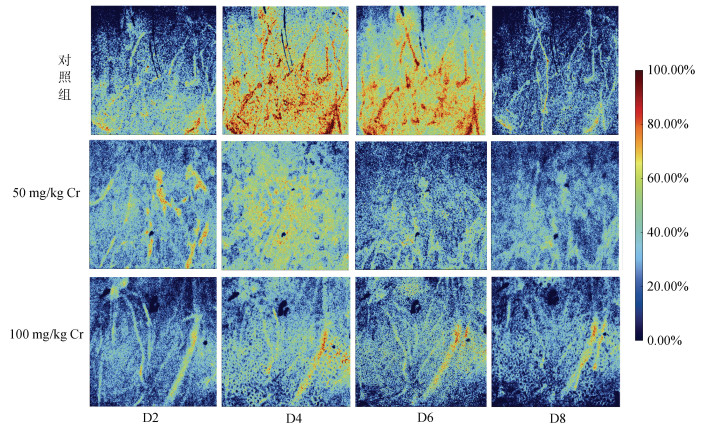
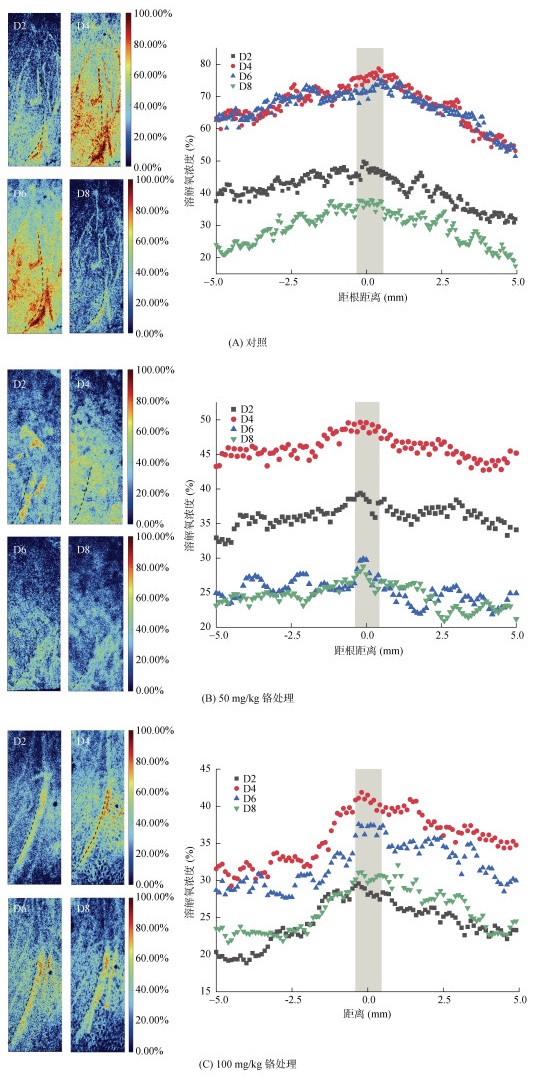
总体上看,溶解氧的空间分布具有显著的异质性。50和100 mg/kg铬处理条件下李氏禾根际土壤中溶解氧浓度较高的热区都集中于根系周围区域,根系的非根尖区域溶解氧浓度很低,而在根尖位置溶解氧浓度较高,实验周期内3个处理根际溶解氧浓度都在10% ~ 80%(图 3)。通过李氏禾的根系泌氧作用,其根际附近形成了高O2浓度的热点区域,并且随着根系的进一步生长,溶解氧从根尖部位释放到缺氧的土壤中,使得热点区域面积增大。结果表明,根际溶解氧浓度显著高于非根际土壤,且距离根部越远,溶解氧平均浓度越低,部分远离根系的土壤处于缺氧状态。对照、50及100 mg/kg铬处理李氏禾根部中心位置溶解氧浓度为距离根5 mm处溶解氧浓度的1.28倍~ 1.41倍、1.16倍~ 1.32倍、1.29倍~ 1.45倍。以对照为例,第4天李氏禾根部中心位置溶解氧浓度(77.2%)是距离根5 mm处溶解氧浓度(54.8%)的1.41倍(图 4)。
|
(图中D2、D4、D6、D8分别表示观测时间第2、4、6、8天;不同颜色代表了土壤中不同溶解氧浓度,其中0%为饱和无水亚硫酸钠溶液,100%为氧饱和水;下同) 图 3 不同铬处理下李氏禾根际溶解氧空间动态变化情况 Fig. 3 Temporal and spatial variation of O2 in rhizospheres of L. hexandra under different Cr treatments |
|
(图中黑色虚线为所分析的根位置) 图 4 不同铬处理下李氏禾根际溶解氧局部分布图和距根部不同距离溶解氧浓度分布散点图 Fig. 4 Temporal and spatial variation of O2 in small areas and one-dimensional distribution of O2 in rhizosphere of L. hexandra under different Cr treatment |
在8 d的拍摄周期中,各处理李氏禾根际溶解氧浓度均呈现先增加后降低的趋势。以对照为例,第2天李氏禾根部中心位置溶解氧浓度为50.2%,第4天增加到77.2%,第8天下降到39.1%(图 4)。由此可推测,在观测初期,李氏禾根系长出的新根释放大量溶解氧,随着这些根的生长速度下降,溶解氧浓度也随之下降。与对照相比,50和100 mg/kg铬处理对李氏禾植物叶片以及根系生长情况具有明显的促进作用,而对根际溶解氧释放具有显著的抑制作用。实验周期内50和100 mg/kg铬处理根际溶解氧浓度都明显低于对照。以第4天植株根部中心位置溶解氧浓度为例,对照为77.2%,显著高于50 mg/kg铬处理的50.2% 和100 mg/kg铬处理的42.3%(图 4A ~ 4C)。此外,第6天和第8天100 mg/kg铬处理李氏禾根系溶解氧浓度较50 mg/kg铬处理高,且存在一定的热点区域,说明高浓度铬处理下,李氏禾根系需要更长的时间作出应激反应。
3 讨论根际是土壤中受植物根系活动影响最为强烈的微域环境,是植物–微生物–土壤相互作用的主要界面[20]。研究表明,植物根系泌氧能通过改变氧化还原电位、调控根际微生物活动等方式改变根际重金属形态和生物有效性,从而影响植物对重金属的吸收[21]。本研究利用平面光极技术提供了铬处理下超富集植物李氏禾根际溶解氧的时空变化情况,为揭示植物修复的根际效应和作用机理提供了科学依据,对丰富植物修复基础理论有着重要的科学意义。
本研究中,3个铬含量下李氏禾根系都在被观测的开始几天快速生长并释放大量的溶解氧、而后几天根际溶解氧含量迅速下降(图 3),这说明植物在修复前期需要在根际形成富氧环境,从而氧化土壤中的一些还原性离子(Fe2+、Mn2+)形成根表铁锰氧化物膜,改变重金属形态及其生物有效性[22]。李氏禾根系泌氧的热区主要集中在新根的根尖位置,而许多植物都被证明在主根和侧根的根尖位置释放氧气,从而保证植物根系快速生长过程中的有氧呼吸,这种规律已经在菹草(Potamogeton crispus)、水稻、大米草(Spartina anglica)等植物根际被发现和报道[23-25]。同时,这也证明植物的根系趋向于朝着有氧的位置生长。Li等[26]发现,芦苇(Phragmites australis)根际溶解氧的微区分布与根系的生长过程及形态密切相关,氧气释放点从整个主根转移到主根根尖,然后又转移到新生的侧根,并且根系发育初期的溶解氧释放量明显比发育后期多。这说明在观测的后几天李氏禾根际溶解氧的降低可能是因为根系生长速度降低。根系泌氧也被认为是很多大型水生植物的主动防御行为,通过根尖的生长向缺氧的沉积物中释放氧气,对一些污染物进行氧化[27]。此外,根系泌氧也为植物根际需氧微生物提供了良好的生存环境,而这些微生物的代谢活动与污染物的去除有着密切的关系[28]。本课题组前期研究表明,李氏禾对铬的吸收和富集与根际高丰度的蜡状芽孢杆菌(Bacillus cereus)密切相关,而蜡状芽孢杆菌是一种好氧微生物,根系泌氧行为可能与蜡状芽孢杆菌在根际微生物群落中的活动有密切关系[29]。
植物的不同生长阶段、不同根组织结构以及根际土壤环境的差异都能影响植物根系泌氧的强度[30]。本研究中,随着土壤中铬含量的增加,李氏禾的根际溶解氧浓度显著下降(图 4)。研究表明,根际较高的溶解氧水平会将土壤中Cr(III)氧化为毒性更强的Cr(VI)[31-32],而土壤修复过程中低氧环境有利于植物根际将Cr(VI) 还原为Cr(III),从而降低土壤毒性[33]。Chen等[34]发现,李氏禾受到Cr(VI) 处理后植物组织体内主要以Cr(III)存在,并且这种还原作用主要与铁的氧化还原和有机酸的络合有关。本课题组前期研究表明,李氏禾主要直接吸附Cr(III)和少量Cr(VI)[35]。因此,本研究推测,铬处理下李氏禾根际溶解氧浓度的降低可能是为了减少土壤中的Cr(VI) 含量。本研究发现,一定含量的铬处理能促进李氏禾的生长发育(表 2),这与之前研究的结果相同[36]。Tian等[37]发现,较好的植株生长发育及通气组织等根系内部形态参数会促进根系向沉积物释放氧气,本研究结果与之相反,本研究中铬处理的根际溶解氧浓度明显低于对照。Cheng等[38]研究表明,重金属会通过降低根系孔隙度和增加根系外皮层木质化程度抑制植物根系泌氧。这说明铬处理可能改变了李氏禾根系特征从而抑制了根系泌氧。此外,研究表明,李氏禾修复铬污染土壤的过程中根际微生物群落多样性会降低,同时会产生一些耐铬微生物将部分土壤中的Cr(VI) 还原为Cr(III),这些微生物的代谢活动也可能消耗了部分溶解氧[29, 39],在植物修复铬污染土壤过程中大部分耐铬微生物成为优势物种后数量和活性会增加[40],因此,可能是修复过程中需氧微生物耗氧量增加导致根际溶解氧浓度下降。目前关于重金属处理对植物根系泌氧的影响机制尚不明确,需要开展更深入的研究加以阐明。
4 结论本研究基于平面光极原位高分辨技术,研究了不同含量水平铬处理下超富集植物李氏禾根际溶解氧的时空变化规律。结果表明,土壤中一定含量的铬能促进李氏禾的生长发育;李氏禾根际土壤中溶解氧浓度较高的热区集中于根系周围区域,在根尖位置溶解氧浓度较高,根际溶解氧含量显著高于非根际土壤,且距离根部越远,溶解氧平均含量越低;随着时间的推移,李氏禾根际溶解氧浓度呈现先升高后降低的趋势,这可能是李氏禾生长发育过程中的生理反应。铬处理下李氏禾根际溶解氧浓度明显更低,这可能是李氏禾为避免根际富氧环境将Cr(III)氧化为毒性更强Cr(VI)的保护性行为。
| [1] |
Ali H, Khan E, Sajad M A. Phytoremediation of heavy metals—Concepts and applications[J]. Chemosphere, 2013, 91(7): 869-881 DOI:10.1016/j.chemosphere.2013.01.075 (  0) 0) |
| [2] |
Alford É R, Pilon-Smits E A H, Paschke M W. Metallophytes—A view from the rhizosphere[J]. Plant and Soil, 2010, 337(1/2): 33-50 (  0) 0) |
| [3] |
Zhang X H, Liu J, Huang H T, et al. Chromium accumulation by the hyperaccumulator plant Leersia hexandra Swartz[J]. Chemosphere, 2007, 67(6): 1138-1143 DOI:10.1016/j.chemosphere.2006.11.014 (  0) 0) |
| [4] |
林华, 林志毅, 满向甜, 等. 蜡状芽孢杆菌协同李氏禾根系分泌物去除水体Cr6+的效应及机制[J]. 生态环境学报, 2020, 29(2): 353-359 (  0) 0) |
| [5] |
Liu J, Duan C Q, Zhang X H, et al. Characteristics of chromium(III) uptake in hyperaccumulator Leersia hexandra swartz[J]. Environmental and Experimental Botany, 2011, 74: 122-126 DOI:10.1016/j.envexpbot.2011.05.008 (  0) 0) |
| [6] |
Lin H, Zhang C K, Zhang X H, et al. Effects of phosphorous fertilizers on growth, Cu phytoextraction and tolerance of Leersia hexandra swartz under different Cu stress levels[J]. International Journal of Phytoremediation, 2020, 22(6): 578-584 DOI:10.1080/15226514.2019.1696742 (  0) 0) |
| [7] |
刘昭君, 林华, 王义安, 等. 磷肥种类对李氏禾富集铜、铬的影响及其生理响应[J]. 生态环境学报, 2021, 30(2): 412-419 (  0) 0) |
| [8] |
Williams P N, Santner J, Larsen M, et al. Localized flux maxima of arsenic, lead, and iron around root apices in flooded lowland rice[J]. Environmental Science & Technology, 2014, 48(15): 8498-8506 (  0) 0) |
| [9] |
Gagnon V, Chazarenc F, Comeau Y, et al. Influence of macrophyte species on microbial density and activity in constructed wetlands[J]. Water Science and Technology: a Journal of the International Association on Water Pollution Research, 2007, 56(3): 249-254 DOI:10.2166/wst.2007.510 (  0) 0) |
| [10] |
Yin D X, Fang W, Guan D X, et al. Localized intensification of arsenic release within the emergent rice rhizosphere[J]. Environmental Science & Technology, 2020, 54(6): 3138-3147 (  0) 0) |
| [11] |
Kuzyakov Y, Razavi B S. Rhizosphere size and shape: Temporal dynamics and spatial stationarity[J]. Soil Biology and Biochemistry, 2019, 135: 343-360 DOI:10.1016/j.soilbio.2019.05.011 (  0) 0) |
| [12] |
Fang W, Williams P N, Zhang H, et al. Combining multiple high-resolution in situ techniques to understand phosphorous availability around rice roots[J]. Environmental Science & Technology, 2021, 55(19): 13082-13092 (  0) 0) |
| [13] |
Kasper E B, Klaus K, Mads L, et al. Nanoparticle-based measurements of pH and O2 dynamics in the rhizosphere of Zostera marina L. : effects of temperature elevation and light-dark transitions[J]. Plant, Cell and Environment, 2016, 39: 1619-1630 DOI:10.1111/pce.12740 (  0) 0) |
| [14] |
Koop-Jakobsen K, Mueller P, Meier R J, et al. Plant-sediment interactions in salt marshes - An optode imaging study of O2, pH, and CO2 gradients in the rhizosphere[J]. Frontiers in Plant Science, 2018, 9: 541 DOI:10.3389/fpls.2018.00541 (  0) 0) |
| [15] |
Sun X, Li Z, Wu L H, et al. Root-induced soil acidification and cadmium mobilization in the rhizosphere of Sedum plumbizincicola: Evidence from a high-resolution imaging study[J]. Plant and Soil, 2019, 436(1/2): 267-282 (  0) 0) |
| [16] |
Han C, Ren J H, Tang H, et al. Quantitative imaging of radial oxygen loss from Valisneria spiralis roots with a fluorescent planar optode[J]. Science of the Total Environment, 2016, 569/570: 1232-1240 DOI:10.1016/j.scitotenv.2016.06.198 (  0) 0) |
| [17] |
Klimant I, Meyer V, Kühl M. Fiber-optic oxygen microsensors, a new tool in aquatic biology[J]. Limnology and Oceanography, 1995, 40(6): 1159-1165 DOI:10.4319/lo.1995.40.6.1159 (  0) 0) |
| [18] |
Koren K, Moßhammer M, Scholz V V, et al. Luminescence lifetime imaging of chemical sensors-A comparison between time-domain and frequency-domain based camera systems[J]. Analytical Chemistry, 2019, 91(5): 3233-3238 DOI:10.1021/acs.analchem.8b05869 (  0) 0) |
| [19] |
Li C, Ding S M, Yang L Y, et al. Planar optode: A two-dimensional imaging technique for studying spatial-temporal dynamics of solutes in sediment and soil[J]. Earth-Science Reviews, 2019, 197: 102916 DOI:10.1016/j.earscirev.2019.102916 (  0) 0) |
| [20] |
Hinsinger P, Plassard C, Jaillard B. Rhizosphere: A new frontier for soil biogeochemistry[J]. Journal of Geochemical Exploration, 2006, 88(1/2/3): 210-213 (  0) 0) |
| [21] |
Manzur M E, Grimoldi A A, Insausti P, et al. Radial oxygen loss and physical barriers in relation to root tissue age in species with different types of aerenchyma[J]. Functional Plant Biology: FPB, 2014, 42(1): 9-17 (  0) 0) |
| [22] |
Xiao W D, Ye X Z, Zhu Z Q, et al. Continuous flooding stimulates root iron plaque formation and reduces chromium accumulation in rice (Oryza sativa L.)[J]. Science of the Total Environment, 2021, 788: 147786 DOI:10.1016/j.scitotenv.2021.147786 (  0) 0) |
| [23] |
Han C, Ren J H, Williams P N, et al. High-resolution imaging of rhizosphere oxygen (O2) dynamics in Potamogeton crispus: Effects of light, temperature and O2 content in overlying water[J]. Plant and Soil, 2019, 441(1/2): 613-627 (  0) 0) |
| [24] |
Larsen M, Santner J, Oburger E, et al. O2 dynamics in the rhizosphere of young rice plants (Oryza sativa L.) as studied by planar optodes[J]. Plant and Soil, 2015, 390(1/2): 279-292 (  0) 0) |
| [25] |
Koop-Jakobsen K, Wenzhöfer F. The dynamics of plant-mediated sediment oxygenation in Spartina anglica rhizospheres—a planar optode study[J]. Estuaries and Coasts, 2015, 38(3): 951-963 DOI:10.1007/s12237-014-9861-y (  0) 0) |
| [26] |
Li C, Ding S M, Ma X, et al. O2 distribution and dynamics in the rhizosphere of Phragmites australis, and implications for nutrient removal in sediments[J]. Environmental Pollution, 2021, 287: 117193 DOI:10.1016/j.envpol.2021.117193 (  0) 0) |
| [27] |
Koren K, Brodersen K E, Jakobsen S L, et al. Optical sensor nanoparticles in artificial sediments—a new tool to visualize O2 dynamics around the rhizome and roots of seagrasses[J]. Environmental Science & Technology, 2015, 49(4): 2286-2292 (  0) 0) |
| [28] |
Courchesne F, Cloutier-Hurteau B, Turmel M C. Relevance of rhizosphere research to the ecological risk assessment of trace metals in soils[J]. Human and Ecological Risk Assessment: An International Journal, 2008, 14(1): 54-72 DOI:10.1080/10807030701790306 (  0) 0) |
| [29] |
Lin H, You S H, Liu L H. Characterization of microbial communities, identification of Cr(VI) reducing bacteria in constructed wetland and Cr(VI) removal ability of Bacillus cereus[J]. Scientific Reports, 2019, 9: 12873 DOI:10.1038/s41598-019-49333-4 (  0) 0) |
| [30] |
Mei X Q, Ye Z H, Wong M H. The relationship of root porosity and radial oxygen loss on arsenic tolerance and uptake in rice grains and straw[J]. Environmental Pollution, 2009, 157(8/9): 2550-2557 (  0) 0) |
| [31] |
Cervantes C, Campos-Garcı́a J, Devars S, et al. Interactions of chromium with microorganisms and plants[J]. FEMS Microbiology Reviews, 2001, 25(3): 335-347 DOI:10.1111/j.1574-6976.2001.tb00581.x (  0) 0) |
| [32] |
Honma T, Ohba H, Kaneko-Kadokura A, et al. Optimal soil eh, pH, and water management for simultaneously minimizing arsenic and cadmium concentrations in rice grains[J]. Environmental Science & Technology, 2016, 50(8): 4178-4185 (  0) 0) |
| [33] |
Malaviya P, Singh A, Anderson T A. Aquatic phytoremediation strategies for chromium removal[J]. Reviews in Environmental Science and Bio/Technology, 2020, 19(4): 897-944 DOI:10.1007/s11157-020-09552-y (  0) 0) |
| [34] |
Chen S M, Zhang X H, Liu J, et al. Reduction of Cr(Ⅵ) to Cr(Ⅲ): a detoxification mechanism in hyperaccumulator leersia hexandra swartz[J]. Fresenius environmental bulletin, 2016, 25(4): 959-968 (  0) 0) |
| [35] |
Li J P, Lin Q Y, Zhang X H, et al. Kinetic parameters and mechanisms of the batch biosorption of Cr(VI) and Cr(III) onto Leersia hexandra Swartz biomass[J]. Journal of Colloid and Interface Science, 2009, 333(1): 71-77 DOI:10.1016/j.jcis.2009.02.021 (  0) 0) |
| [36] |
Zhang X P, Bian F Y, Zhong Z K, et al. Deciphering the rhizosphere microbiome of a bamboo plant in response to different chromium contamination levels[J]. Journal of Hazardous Materials, 2020, 399: 123107 DOI:10.1016/j.jhazmat.2020.123107 (  0) 0) |
| [37] |
Tian C C, Wang C B, Tian Y Y, et al. Root radial oxygen loss and the effects on rhizosphere microarea of two submerged plants[J]. Polish Journal of Environmental Studies, 2015, 24: 1795-1802 DOI:10.15244/pjoes/38971 (  0) 0) |
| [38] |
Cheng H, Wang Y S, Li C D, et al. Mixture of Pb, Zn and Cu on root permeability and radial oxygen loss in the mangrove Bruguiera gymnorrhiza[J]. Ecotoxicology (London, England), 2020, 29(6): 691-697 DOI:10.1007/s10646-020-02234-z (  0) 0) |
| [39] |
Li J P, Lin Q Y, Zhang X H. Mechanism of electron transfer in the bioadsorption of hexavalent chromium within Leersia hexandra Swartz granules by X-ray photoelectron spectroscopy[J]. Journal of Hazardous Materials, 2010, 182(1/2/3): 598-602 (  0) 0) |
| [40] |
Wang B C, Zhu S X, Li W J, et al. Effects of chromium stress on the rhizosphere microbial community composition of Cyperus alternifolius[J]. Ecotoxicology and Environmental Safety, 2021, 218: 112253 DOI:10.1016/j.ecoenv.2021.112253 (  0) 0) |
2. Collaborative Innovation Center for Water Pollution Control and Water Safety Guarantee in Karst Area, Guilin University of Technology, Guilin 541004, China;
3. Guangxi Key Laboratory of Environmental Pollution Control Theory and Technology for Science and Education Combined with Science and Technology Innovation Base, Guilin University of Technology, Guilin 541004, China
 2022, Vol. 54
2022, Vol. 54


