2. 上海辰山植物园, 华东野生濒危资源植物保育中心, 上海 201602
土壤微生物是城市生态系统中的一部分,对城市绿地养分循环起着重要作用[1]。它们参与有机质分解、驱动养分循环、活化土壤中的营养元素,对外界环境条件的变化十分敏感,经常用来反映土壤质量和健康状况[2]。微生物群落结构在不发生人为或自然干扰的情况下,一般处于相对稳定的状态[3]。然而,当前城市地区的扩张增加了人类活动对土壤的影响,改变了城市绿地环境,塑造了新的植被格局[4],这对城市土壤微生物的影响巨大。
随着城市建设要求的不断提高,景观竹被广泛应用于城市各类绿地当中,其与林下植被搭配形成了具有很高观赏性和一定经济价值的竹林景观。上海在20世纪90年代末就开始在各类绿地中广泛使用竹林景观美化城市风貌[5]。然而,竹林的应用可能会显著改变区域土壤理化性质,也会影响土壤微生物的组成和丰度。赵天心等[6]研究显示,毛竹替代阔叶树种或马尾松形成纯林后,土壤细菌结构较真菌结构变化响应更敏感,随着毛竹种植的时间增加最上层土壤细菌群落呈现出抗干扰性。王树梅等[7]对带状采伐后毛竹林土壤细菌群落的变化进行分析,发现采伐宽度可以改变土壤有效磷、全钾、速效钾、有机质、全氮、碱解氮含量等土壤指标,土壤微生物群落丰富度也随着采伐宽度呈现先升后降的趋势。翟婉璐等[8]研究显示,覆盖经营措施会导致雷竹林表层土壤pH逐年降低,土壤有机质及氮、磷、钾等养分含量逐渐增加,土壤细菌丰度与多样性随时间变化,变形菌门丰度上升明显。
上述研究侧重于自然竹林和经济竹林生态,对城市竹林生态有一定的指导意义却也缺少针对性,关于城市绿地竹林景观的研究目前也多集中于造景配置、竹种栽植与养护技术等[9]。因此,本研究从城市园林视角出发,以上海绿地景观中常见的毛竹、红哺鸡竹和淡竹林为研究对象,通过土壤理化指标分析和微生物Illumina MiSeq高通量测序,开展城市绿地不同景观竹林对土壤理化性质以及微生物群落影响的研究,以明晰景观竹林对土壤微环境的潜在影响,为不同绿地竹林的栽植提供科学依据,同时也可以为研究城市园林绿化提供新思路。
1 材料与方法 1.1 研究区概况研究地点位于上海辰山植物园内,属于北亚热带季风湿润气候,最高气温37.6 ℃,最低气温–8.9 ℃,年均温为15.6 ℃,年均日照时数1 817 h,年均降水量1 313 mm[5]。竹园位于植物园内北面,占地约30 000 m2,主要种植土壤来源于浙江安吉,pH 5.5,为偏酸性红壤,后加入少量有机质、草炭、肥料混合。自2016年竹园改建至今,已有景观竹70余种,呈片状分散布局,面积在200 ~ 1 600 m2,均采取统一管理措施。其中,在城市绿地中应用最为广泛的毛竹、红哺鸡竹(以下简称红竹)、淡竹的成林应用面积大、群落稳定,为本研究试验样地。
1.2 样品采集选择毛竹(9 500株/hm2)、红竹(25 000株/hm2)、淡竹(40 000株/hm2)3种竹林,在每种竹林内按3 m间隔设置9个取样样地(4 m × 4 m),共计27块。在每块样地去除表层落叶等杂物后采用五点取样法采集0 ~ 20 cm土层土壤样品,装入无菌袋自封后写上标签。土样运回实验室后,各样品分两份,一份在阴凉处铺平进行自然风干、研磨、过60目筛后用于土壤理化性质测定;一份用四分法取细土置于20℃冰箱保存并尽快用于Illumina MiSeq高通量测序。
1.3 土壤理化指标测定土壤pH采用电位法测定;电导率(EC)采用电导法测定;全氮(TN)、全磷(TP)和全钾(TK)分别采用凯氏定氮法、钼锑抗比色法和火焰光度计法测定;铵态氮(AN)和硝态氮(NN)采用靛酚蓝比色法和紫外分光光度法测定;有效磷(AP)和速效钾(AK)采用钼锑抗比色法和火焰光度计法测定;有机质(OM)和微生物生物量碳(MBC)采用重铬酸钾外加热法和氯仿熏蒸法测定;含水率(MC)采用烘干法测定[10]。
1.4 土壤微生物高通量测序利用Fast DNA Spin Kit for Soil(MP Biomedicals,美国)提取土壤总DNA,并用1% 的琼脂糖凝胶电泳检测DNA质量,使用NanoDrop 2000测定DNA浓度和纯度;使用引物338F(5′-ACTCCTACGGGAGG CAGCAG-3′)和806R(5′-GGACTACHVGGGTWTCT AAT-3′)对土壤细菌16S rRNA基因V3 ~ V4可变区进行PCR扩增,扩增程序如下:95℃预变性3 min;95℃变性30 s,55℃退火30 s,72℃延伸30 s,27个循环;72℃稳定延伸10 min,最后4℃保存。对真菌ITS序列进行PCR扩增(特异引物为ITS1F:5′-CTTGGTCATTTAGAGGAAGTAA-3′和ITS2R:5′-GCTGCGTTCTTCATCGATGC-3′),扩增流程:95 ℃预变性3 min;95℃变性30 s,55℃退火30 s,72 ℃延伸45 s,35个循环;72℃稳定延伸10 min,最终10℃保存。PCR反应体系为:5×TransStart FastPfu缓冲液2 μl,2.5 mmol/L dNTPs 2 μl,5 μmol/L上游引物0.8 μl,5 μmol/L下游引物0.8 μl,TransStart FastPfu DNA聚合酶0.2 μl,模板DNA 10 ng,补足至20 μl。在Illumina公司的MiSeqPE 300平台上测序(上海美吉生物医药科技有限公司)。
1.5 数据处理与分析使用上海美吉生物医药科技有限公司云平台进行交互式生物信息云分析(http://www.i-sanger.com),使用UPARSE软件(version7.1 http://drive5.com/uparse/),根据97% 的相似度对序列进行OTU聚类并剔除嵌合体。利用RDP classifier(http://rdp.cme.msu.edu/)对每条序列进行物种分类注释,比对Silva & Unite数据库,设置比对阈值为70%,根据OTU计算样本微生物群落结构组成、α多样性、β多样性(PCoA)、土壤性质与微生物关联性分析和微生物功能预测并制作图形。利用Excel 2019和SPSS 22.0软件进行数据统计分析,其中使用单因素方差分析(one-way ANOVA)比较不同竹林土壤理化性质差异,并用LDS多重比较分析显著性(P < 0.05);利用Origin 2018软件进行不同竹林土壤理化性质差异和竹林土壤真菌FUNGuild功能预测绘图;利用Adobe Photoshop CC 2018和Adobe Illustrator CC 2018进行后期图形处理。
2 结果分析 2.1 不同竹林土壤理化指标竹种的变化对土壤中全磷(TP)、有效磷(AP)、有机质(OM)、全氮(TN)、全钾(TK)、电导率(EC)有显著影响(P < 0.05);而对pH、铵态氮(AN)、硝态氮(NN)、速效钾(AK)、微生物生物量碳(MBC)、含水率(MC)影响不显著(P > 0.05)(图 1)。土壤中全磷、有效磷、含量呈现毛竹林土壤大于红竹林土壤和淡竹林土壤(图 1C、1I),有机质含量、电导率呈现毛竹林土壤大于红竹林土壤(图 1H、1L),全氮含量呈现毛竹林土壤和淡竹林土壤大于红竹林土壤(图 1F),全钾含量呈现淡竹林土壤大于毛竹林土壤和红竹林土壤(图 1G)。
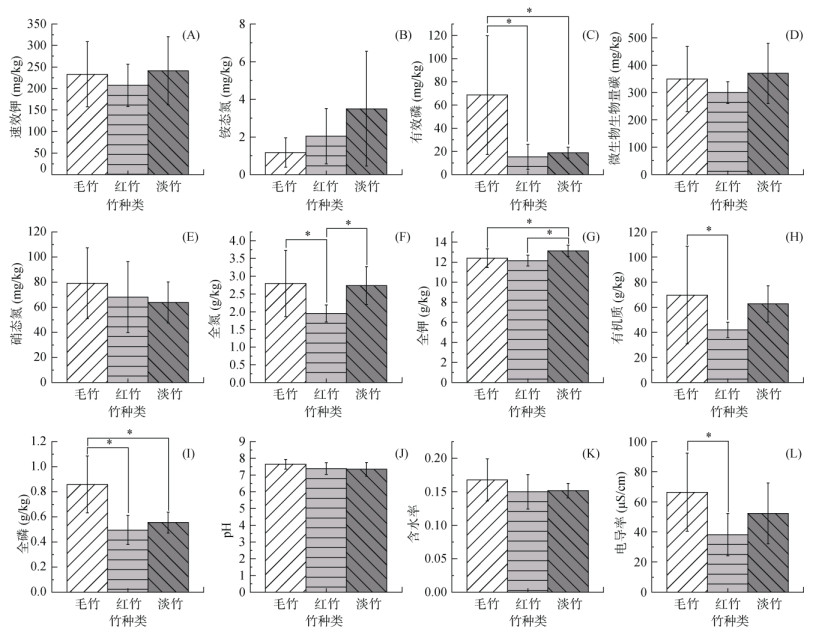
|
(图中*表示在P < 0.05水平差异显著) 图 1 不同竹林土壤理化指标 Fig. 1 Soil physiochemical indexes under different bamboo forests |
通过土壤微生物α多样性分析可以看出,在OTU水平上,土壤细菌α多样性均存在显著性差异,其中毛竹林土壤细菌Sobs与Shannon指数最高,且显著高于其他竹林,淡竹林土壤细菌Sobs与Shannon指数最低(图 2A、2B);毛竹林和红竹林土壤真菌Sobs指数显著高于淡竹林,3种竹林土壤真菌Shannon指数无显著性差异(图 2C、2D)。
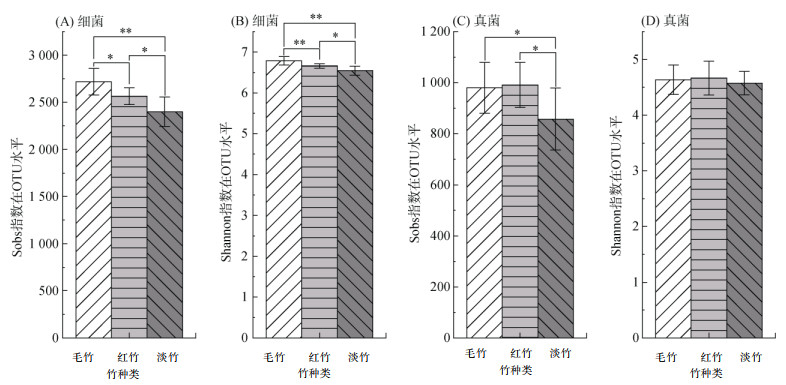
|
(图中*、**、***分别表示在P < 0.05、P < 0.01、P < 0.001水平差异显著,下同) 图 2 三种竹林土壤细菌和真菌α多样性 Fig. 2 Alpha diversity indexes of soil bacteria and fungi under three bamboo forests |
通过bray_curtis距离算法和ANOSIM组间差异检验,可以看出,不同竹林下细菌和真菌群落组成变化明显;毛竹林土壤与其他竹林土壤细菌组成的差异最大(图 3A);3种竹林土壤真菌群落组成较细菌群落组间差异更为明显(图 3B)。
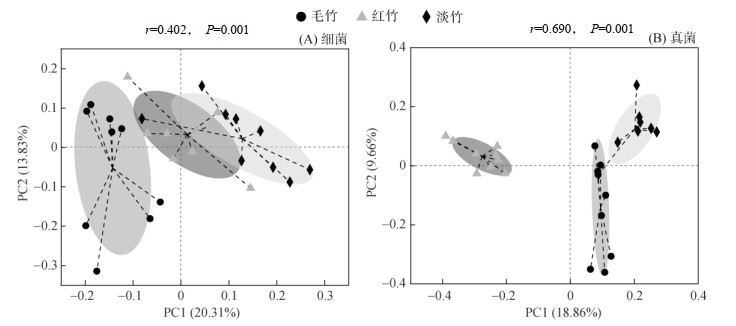
|
图 3 三种竹林土壤细菌和真菌OTU水平群落结构PCoA分析 Fig. 3 PCoA analyses of soil bacteria and fungi community structures at OTU levels under three bamboo forests |
在所有竹林土壤中,放线菌门(Actinobacteriota)是最丰富的菌门,占所有细菌群落丰度的28.39%(图 4A),其在淡竹林土壤中丰度占比最高为32.1%、在红竹林土壤中为29.6%、在毛竹林土壤中为23.4%。同时,竹林土壤细菌的主要菌门还有变形菌门(Proteobacteria),占比21.04%(淡竹林土壤18.5%、红竹林土壤20.6%、毛竹林土壤23.9%);酸杆菌门(Acidobacteriota),占比15.92%(淡竹林土壤15.2%、红竹林土壤15.8%、毛竹林土壤16.6%);绿弯菌门(Chloroflexi),占比15.29%(淡竹林土壤19.1%、红竹林土壤14.4%、毛竹林土壤12.3%)等(图 4C)。
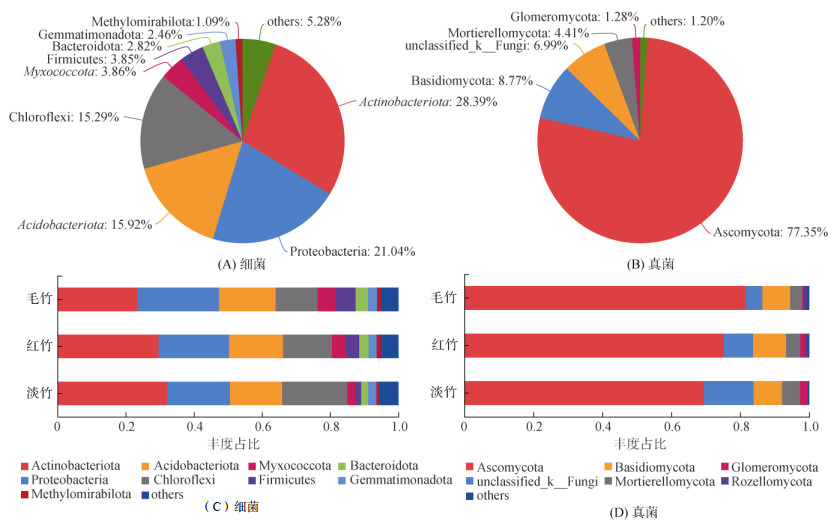
|
图 4 三种竹林土壤门水平上细菌和真菌群落丰度图(相对丰度0.01的类群合并入Others) Fig. 4 Bacterial and fungal community abundances at phylum levels under different bamboo forests |
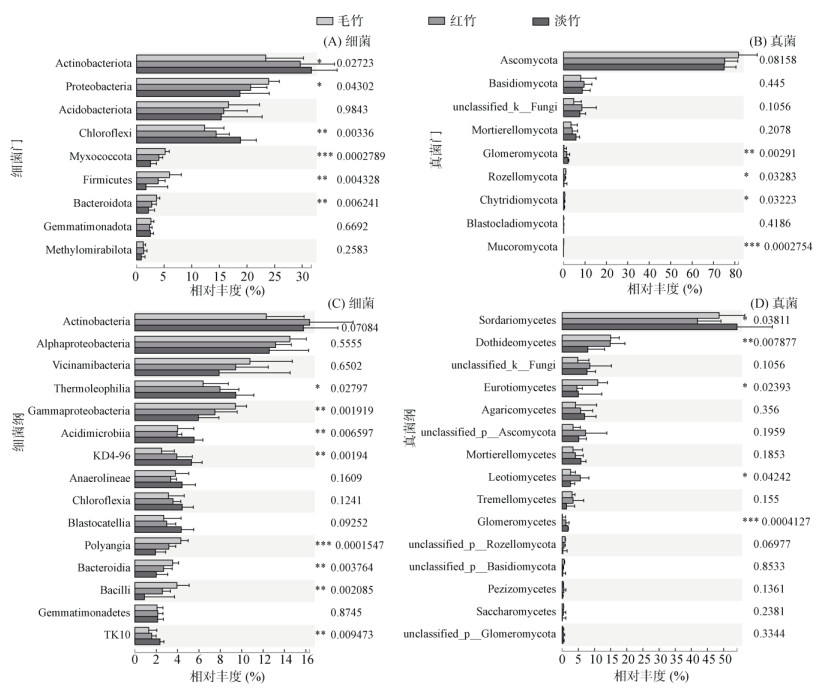
从组间差异性检验可以看出,在门水平上,放线菌门和绿弯菌门在淡竹林土壤中的相对丰度显著高于其他竹林土壤,且在毛竹林土壤中丰度最低,变形菌门、粘球菌门(Myxococcota)、厚壁菌门(Firmicutes)和拟杆菌门(Bacteroidota)的相对丰度则不同,其在毛竹林土壤中丰度最高,在淡竹林中显著最低(图 5A)。在纲水平上,嗜热油菌纲(Thermoleophilia)、酸微菌纲(Acidimicrobiia)、KD4-96和TK10在淡竹林土壤中更丰富,γ-变形菌纲(Gammaproteobacteria)、多囊粘菌纲(Polyangia)、拟杆菌纲(Bacteroidia)和杆菌纲(Bacilli)则在毛竹林土壤中更丰富(图 5C)。
|
(图中每一组柱图对应的数值表示方差分析的P值) 图 5 不同竹林土壤细菌和真菌在门水平与纲水平上物种差异 Fig. 5 Species differences at phylum and class levels of soil bacteria and fungi under different bamboo forests |
在所有竹林土壤中,真菌群落主要由子囊菌门(Ascomycota)构成,其相对丰度占总体的77.35%,其中毛竹林土壤77.35%、红竹林土壤75.17%、淡竹林土壤69.46%,它与占比8.77% 的担子菌门(Basidiomycota)(毛竹林土壤8.77%、红竹林土壤9.56%、淡竹林土壤8.25%)共同占据了竹林土壤真菌的86.12%(图 4B、4D)。
不同竹林土壤真菌优势门差异不显著,但是在纲水平上可以看出,子囊菌门中的粪壳菌纲(Sordariomycetes)在淡竹林土壤中丰度显著高于毛竹林和红竹林土壤,座囊菌纲(Dothideomycetes)在红竹林与毛竹林土壤中丰度显著高于淡竹林土壤,锤舌菌纲(Leotiomycetes)在红竹林土壤中丰度显著高于毛竹林和淡竹林土壤,散囊菌纲(Eurotiomycetes)在毛竹林土壤中丰度显著高于淡竹林和红竹林土壤(图 5B、5D)。这些差异在更下级目水平中也可以看到,如粪壳菌纲中的粪壳菌目(Sordariales)和座囊菌纲中的格孢腔菌目(Pleosporales)。
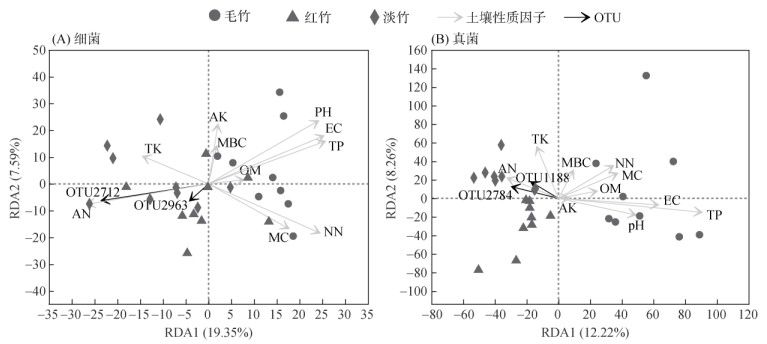
2.4 不同竹林土壤微生物群落与土壤性质之间的联系通过对12个土壤性质因子(pH、EC、OM、TN、AN、NN、TP、AP、TK、AK、MBC、MC)进行共线性分析,剔除2个共线性高的土壤指标(TN、AP),然后进行RDA分析,结果发现,在OTU水平上土壤因子解释了26.94% 细菌群落的变化(图 6A),其中pH(R2=0.579)、NN(R2=0.501)、EC(R2=0.498)、TP(R2=0.475)、AN(R2=0.414)、MC(R2=0.308)、AK(R2=0.233)和MBC(R2=0.09)与细菌群落分布显著相关(表 1)。土壤因子对真菌群落变异的解释度为20.48%(图 6B),其中TP(R2=0.68)、EC(R2=0.318)和TK(R2=0.258)与真菌群落分布显著相关(表 1)。从图 6中还可以看出,大部分土壤因子如pH、EC、OM、TN、NN、TP、AP、AK、MBC和MC均与竹林土壤细菌和真菌丰度占比前二的OTU呈不同程度负相关性,TK和AN则与其呈正相关性。
|
图 6 OTU水平上三种竹林土壤细菌和真菌与土壤理化指标RDA分析 Fig. 6 RDA analysis of soil bacteria and fungi with soil physiochemical indexes at OUT levels under three bamboo forests |
|
|
表 1 土壤理化指标与土壤微生物相关性 Table 1 Correlation between soil physiochemical indexes and soil microorganisms |
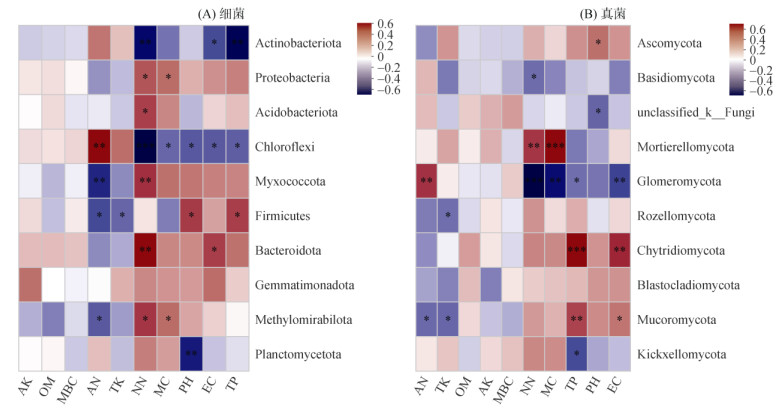
土壤因子与物种之间的heatmap图显示了某一理化指标与某一微生物群落的相关性,其中NN、EC和TP与放线菌门相对丰度呈显著负相关,NN和MC与变形菌门相对丰度呈显著正相关,NN与放线菌门相对丰度呈显著正相关,NN、MC、pH、EC和TP与绿弯菌门相对丰度呈显著负相关,AN与绿弯菌门相对丰度呈显著正相关(图 7A)。对于真菌群落,pH与子囊菌门相对丰度呈显著正相关,NN与担子菌门相对丰度呈显著负相关,NN和MC与被孢霉门(Mortierellomycota)相对丰度呈显著正相关,NN、MC、TP和EC与球囊菌门(Glomeromycota)相对丰度呈显著负相关(图 7B)。
|
图 7 门水平上3种竹林土壤细菌和真菌与土壤理化指标相关性 Fig. 7 Correlation of soil bacteria and fungi with soil physiochemical indexes at phylum levels under three bamboo forests |
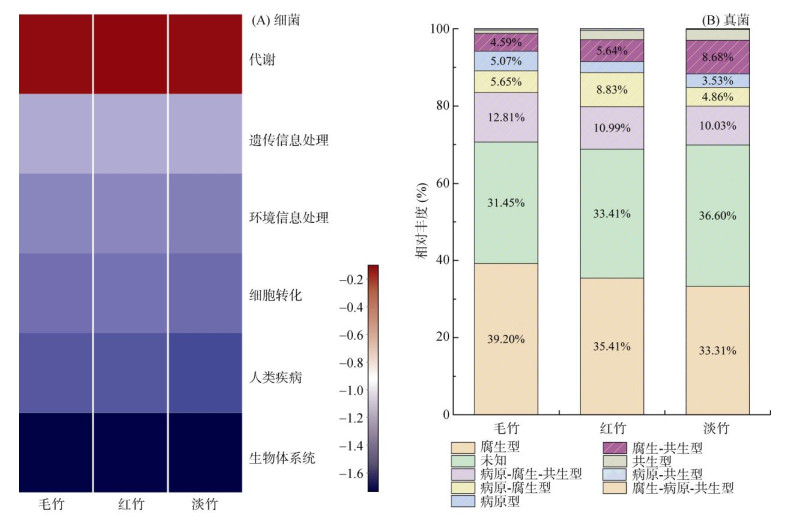
PICRUST分析将竹林土壤细菌分为6个一级功能层,其中代谢功能占绝对优势,相对丰度占比达到78.7% ~ 79.2%,其次是遗传信息处理功能占6.65% ~ 6.80%、环境信息处理功能占4.80% ~ 5.04%、细胞转化功能占4.07% ~ 4.21%、人类疾病功能占3.18% ~ 3.40% 和生物体系统功能占1.84% ~ 1.87%(图 8A)。
|
图 8 三种竹林土壤细菌PICRUSt2和真菌FUNGuild功能预测 Fig. 8 Functional prediction of soil bacteria PICRUSt2 and FUNGuild under three bamboo forests |
根据FUNGuild功能预测将竹林土壤真菌根据营养型分为腐生型、未知、病原–腐生–共生型、病原–腐生型、病原型、腐生–共生型、共生型、病原–共生型、腐生–病原–共生型9类。其中腐生型为最主要营养型,其在毛竹林、红竹林和淡竹林土壤的丰度占比分别为39.20%、35.41% 和33.31%(图 8B)。
3 讨论 3.1 不同景观竹林土壤中微生物多样性与群落组成α多样性是反映微生物群落结构的重要指标,3种竹林土壤中毛竹林土壤细菌Sobs指数和Shannon指数均显著高于其他两种竹林,毛竹林和红竹林土壤真菌Sobs指数高于淡竹林土壤,但3种竹林土壤真菌Shannon指数并无显著性差异,这表明不同竹林对细菌群落的构成和丰度具有很大影响,对真菌丰富度有影响但对多样性的影响较小。造成这种情况的原因可能和不同竹林的郁闭度有关。毛竹林密度较小,林内受光面积大使得林内土壤温度较高,而淡竹林则相反,由于微生物对土壤温度变化敏感[11],所以这种密度差异会一定程度影响竹林内细菌的增殖。此外,毛竹林土壤氮、磷和有机质等含量高,养分较充足,利于微生物增殖。
不同植物类型能改变土壤微生物所处环境,进而使微生物群落构成不同[12]。本研究发现,不同竹林土壤细菌和真菌的群落构成均具有显著差异。如放线菌门(Actinobacteriota)在淡竹林土壤中的丰度显著性高于毛竹林土壤,这是由于放线菌门在土壤中通常参与降解植物木质素和转化果胶与纤维素[13],两种竹林密度差异较大,淡竹林的高密度造成丰富的凋落物覆盖和更密的根系组织,使得土壤中植物纤维的含量升高,进而造成放线菌门数量增加。此外放线菌门还具有解磷作用,毛竹林土壤磷含量显著高于淡竹林土壤,这可能是放线菌门的丰度差异造成的。变形菌门(Proteobacteria)在毛竹林土壤中的含量显著高于淡竹林土壤,其下主要包含α-变形菌纲(Alphaproteobacteria)和γ-变形菌纲(Gammaproteobacteria)两个菌纲,α-变形菌纲在这两种竹林土壤中无显著差异,γ-变形菌纲在毛竹林土壤中丰度最高,且显著高于其他竹林。这可能是因为毛竹林土壤磷含量显著高于其他竹林土壤,而γ-变形菌纲中的部分细菌对土壤中难溶性磷酸盐有溶解作用[14]。同时γ-变形菌纲包含许多与动物排泄有关的病原菌,毛竹林较为宽松的立柱密度可能适合某些小动物或鸟类的生存活动,使得微生物群落构成变得复杂。绿弯菌门(Chloroflexi)是一类寡营养型细菌,喜欢在贫瘠的土壤中生存[15],其在营养较高的毛竹林土壤中含量最低,符合其寡营养型的特点。
竹林土壤真菌以子囊菌门(Ascomycota)为优势门,子囊菌门广泛存在于土壤中,多为腐生菌,是土壤中重要的分解者,可以降解土壤中复杂的有机质和难以分解的纤维素,在养分循环中扮演着关键作用[16],竹林环境中大量的鞭根与落叶可以给其提供良好的身存环境。同时子囊菌门中存在有许多能引起植物病害的病原菌,可以引起根腐、茎腐、果(穗)腐和枝枯等病害,在进行竹林养护和林下植物配植时应对此进行充分考虑。有研究表明,土壤性质与微生物会对林内植物造成许多直接或间接的影响[17],不同竹林内的土壤微环境可能会对竹林后续生长以及林内植物产生影响。在后续研究中,针对3种竹林选择了具有观赏性与经济价值的兰科植物白及进行林下种植,发现不同竹林下白及生长差异显著,这除受竹林光照条件差异的影响外,还可能与不同竹林下土壤性质与微生物群落密切相关。
3.2 土壤理化性质对微生物群落组成的影响微生物群落会根据土壤养分变化产生不同响应。本研究中,在OTU水平上26.94% 和20.48% 的土壤细菌和真菌群落的变化是由所选择的土壤理化指标解释的,解释度偏低可能是因为土壤微生物在OTU水平上分类单元较多,变化规律复杂,同时微生物的变化受到土壤、光照和林内温湿度等多方面的影响,所选因子不能完全解释其变化造成的。所选因子中pH、硝态氮、电导率、全磷、铵态氮、含水率、速效钾和微生物生物量碳对土壤细菌群落影响显著,全磷、电导率和全钾对土壤真菌群落影响显著,但显著程度不同,这是由于微生物种群对土壤养分变化的响应不同所导致的。相比于竹林土壤真菌,土壤细菌对土壤养分变化的反应更为敏感。
在不同的土壤中,土壤pH一般和细菌群落的变化相关性较强[18]。在本研究中,不同竹林土壤pH没有显著的变化,但是通过RDA分析可以看到,pH对细菌群落的组成有显著影响,如和绿弯菌门相对丰度显著负相关,和厚壁菌门(Firmicutes)相对丰度显著正相关,真菌对于pH的变化则没有表现出如同细菌一样的敏感反应。此外,本研究结果表明,细菌群落构成与土壤含水量相关性强,而真菌群落构成与含水量相关性很小,这与真菌对干燥环境的抵抗力普遍较强的研究一致[19]。全磷对于土壤细菌和真菌群落组成均有显著影响,说明磷元素在建立土壤微生物群落中具有重要意义。氮元素的转化一直是土壤微生物研究的重要部分,本研究中竹种的改变对于竹林土壤铵态氮和硝态氮含量并没有显著影响,但铵态氮和硝态氮含量的一些差异却显著影响了土壤中细菌群落的组成,土壤铵态氮含量与绿弯菌门相对丰度呈显著正相关,与粘球菌门(Myxococcota)相对丰度呈显著负相关,而硝态氮则恰好相反,且与其他相对丰度更高的菌门呈现相关关系,土壤细菌对于硝态氮含量更为敏感。土壤真菌对于其变化的响应也有不同,如硝态氮含量与相对丰度占比前二的真菌OUT丰度呈负相关性,铵态氮含量则与其呈正相关性等。这些结果说明细菌和真菌对于氮的影响有其特殊的机制。
3.3 竹林土壤微生物功能预测PICRUSt分析将竹林土壤细菌功能基因分为6大类,可以看出,3种竹林土壤细菌功能差异较小,代谢通路所涉及的土壤细菌相对丰度近80% 占绝对优势,这与其他植物对土壤细菌功能研究有所不同,如丁钰珮等[20]对呼伦贝尔沙地樟子松人工林土壤细菌代谢功能预测,发现其相对丰度占比为26.43%,高嵩等[21]对龙胆草根际土壤细菌功能预测发现其代谢功能占比近50%。竹林土壤代谢功能基因相对丰度高,说明竹林土壤代谢能力强,对养分的吸收利用率高。在竹林土壤微生物代谢2级通路中,最重要的有碳水化合物和氨基酸代谢。其中,碳水化合物代谢主要与固氮、溶磷等作用密切相关,氨基酸代谢主要与植株氮素的循环息息相关[22],这说明竹林土壤细菌的优势功能主要集中在碳、氮两种元素的分解转化,这和竹林土壤中放线菌门、变形菌门的优势丰度也相契合。
对竹林土壤真菌进行FUNGuild功能预测,将竹林土壤按营养型分为9类,腐生真菌是竹林土壤里最重要的营养型,这可能是因为子囊菌门在土壤真菌组成中占比最高造成的。此外,腐生真菌下的细分Guild中以未分类的腐生真菌占多数,这说明子囊菌门和腐生营养型真菌在土壤中的作用还有待进一步发掘和研究。毛竹林腐生真菌占比略高于淡竹林和红竹林也符合毛竹林土壤子囊菌门占比最大的结果,并且该结果可能对毛竹林土壤氮、磷和有机质等的积累有积极作用。
4 结论竹林类型显著影响林下土壤性质,其中毛竹林土壤氮、磷和有机质等积累优势显著,电导率高。不同竹林类型下土壤细菌和真菌的群落组成具有差异,放线菌门(Actinobacteriota)、绿弯菌门(Chloroflexi)在淡竹林土壤中的相对丰度最高,且显著高于其他竹林,而变形菌门(Proteobacteria)、粘球菌门(Myxococcota)的相对丰度在毛竹林土壤中最高;土壤真菌优势门在各竹林土壤间的差异并不显著。土壤细菌对于所选土壤指标变化的响应更加敏感。竹林土壤细菌代谢功能最为活跃,有利于促进植物对养分的吸收和利用;土壤真菌中腐生营养型占比最高。综上,小规模景观竹林会对土壤性质与土壤微生物造成显著影响,这一结果可能会进而影响竹林以及林内植被的生长,以后在进行竹林景观建设中应尤其注意竹林、土壤以及林下植物的互作关系,科学配置。
| [1] |
Ye R W, Thomas S M. Microbial nitrogen cycles: Physiology, genomics and applications[J]. Current Opinion in Microbiology, 2001, 4(3): 307-312 DOI:10.1016/S1369-5274(00)00208-3 (  0) 0) |
| [2] |
蒋婧, 宋明华. 植物与土壤微生物在调控生态系统养分循环中的作用[J]. 植物生态学报, 2010, 34(8): 979-988 (  0) 0) |
| [3] |
吴昌明, 范少辉, 冯云, 等. 带状采伐对毛竹林土壤细菌群落结构的影响[J]. 中南林业科技大学学报, 2021, 41(7): 42-51 (  0) 0) |
| [4] |
王义祥, 翁伯琦, 黄毅斌. 土地利用和覆被变化对土壤碳库和碳循环的影响[J]. 亚热带农业研究, 2005, 1(3): 44-51 (  0) 0) |
| [5] |
刘雪晴. 竹子造景艺术在上海辰山植物园竹园改造中的设计应用[D]. 上海: 上海师范大学, 2016.
(  0) 0) |
| [6] |
赵天心, 毛新伟, 程敏, 等. 毛竹种植对土壤细菌和真菌群落结构及多样性的影响[J]. 应用生态学报, 2017, 28(11): 3740-3750 (  0) 0) |
| [7] |
王树梅, 王波, 范少辉, 等. 带状采伐对毛竹林土壤细菌群落结构及多样性的影响[J]. 南京林业大学学报(自然科学版), 2021, 45(2): 60-68 (  0) 0) |
| [8] |
翟婉璐, 钟哲科, 高贵宾, 等. 覆盖经营对雷竹林土壤细菌群落结构演变及多样性的影响[J]. 林业科学, 2017, 53(9): 133-142 (  0) 0) |
| [9] |
胡娇丽, 周昌平, 黄云峰. 观光型竹类植物专类园改造提升与景观营建[J]. 竹子学报, 2017, 36(3): 90-94 (  0) 0) |
| [10] |
鲁如坤. 土壤农业化学分析方法[M].
中国农业科技出版社, 北京, 2000
(  0) 0) |
| [11] |
曾宪礼. 皖南毛竹林带状采伐恢复特征及影响因子研究[D]. 北京: 中国林业科学研究院, 2019.
(  0) 0) |
| [12] |
Wen X Y, Dubinsky E, Wu Y, et al. Wheat, maize and sunflower cropping systems selectively influence bacteria community structure and diversity in their and succeeding crop's rhizosphere[J]. Journal of Integrative Agriculture, 2016, 15(8): 1892-1902 (  0) 0) |
| [13] |
Kirby R. Actinomycetes and lignin degradation[J]. Advances in Applied Microbiology, 2005, 58: 125-168 (  0) 0) |
| [14] |
Juhnke M E, Mathre D E, Sands D C. Identification and characterization of rhizosphere-competent bacteria of wheat[J]. Applied and Environmental Microbiology, 1987, 53(12): 2793-2799 (  0) 0) |
| [15] |
Fierer N, Bradford M A, Jackson R B. Toward an ecological classification of soil bacteria[J]. Ecology, 2007, 88(6): 1354-1364 (  0) 0) |
| [16] |
杨寅, 邱钰明, 王中斌, 等. 重度火烧迹地兴安落叶松(Larix gmelinii)根际土壤真菌群落研究[J]. 生态学报, 2021, 41(23): 9399-9409 (  0) 0) |
| [17] |
苗原, 刘啸林, 王敏, 等. 火烧和氮沉降条件下土壤微生物对林下植被动态影响的研究进展[J]. 河南师范大学学报(自然科学版), 2021, 49(6): 19-23, 2 (  0) 0) |
| [18] |
Tripathi B M, Stegen J C, Kim M, et al. Soil pH mediates the balance between stochastic and deterministic assembly of bacteria[J]. The ISME Journal, 2018, 12(4): 1072-1083 (  0) 0) |
| [19] |
Wang J, Liu G B, Zhang C, et al. Higher temporal turnover of soil fungi than bacteria during long-term secondary succession in a semiarid abandoned farmland[J]. Soil and Tillage Research, 2019, 194: 104305 (  0) 0) |
| [20] |
丁钰珮, 杜宇佳, 高广磊, 等. 呼伦贝尔沙地樟子松人工林土壤细菌群落结构与功能预测[J]. 生态学报, 2021, 41(10): 4131-4139 (  0) 0) |
| [21] |
高嵩, 孙文松, 温健, 等. 连作龙胆草根际土壤细菌多样性及功能预测分析[J]. 沈阳农业大学学报, 2021, 52(1): 102-108 (  0) 0) |
| [22] |
杨盼, 翟亚萍, 赵祥, 等. 丛枝菌根真菌和根瘤菌互作对苜蓿根际土壤细菌群落结构的影响及PICRUSt功能预测分析[J]. 微生物学通报, 2020, 47(11): 3868-3879 (  0) 0) |
2. Plant Conservation Center of East China Wild and Endangered Resources, Shanghai Chenshan Botanical Garden, Shanghai 201602, China
 2022, Vol. 54
2022, Vol. 54


