土壤有机碳(SOC)的稳定性是指其抵抗微生物降解的能力[1],它极大地影响着碳的循环和周转,对碳的固存、储量及其变化起着直接决定性的作用[2]。草地是世界上分布最广的植被类型之一,覆盖了全球40% 陆地面积,存储了陆地生态系统中34%的碳,在全球碳循环中扮演着重要的角色[3]。其中,土壤是草地生态系统碳储量的主要载体。因此,研究草地生态系统中SOC稳定性的变化及其影响因素,对全球碳循环、气候变化及其两者之间相互作用的研究具有重要意义[4]。
灌丛化是指灌木的盖度、密度和生物量在草地中显著增加,使得没有灌丛出现的纯草地转变为灌丛化草地的一种现象[5-7]。引起灌丛化可能的原因有气候变暖、氮沉降、CO2浓度增加、过度放牧和火烧等[8]。灌丛化在过去的150年间,在全球草地,特别是干旱区半干旱区草地中被广泛报道[8]。全球草地约有10% ~ 20% 的面积发生了灌丛化,遍布于非洲、美洲、大洋洲、亚洲以及欧洲地中海沿岸国家和地区[5]。在中国,灌丛化现象也有大量报道[9-11],其中锦鸡儿是最为常见的灌丛化植物[12]。灌丛化会造成草地生态系统功能的改变[6]。其中,在固碳功能上,灌丛化通过改变有机质输入的数量和质量及其分解累积的因素而显著影响SOC的储量[13]。基于灌丛化现象在草地中的普遍性,研究灌丛化对SOC稳定性的影响将有助于深入了解这种现象以及草地生态系统在未来碳循环中可能的影响。
在SOC稳定性及其变化的评价方法上,室内培养法通过控制温度和水分条件模拟SOC在自然条件下的分解过程,可以直观地评价SOC的稳定性,但是因为室内培养法的时间有限,不能完整地测定SOC稳定性[14]。除此之外,评价SOC稳定性常用的还有物理和化学分组法。这些方法是将SOC划分为稳定性不同的组分,通过各组分所占的比例来评价SOC稳定性及其变化。物理法包括颗粒大小分组法和密度分组法或这两种方法的结合[15-16]。化学分组法根据SOC对水、酸或碱的溶解程度或氧化性来进行分组[17]。但是,有研究发现,这些分组方法并不能很准确地反映SOC的稳定性,例如,易被稀酸氧化的SOC组分并不能代表易被微生物分解的那部分SOC[18]。
固态13C核磁共振(13C NMR)技术可以在分子水平上确定SOC的化学结构,通过不同类型碳组分的比例确定SOC的稳定性程度[19]。大部分SOC的核磁共振谱图都包含4个明显共振区:烷基碳区(δ= 0 ~ 45)、烷氧碳区(δ=45 ~ 110)、芳香碳区(δ=110 ~ 160)和羰基碳区(δ=160 ~ 220)[20]。烷氧碳是最易分解的官能团;烷基碳则是抗分解SOC官能团,不易受到外源SOC的影响[21]。烷基碳/烷氧碳的比值能够反映SOC的分解程度,比值较高说明SOC的分解程度较高,不易再分解;比值较低则说明SOC还具备很大的分解潜力[19]。
热分析方法,包括热重分析(TG)和差示扫描量热分析(DSC)也是近些年来间接评价SOC稳定性的新方法。TG法和DSC法分别能够反映在热反应中样品的质量和能量的动态变化,可以完整地测定SOC稳定性,弥补室内测定法的不足[22]。热分析法综合了燃烧过程中SOC分子内键的断裂以及SOC与矿物表面结合键在断裂时的能量输入和产出[23]。在高温下才能燃烧氧化的SOC组分难以被微生物分解,因此具有很高的生物稳定性;反之亦然[23]。在TG法中,热易分解的SOC质量(较低温度下分解的SOC)与SOC总质量的比值(%Exo1)或SOC分解一半时的温度(TG-T50)可以用来表征SOC稳定性及其变化;在DSC法中,SOC在能量释放一半时对应的温度(DSC-T50)或能量密度(ED,燃烧SOC的能量变化值与SOC质量之比)用来衡量SOC的稳定性及其变化。
新疆属于典型的干旱半干旱气候区,其独特的“三山夹两盆”的地貌格局使得气候、土壤和植被沿海拔规律性地变化,相应地也形成了从温性荒漠到山地草甸不同类型的草地[24]。除草本植物外,灌丛是新疆草地中常见的植被成分。本研究在天山北坡东段,选取沿海拔梯度分布的4类草地,使用13C NMR技术与TG-DSC法,对SOC化学结构和热稳定性进行研究,目的在于:①通过对比不同类型草地,揭示干旱区草地SOC的化学结构和热稳定性沿海拔(从温性荒漠到山地草甸)的变化规律;②尽管目前缺少用于了解灌丛盖度发生变化的文献记录、连续监测数据、航空照片和遥感图像[11],还不能判断新疆草地的灌丛化进程,但是通过对比现有的灌丛间空地和灌丛下土壤,能揭示(若新疆草地已经历了灌丛化)或预测(若新疆草地还未经历灌丛化)灌丛化对干旱区草地SOC化学结构和热稳定性的影响;③通过分析SOC的热稳定性与SOC化学结构之间的关系,阐明两类方法在评价SOC稳定性上的联系。
1 材料与方法 1.1 研究区概况研究区位于新疆天山北坡东段,该区域属于典型的大陆性干旱半干旱气候,降水稀少而蒸发强烈,年平均气温约为3℃,年降水量为46.1 ~ 508.7 mm,年蒸发量为1 241.7 ~ 2 046.7 mm,无霜期为121d。
1.2 样品采集本研究在天山北坡中东段选取沿海拔梯度分布的4类草地作为研究样地,即温性荒漠(temperate desert,TD)、温性草原化荒漠(temperate steppe desert,TSD)、温性荒漠草原(temperate desert steppe,TDS)和山地草甸(mountainous meadow,MM)(图 1),前3类以下简称荒漠、草原化荒漠和荒漠草原。从荒漠到山地草甸,年均降水量和土壤全氮含量逐渐增加,而年均气温和土壤pH逐渐减小,土壤类型沿海拔的增加依次为棕钙土、粟钙土和草甸土(表 1)。4类草地中常见的灌丛植物为草原锦鸡儿和黄蔷薇(表 1)。在每类草地中,选择10株成年、基径最大且基本一致的灌木,以使灌丛化的影响达到最大。在每株灌丛冠幅边缘的东南西北4个方向与灌木基径的中点位置采集土壤样品,将5个方位采集的土样混合为一个土样(即灌丛下土样)。另设置10个灌丛斑块间采样位置(即灌丛间土样),此位置离最近的灌丛距离超过40 cm,以避免邻近灌丛的影响。土壤取样深度为0 ~ 10 cm,取回的土样剔除根系等杂质自然风干后,一部分用于SOC含量等理化性质的测定,另一部分用于TG-DSC法和13C NMR技术分析。

|
图 1 4类草地灌丛下与灌丛间SOC的13C NMR谱图 Fig. 1 13C NMR spectra of SOC under shrubs and interspaces in four grassland types |
|
|
表 1 4类草地的基本信息 Table 1 Description of basic characteristics of four grassland types |
SOC含量的测定:取30 g风干土样过120目筛后,用盐酸去除无机碳(SIC),置于70℃烘箱中烘至恒重后,使用元素分析仪(EuroEA3000,德国)测定SOC含量[25]。
SOC化学结构分析:取5 g风干土样过100目筛后,置于离心管中,加入50 ml 10% HF溶液,振荡1 h,3 000 r/min离心10 min,移去上清液,继续用HF处理,共处理8次,振荡时间分别为4次1 h,3次12 h,1次24 h。HF处理完毕后,用20 ml蒸馏水将离心管中土样洗至中性(5 ~ 6次),冷冻干燥后用球磨仪(RetschMM500,德国)粉碎过120目筛,然后使用核磁共振仪(BrukerAV400MHz,瑞士)进行分析。
SOC热稳定性分析:取30 mg风干土样过100目筛后,使用TG-DSC联合分析仪(NetzschSTA409PC,德国)进行分析。
1.4 数据处理SOC中各类型官能团含量的相对比例:通过对13C NMR谱峰曲线的相应区域积分获得。
表征SOC热稳定性强弱的指标在TG法中为%Exo1和TG-T50,在DSC法中为DSC-T50和ED。%Exo1、DSC-T50和ED值越低,TG-T50值越高,表明SOC热稳定性越高。此外,在DSC法中,还可以用热分解能力不同的SOC燃烧释放出的能量占总的放热能量(Q)的比值来表征SOC的热稳定性。总的放热能量Q(J)通过在200 ~ 650℃的放热区域内对DSC曲线进行积分来获得。PQ1(200 ~ 375℃)、PQ2(375 ~ 475℃)和PQ3(475 ~ 550℃)分别为不稳定SOC(包括碳水化合物和其他脂肪族化合物)、难降解SOC(包括木质素或其他多酚)和高难度降解SOC(如腐殖酸、腐殖质、黑炭等)燃烧释放能量(温度区间内的DSC曲线积分)占总燃烧能量(Q)的百分比[26]。
在不同类型草地间以及不同类型草地的灌丛间和灌丛下,对SOC含量和热分析指标%Exo1、TG-T50、ED、DSC-T50、PQ1、PQ2和PQ3利用最小显著性差异(LSD)法进行差异性比较。
2 结果与分析 2.1 灌丛化对草地SOC化学结构的影响13C NMR谱图(图 1)显示,灌丛下SOC主要由易降解的官能团烷氧碳(δ=45 ~ 110)和3个较难降解的官能团即烷基碳(δ=0 ~ 45)、芳香碳(δ=110 ~ 160)及羰基碳(δ=160 ~ 220)组成。烷氧碳占的比例最大为36.52% ~ 53.60%;其次为烷基碳和芳香碳,分别为22.35% ~ 37.05% 和10.82% ~ 29.53%;羰基碳占比例最小,为4.71% ~ 11.36%(表 2)。
|
|
表 2 4类草地灌丛下与灌丛间SOC各官能团相对含量(%) Table 2 Relative contents of different functional groups of SOC under shrubs and interspaces in four grassland types |
灌丛间芳香碳的比例沿海拔梯度从温性荒漠到山地草甸而降低,灌丛下芳香碳的比例沿海拔梯度没有明显变化;其他官能团的比例沿海拔梯度的变化不明显。
相比灌丛间,在荒漠中,灌丛下烷氧碳的相对含量减少3.30个百分点,而芳香碳增加2.89个百分点;在草原化荒漠中,灌丛下烷基碳和烷氧碳分别增加8.25个百分点和3.51个百分点,芳香碳和羰基碳分别减少12.24个百分点和3.03个百分点;在荒漠草原中,灌丛下烷基碳、烷氧碳和芳香碳分别增加2.76个百分点和1.18个百分点,羰基碳减少2.76个百分点;在山地草甸中,灌丛下烷氧碳减少14.50个百分点,芳香碳增加8.65个百分点(表 2)。在4类草地中,灌丛下相比于灌丛间,烷基碳/烷氧碳比值均有增加,在荒漠、草原化荒漠、荒漠草原和山地草甸,分别增加0.10、0.09、0.03、0.21。
2.2 灌丛化对草地SOC热稳定性的影响 2.2.1 TG法TG曲线是指在燃烧过程中,样品质量的损失量占总质量的比例随温度变化的曲线。在TG曲线中,在200 ~ 550℃损失的质量被认为是SOC的质量[22],550 ℃后损失的为SIC和土壤中顽固的物质[27]。灌丛下和灌丛间SOC样品损失的相对质量在荒漠中分别为4.38% 和5.09%(图 2A),在草原化荒漠中为3.79% 和2.13%(图 2B),在荒漠草原中为14.98% 和5.59%(图 2C),在山地草甸中为22.87% 和13.99%(图 2D)。

|
图 2 4类草地灌丛下与灌丛间土壤的TG曲线 Fig. 2 TG curves of soils under shrubs and interspaces in four grassland types |
荒漠草原和山地草甸的SOC含量显著高于荒漠和草原化荒漠(图 3A);在荒漠和草原化荒漠中,灌丛间和灌丛下SOC含量没有显著差异;在荒漠草原和山地草甸中,灌丛下SOC含量相比灌丛间分别增加了27.95% 和23.54%(图 3A)。TG曲线中土壤样品的损失量与元素分析仪测定的SOC含量极显著相关(P < 0.01)(图 3B),说明SOC含量越高,TG曲线中200 ~ 550 ℃损失的有机碳越多。
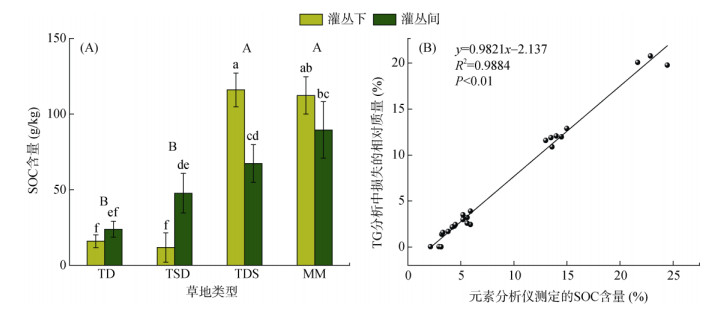
|
(图中小写字母不同表示不同类型草地灌丛下及灌丛间的SOC含量差异显著(P < 0.05);大写字母不同表示不同草地类型之间SOC平均含量差异显著(P < 0.05);下同。) 图 3 元素分析仪测定的4类草地灌丛下与灌丛间的SOC含量(A)及其与TG法中土壤SOC损失量的相关性(B) Fig. 3 SOC contents measured by element analyzer under shrubs and interspaces in four grassland types (A) and correlation with soil SOC loss quality in TG analysis (B) |
TG-T50为从草原化荒漠(430.22 ℃)、荒漠(409.17 ℃)、荒漠草原(368.86 ℃)到山地草甸(350.36 ℃)依次降低(图 4A);山地草甸的%Exo1(67.71%)显著高于荒漠(45.71%)、草原化荒漠(40.54%)和荒漠草原(58.85%),而草原化荒漠与荒漠之间没有明显差异(图 4B)。在荒漠中,%Exo1和TG-T50在灌丛下(分别为48.32% 和405.58 ℃)与灌丛间(为43.11% 和412.76 ℃)没有明显差异;在草原化荒漠、荒漠草原和山地草甸中,灌丛下的TG-T50(分别为439.13、382.75和359.85 ℃)显著高于灌丛间(分别为411.31、354.91和340.87 ℃);在草原化荒漠和山地草甸,灌丛下的%Exo1(分别为33.91% 和61.36%)显著低于灌丛间(分别为47.18% 和73.07%) (图 4)。
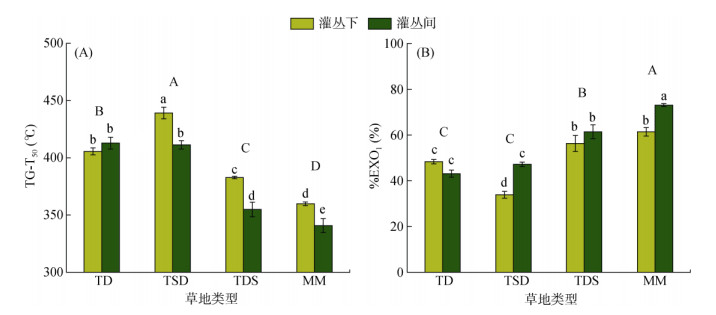
|
图 4 4类草地灌丛下和灌丛间土壤的TG-T50(A)和%Exo1(B) Fig. 4 TG-T50 (A) and %Exo1 (B) of soils under shrubs and interspaces in four grassland types |
DSC曲线反映了样品燃烧能量的变化(图 5)。在0 ~ 200℃,能量为负值,是因为土壤中水分蒸发吸收了热量;> 200℃,能量为正值,是由于SOC燃烧产生的放热反应。
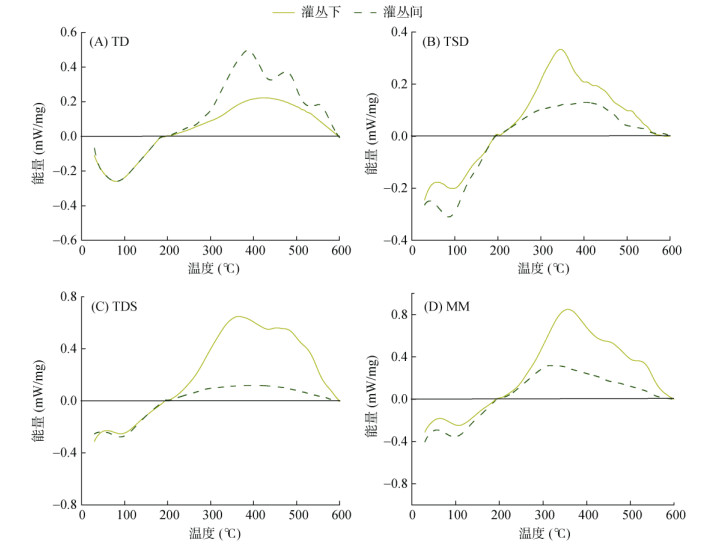
|
图 5 4类草地灌丛下与灌丛间土壤的DSC曲线 Fig. 5 DSC curves of soils under shrubs and interspaces in four grassland types |
荒漠草原的Q值(169.13 J)显著高于荒漠(70.83 J)和草原化荒漠(41.55 J),而与山地草甸(113.03 J)没有显著差异(图 6A);PQ1在草原化荒漠(51.07%)和山地草甸(50.06%)显著高于荒漠(30.30%)和荒漠草原(35.77%)(图 6B);荒漠的PQ2(42.79%)显著高于草原化荒漠(36.36%)、荒漠草原(35.86%)和山地草甸(32.96%),而草原化荒漠和荒漠草原没有显著差异(图 6C);荒漠(20.60%)和荒漠草原(20.84%)的PQ3显著高于草原化荒漠(10.72%)和山地草甸(13.12%)(图 6D)。在荒漠中,灌丛下的Q值和PQ1(分别为49.93 J和29.04%)显著低于灌丛间(分别为91.74 J和36.57%),而灌丛下PQ3(22.74%)显著高于灌丛间(18.45%)(图 6D);在草原化荒漠、荒漠草原和山地草甸,灌丛下Q值(分别为54.94、233.21和164.09 J)显著高于灌丛间(分别为28.17、105.05和61.91 J),并且灌丛下PQ1(分别为47.83%、25.51% 和42.11%)显著低于灌丛间(分别为56.31%、43.03% 和55.01%),而草原化荒漠和山地草甸灌丛下PQ2(分别为34.16% 和30.78%)显著低于灌丛间(分别为38.56% 和35..13%),荒漠草原和山地草甸灌丛下PQ3(分别为26.31% 和14.86%)显著高于灌丛间(分别为15.38% 和11.38%)(图 6B ~ 6D)。

|
图 6 4类草地灌丛下与灌丛间土壤的Q(A)、PQ1(B)、PQ2(C)和PQ3(D) Fig. 6 Q(A), PQ1(B), PQ2 (C) and PQ3 (D) of soils under shrubs and interspaces in four grassland types |
山地草甸(26.60 J/mg)的ED值显著低于荒漠(39.04 J/mg)和荒漠草原(34.25 J/mg),而与草原化荒漠(41.49 J/mg)没有显著差异(图 7A);荒漠(415.69℃)和草原化荒漠(416.61℃)DSC-T50高于荒漠草原(368.56℃)和山地草甸(369.27℃)(图 7B)。在荒漠、草原化荒漠和山地草甸中,灌丛下的ED值(分别为27.08、32.54和14.18J/mg)显著低于灌丛间(分别为51.01、35.95和39.02 J/mg);在草原化荒漠、荒漠草原和山地草甸中,灌丛下的DSC-T50(分别为388.51、357.89和358.02℃)显著低于灌丛间(分别为444.72、376.23和380.52℃)(图 7)。
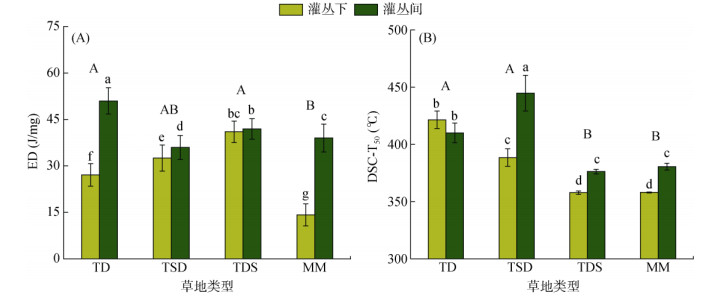
|
图 7 4类草地灌丛下与灌丛间土壤的ED和DSC-T50 Fig. 7 ED and DSC-T50 of soils under shrubs and interspaces in four grassland types |
TG-T50、DSC-T50与%Exo1之间显著相关(P < 0.05);ED与TG-T50、DSC-T50、%Exo1均无显著相关性;PQ1与DSC-T50、ED呈负相关;PQ2与%Exo1呈负相关,与TG-T50呈正相关;PQ3与TG-T50呈负相关,与DSC-T50呈正相关(表 3)。
|
|
表 3 热分析指标之间的相关性 Table 3 Correlation between indexes of thermal analysis |
TG-T50与烷氧碳相对含量呈显著负相关(P < 0.05);%Exo1与烷氧碳相对含量呈显著正相关(P < 0.05);DSC-T50与烷基碳相对含量呈显著的负相关(P < 0.05);ED与烷氧碳、烷基碳相对含量呈显著负相关(P < 0.01),而与芳香碳、羰基碳相对含量呈显著正相关(P < 0.05)。
PQ1与烷基碳相对含量呈显著正相关(P < 0.01),但与芳香碳、羰基碳相对含量呈显著负相关(P < 0.05);PQ2与烷氧碳相对含量呈显著负相关(P < 0.01),与芳香碳相对含量呈现显著正相关(P < 0.05);PQ3则与难降解官能团呈现了两种相反的相关关系,与烷基碳相对含量呈显著负相关(P < 0.01),而与羰基碳相对含量呈显著正相关(P < 0.01)。烷基碳/烷氧碳比值与DSC-T50、%Exo1呈显著负相关,与TG-T50呈显著正相关(P < 0.01)。
|
|
表 4 SOC官能团相对含量与热分析指标的相关性 Table 4 Correlation between relative contents of SOC functional groups and thermal analysis indexes |
以往的研究表明,在荒漠中灌丛主要通过根系吸收养分、微生物活动分解凋落物以及根系分泌物和根组织的脱落物的沉积等生物过程使得灌丛下土壤养分的含量增加,形成“肥岛”[11]。但在本研究中,在荒漠和草原化荒漠中,灌丛间和灌丛下的SOC含量差异不显著,没有发现“肥岛”现象,可能的原因是灌丛还受到非生物性限制要素的影响,如风、水等,这些因素复杂的交互作用使灌丛下有机质等养分的聚集受到限制[9]。
在SOC官能团的组成比例上,本研究与以往大多数的研究结果一致[28-30],即烷氧碳比例最高,其次为烷基碳和芳香碳,然后为羰基碳。SOC主要来源于植物残体,植物残体化学结构的相似是导致不同研究中SOC化学结构相似的原因[31]。烷氧碳是植物残体SOC的主要组成部分,因此烷氧碳比例最高[32]。在本研究中,随着海拔的升高,各类草地灌丛间土壤中芳香碳所占比例下降,这是由于气温降低,土壤酶活性和微生物活性减弱,减缓了土壤腐殖化作用[33]。Chen等[34]在台湾中部草地也发现土壤中芳香碳含量沿海拔降低,这是因为较高海拔地区较大的降雨量使得木质素的可溶性碎片在腐殖化过程中被滤出,导致输入SOC固定周期延长,从而较难形成稳定的芳香核结构。而在各类草地的灌丛下,芳香碳所占比例没有出现随海拔升高而降低的趋势,可能的原因是灌丛化出现。草原化荒漠中的烷基碳/烷氧碳比值较高,在灌丛下和灌丛间分别为0.72 ~ 0.81,而在荒漠草原中该值较低,灌丛下和灌丛间分别为0.51 ~ 0.54,其他类草地为0.44 ~ 0.81。以往的研究认为,当烷基碳/烷氧碳比值大于0.65时,说明土壤腐殖化程度较高,稳定性较大[34]。烷基碳/烷氧碳比值在不同类草地之间的差异可能与植被组成、土壤母质和气候条件有关[35]。
尽管在荒漠和草原化荒漠中,灌丛化并没有影响SOC的含量,但在这2类草地以及荒漠草原和山地草甸中,灌丛下的SOC的化学结构都不同于灌丛间,表明灌丛化改变了SOC的化学结构。在4类草地中,灌丛化均增加了烷基碳/烷氧碳的比值,表明灌丛化增加了SOC的腐殖化程度和化学结构稳定性[36]。在荒漠和山地草甸,可能的原因是灌丛凋落物与植物残体的输入,提高了土壤微生物对土壤中SOC的利用程度,大量烷氧碳被吸收利用,导致烷基碳/烷氧碳比值增加[34];在草原化荒漠、荒漠草原,可能的原因是灌丛凋落物与植物残体分解程度较低时会将部分有机物质(如角质、软木脂等)选择性保留,这类有机物质组成主要是烷基碳,导致烷基碳/烷氧碳比值增加。其他官能团的相对含量从灌丛间到灌丛下的变化也并不一致。例如,在山地草甸中,从灌丛间到灌丛下芳香碳和羧基碳相对含量增加,而在草原化荒漠中,芳香碳和羧基碳的相对含量降低。SOC化学结构从灌丛间到灌丛下的变化在不同类草地中不一致,可能是与不同类草地的气候条件、土壤类型、土壤质地,以及这些因素所导致的微生物种类、活性和代谢残体特征有关[37]。另外,灌丛物种的不同(在荒漠、草原化荒漠和荒漠草原为草原锦鸡儿,在山地草甸为蔷薇)所带来的凋落物和根系分泌物的数量和质量的不同也可能是在不同类草地中灌丛化导致SOC化学结构不同的原因之一[37]。
SOC热稳定性指标%Exo1、TG-T50和DSC-T50分析表明,低海拔的荒漠和草原化荒漠的SOC热稳定性高于高海拔的荒漠草原和山地草甸的。产生这一结果的原因可能是,土壤水分与土壤微生物活动以及土壤呼吸作用密切相关,通常土壤含水率较高的土壤,其土壤微生物对植物残体的分解作用相对较强[10],导致更多的植物残体被降解成不稳定的SOC进入土壤,从而降低了SOC热稳定性。另外,地下生物量的改变对SOC热稳定性也有一定的影响。随着海拔升高植物地下生物量输入会增加[38],地下细根生物量的增加一方面增加了土壤中有机物质的输入,导致了SOC含量的变化(图 3),另一方面根系分泌物(碳水化合物)和根组织的脱落物增加使有机质组成比例发生改变,易分解的有机质相对含量升高,因此SOC热稳定性减弱。
在草原化荒漠、荒漠草原和山地草甸中,灌丛下的%Exo1和DSC-T50均高于灌丛间,而TG-T50低于灌丛间,说明在这些类草地中,灌丛化增加了SOC热稳定性。基于本研究中,烷基碳/烷氧碳比值与DSC-T50、%Exo1和TG-T50具有较好的相关性,因此可以推测灌丛化增加了化学结构的稳定性是增加SOC热稳定性的一个主要原因。另外,在山地草甸中,灌丛化导致烷氧碳化合物含量减少,而羧基碳和芳香碳化合物含量增多也是灌丛化增加SOC热稳定性的一个原因。在荒漠中,尽管指标%Exo1、TG-T50和DSC-T50在灌丛下与灌丛间没有差异,但是PQ1减小而PQ3增加,也表明灌丛化增加SOC的热稳定性。
指标%Exo1、TG-T50和DSC-T50之间相关性较好,但这些指标与ED没有显著相关性。Barros等[27]在西班牙北部草地SOC热稳定性的研究中也发现,ED不能很好地判断SOC的热稳定性,这可能是因为热分析试验中包括了不同物质的高温分解以及能量的转化,而物质能量的释放十分复杂,如土壤中有机无机复合体结合时化学键的断裂会释放大量的能量,影响了ED数值的准确性。
已往的研究表明,13C NMR和热分析技术可以相互补充解释部分SOC稳定性的变化[23]。在本研究中,TG-T50与烷氧碳相对含量有显著的负相关性,DSC-T50与烷基碳相对含量有显著的负相关性,证实了SOC的热稳定性和其化学结构具有一致性。但是在本研究中,仍存在矛盾的相关关系,例如,难降解官能团烷基碳相对含量与PQ1呈显著正相关关系,与PQ3呈显著负相关关系。这可能是因为热分析数据变化和13C NMR化学位移区域之间的直接对应关系不一定完全匹配,如一些土壤中难降解的物质可以在DSC曲线的Q1区域产生燃烧峰。这在一定程度上说明了DSC可能会对SOC热稳定性做出错误的解释[27]。
4 结论灌丛化改变了干旱区草地SOC的化学结构,增加了SOC化学结构稳定性;处于较低海拔的草地的SOC热稳定性高于处于较高海拔的草地;灌丛化增加了干旱区草地SOC的热稳定性;13C NMR技术与TG、DSC技术可以相互补充来解释SOC稳定性的变化。
| [1] |
Gregorich E G, Gillespie A W, Beare M H, et al. Evaluating biodegradability of soil organic matter by its thermal stability and chemical composition[J]. Soil Biology and Biochemistry, 2015, 91: 182-191 DOI:10.1016/j.soilbio.2015.08.032 (  0) 0) |
| [2] |
Puissant J, Mills R T E, Robroek B J M, et al. Climate change effects on the stability and chemistry of soil organic carbon pools in a subalpine grassland[J]. Biogeochemistry, 2017, 132(1/2): 123-139 (  0) 0) |
| [3] |
White R P, Murray S, Rohweder M, et al. Pilot analysis of global ecosystems: Grassland ecosystems[J]. World Resources Institute, 2000, 4(06): 275 (  0) 0) |
| [4] |
van Auken O W. Shrub invasions of North American semiarid grasslands[J]. Annual Review of Ecology and Systematics, 2000, 31: 197-215 DOI:10.1146/annurev.ecolsys.31.1.197 (  0) 0) |
| [5] |
Archer S, Boutton T W, Hibbard K A. Trees in grasslands: Biogeochemical consequences of woody plant expansion—ScienceDirect[J]. Global Biogeochemical Cycles in the Climate System, 2001, 115-137 (  0) 0) |
| [6] |
Roques K G, O'Connor T G, Watkinson A R. Dynamics of shrub encroachment in an African savanna: Relative influences of fire, herbivory, rainfall and density dependence[J]. Journal of Applied Ecology, 2001, 38(2): 268-280 DOI:10.1046/j.1365-2664.2001.00567.x (  0) 0) |
| [7] |
D'Odorico P, Okin G S, Bestelmeyer B T. A synthetic review of feedbacks and drivers of shrub encroachment in arid grasslands[J]. Ecohydrology, 2012, 5(5): 520-530 DOI:10.1002/eco.259 (  0) 0) |
| [8] |
Zhang Z, Wang S P, Nyren P, et al. Morphological and reproductive response of Caragana microphylla to different stocking rates[J]. Journal of Arid Environments, 2006, 67(4): 671-677 DOI:10.1016/j.jaridenv.2006.03.015 (  0) 0) |
| [9] |
郑敬刚, 张本昀, 何明珠, 等. 灌丛化对贺兰山西坡草场土壤异质性的影响[J]. 干旱区研究, 2009, 26(1): 26-31 (  0) 0) |
| [10] |
高琼, 刘婷. 干旱半干旱区草原灌丛化的原因及影响-争议与进展[J]. 干旱区地理, 2015, 38(6): 1202-1212 (  0) 0) |
| [11] |
蔡文涛, 来利明, 李贺祎, 等. 草地灌丛化研究进展[J]. 应用与环境生物学报, 2016, 22(4): 531-537 (  0) 0) |
| [12] |
Peng H Y, Li X Y, Li G Y, et al. Shrub encroachment with increasing anthropogenic disturbance in the semiarid Inner Mongolian grasslands of China[J]. CATENA, 2013, 109: 39-48 DOI:10.1016/j.catena.2013.05.008 (  0) 0) |
| [13] |
Jackson R B, Banner J L, Jobbágy E G, et al. Ecosystem carbon loss with woody plant invasion of grasslands[J]. Nature, 2002, 418(6898): 623-626 DOI:10.1038/nature00910 (  0) 0) |
| [14] |
Creamer C A, Filley T R, Boutton T W, et al. Controls on soil carbon accumulation during woody plant encroachment: Evidence from physical fractionation, soil respiration, and δ13C of respired CO2[J]. Soil Biology and Biochemistry, 2011, 43(8): 1678-1687 DOI:10.1016/j.soilbio.2011.04.013 (  0) 0) |
| [15] |
von Lützow M, Kögel-Knabner I, Ekschmitt K, et al. SOM fractionation methods: Relevance to functional pools and to stabilization mechanisms[J]. Soil Biology and Biochemistry, 2007, 39(9): 2183-2207 DOI:10.1016/j.soilbio.2007.03.007 (  0) 0) |
| [16] |
曾宏达, 杜紫贤, 杨玉盛, 等. 城市沿江土地覆被变化对土壤有机碳和轻组有机碳的影响[J]. 应用生态学报, 2010, 21(3): 701-706 (  0) 0) |
| [17] |
Sarkhot D V, Grunwald S, Ge Y, et al. Comparison and detection of total and available soil carbon fractions using visible/near infrared diffuse reflectance spectroscopy[J]. Geoderma, 2011, 164(1/2): 22-32 (  0) 0) |
| [18] |
Sun Y N, Huang S, Yu X C, et al. Differences in fertilization impacts on organic carbon content and stability in a paddy and an upland soil in subtropical China[J]. Plant and Soil, 2015, 397(1/2): 189-200 (  0) 0) |
| [19] |
Simpson A J, McNally D J, Simpson M J. NMR spectroscopy in environmental research: From molecular interactions to global processes[J]. Progress in Nuclear Magnetic Resonance Spectroscopy, 2011, 58(3/4): 97-175 (  0) 0) |
| [20] |
Leifeld J. Thermal stability of black carbon characterised by oxidative differential scanning calorimetry[J]. Organic Geochemistry, 2007, 38(1): 112-127 (  0) 0) |
| [21] |
郭素春, 郁红艳, 朱雪竹, 等. 长期施肥对潮土团聚体有机碳分子结构的影响[J]. 土壤学报, 2013, 50(5): 922-930 (  0) 0) |
| [22] |
赵龙华, 刘小粉, 王雅婧, 等. 基于热分析技术的土壤有机质含量和稳定性分析[J]. 农业工程学报, 2016, 32(10): 105-114 (  0) 0) |
| [23] |
Peltre C, Fernández J M, Craine J M, et al. Relationships between biological and thermal indices of soil organic matter stability differ with soil organic carbon level[J]. Soil Science Society of America Journal, 2013, 77(6): 2020-2028 (  0) 0) |
| [24] |
杨红飞, 刚成诚, 穆少杰, 等. 近10年新疆草地生态系统净初级生产力及其时空格局变化研究[J]. 草业学报, 2014, 23(3): 39-50 (  0) 0) |
| [25] |
王巧环, 任玉芬, 孟龄, 等. 元素分析仪同时测定土壤中全氮和有机碳[J]. 分析试验室, 2013, 32(10): 41-45 (  0) 0) |
| [26] |
Merino A, Ferreiro A, Salgado J, et al. Use of thermal analysis and solid-state 13C CP-MAS NMR spectroscopy to diagnose organic matter quality in relation to burn severity in Atlantic soils[J]. Geoderma, 2014, 226/227: 376-386 (  0) 0) |
| [27] |
Barros N, Salgado J, Villanueva M, et al. Application of DSC–TG and NMR to study the soil organic matter[J]. Journal of Thermal Analysis and Calorimetry, 2011, 104(1): 53-60 (  0) 0) |
| [28] |
Pisani O, Hills K M, Courtier-Murias D, et al. Molecular level analysis of long term vegetative shifts and relationships to soil organic matter composition[J]. Organic Geochemistry, 2013, 62: 7-16 (  0) 0) |
| [29] |
Mendham D S, Mathers N J, O'Connell A M, et al. Impact of land-use on soil organic matter quality in south-western Australia—characterization with 13C CP/MAS NMR spectroscopy[J]. Soil Biology and Biochemistry, 2002, 34(11): 1669-1673 (  0) 0) |
| [30] |
Faz Cano A, Mermut A R, Ortiz R, et al. 13C CP/MAS-NMR spectra of organic matter as influenced by vegetation, climate, and soil characteristics in soils from Murcia, Spain[J]. Canadian Journal of Soil Science, 2002, 82(4): 403-411 (  0) 0) |
| [31] |
Dungait J A J, Kemmitt S J, Michallon L, et al. Variable responses of the soil microbial biomass to trace concentrations of 13C-labelled glucose, using 13C-PLFA analysis[J]. European Journal of Soil Science, 2011, 62(1): 117-126 (  0) 0) |
| [32] |
Mahieu N, Randall E W, Powlson D S. Statistical analysis of published carbon-13 CPMAS NMR spectra of soil organic matter[J]. Soil Science Society of America Journal, 1999, 63(2): 307-319 (  0) 0) |
| [33] |
董玉清, 官鹏, 卢瑛, 等. 猫儿山不同海拔土壤有机碳组分构成及含量特征[J]. 土壤通报, 2020, 51(5): 1142-1151 (  0) 0) |
| [34] |
Chen J S, Chiu C Y. Characterization of soil organic matter in different particle-size fractions in humid subalpine soils by CP/MAS 13C NMR[J]. Geoderma, 2003, 117(1/2): 129-141 (  0) 0) |
| [35] |
商素云, 姜培坤, 宋照亮, 等. 亚热带不同林分土壤表层有机碳组成及其稳定性[J]. 生态学报, 2013, 33(2): 416-424 (  0) 0) |
| [36] |
卓苏能, 文启孝. 核磁共振技术在土壤有机质研究中应用的新进展(上)[J]. 土壤学进展, 1994, 22(5): 46-52 (  0) 0) |
| [37] |
Soucémarianadin L N, Erhagen B, Nilsson M B, et al. Two dimensional NMR spectroscopy for molecular characterization of soil organic matter: Application to boreal soils and litter[J]. Organic Geochemistry, 2017, 113: 184-195 (  0) 0) |
| [38] |
严月, 朱建军, 张彬, 等. 草原生态系统植物地下生物量分配及对全球变化的响应[J]. 植物生态学报, 2017, 41(5): 585-596 (  0) 0) |
 2022, Vol. 54
2022, Vol. 54


