2. 中国农业大学水利与土木工程学院, 北京 100083;
3. 山东省肥城市湖屯镇人民政府财政所, 山东泰安 271600
全球盐碱地面积达1×109 hm2以上[1],并以每年(1.5 ~ 2.0)×107 hm2的速度扩张[2]。我国耕地盐渍化面积达9.2×106 hm2,约占我国耕地面积6.62%[3]。盐碱化土壤使粮食大幅度减产,以我国盐渍化问题严重的新疆地区为例,轻度盐渍化土壤使作物减产10% ~ 15%,中度盐渍化土壤使作物减产20% 以上[4]。土壤含盐量过高会破坏土壤内水分平衡,降低土壤通透性,造成土壤板结和胶结,从而降低了土壤肥力[5];同时,土壤含盐量过高还会破坏作物体内水分与活性氧代谢的动态平衡,抑制叶片光合作用[6]与根系对土壤养分的吸收[7],从而大幅降低了作物生产力。因此,改良盐碱土壤对提高土壤生产力和保障全球粮食安全具有重要意义。
目前,改良盐碱地的方法主要包括物理方法(掺加生物质炭、秸秆深埋、暗管排水)[8]、化学方法(化学改良剂)[9]和生物改良方法。其中,接种根际促生菌(PGPR)作为一种生物改良盐碱地的方法,具有环境友好且经济高效的优势[10]。PGPR通过联合固氮溶磷解钾作用活化养分,同时产生铁载体和植物激素,降低作物体内乙烯水平,并提升菌根功能等机制促进作物生长,进而提升作物产量[11]。PGPR通过实现根系离子稳态,促进植物光合作用[6]、提高抗氧化能力[12]、增加根系养分吸收[13],以及诱导植物激素信号传导来克服盐胁迫危害[14]。目前,有研究表明盐碱地接种PGPR对玉米、小麦、大豆、水稻、菜豆等作物具有明显的增产提质效应[15]。然而,由于土壤盐碱程度、PGPR接种方式及施用菌种的差异,现有研究发现PGPR对盐碱改良效果偏差较大,在促进作物增产提质方面所得到的结论并不一致。Nadeem等[16]在不同盐度条件下小麦盆栽试验中发现,重度盐度下施用PGPR对籽粒产量提升效果是轻度盐度下的8.8倍。徐玥等[17]研究发现PGPR不同接种方式对大豆单株粒数、百粒重及产量增加幅度存在明显差异。Chang等[18]研究发现接种起皱假单胞菌使燕麦产量增加28%,而复合菌株使燕麦产量增加了175%。因此,明确PGPR在上述条件下的应用效果对于科学合理施用PGPR具有重要意义。本文综合了1990—2021年已发表的在盐碱条件下接种PGPR的文献资料,利用Meta方法分析了不同土壤盐碱程度、PGPR接种方式和施用菌种对土壤盐碱化指标、土壤肥力指标、作物产量与品质的影响,并通过结构方程模型分析探讨了盐碱地接种PGPR对作物产量与品质的调控路径。本研究结果可对盐碱地改良与盐碱地作物产量品质的提升提供科技支撑。
1 材料与方法 1.1 数据来源及筛选本研究收集了1990—2021年已发表的关于盐碱地根际促生菌(PGPR)应用效果的文献,其中英文文献来自Web of Science核心合集数据库(http://www.webofscience.com/),中文文献来自中国知网(http://www.cnki.net/)。本研究所用英文关键词包括PGPR、rhizosphere bacteri*、rhizobacteri*、biofertilizer、biofertiliser、microbial inoculants、salt、saline、salinity、salt stress等及其组合,布尔截断(*)用于确保单词变体(如bacteria与bacterium)。中文关键词包括根际促生菌、微生物菌肥、微生物菌剂、复合微生物、土壤改良、盐碱土、盐碱胁迫等及其组合,共收集到2 773篇文献。在此基础上,使用以下标准对文献进行筛选:①植物必须暴露在盐分条件下或通过灌溉进行盐分处理;②同一试验包含配对的盐胁迫下接种与不接种PGPR处理;③试验具有明确的重复数;④研究测定包含土壤理化性质、作物产量品质及生长指标。经以上标准严格筛选,最终获得163篇文献,其中包括英文文献120篇,中文文献43篇,可进行分析的试验数据2 468对。
1.2 数据分类与分组为比较盐碱地接种PGPR对土壤理化性质及作物产量、品质的影响,本研究共选择了4类18个评价指标作为研究对象(表 1)。
|
|
表 1 土壤和作物响应指标分类 Table 1 Classification of soil and plant response indicators |
由于研究对象和研究方法不同,PGPR在不同盐碱程度、接种方式和施用菌种条件下对土壤和作物影响存在差异。因此,本研究对已收集的数据以多种方式进行分组(表 2):按接种方式分为种子接种和土壤接种;按土壤盐碱程度分为轻度、中度和重度盐碱[19];按PGPR菌种分为芽孢杆菌属、假单胞菌属、其他菌属和复合菌属(多种菌种混合)。
|
|
表 2 数据分类依据 Table 2 Data classification bases in meta-analysis |
从所收集的文献中提取盐碱地接种与未接种PGPR处理下作物相关指标及土壤指标的所有数据。表格、文本形式的数据直接获取,通过GetData软件提取图表数据。每个完整的数据需要包括数据的平均数、标准差(standard deviation, SD)及样本数(n)。若文献中未提供标准差和标准误(standard error, SE),我们将标准差估计为平均值(X)除以样本量的平方根[20],计算公式如下:
| $ {\text{SD}} = X/\sqrt n $ | (1) |
若文献中提供的数据是以标准误的形式表示离散程度的,根据如下公式转换[21]:
| $ {\text{SD}} = \sqrt n \cdot {\text{SE}} $ | (2) |
Meta分析通过Metawin2.1(Sinauer Associates,Sunderland,USA)进行,在Metawin软件中输入各研究中处理组(接种PGPR)和对照组(不接种PGPR)的均值,及其对应的标准偏差和样本数。利用随机效应模型计算效应值(lnRR),对应指标效应值lnR的方差V,计算公式如下:
| $ \ln {\text{RR}} = \frac{{\ln {X_{\text{t}}}}}{{\ln {X_{\text{c}}}}} = \ln {X_t} - \;\ln {X_c} $ | (3) |
| $ V = \frac{{{\text{SD}}_{\text{t}}^2}}{{{n_t}\overline X _{\text{t}}^2}} + \frac{{{\text{SD}}_{\text{c}}^2}}{{{n_c}\overline X _{\text{c}}^2}} $ | (4) |
将不同研究数据对进行加权求和得到综合效应值
| $ \ln {R_{ + + }} = \frac{{\sum {(\ln {R_i} \cdot {w_i})} }}{{\sum {{w_i}} }} $ | (5) |
式中:RR为响应比,lnRR为效应值;SDt、nt、Xt分别为处理组标准偏差、样本数和均值;SDc、nc、Xc分别为对照组标准偏差、样本数和均值;lnR++为加权后的综合效应值;lnRi和wi分别为第i对数据对的效应值和权重;加权综合效应值lnR++的标准差公式和每对数据对的权重v和综合效应值lnR++的95% 置信区间,计算公式如下:
| $ {S_{\ln {R_{ + + }}}} = \sqrt {\frac{1}{{\sum {{w_i}} }}} $ | (6) |
| $ w = \frac{1}{v} $ | (7) |
| $ 95\% {\text{Cl}} = \ln {R_{ + + }} \pm 1.96{S_{\ln {R_{ + + }}}} $ | (8) |
为了更加直观地反映接种PGPR对作物和土壤的影响,通过如下公式计算得到各指标的变化百分数,采用Origin软件进行作图。
| $ S = \left[ {\exp \left( {{\text{lnRR}}} \right) - 1} \right] \times 100\% $ | (9) |
式中:S为接种PGPR相对于未接种条件下各指标的相对变化。如果S的95% 置信区间包含0,认为该指标处理组和对照组间差异不显著;若S的95% 置信区间不包含0,认为二者间差异显著,显著性水平P < 0.05。
1.3.2 结构方程模型处理及分析采用结构方程模型对盐碱地接种PGPR对土壤盐碱改良及肥力提高、作物生长、产量品质的影响路径进行分析,对土壤盐碱指标(pH和EC)、土壤肥力指标(有效磷、速效钾、速效氮、全氮和有机质)、作物生长指标(叶绿素a、叶绿素b、叶绿素SPAD及抗氧化酶活性)、品质(类胡萝卜素、可溶性糖和可溶性蛋白)分别进行主成分分析,并用PCA第一主成分轴进行表征。利用AMOS软件作结构方程模型图,采用SPSS 28.0对Meta分析中提取的数据进行处理。本文采用绝对适配统计量
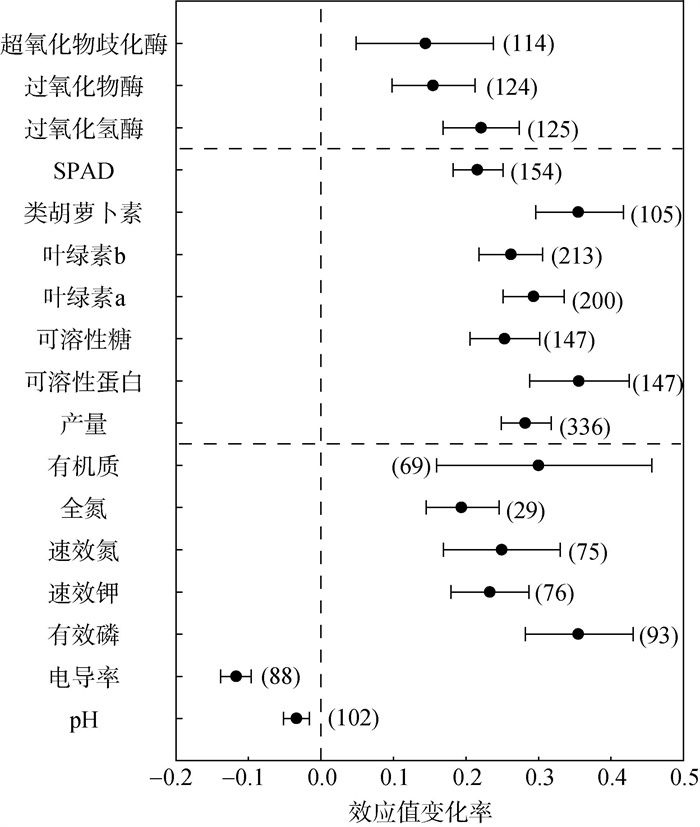
盐碱地应用PGPR对土壤及作物相关指标的影响如图 1所示。结果表明,盐碱地应用PGPR可以降低土壤盐碱化程度,与对照组相比,土壤pH和EC平均效应值分别减少了3.3%、11.6%(P < 0.05)。接种PGPR可以提高土壤肥力,其中有效磷、速效钾、速效氮、土壤全氮及土壤有机质平均效应值分别增加了35.3%、23.3%、30.8%、24.9% 和19.6%。同时,接种PGPR能够提升作物抗氧化酶活性和叶绿素指标,其中CAT、POD和SOD活性平均效应值分别增加了22.1%、15.4% 和14.7%,叶绿素a、叶绿素b、叶绿素叶色值(SPAD)等生长指标分别增加了29.4%、26.3%、21.4%。此外,施用PGPR显著提升了作物的产量与品质,其中作物产量、类胡萝卜素、可溶性蛋白、可溶性糖含量平均效应值分别增加了27.9%、35.2%、35.4%、25.2%。
|
(误差条表示95% 的置信区间,括号内数值代表样本数,下图同) 图 1 各指标对盐胁迫下接种PGPR的综合响应 Fig. 1 Comprehensive responses of indicators to PGPR application in saline-alkali land |
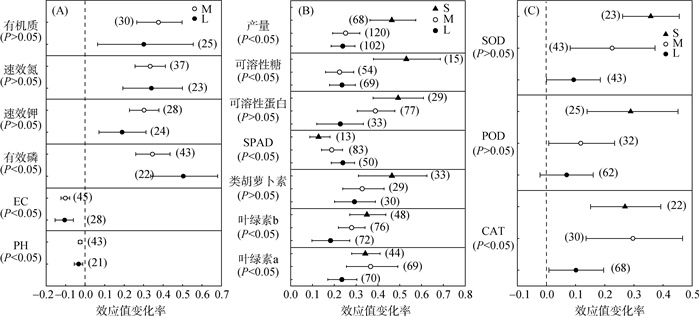
不同盐碱程度下接种PGPR对土壤理化指标和作物产量、品质的影响如图 2所示。结果表明,不同盐碱程度下接种PGPR提高了土壤肥力指标(有效磷、速效钾、速效氮、全氮、有机质)和作物叶绿素指标(叶绿素a、叶绿素b、叶绿素SPAD)。轻度盐碱和中度盐碱条件下接种PGPR对土壤有效磷的增加更明显,较对照组平均效应值分别增加了49.6% 和34.1%。重度盐碱条件下接种PGPR对产量和品质(类胡萝卜素、可溶性蛋白和可溶性糖含量)的增加更明显,较对照组平均效应值分别增加了45.4%、45.8%、40.2% 和39.6%。接种PGPR后植物体内CAT活性、POD活性、SOD活性随盐碱增大呈现上升趋势,重度盐碱条件下对SOD活性和POD活性平均效应值增加更明显,较对照组平均效应值分别增加了35.7%、27.6%。
|
(L为轻度盐碱;M为中度盐碱;S为重度盐碱) 图 2 不同盐碱程度下土壤理化指标(A)、作物产量和品质(B)以及植物抗氧化酶(C)对接种PGPR的响应 Fig. 2 Responses of soil physicochemical indexes (A), crop yield and quality (B) and plant antioxidant enzyme (C) to PGPR inoculation under different salt stresses |
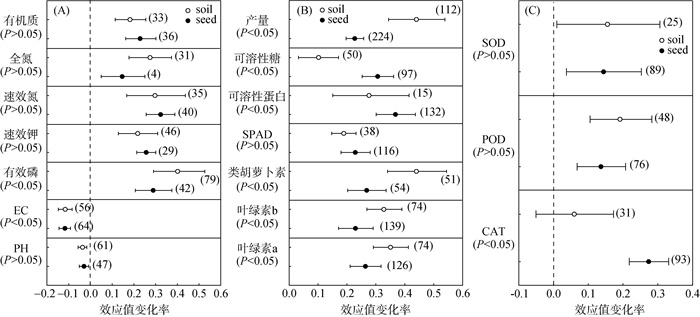
不同接种方式下PGPR对土壤理化指标和作物产量、品质的影响如图 3所示。结果表明,土壤接种和种子接种PGPR均降低了pH和EC,提高了土壤养分和作物产量、品质。土壤接种PGPR对土壤有效磷、全氮、类胡萝卜素和产量的增加更明显,较对照组平均效应值分别增加了38.8%、27.3%、43.6%、43.8%。种子接种PGPR对可溶性糖含量和可溶性蛋白含量的增加更明显,较对照组平均效应值分别增加了30.5%、36.5%,并促进作物抗氧化酶CAT、POD、SOD的活性。
|
(soil为土壤接种;seed为种子接种) 图 3 不同PGPR接种方式对盐碱地土壤理化指标(A)、作物产量和品质(B)以及植物抗氧化酶(C)的影响 Fig. 3 Effects of PGPR inoculation modes on soil physicochemical indexes (A), crop yield and quality (B) and plant antioxidant enzyme (C) in saline-alkali land |
盐碱地接种不同菌种PGPR对土壤理化指标和作物产量、品质的影响如图 4所示。结果表明,盐碱地接种假单孢菌属对土壤pH的降低最明显,较对照组平均效应值降低了5.8%;接种假单孢菌属和复合菌属对EC的降低最明显,较对照组平均效应值分别降低了12.4%、13.0%。与接种单一菌属相比,接种复合菌属对土壤有效磷、速效氮、全氮效应值增加更明显,较对照组平均效应值分别增加了44.1%、48.3%、31.0%。与接种其他菌属相比,接种芽孢杆菌属对叶绿素(叶绿素a和类胡萝卜素)、抗氧化酶(CAT和POD)、产量、品质的增加更明显,以产量的增加最为显著,较对照组平均效应值增加了44.9%。

|
(B为芽孢杆菌属;PS为假单胞菌属;OB为其他菌属;M为复合菌属) 图 4 土壤理化指标(A)、作物产量和品质(B)以及植物抗氧化酶(C)对盐碱地接种不同菌种PGPR的响应 Fig. 4 Responses of soil physicochemical indexes (A), crop yield and quality (B) and plant antioxidant enzyme (C) to different genuses of PGPR inoculation in saline-alkali land |
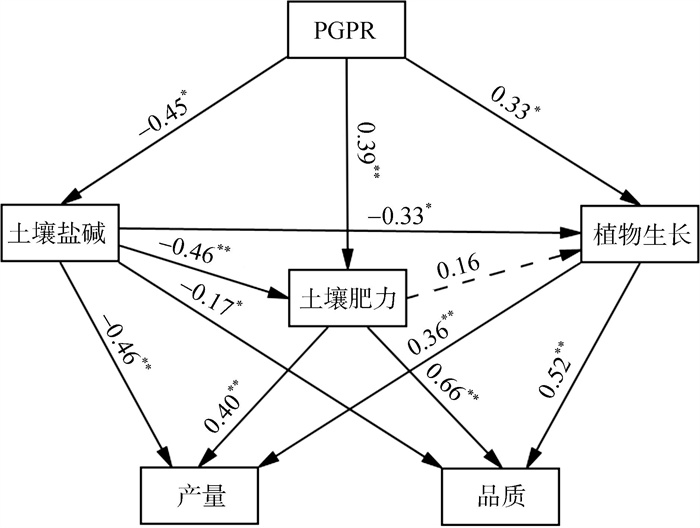
通过构建SEM揭示了接种PGPR对盐碱地作物产量与品质的调控路径,优化后的适配模型如图 5所示,模型适配参数
|
(***、**、* 分别表示达到P < 0.01、P < 0.05、P < 0.1显著水平;虚线表示不显著) 图 5 土壤盐碱改良及肥力提高对增产效果影响的结构方程模型 Fig. 5 Structural equation model of soil saline-alkali improvement and soil fertility improvement on yield increase |
本文整合了1990—2021年已发表的关于盐碱地PGPR应用效果的文献,通过Meta分析发现,施用PGPR可以明显降低土壤盐碱程度,提升作物产量与品质(图 1)。PGPR繁殖代谢过程中,可以通过分泌多糖和黏胶改善土壤团粒结构和化学性质[23],例如,疏松土壤结构、降低土壤容重、增加土壤中非毛细管孔隙[24]等。因此,施用PGPR可以增强灌水对土壤表层盐分的淋洗作用,减少了土壤表层盐分的积累[25],从而降低了土壤盐分对作物产量品质的抑制作用。同时,PGPR显著提升了土壤中有效磷、速效钾、速效氮、全氮和有机质含量(图 1)。PGPR可以通过自身代谢产生的固氮酶[26]、磷酸酶、核酸酶[27]或有机酸[28]从而实现固氮、溶磷、解钾等功能,提高了土壤中有效氮、磷、钾含量与土壤肥力。此外,接种PGPR可以提高盐碱地作物超氧化物歧化酶、过氧化物酶、过氧化氢酶等活性,从而缓解土壤盐碱程度过高对作物造成的氧化损害[29]。光合作用作为植物生长的必要条件,土壤盐碱化程度过高导致作物叶片渗透胁迫和氧化胁迫,增加了光合色素降解速率并抑制了光合色素的合成[30-31],从而降低了作物生物量的积累。盐碱地作物接种PGPR可以提高叶绿素含量和抗氧化酶活性,减少作物根系对Na+的吸收,增加对氮、磷及镁等营养元素的吸收,促进了光合色素的合成[32],进而提高了作物的产量与品质。
本研究表明盐碱地施用PGPR引起的增产提质效应在重度盐碱条件下效果更明显,这可能是由于重度盐碱较中度和轻度盐碱条件对作物生长的抑制作用更加明显。盐度严重影响植物的代谢活动和生物量的产生[33],贺奇等[34]研究发现水稻产量降低幅度与盐碱胁迫成正比,尤以重度盐碱胁迫下,穗粒重降低最显著。张丽华等[35]研究表明随着盐碱胁迫程度的增大,猴樟株高、根系数量和根系活力受到的抑制作用越强。Nadeem等[36]发现玉米在4、8和12 dS/m盐胁迫条件下接种PGPR后产量显著提高,并且在12 dS/m盐胁迫下接种对玉米产量的提升幅度最大。此外,本文结果表明土壤接种PGPR较种子接种对产量促进效应更显著。尽管种子接种能够使PGPR有效定殖在作物根际,维持作物在幼苗期较长时间内的生理生长状态[37],然而盐碱地的改良是一个长期缓慢的过程,需要通过长期、直接、连续施用PGPR来发挥其改良土壤与增产提质的功效[38]。本研究发现盐碱地接种PGPR的应用效果与接种菌种密切相关。在施用假单胞菌属条件下,土壤pH降低效果更显著(5.2% ~ 9.5%);在施用复合菌属PGPR时,土壤电导率降低效果更显著(9.7% ~ 17.0%)。这可能是由不同菌种PGPR生物学特性的差异造成的。例如,假单胞菌作为常见解磷细菌[26],施入土壤后自身代谢产生的有机酸在起到溶磷效果的同时降低了根际微环境的pH[39];而复合菌属,如根瘤菌和胶质类芽孢杆菌双接种,能更有效地促进宿主植物结瘤固氮,并且通过协同作用提高了植物养分利用率[40]。Ahmad等[41]发现在同一条件下,具有多个性状的复合PGPR菌属可能比含有较少性状的单一菌属在降低土壤盐度方面更具有优势。处于同一营养水平的PGPR间的协同作用源于代谢交叉喂养,促使彼此受益,从而增大了复合菌属的作用效果[42]。此外,本文结果表明接种芽孢杆菌属对产量品质促进效应更显著。芽孢杆菌具有产生内生孢子的能力,其相对于其他菌属对极端pH、盐度等各种土壤环境适应能力更强[43]。
4 结论本研究基于Meta分析方法对接种PGPR条件下土壤盐碱、土壤肥力、作物产量与品质进行了整合分析和评价,结果表明:接种PGPR可以有效降低土壤盐碱程度,提高土壤肥力,提高植物叶绿素与抗氧化酶含量,从而实现盐碱地作物的增产提质效果;与中、低度盐碱条件相比,重度盐碱条件下施用PGPR对降低土壤pH、EC,提高作物产量与品质的效果更好;接种芽孢杆菌对盐碱地作物的产量与品质提升效果最明显,并且土壤接种较种子接种更有优势。
| [1] |
Egamberdieva D, Wirth S, Bellingrath-Kimura S D, et al. Salt-tolerant plant growth promoting rhizobacteria for enhancing crop productivity of saline soils[J]. Nature Plants, 2019, 10: 2791 (  0) 0) |
| [2] |
Ruiz-Lozano J M, Porcel R, Azcón C, et al. Regulation by arbuscular mycorrhizae of the integrated physiological response to salinity in plants: New challenges in physiological and molecular studies[J]. Journal of Experimental Botany, 2012, 63(11): 4033-4044 DOI:10.1093/jxb/ers126 (  0) 0) |
| [3] |
杨劲松. 中国盐渍土研究的发展历程与展望[J]. 土壤学报, 2008, 45(5): 837-845 DOI:10.3321/j.issn:0564-3929.2008.05.010 (  0) 0) |
| [4] |
努尔沙吾列·哈斯木汉. 新疆土壤盐渍化成因及其防治对策[J]. 科学技术创新, 2020(9): 52-53 DOI:10.3969/j.issn.1673-1328.2020.09.027 (  0) 0) |
| [5] |
姜焕焕, 李嘉钦, 陈刚, 等. 解磷微生物及其在盐碱土中的应用研究进展[J]. 土壤, 2021, 53(6): 1125-1131 DOI:10.13758/j.cnki.tr.2021.06.004 (  0) 0) |
| [6] |
Gong X L, Chao L, Zhou M, et al. Oxidative damages of maize seedlings caused by exposure to a combination of potassium deficiency and salt stress[J]. Plant and Soil, 2011, 340(1/2): 443-452 (  0) 0) |
| [7] |
刘奕媺, 于洋, 方军. 盐碱胁迫及植物耐盐碱分子机制研究[J]. 土壤与作物, 2018, 7(2): 201-211 (  0) 0) |
| [8] |
周利颖, 李瑞平, 苗庆丰, 等. 排盐暗管间距对河套灌区重度盐碱土盐碱特征与肥力的影响[J]. 土壤, 2021, 53(3): 602-609 DOI:10.13758/j.cnki.tr.2021.03.021 (  0) 0) |
| [9] |
唐雪, 尚辉, 刘广明, 等. 复合改良剂对盐碱土改良及植物生长的影响[J]. 土壤, 2021, 53(5): 1033-1039 DOI:10.13758/j.cnki.tr.2021.05.019 (  0) 0) |
| [10] |
张瑞楠, 邢永秀. 微生物菌肥在作物种植中应用效果与前景分析[J]. 现代农机, 2022(1): 94-95 (  0) 0) |
| [11] |
杨劲松, 姚荣江, 王相平, 等. 中国盐渍土研究: 历程、现状与展望[J]. 土壤学报, 2022, 59(1): 10-27 (  0) 0) |
| [12] |
刘铎, 丛日春, 高卫东, 等. 盐碱胁迫对柳树抗氧化酶的影响[J]. 水土保持通报, 2017, 37(5): 53-57 (  0) 0) |
| [13] |
Kaushal M. Insights into microbially induced salt tolerance and endurance mechanisms (STEM) in plants[J]. Front Microbiol, 2020, 11: 1518 DOI:10.3389/fmicb.2020.01518 (  0) 0) |
| [14] |
Ilangumaran G, Smith D L. Plant growth promoting rhizobacteria in amelioration of salinity stress: A systems biology perspective[J]. Frontiers in Plant Science, 2017, 8: 1768 DOI:10.3389/fpls.2017.01768 (  0) 0) |
| [15] |
潘晶, 黄翠华, 彭飞, 等. 植物根际促生菌诱导植物耐盐促生作用机制[J]. 生物技术通报, 2020, 36(9): 75-87 (  0) 0) |
| [16] |
Nadeem S M, Zahir Z A, Naveed M, et al. Rhizobacteria capable of producing ACC-deaminase may mitigate salt stress in wheat[J]. Soil Science Society of America Journal, 2010, 74(2): 533-542 DOI:10.2136/sssaj2008.0240 (  0) 0) |
| [17] |
徐玥, 李玲, 胥雅馨, 等. 根瘤菌接种方式对复播大豆生长及结瘤的影响[J]. 新疆农业科学, 2022, 59(4): 810-817 (  0) 0) |
| [18] |
Chang P, Gerhardt K E, Huang X D, et al. Plant growth-promoting bacteria facilitate the growth of barley and oats in salt-impacted soil: Implications for phytoremediation of saline soils[J]. International Journal of Phytoremediation, 2014, 16(11): 1133-1147 (  0) 0) |
| [19] |
Stavi I, Thevs N, Priori S. Soil salinity and sodicity in drylands: A review of causes, effects, monitoring, and restoration measures[J]. Frontiers in Environmental Science, 2021, 9: 11-25 (  0) 0) |
| [20] |
Worchel E R, Giauque H E, Kivlin S N. Fungal symbionts alter plant drought response[J]. Microbial Ecology, 2013, 65(3): 671-678 (  0) 0) |
| [21] |
张彦军, 党水纳, 任媛媛, 等. 基于Meta分析的土壤呼吸对凋落物输入的响应[J]. 生态环境学报, 2020, 29(3): 447-456 (  0) 0) |
| [22] |
Tucker L R, Lewis C. A reliability coefficient for maximum likelihood factor analysis[J]. Psychometrika, 1973, 38(1): 1-10 (  0) 0) |
| [23] |
张辉, 李维炯, 倪永珍. 生物有机无机复合肥对土壤微生物活性的影响[J]. 农村生态环境, 2004, 20(1): 37-40 (  0) 0) |
| [24] |
逄焕成, 李玉义, 于天一, 等. 不同盐胁迫条件下微生物菌剂对土壤盐分及苜蓿生长的影响[J]. 植物营养与肥料学报, 2011, 17(6): 1403-1408 (  0) 0) |
| [25] |
严慧峻, 逄焕成, 李玉义, 等. 微生物复混肥对盐碱土及白菜品质改良的影响[J]. 中国农学通报, 2008, 24(12): 270-273 (  0) 0) |
| [26] |
侯海军, 秦红灵, 陈春兰, 等. 土壤氮循环微生物过程的分子生态学研究进展[J]. 农业现代化研究, 2014, 35(5): 588-594 (  0) 0) |
| [27] |
王素英, 陶光灿, 谢光辉, 等. 我国微生物肥料的应用研究进展[J]. 中国农业大学学报, 2003, 8(1): 14-18 (  0) 0) |
| [28] |
缑晶毅, 索升州, 姚丹, 等. 微生物肥料研究进展及其在农业生产中的应用[J]. 安徽农业科学, 2019, 47(11): 13-17 (  0) 0) |
| [29] |
韩文星, 姚拓, 席琳乔, 等. PGPR菌肥制作及其对燕麦生长和品质影响的研究[J]. 草业学报, 2008, 17(2): 75-84 (  0) 0) |
| [30] |
Pan J, Huang C H, Peng F, et al. Effect of arbuscular mycorrhizal fungi (AMF) and plant growth-promoting bacteria (PGPR) inoculations on Elaeagnus angustifolia L. in saline soil[J]. Applied Sciences, 2020, 10(3): 945 (  0) 0) |
| [31] |
A Murkute A, Sharma S, K Singh S. Studies on salt stress tolerance of Citrus rootstock genotypes with arbuscular mycorrhizal fungi[J]. Horticultural Science, 2011, 33(No.2): 70-76 (  0) 0) |
| [32] |
Pan J, Peng F, Xue X, et al. The growth promotion of two salt-tolerant plant groups with PGPR inoculation: A meta-analysis[J]. Sustainability, 2019, 11(2): 378 (  0) 0) |
| [33] |
Kirst G O. Salinity tolerance of eukaryotic marine algae[J]. Annual Review of Plant Physiology and Plant Molecular Biology, 1990, 41: 21-53 (  0) 0) |
| [34] |
贺奇, 王昕, 马洪文, 等. 盐碱胁迫对宁夏水稻籽粒灌浆及穗部性状的影响[J]. 东北农业科学, 2021, 46(6): 11–16, 69 (  0) 0) |
| [35] |
张丽华, 韩浩章, 李素华, 等. NaCl和Na2CO3处理对猴樟幼苗生长发育的影响[J]. 天津农业科学, 2019, 25(12): 15-18 (  0) 0) |
| [36] |
Nadeem S M, Zahir Z A, Naveed M, et al. Preliminary investigations on inducing salt tolerance in maize through inoculation with rhizobacteria containing ACC deaminase activity[J]. Canadian Journal of Microbiology, 2007, 53(10): 1141-1149 (  0) 0) |
| [37] |
张康康, 侯丹平, 谭金松, 等. 种子引发技术及其提高抗旱性的机制[J]. 耕作与栽培, 2021, 41(3): 38–44, 53 (  0) 0) |
| [38] |
宋以玲, 马学文, 于建, 等. 复合微生物肥料替代部分复合肥对花生生长及根际土壤微生物和理化性质的影响[J]. 山东科学, 2019, 32(1): 38–45, 123 (  0) 0) |
| [39] |
刘丹丹, 李敏, 刘润进. 我国植物根围促生细菌研究进展[J]. 生态学杂志, 2016, 35(3): 815-824 (  0) 0) |
| [40] |
刘丽, 马鸣超, 姜昕, 等. 根瘤菌与促生菌双接种对大豆生长和土壤酶活的影响[J]. 植物营养与肥料学报, 2015, 21(3): 644-654 (  0) 0) |
| [41] |
Ahmad M, Zahir Z A, Asghar H N, et al. Inducing salt tolerance in mung bean through coinoculation with rhizobia and plant-growth-promoting rhizobacteria containing 1-aminocyclopropane-1-carboxylate deaminase[J]. Canadian Journal of Microbiology, 2011, 57(7): 578-589 (  0) 0) |
| [42] |
Mulder C P, Uliassi D D, Doak D F. Physical stress and diversity-productivity relationships: The role of positive interactions[J]. Proceedings of the National Academy of Sciences of the United States of America, 2001, 98(12): 6704-6708 (  0) 0) |
| [43] |
Yadav A N, Verma P, Kumar M, et al. Diversity and phylogenetic profiling of niche-specific Bacilli from extreme environments of India[J]. Annals of Microbiology, 2015, 65(2): 611-629 (  0) 0) |
2. College of Water Resources & Civil Engineering, China Agricultural University, Beijing 100083, China;
3. Hutun Town People's Government Financial Office, Feicheng City, Taian, Shandong 271600, China
 2022, Vol. 54
2022, Vol. 54


